Candida albicans -Candida albicans
| Candida albicans | |
|---|---|

|
|
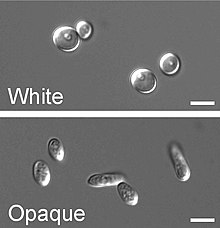
| Candida albicans vizualizată prin colorare Gram și microscopie. Rețineți hifele și clamidosporii , care au un diametru de 2-4 µm . | |
| Clasificare științifică | |
| Regatul: | |
| Divizia: | |
| Clasă: | |
| Ordin: | |
| Familie: | |
| Gen: | |
| Specii: |
C. albicans
|
| Numele binomului | |
|
Candida albicans ( C.-P. Robin ) Berkhout (1923)
|
|
| Sinonime | |
|
|
Candida albicans este o drojdie patogenă oportunistăcare este un membru comun al florei intestinale umane. Poate supraviețui și în afara corpului uman. Este detectat în tractul gastro-intestinal și gura la 40-60% dintre adulții sănătoși. Acesta esteobicei un comensale organism, dar poate deveni patogene în imunocompromisi indivizi sub o varietate de condiții. Este una dintre puținele specii din genul Candida care provoacă candidoză la infecția umană, care rezultă dintr-o creștere excesivă a ciupercii. Candidoza este, de exemplu, adesea observată la pacienții infectați cu HIV . C. albicans este cea mai comună specie fungică izolată din biofilme formate fie pe dispozitive medicale (permanente) implantate, fie pe țesuturi umane. C. albicans , C. tropicalis , C. parapsilosis și C. glabrata sunt împreună responsabile pentru 50-90% din toate cazurile de candidoză la om. O rată a mortalității de 40% a fost raportată la pacienții cu candidoză sistemică din cauza C. albicans . Potrivit unei estimări, candidozele invazive contractate într-un spital cauzează 2800 până la 11.200 de decese anual în SUA. Cu toate acestea, este posibil ca aceste cifre să nu reflecte cu adevărat amploarea reală a daunelor cauzate de acest organism, având în vedere noi studii care indică faptul că C. albicans poate traversa bariera hematoencefalică .
C. albicans este frecvent utilizat ca organism model pentru agenții patogeni fungici. În general , este menționată ca o ciuperca dimorfică deoarece creste atat ca drojdie si filamentoși celule. Cu toate acestea, are mai multe fenotipuri morfologice diferite, inclusiv forme opace, GUT și pseudohipale. C. albicans a fost mult timp considerat un organism diploid obligatoriu fără un stadiu haploid. Totuși, acesta nu este cazul. Alături de un stadiu haploid C. albicans poate exista și într-un stadiu tetraploid. Aceasta din urmă se formează atunci când celulele diploide C. albicans se împerechează atunci când sunt în formă opacă. Dimensiunea genomului diploid este de aproximativ 29 Mb și până la 70% din genele care codifică proteinele nu au fost încă caracterizate. C. albicans este ușor cultivat în laborator și poate fi studiat atât in vivo, cât și in vitro . În funcție de media, se pot face diferite studii, deoarece media influențează starea morfologică a C. albicans . Un tip special de mediu este CHROMagar ™ Candida, care poate fi utilizat pentru identificarea diferitelor specii de candida.
Etimologie
Candida albicans poate fi văzută ca o tautologie . Candida provine din cuvântul latin candidus, adică alb. Albicans în sine este participiul prezent al cuvântului latin albicō, adică devenind alb. Acest lucru duce la albul care devine alb, făcându-l o tautologie.
Este adesea denumit în scurt timp ca aftă, candidoză sau candida. Peste o sută de sinonime au fost folosite pentru a descrie C. albicans . Peste 200 de specii au fost descrise în genul candida. Cea mai veche referință la afte, cel mai probabil cauzată de C. albicans , datează de la 400 î.Hr. în Hipocrate munca " Dintre epidemiile care descriu candidoza orală.
Genomul
Genomul C. albicans este de aproape 16Mb pentru dimensiunea haploidă (28Mb pentru stadiul diploid) și constă din 8 seturi de perechi de cromozomi numite chr1A, chr2A, chr3A, chr4A, chr5A, chr6A, chr7A și chrRA. Al doilea set ( C. albicans este diploid) are nume similare, dar cu un B la final. Chr1B, chr2B, ... și chrRB. Întregul genom conține 6.198 cadre deschise de citire (ORF). Șaptezeci la sută din aceste ORF nu au fost încă caracterizate. Întregul genom a fost secvențiat, făcându-l unul dintre primii ciuperci care a fost complet secvențiat (alături de Saccharomyces cerevisiae și Schizosaccharomyces pombe ). Toate cadrele de citire deschise (ORF) sunt, de asemenea, disponibile în vectori adaptați la Gateway . Lângă acest ORFeome există, de asemenea, disponibilitatea unei biblioteci GRACE (înlocuirea genei și expresia condiționată) pentru a studia genele esențiale din genomul C. albicans . Cele mai frecvent utilizate tulpini pentru studierea C. albicans sunt tulpinile WO-1 și SC5314. Se știe că tulpina WO-1 trece între forma alb-opacă cu o frecvență mai mare, în timp ce tulpina SC5314 este tulpina utilizată pentru referința secvenței genetice.
Una dintre cele mai importante caracteristici ale genomului C. albicans este heterozigoza ridicată. La baza acestei heterozigozități stă apariția rearanjărilor și modificărilor cromozomiale numerice și structurale ca mijloace de generare a diversității genetice prin polimorfisme de lungime cromozomială (contracția / expansiunea repetărilor), translocații reciproce , deleții cromozomiale , polimorfisme mononucleotide nesinonime și trisomie a individului cromozomi. Aceste modificări cariotipice duc la modificări ale fenotipului, care este o strategie de adaptare a acestei ciuperci. Aceste mecanisme sunt în continuare explorate odată cu disponibilitatea analizei complete a genomului C. albicans .
O caracteristică neobișnuită a genului Candida este că în multe dintre speciile sale (inclusiv C. albicans și C. tropicalis , dar nu, de exemplu, C. glabrata ) codonul CUG , care specifică în mod normal leucina, specifică serina în aceste specii. Acesta este un exemplu neobișnuit de abatere de la codul genetic standard , iar majoritatea acestor abateri se află în codoni de început sau, pentru eucariote , coduri genetice mitocondriale . Această modificare poate, în unele medii, să ajute aceste specii Candida prin inducerea unui răspuns permanent la stres, o formă mai generalizată a răspunsului la șoc termic . Cu toate acestea, această utilizare diferită a codonilor face mai dificilă studierea interacțiunilor proteină-proteină C. albicans în organismul model S. cerevisiae . Pentru a depăși această problemă , a fost dezvoltat un sistem specific cu doi hibrizi de C. albicans .
Genomul C. albicans este extrem de dinamic, contribuit de diferite traduceri CUG, iar această variabilitate a fost utilizată în mod avantajos pentru studii epidemiologice moleculare și studii de populație la această specie. Secvența genomului a permis identificarea prezenței unui ciclu parasexual (fără diviziune meiotică detectată ) în C. albicans . Acest studiu al evoluției reproducerii sexuale la șase specii de Candida a constatat pierderi recente în componentele căii majore de formare a încrucișării meiotice, dar păstrarea unei căi minore. Autorii au sugerat că, în cazul în care speciile Candida suferă meioză, aceasta este cu mașini reduse sau cu mașini diferite și au indicat că ciclurile meiotice nerecunoscute pot exista la multe specii. Într-un alt studiu evolutiv, introducerea redefinirii parțiale a identității CUG (din speciile Candida ) în clonele Saccharomyces cerevisiae a provocat un răspuns la stres care a afectat negativ reproducerea sexuală. Această redefinire a identității CUG, care apare la strămoșii speciilor Candida , s-a considerat că blochează aceste specii într-o stare diploidă sau poliploidă cu posibil blocaj al reproducerii sexuale.
Morfologie
C. albicans prezintă o gamă largă de fenotipuri morfologice datorate comutării fenotipice și tranziției mugurilor la hifă. Tranziția drojdie-la-hife (filamentare) este un proces rapid și indus de factori de mediu. Comutarea fenotipică este spontană, are loc la rate mai mici și în anumite tulpini sunt cunoscute până la șapte fenotipuri diferite. Cel mai bine studiat mecanism de comutare este comutarea de la alb la opac (un proces epigenetic). Au fost descrise și alte sisteme. Două sisteme (sistemul de comutare de înaltă frecvență și comutarea de la alb la opac) au fost descoperite de David R. Soll și colegii săi. Comutarea în C. albicans este adesea, dar nu întotdeauna, influențată de condițiile de mediu, cum ar fi nivelul de CO 2 , condițiile anaerobe, mediul utilizat și temperatura. În forma sa de drojdie, C. albicans variază de la 10 la 12 microni . Pe pseudohifele numite clamidospori se pot forma spori care supraviețuiesc atunci când sunt puși în condiții nefavorabile, cum ar fi anotimpurile uscate sau fierbinți.
Comutare de drojdie la hifă
Deși este adesea denumit dimorf , C. albicans este, de fapt, polifenic (adesea denumit și pleomorf ). Când este cultivat în mediu de laborator standard de drojdie, C. albicans crește ca celule ovoidale de „drojdie”. Cu toate acestea, modificările ușoare ale mediului în temperatură, CO 2 , nutrienți și pH pot duce la o trecere morfologică la creșterea filamentoasă. Celulele filamentoase au multe asemănări cu celulele de drojdie. Ambele tipuri de celule par să joace un rol specific, distinct în supraviețuirea și patogenitatea C. albicans . Celulele de drojdie par să fie mai potrivite pentru diseminarea în sânge, în timp ce celulele hifale au fost propuse ca factor de virulență. Celulele hifale sunt invazive și se speculează că sunt importante pentru penetrarea țesuturilor, colonizarea organelor și supraviețuirea, plus macrofagele care scapă. Trecerea de la drojdie la celulele hifale este denumită a fi unul dintre factorii cheie în virulența C. albicans ; cu toate acestea, nu se consideră necesar. Când celulele C. albicans sunt cultivate într-un mediu care imită mediul fiziologic al unei gazde umane, acestea cresc ca celule filamentoase (atât hife adevărate, cât și pseudohife). C. albicans poate forma, de asemenea, clamidospori , a căror funcție rămâne necunoscută, dar se presupune că joacă un rol în supraviețuirea mediilor dure, deoarece acestea se formează cel mai adesea în condiții nefavorabile.
Cascada de semnalizare cAMP-PKA este crucială pentru morfogeneză și un regulator transcripțional important pentru trecerea de la celule ca drojdii la celule filamentoase este EFG1.

Comutare de înaltă frecvență
Pe lângă tranziția bine studiată de la drojdie la hife, au fost descrise și alte sisteme de comutare. Un astfel de sistem este sistemul de „comutare de înaltă frecvență”. În timpul acestei comutări sunt generate spontan diferite morfologii celulare ( fenotipuri ). Acest tip de comutare nu are loc în masă, reprezintă un sistem de variabilitate și se întâmplă independent de condițiile de mediu. Tulpina 3153A produce cel puțin șapte morfologii diferite ale coloniilor. În multe tulpini, diferitele faze se convertesc spontan la celălalt (ele) la o frecvență joasă. Comutarea este reversibilă, iar tipul de colonie poate fi moștenit de la o generație la alta. Abilitatea de a trece prin atât de multe fenotipuri (morfologice) diferite face ca C. albicans să poată crește în medii diferite, atât ca un comensal, cât și ca agent patogen.
În tulpina 3153A , a fost găsită o genă numită SIR2 (pentru regulatorul de informație silențios), care pare a fi importantă pentru comutarea fenotipică. SIR2 a fost găsită inițial în Saccharomyces cerevisiae (drojdie de bere), în cazul în care este implicat in cromozomiale tacere -un forma de reglare a transcrierii , în care regiuni ale genomului sunt reversibil inactivate prin modificări ale cromatinei structura (cromatinei este complexul de ADN și proteine care fac cromozomi ). În drojdie, genele implicate în controlul tipului de împerechere se găsesc în aceste regiuni silențioase, iar SIR2 își reprimă expresia menținând o structură de cromatină silențioasă competentă în această regiune. Descoperirea unui SIR2 de C. albicans implicat în comutarea fenotipică sugerează că are și regiuni silențioase controlate de SIR2 , în care pot locui genele specifice fenotipului. Modul în care SIR2 este reglementat în S. cerevisiae poate oferi încă mai multe indicii cu privire la mecanismele de comutare ale C. albicans .
Comutare alb-opac
Alături de dimorfism și primul sistem de comutare de înaltă frecvență descris, C. albicans suferă un alt proces de comutare de înaltă frecvență numit comutare de la alb la opac, care este un alt proces de comutare fenotipic la C. albicans . A fost al doilea sistem de comutare de înaltă frecvență descoperit la C. albicans . Comutarea de la alb la opac este un sistem de comutare epigenetică . Comutarea fenotipică este adesea utilizată pentru a se referi la comutarea alb-opac, care constă din două faze: una care crește sub formă de celule rotunde în colonii albe și netede (denumită formă albă) și una care este asemănătoare cu tija și crește ca plat, gri colonii (numită formă opacă). Această trecere de la celule albe la celule opace este importantă pentru virulență și procesul de împerechere a C. albicans, deoarece forma opacă este forma competentă de împerechere , fiind de un milion de ori mai eficientă în împerechere în comparație cu tipul alb. Această comutare între forma albă și cea opacă este reglementată de regulatorul WOR1 (Regulatorul alb la opac 1) care este controlat de represorul locus de tip imperechere (MTL) (a1-α2) care inhibă expresia WOR1. Pe lângă faza albă și opacă există și o a treia: fenotipul gri. Acest fenotip arată cea mai mare capacitate de a provoca infecții cutanate. Fenotipurile albe, opace și gri formează un sistem de comutare fenotipic tristabil. Deoarece este adesea dificil să se facă diferența între celulele albe, opace și cele gri, floxina B, un colorant, poate fi adăugată la mediu.
O posibilă moleculă de reglare în comutarea albă către opacă este Efg1p , un factor de transcripție găsit în tulpina WO-1 care reglează dimorfismul și, mai recent, s-a sugerat că ajută la reglarea comutării fenotipice. Efg1p se exprimă numai în alb și nu în celulă gri, iar supraexprimarea Efg1p în formă gri provoacă o conversie rapidă la forma albă.
Comutator alb-GUT
Un tip foarte special de comutator fenotipic este comutatorul alb-GUT (tranziție indusă gastrointestinal). Celulele GUT sunt extrem de adaptate la supraviețuirea în tractul digestiv prin adaptări metabolice la nutrienții disponibili în tractul digestiv. Celulele GUT trăiesc ca organisme comensale și depășesc alte fenotipuri. Trecerea de la celulele albe la celulele GUT este condusă de trecerea prin intestin, unde parametrii de mediu declanșează această tranziție prin creșterea expresiei WOR1.
Rolul în boală
Candida se găsește în întreaga lume, dar compromite cel mai frecvent persoanele imunodeprimate diagnosticate cu boli grave, cum ar fi HIV și cancerul. Candida este clasificată drept unul dintre cele mai frecvente grupuri de organisme care provoacă infecții dobândite în spital . În special persoanele cu risc ridicat sunt pacienții care au fost supuși recent unei intervenții chirurgicale, un transplant sau care se află în Unitățile de Terapie Intensivă (UCI), infecțiile cu C. albicans sunt sursa principală a infecțiilor fungice la pacienții cu boli critice sau cu pacienții cu imunitate compromisă. Acești pacienți dezvoltă predominant candidoză orofaringiană sau aftoasă, care poate duce la malnutriție și poate interfera cu absorbția medicamentelor. Metodele de transmitere includ mama la copil prin naștere, infecții dobândite de la oameni la oameni, care apar cel mai frecvent în spitale în care pacienții imunocompromiși dobândesc drojdia de la lucrătorii din domeniul sănătății și au o rată de incidență de 40%. Oamenii se pot infecta după ce întrețin relații sexuale cu o femeie care are o infecție vaginală cu drojdie. Părțile corpului care sunt frecvent infectate includ pielea, organele genitale, gâtul, gura și sângele. Trăsăturile distinctive ale infecției vaginale includ secreția și aspectul uscat și roșu al mucoasei sau pielii vaginale. Candida continuă să fie al patrulea organism cel mai frecvent izolat în infecțiile din sânge. Oamenii sănătoși, de obicei, nu suferă (grav) de infecții superficiale cauzate de o modificare locală a imunității celulare, așa cum se observă la pacienții cu astm care utilizează corticosteroizi orali.
Infecții superficiale și locale
Apare frecvent ca o infecție superficială pe membranele mucoase din gură sau vagin. Odată în viață, aproximativ 75% dintre femei vor suferi de candidoză vulvovaginală (VVC) și aproximativ 90% din aceste infecții sunt cauzate de C. albicans . Poate afecta și o serie de alte regiuni . De exemplu, mai mare prevalenta de colonizare a C. albicans a fost raportată la indivizii tineri cu piercing limba , în comparație cu persoanele potrivite neperforată. Pentru a infecta țesutul gazdă, forma obișnuită de drojdie unicelulară de C. albicans reacționează la indicii de mediu și se transformă într-o formă filamentoasă invazivă, multicelulară, un fenomen numit dimorfism . În plus, o infecție excesivă este considerată o superinfecție, termenul aplicat de obicei atunci când o infecție devine oportunistă și foarte rezistentă la antifungice. Apoi devine suprimabil de către antibiotice. Infecția este prelungită atunci când tulpina sensibilă originală este înlocuită de tulpina rezistentă la antibiotice.
Se știe că candidoza provoacă simptome gastro-intestinale (GI) în special la pacienții imunocompromiși sau la cei care primesc steroizi (de exemplu pentru a trata astmul ) sau antibiotice. Recent, există o literatură emergentă că o creștere excesivă a ciupercilor în intestinul subțire al subiecților neimunocompromiși poate provoca simptome GI inexplicabile. Creșterea fungică a intestinului subțire (SIFO) se caracterizează prin prezența unui număr excesiv de organisme fungice în intestinul subțire asociat cu simptome gastrointestinale. Cele mai frecvente simptome observate la acești pacienți au fost eructații, balonare, indigestie, greață, diaree și gaze. Mecanismul (mecanismele) care predispune la SIFO nu este clar. Sunt necesare studii suplimentare; atât pentru a confirma aceste observații, cât și pentru a examina relevanța clinică a excrescenței fungice.
Infecții sistemice
Infecții fungice sistemice ( fungemias ) , inclusiv cele de C. albicans au aparut ca importante cauze de morbiditate și mortalitate la imunocompromisi pacienti ( de exemplu, SIDA , cancer chimioterapie , organe sau de măduvă osoasă transplant). C. albicans formează adesea biofilme în interiorul corpului. Astfel de biofilme de C. albicans se pot forma pe suprafața dispozitivelor sau organelor medicale implantabile. În aceste biofilme se găsește adesea împreună cu Staphylococcus aureus . Astfel de infecții multispeciale duc la mortalități mai mari. În plus , infecțiile dobândite de spital cu C. albicans au devenit o cauză de probleme majore de sănătate. Mai ales odată ce celulele candidei sunt introduse în fluxul sanguin se poate produce o mortalitate ridicată, până la 40-60%.
Deși Candida albicans este cea mai frecventă cauză de candidemie , a existat o scădere a incidenței și o izolare crescută a speciilor non-albicans de Candida în ultimii ani. Măsurile preventive includ menținerea unei bune igiene orale, menținerea unui stil de viață sănătos, inclusiv o alimentație bună, utilizarea atentă a antibioticelor, tratarea zonelor infectate și menținerea pielii uscate și curate, fără răni deschise.
Rolul C. albicans în boala Crohn
Legătura dintre C. albicans și boala Crohn a fost investigată într-o cohortă mare. Acest studiu a demonstrat că membrii familiilor cu mai multe cazuri de boală Crohn erau mai predispuși să fie colonizați de C. albicans decât membrii familiilor de control. Studiile experimentale arată că colita indusă chimic promovează colonizarea C. albicans . La rândul său, colonizarea C. albicans generează anticorpi anti- Saccharomyces cerevisiae (ASCA), crește inflamația, scorurile histologice și expresia citokinelor pro-inflamatorii.
Tratament
Există relativ puține medicamente care pot trata cu succes Candidoza. Tratamentul include de obicei:
- amfotericină B , echinocandină sau fluconazol pentru infecții sistemice
- nistatină pentru infecțiile orale și esofagiene
- clotrimazol pentru infecții cu piele și drojdie genitală
În mod similar cu rezistența la antibiotice, rezistența la mulți anti-fungici devine o problemă. Pentru a face față acestei probleme trebuie dezvoltate noi anti-fungice, deoarece sunt disponibile doar un număr limitat de anti-fungice. O problemă generală este că, spre deosebire de bacterii, ciupercile sunt adesea trecute cu vederea ca o potențială problemă de sănătate.
Implicații economice
Având în vedere faptul că candidoza este a patra (până la a treia) infecție dobândită în spital la nivel mondial, aceasta conduce la implicații financiare imense. Aproximativ 60.000 de cazuri de candidoză sistemică în fiecare an doar în SUA duc la un cost cuprins între 2-4 miliarde de dolari. Costurile totale pentru candidoză sunt printre cele mai mari în comparație cu alte infecții fungice datorită prevalenței ridicate. Costurile imense sunt explicate parțial de o ședere mai lungă în unitatea de terapie intensivă sau în spital, în general. O ședere prelungită cu încă 21 de zile în comparație cu pacienții neinfectați nu este neobișnuită.
Dezvoltarea biofilmului
Etape de formare a biofilmului
Biofilmul de C. albicans este format în patru etape. În primul rând, există etapa inițială de aderență, în care celulele în formă de drojdie aderă la substrat. A doua etapă se numește etapă intermediară, în care celulele se propagă pentru a forma microcolonii , iar tuburile germinale se formează pentru a produce hife. În etapa de maturare, biomasa biofilmului se extinde, se acumulează matricea extracelulară și crește rezistența la medicamente. În ultima etapă a formării biofilmului, celulele în formă de drojdie sunt eliberate pentru a coloniza mediul înconjurător (dispersie). Celulele de drojdie eliberate dintr-un biofilm au proprietăți noi, inclusiv virulență crescută și toleranță la medicamente.
Zap1
Zap1, cunoscut și sub numele de Csr1 și Sur1 (proteină activatoare care răspunde la zinc), este un factor de transcripție care este necesar pentru formarea hifei în biofilmele C. albicans . Zap1 controlează echilibrul drojdiei și celulelor hifale, transportorii de zinc și genele reglementate de zinc în biofilmele de C. albicans .
Zinc
Zincul (Zn 2+ ) este important pentru funcția celulară a C. albicans, iar Zap1 controlează nivelurile de zinc din celule prin intermediul transportorilor de zinc Zrt1 și Zrt2. Reglarea concentrației de zinc în celule este importantă pentru viabilitatea celulei și dacă nivelurile de zinc devin prea mari, este toxică pentru celule. Zrt1 transportă ionii de zinc cu afinitate ridicată, iar Zrt2 transportă ionii de zinc cu afinitate mică.
Mecanisme și proteine importante pentru patogeneză
Filamentarea
Capacitatea de a comuta între celulele de drojdie și celulele hifale este un factor important de virulență. Multe proteine joacă un rol în acest proces. Filamentarea în C. albicans este un proces foarte complex. Formarea hifelor poate ajuta, de exemplu, Candida albicans să scape de macrofagele din corpul uman. Mai mult, C. albicans suferă tranziția drojdie-la-hifă în fagozomul macrofagic acid. Aceasta cauzează inițial distensia membranei fagozomului care duce în cele din urmă la alcalinizarea fagozomală prin ruptură fizică, urmată de evadare.
Hwp1
Hwp1 reprezintă proteina peretelui hifal 1. Hwp1 este o manoproteină localizată pe suprafața hifelor sub forma hifală a C. albicans . Hwp1 este un substrat transglutaminază de mamifer . Această enzimă gazdă permite Candida albicans să se atașeze stabil de celulele epiteliale gazdă. Aderența C. albicans la celulele gazdă este un prim pas esențial în procesul de infecție pentru colonizare și inducerea ulterioară a infecției mucoasei.
Slr1
Proteina de legare ARN Slr1 joacă un rol în formarea instigare hyphal si virulenta in C. albicans .
Candidalizină
Candidalizina este o toxină peptidică α-elicoidală citolitică de 31-aminoacizi care este eliberată de C. albicans în timpul formării hifalei. Contribuie la virulență în timpul infecțiilor mucoasei.
Instrumente genetice și genomice
Datorită naturii sale de organism model, fiind un agent patogen uman important și utilizarea alternativă a codonilor (CUG tradusă mai degrabă în serină decât în leucină), au fost create mai multe proiecte și instrumente specifice pentru studierea C. albicans . Cu toate acestea, natura diploidă și absența unui ciclu sexual îl fac să fie un organism greu de studiat. Cu toate acestea, în ultimii 20 de ani, au fost dezvoltate multe sisteme pentru a studia C. albicans într-un nivel genetic mai aprofundat.
Marcatori de selecție
Cei mai utilizați markeri de selecție în C. albicans sunt markerul de rezistență CaNAT1 (conferă rezistență împotriva nurtotricinei ) și MPAr sau IMH3r (conferă rezistență la acidul micofenolic ). Lângă producătorii de selecție menționați mai sus, au fost generate câteva tulpini auxotrofice pentru a lucra cu factorii de decizie auxotrofici. URA3 Markerul (URA3 blaster metodă) este o strategie adesea folosit in tulpini de uridină auxotrofice; cu toate acestea, studiile au arătat că diferențele în poziția URA3 în genom pot fi implicate în patogenia C. albicans . Pe lângă selecția URA3 se poate utiliza și autotrofia histidinei, leucinei și argininei. Avantajul utilizării acestor autotrofii constă în faptul că prezintă virulență de tip sălbatic sau aproape de tip sălbatic într-un model de șoarece comparativ cu sistemul URA3. O aplicație a autotrofiei leucinei, argininei și histidinei este de exemplu sistemul candida cu doi hibrizi.
Genomul secvenței complete
Genomul complet al C. albicans a fost secvențiat și pus la dispoziția publicului într-o bază de date Candida . Tulpina heterozigotă diploidă utilizată pentru acest proiect complet de secvență a genomului este tulpina de laborator SC5314. Secvențierea a fost realizată folosind o abordare a pușcii cu genom întreg.
Proiect ORFeome
Fiecare ORF prezis a fost creat într-un vector adaptat la gateway (pDONR207) și pus la dispoziția publicului. Vectorii ( plasmidele ) pot fi propagate în E.coli și crescute pe mediu gentamicină LB + . În acest fel, fiecare ORF este ușor disponibil într-un vector ușor de utilizat. Folosind sistemul gateway este posibil să se transfere ORF de interes către orice alt vector adaptat la gateway pentru studii ulterioare ale ORF specifice.
Plasmida integrativă CIp10
Contrar drojdiei, S. cerevisiae plasmidele episomale nu rămân stabile în C. albicans . Pentru a lucra cu plasmidele din C. albicans trebuie astfel utilizată o abordare integrativă (integrarea plasmidică în genom). O a doua problemă este că majoritatea transformărilor plasmidice sunt destul de ineficiente la C. albicans ; cu toate acestea, plasmida CIp10 depășește aceste probleme și poate fi utilizată cu ușurință pentru a transforma C. albicans într-un mod foarte eficient. Plasmida se integrează în interiorul locusului RP10 deoarece întreruperea unei alele RP10 nu pare să afecteze viabilitatea și creșterea C. albicans . Mai multe adaptări ale acestei plasmide au fost făcute după ce originalul a devenit disponibil.
Sistem Candida cu doi hibrizi (C2H)
Datorită utilizării aberante a codonilor de C. albicans , este mai puțin fezabilă utilizarea organismului gazdă comun ( Saccharomyces cerevisiae ) pentru studii cu doi hibrizi . Pentru a depăși această problemă a fost creat un sistem cu doi hibrizi (C2H) C. albicans . Tulpina SN152 care este auxotrofică pentru leucină, arginină și histidină a fost utilizată pentru a crea acest sistem C2H. A fost adaptat prin integrarea unei gene reporter HIS1 precedată de cinci secvențe LexAOp. În sistemul C2H, plasmida momeală (pC2HB) conține Staphylococcus aureus LexA BD, în timp ce plasmida pradă (pC2HP) adăpostește AD VP16 viral. Ambele plasmide sunt plasmide integrative, deoarece plasmidele episomale nu rămân stabile în C. albicans . Gena reporter utilizată în sistem este gena HIS1 . Când proteinele interacționează, celulele vor putea crește pe mediu lipsit de histidină datorită activării genei raportoare HIS1 . Până acum au fost detectate mai multe interacțiuni folosind acest sistem într-o configurație la scară redusă. De asemenea, a fost efectuat un prim screening de mare capacitate. Proteinele care interacționează pot fi găsite la BioGRID .
Complementarea fluorescenței bimoleculare (BiFC)
Pe lângă sistemul C2H , a fost dezvoltat un sistem BiFC pentru a studia interacțiunile proteină-proteină la C. albicans . Cu acest sistem, interacțiunile proteice pot fi studiate în localizarea lor subcelulară nativă, contrar unui sistem C2H în care proteinele sunt forțate să intre în nucleu. Cu BiFC se pot studia, de exemplu, interacțiunile proteice care au loc la nivelul membranei celulare sau a membranei vacuolare.
Microarrays
Atât ADN-ul cât și microarrays-urile de proteine au fost concepute pentru a studia profilurile de expresie ADN și producția de anticorpi la pacienții împotriva proteinelor din peretele celular al C. albicans .
Biblioteca GRACE
Folosind un sistem promotor reglabil cu tetraciclină, a fost creată o bibliotecă de înlocuire genică și expresie condițională (GRACE) pentru 1.152 de gene. Prin utilizarea promotorului reglabil și eliminarea uneia dintre alelele genei specifice a fost posibil să se facă o discriminare între genele neesențiale și esențiale. Dintre cele 1.152 gene testate 567 s-au dovedit a fi esențiale. Cunoașterea genelor esențiale poate fi folosită pentru a descoperi noi antifungice.
CRISPR / Cas9
CRISPR / Cas9 a fost adaptat pentru a fi utilizat la C. albicans . Au fost efectuate mai multe studii folosind acest sistem.
Aplicație în inginerie
C. albicans a fost utilizat în combinație cu nanotuburi de carbon (CNT) pentru a produce materiale țesuturi bio-nano-compozite conductoare electric stabile care au fost utilizate ca elemente de detectare a temperaturii.
Notabile C. albicans cercetători
Vezi si
- Permeabilitatea intestinală
- Drojdie Torula ( Candida utilis )
- Infecție neonatală
- Utilizarea codonilor
Referințe
Lecturi suplimentare
- Cote, Frank C. (1988). Candida și candidoza (ed. A II-a). Baillière Tindall. ISBN 978-0702012655.
- Waldman A, Gilhar A, Duek L, Berdicevsky I (mai 2001). „Incidența candidei în psoriazis - un studiu asupra florei fungice a pacienților psoriazici”. Micoze . 44 (3-4): 77-81. doi : 10.1046 / j.1439-0507.2001.00608.x . PMID 11413927 . S2CID 36201859 .
- Zordan RE, Miller MG, Galgoczy DJ, Tuch BB, Johnson AD (octombrie 2007). „Buclele de feedback transcripționale interblocate controlează comutarea alb-opacă în Candida albicans” . PLOS Biology . 5 (10): e256. doi : 10.1371 / journal.pbio.0050256 . PMC 1976629 . PMID 17880264 .
- Rossignol T, Lechat P, Cuomo C, Zeng Q, Moszer I, d'Enfert C (ianuarie 2008). „CandidaDB: o bază de date multi-genomică pentru speciile Candida și Saccharomycotina conexe” . Cercetarea acizilor nucleici . 36 (Problema bazei de date): D557–61. doi : 10.1093 / nar / gkm1010 . PMC 2238939 . PMID 18039716 .
- "Cum Candida albicans schimbă fenotipul - și înapoi: gena de silențiere SIR2 are un cuvânt de spus în tipul de colonie Candida" . NCBI Coffeebreak . 24.11.1999 . Adus 02-11-2008 .