Defect cardiac congenital - Congenital heart defect
| Defect cardiac congenital | |
|---|---|
| Alte nume | Anomalie congenitală a inimii, boli cardiace congenitale |
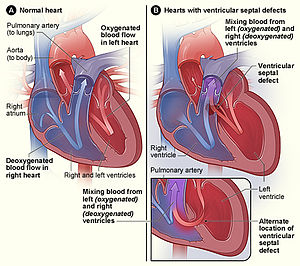 | |
| Structura normală a inimii (stânga) în comparație cu două locații comune pentru un defect septal ventricular (dreapta), cea mai comună formă de defect cardiac congenital. | |
| Specialitate | Cardiologie |
| Simptome | Respirație rapidă, piele albăstruie , slabă creștere în greutate, senzație de oboseală |
| Complicații | Insuficienta cardiaca |
| Tipuri | Defecte cardiace cianotice , defecte cardiace non-cianotice |
| Cauze | Adesea necunoscut |
| Factori de risc | Infecție cu rubeolă în timpul sarcinii , alcool sau tutun , părinții fiind strâns înrudiți, stare nutrițională slabă, administrarea de antidepresive în timpul sarcinii sau obezitate la mamă |
| Tratament | Niciuna, proceduri bazate pe cateter , chirurgie cardiacă , transplant de inimă |
| Prognoză | În general bun (cu tratament) |
| Frecvență | 48,9 milioane (2015) |
| Decese | 303.300 (2015) |
Un defect cardiac congenital ( CHD ), cunoscut și ca anomalie cardiacă congenitală și boală cardiacă congenitală , este un defect în structura inimii sau a vaselor mari care este prezent la naștere . Semnele și simptomele depind de tipul specific de defect. Simptomele pot varia de la niciuna la viață. Atunci când sunt prezente, simptomele pot include respirație rapidă, piele albăstruie ( cianoză ), creștere slabă în greutate și senzație de oboseală. CHD nu provoacă dureri în piept. Majoritatea defectelor cardiace congenitale nu sunt asociate cu alte boli. O complicație a CHD este insuficiența cardiacă .
Cauza unui defect cardiac congenital este adesea necunoscută. Factorii de risc includ anumite infecții în timpul sarcinii, cum ar fi rubeola , utilizarea anumitor medicamente sau droguri, cum ar fi alcoolul sau tutunul , părinții care au o relație strânsă sau starea nutrițională slabă sau obezitatea la mamă. A avea un părinte cu un defect cardiac congenital este, de asemenea, un factor de risc. O serie de afecțiuni genetice sunt asociate cu defecte cardiace, inclusiv sindromul Down , sindromul Turner și sindromul Marfan . Defectele cardiace congenitale sunt împărțite în două grupe principale: defecte cardiace cianotice și defecte cardiace necianotice , în funcție de faptul dacă copilul are potențialul de a deveni de culoare albăstruie. Defectele pot implica pereții interiori ai inimii, valvele inimii sau vasele mari de sânge care duc către și din inimă.
Defectele cardiace congenitale sunt parțial prevenibile prin vaccinarea împotriva rubeolei , adăugarea de iod la sare și adăugarea de acid folic la anumite produse alimentare. Unele defecte nu au nevoie de tratament. Alții pot fi tratați în mod eficient cu proceduri bazate pe cateter sau chirurgie cardiacă . Ocazional pot fi necesare mai multe operații sau poate fi necesar un transplant de inimă . Cu un tratament adecvat, rezultatele sunt în general bune, chiar și cu probleme complexe.
Defectele congenitale ale inimii sunt cele mai frecvente defecte congenitale . În 2015, erau prezenți la 48,9 milioane de oameni la nivel global. Acestea afectează între 4 și 75 la 1.000 de nașteri vii, în funcție de modul în care sunt diagnosticate. În aproximativ 6 până la 19 la 1.000 provoacă un grad moderat până la sever de probleme. Defectele cardiace congenitale sunt principala cauză a deceselor legate de defectele congenitale: în 2015, acestea au dus la 303.300 decese, în scădere față de 366.000 decese în 1990.
semne si simptome
Semnele și simptomele sunt legate de tipul și severitatea defectului cardiac. Simptomele apar frecvent la începutul vieții, dar este posibil ca unele CHD să rămână nedetectate de-a lungul vieții. Unii copii nu prezintă semne, în timp ce alții pot prezenta dificultăți de respirație, cianoză , leșin , suflu cardiac , subdezvoltarea membrelor și mușchilor, hrănire sau creștere slabă sau infecții respiratorii. Defectele congenitale ale inimii provoacă o structură anormală a inimii, ducând la producerea anumitor sunete numite murmur cardiac . Acestea pot fi uneori detectate prin auscultare ; cu toate acestea, nu toate murmururile cardiace sunt cauzate de defecte cardiace congenitale.
Condiții asociate
Defectele cardiace congenitale sunt asociate cu o incidență crescută a altor șapte afecțiuni medicale specifice, denumite împreună asociația VACTERL :
- V - Anomalii vertebrale
- A - Atrezia anală
- C - Anomalii cardiovasculare
- T - Fistula traheoesofagiană
- E - Atrezia esofagiană
- R - Anomalii renale (renale) și / sau radiale
- L - Defecte ale membrelor
Defectul septal ventricular (VSD), defectele septului atrial și tetralogia Fallot sunt cele mai frecvente defecte cardiace congenitale observate în asocierea VACTERL. Defectele mai puțin frecvente în asociere sunt trunchiul arterios și transpunerea arterelor mari.
Cauze
Cauza bolilor cardiace congenitale poate fi genetică, de mediu sau o combinație a ambelor.
Genetic
Mutațiile genetice , adesea sporadice, reprezintă cea mai mare cauză cunoscută de defecte cardiace congenitale. Acestea sunt descrise în tabelul de mai jos.
| Leziuni genetice | Procent atribuibil | Exemple | Metoda de testare genetică primară |
|---|---|---|---|
| Aneuploidii | 5-8% | Trisomii autozomale supraviețuitoare (cromozomii 13 , 18 , 21 ), monosomia cromozomului X (sindromul Turner) | Cariotipare |
| Copiați variante de număr | 10-12% | 22q11.2 ștergere / duplicare (velocardiofacial / sindrom DiGeorge) , 1 q21.1 ștergere / duplicare , 8p23.1 ștergere / duplicare , 15q11.2 ștergere (sindrom Burnside-Butler) | Hibridizare genomică comparativă a matricei (cunoscută și sub numele de analiza cromozomială a microarraysului) |
| Varianta moștenită de codificare a proteinelor cu un singur nucleotid (SNV) sau inserție / deleție mică (indel) | 3-5% | Sindromul Holt-Oram , sindromul Noonan , sindromul Alagille | Panoul de gene |
| SNV sau indel de codificare a proteinelor de novo | ~ 10% | Mutații la gene puternic exprimate în timpul dezvoltării inimii | Secvențierea întregului exom |
Căi moleculare
Genele care reglementează secvența complexă de dezvoltare au fost doar parțial elucidate. Unele gene sunt asociate cu defecte specifice. O serie de gene au fost asociate cu manifestări cardiace. Mutațiile unei proteine ale mușchiului cardiac, lanțul greu α-miozină ( MYH6 ) sunt asociate cu defecte ale septului atrial. Mai multe proteine care interacționează cu MYH6 sunt, de asemenea, asociate cu defecte cardiace. Factorul de transcriere GATA4 formează un complex cu Tbx5 care interacționează cu MYH6. Un alt factor, gena homeobox (de dezvoltare), NKX2-5 interacționează, de asemenea, cu MYH6. Mutațiile tuturor acestor proteine sunt asociate atât cu defecte septale atriale, cât și ventriculare; În plus, NKX2-5 este asociat cu defecte ale conducției electrice a inimii, iar TBX5 este legat de sindromul Holt-Oram, care include defecte de conducere electrică și anomalii ale membrului superior. Wnt semnalizare co-factori BCL9 , BCL9L și PYGO ar putea fi o parte a acestei cai moleculare, ca atunci cand genele lor sunt mutante, aceasta cauzează fenotipuri similare cu trăsăturile prezente în sindromul Holt-Oram . O altă genă T-box, TBX1 , este implicată în sindromul velo-cardio-facial Sindromul DiGeorge , cea mai frecventă deleție care are simptome extinse, inclusiv defecte ale tractului de ieșire cardiacă, inclusiv tetralogia Fallot .
| MYH6 | GATA4 | NKX2-5 | TBX5 | TBX1 | |
|---|---|---|---|---|---|
| Locus | 14q11.2-q13 | 8p23.1-p22 | 5q34 | 12q24.1 | 22q11.2 |
| Sindromul | Holt-Oram | DiGeorge | |||
| Defecte ale septului atrial | ✔ | ✔ | ✔ | ✔ | |
| Defecte septale ventriculare | ✔ | ✔ | ✔ | ||
| Anomalii ale conducerii electrice | ✔ | ✔ | |||
| Anomalii ale tractului de ieșire | ✔ | ||||
| Manifestări non-cardiace | Anomalii ale membrelor superioare | Mici sau absente timus mici sau absente paratiroide anomalii faciale |
Calea de semnalizare a crestăturii , un mecanism de reglementare pentru creșterea și diferențierea celulelor , joacă un rol larg în mai multe aspecte ale dezvoltării cardiace. Elementele de crestătură sunt implicate în determinarea părților drepte și stângi ale planului corpului, astfel încât plierea direcțională a tubului cardiac poate fi afectată. Semnalizarea crestăturii este implicată la începutul formării pernelor endocardice și continuă să fie activă pe măsură ce se dezvoltă în septuri și valve. De asemenea, este implicat în dezvoltarea peretelui ventricular și a conexiunii tractului de ieșire la marile vase. Mutațiile genei pentru unul dintre liganzii de notch, Jagged1 , sunt identificate în majoritatea cazurilor examinate de displazie arteriohepatică ( sindrom Alagille ), caracterizate prin defecte ale vaselor mari (stenoza arterei pulmonare), a inimii ( tetralogia Fallot în 13%) de cazuri), ficat, ochi, față și oase. Deși mai puțin de 1% din toate cazurile, în care nu se găsesc defecte în gena Jagged1 , defecte se găsesc în gena Notch2 . În 10% din cazuri, nu se găsește nicio mutație în nici una dintre gene. Pentru un alt membru al familiei de gene , mutațiile genei Notch1 sunt asociate cu supapa aortică bicuspidă , o supapă cu două pliante în loc de trei. Notch1 este, de asemenea, asociat cu calcificarea valvei aortice, a treia cea mai frecventă cauză a bolilor de inimă la adulți.
Mutațiile unui mecanism de reglare celulară, calea Ras / MAPK sunt responsabile pentru o varietate de sindroame, inclusiv sindromul Noonan , sindromul LEOPARD , sindromul Costello și sindromul cardiofaciocutanat în care există implicare cardiacă. În timp ce condițiile enumerate sunt cauze genetice cunoscute, există probabil multe alte gene care sunt mai subtile. Se știe că riscul de defecte cardiace congenitale este mai mare atunci când există o rudă apropiată cu una.
De mediu
Factorii de mediu cunoscuți includ anumite infecții în timpul sarcinii, cum ar fi rubeola , droguri ( alcool , hidantoină , litiu și talidomidă ) și boli materne ( diabet zaharat , fenilcetonurie și lupus eritematos sistemic ). Expunerea la alcool la tată pare, de asemenea, să crească riscul de defecte congenitale ale inimii.
A fi supraponderal sau obez crește riscul de boli congenitale ale inimii. În plus, pe măsură ce crește obezitatea maternă , crește și riscul de defecte cardiace. Nu a fost identificat un mecanism fiziologic distinct pentru a explica legătura dintre obezitatea maternă și boala coronariană, dar atât deficitul de folat pre-sarcină cât și diabetul au fost implicate în unele studii.
Mecanism
Există o secvență complexă de evenimente care au ca rezultat o inimă bine formată la naștere și întreruperea oricărei porțiuni poate duce la un defect. Momentul ordonat al creșterii celulare, al migrației celulare și al morții celulare programate („ apoptoza ”) a fost studiat pe larg și genele care controlează procesul sunt elucidate. În jurul zilei 15 de dezvoltare, celulele care vor deveni inima există în două benzi în formă de potcoavă ale stratului de țesut mediu ( mezoderm ), iar unele celule migrează dintr-o porțiune a stratului exterior ( ectoderm ), creasta neuronală , care este sursă a unei varietăți de celule găsite în tot corpul. În ziua 19 de dezvoltare, se formează o pereche de elemente vasculare, „tuburile endocardice”. Tuburile se fuzionează atunci când celulele sunt supuse morții programate, iar celulele din primul câmp cardiac migrează către tub și formează un inel de celule cardiace ( miocite ) în jurul acestuia până în ziua 21. În ziua 22, inima începe să bată și de zi cu zi 24, sângele circulă.
În ziua 22, sistemul circulator este bilateral simetric, cu vase pereche pe fiecare parte și inima constând dintr-un tub simplu situat în linia mediană a structurii corpului. Porțiunile care vor deveni atria și vor fi situate cel mai aproape de cap sunt cele mai îndepărtate de cap. Din zilele 23 până la 28, tubul inimii se pliază și se răsucește, cu viitorii ventriculi care se mișcă la stânga centrului (locația finală a inimii) și atriile care se deplasează spre cap.
În ziua 28, zonele de țesut din tubul inimii încep să se extindă spre interior; după aproximativ două săptămâni, aceste expansiuni, „ septul primum ” membranos și „ pernele endocardice ” musculare , fuzionează pentru a forma cele patru camere ale inimii. Dacă nu se fuzionează corect va rezulta un defect care poate permite scurgerea sângelui între camere. După ce acest lucru se întâmplă, celulele care au migrat de pe creasta neuronală încep să împartă bulbul cordis , tractul principal de ieșire este împărțit în două prin creșterea unui sept spiralat, devenind marile vase - segmentul ascendent al aortei și trunchiul pulmonar. Dacă separarea este incompletă, rezultatul este un „trunchi arterios persistent”. Vasele pot fi inversate („ transpunerea marilor vase ”). Cele două jumătăți ale tractului divizat trebuie să migreze în pozițiile corecte peste ventriculii corespunzători. O defecțiune poate duce la scurgerea de sânge în vasul greșit (de exemplu, aorta suprasolicitată ). Inima cu patru camere și marile vase au caracteristici necesare pentru creșterea fetală . Plămânii nu sunt extinși și nu pot găzdui volumul circulator complet. Există două structuri pentru a evita fluxul de sânge departe de plămâni. Celulele dintr-o parte a septului primum mor creând o gaură în timp ce celulele musculare, „ septul secundum ”, cresc de-a lungul părții atriale drepte a septului primum, cu excepția unei regiuni, lăsând un spațiu prin care sângele poate trece de la artiumul drept la atriul stâng, foramenul oval . Un vas mic, ductus arteriosus permite sângelui din artera pulmonară să treacă în aortă.
Modificări la naștere
Ductul arterios rămâne deschis din cauza factorilor circulanți, inclusiv a prostaglandinelor . Foramenul oval rămâne deschis din cauza fluxului de sânge de la atriul drept la atriul stâng. Pe măsură ce plămânii se extind, sângele curge ușor prin plămâni și porțiunea membranoasă a foramenului oval (septul primum) cade peste porțiunea musculară (septul secundum). Dacă închiderea este incompletă, rezultatul este un brevet foramen ovale . Cele două clape pot fuziona, dar mulți adulți au un foramen ovale care rămâne închis doar din cauza diferenței de presiune dintre atrii.
Teorii
Rokitansky (1875) a explicat defectele cardiace congenitale ca pauze în dezvoltarea inimii în diferite etape de ontogeneză . Spitzer (1923) le tratează ca reveniri la una dintre etapele filogenezei . Krimski (1963), sintetizând două puncte de vedere anterioare, a considerat bolile congenitale ale inimii ca o oprire a dezvoltării la un anumit stadiu al ontogenezei, corespunzător acestei sau acelei etape a filogenezei. Prin urmare, aceste teorii pot explica doar tipurile de defecte feminine și neutre.
Diagnostic
Multe defecte cardiace congenitale pot fi diagnosticate prenatal prin ecocardiografie fetală . Acesta este un test care poate fi făcut în timpul celui de-al doilea trimestru de sarcină, când femeia este însărcinată cu aproximativ 18-24 săptămâni. Poate fi o ecografie abdominală sau ecografie transvaginală .
Dacă un copil se naște cu boli cardiace cianotice, diagnosticul se face de obicei la scurt timp după naștere datorită culorii albastre a pielii lor (numită cianoză).
Dacă un copil se naște cu un defect de sept sau un defect de obstrucție, adesea simptomele lor sunt vizibile numai după câteva luni sau uneori chiar și după mulți ani.
Clasificare
Există o serie de sisteme de clasificare pentru defectele cardiace congenitale. În 2000, Nomenclatura Internațională Congenitală a Chirurgiei Inimii a fost dezvoltată pentru a oferi un sistem de clasificare generică.
Hipoplazie
Hipoplazia poate afecta inima, rezultând de obicei subdezvoltarea ventriculului drept sau a ventriculului stâng . Acest lucru face ca doar o parte a inimii să fie capabilă să pompeze sânge în mod eficient în corp și plămâni . Hipoplazia inimii este rară, dar este cea mai gravă formă de CHD. Se numește sindrom hipoplazic al inimii stângi atunci când afectează partea stângă a inimii și sindrom hipoplastic al inimii drepte când afectează partea dreaptă a inimii. În ambele condiții, prezența unui canal arterial patent (și, atunci când hipoplazia afectează partea dreaptă a inimii, un foramen ovale brevetat ) este vitală pentru capacitatea sugarului de a supraviețui până când se poate efectua o intervenție chirurgicală cardiacă de urgență, deoarece fără aceste căi sângele nu poate circula către corp (sau plămâni, în funcție de ce parte a inimii este defectă). Hipoplazia inimii este în general un defect cardiac cianotic .
Defecte obstructive
Defectele obstructive apar atunci când valvele cardiace, arterele sau venele sunt anormal de înguste sau blocate . Defectele frecvente includ stenoza pulmonară , stenoza aortică și coarctarea aortei , alte tipuri, cum ar fi stenoza valvei aortice bicuspide și stenoza subaortică fiind relativ rare. Orice îngustare sau blocaj poate provoca mărirea inimii sau hipertensiune .
Defecte septale
Septul este un perete de tesut care separa inima stanga de inima dreapta . Defectele din septul interatrial sau septul interventricular permit sângelui să curgă din partea stângă a inimii spre dreapta, reducând eficiența inimii. Defectele septale ventriculare sunt colectiv cel mai frecvent tip de CHD, deși aproximativ 30% dintre adulți au un tip de defect septal atrial numit sonda brevetului foramen ovale .
Defecte cianotice
Defectele cardiace cianotice sunt denumite astfel deoarece au ca rezultat cianoză , o decolorare a gri-albăstrui a pielii din cauza lipsei de oxigen din organism. Astfel de defecte includ trunchiul arterios persistent , conexiunea venoasă pulmonară anomală totală , tetralogia Fallot , transpunerea marilor vase și atrezia tricuspidă .
Defecte
- Stenoza aortica
- Defect septal atrial (ASD)
- Defect de sept atrioventricular (AVSD)
- Valvă aortică bicuspidă
- Cardiomiopatia
- Bloc cardiac complet (CHB)
- Dextrocardia
- Ventricul stâng cu intrare dublă (DILV)
- Ventriculul drept cu dublă ieșire (DORV)
- Anomalia lui Ebstein
- Sindromul hipoplastic al inimii stângi (HLHS)
- Sindromul hipoplastic al inimii drepte (HRHS)
- Stenoza mitrală
- Trunchiul arterios persistent
- Atrezia pulmonară
- Stenoză pulmonară
- Rabdomioame (Tumori ale inimii)
-
Transpunerea marilor vase
- dextro-Transpunerea arterelor mari (d-TGA)
- levo-Transpunerea marilor artere (l-TGA)
- Atrezia tricuspidă
- Defect septal ventricular (VSD)
- Sindromul Wolff-Parkinson-White (WPW)
Unele afecțiuni afectează marile vase sau alte vase aflate în imediata apropiere a inimii, dar nu și a inimii în sine, dar sunt adesea clasificate ca defecte cardiace congenitale.
- Coarctația aortei (CoA)
- Arc dublu aortic , artera subclaviană aberantă și alte malformații ale arterelor mari
- Arc aortic întrerupt (IAA)
- Brevet ductus arteriosus (PDA)
- Sindromul scimitar (SS)
Unele constelații de defecte multiple sunt frecvent întâlnite împreună.
- Tetralogia lui Fallot (ToF)
- Pentalogia lui Cantrell
- Sindromul Shone / Complexul Shone / Anomalia Shone
Tratament
CHD poate necesita intervenții chirurgicale și medicamente. Medicamentele includ diuretice, care ajută organismul să elimine apa, sărurile și digoxina pentru întărirea contracției inimii. Acest lucru încetinește bătăile inimii și elimină puțin lichid din țesuturi. Unele defecte necesită proceduri chirurgicale pentru restabilirea circulației la normal și, în unele cazuri, sunt necesare mai multe intervenții chirurgicale.
Cardiologia intervențională oferă acum pacienților alternative minim invazive la intervenția chirurgicală pentru unii pacienți. Valva pulmonară transcateter cu melodie (TPV), aprobată în Europa în 2006 și în SUA în 2010 în baza unei scutiri de dispozitive umanitare (HDE), este concepută pentru a trata pacienții cu boli cardiace congenitale cu o conductă disfuncțională în tractul lor de ieșire ventricular drept (RVOT) . RVOT este legătura dintre inimă și plămâni; odată ce sângele ajunge în plămâni, acesta este îmbogățit cu oxigen înainte de a fi pompat în restul corpului. Tehnologia valvei pulmonare Transcatheter oferă un mijloc mai puțin invaziv de a prelungi durata de viață a unei conducte RVOT eșuate și este concepută pentru a permite medicilor să livreze o valvă pulmonară de înlocuire printr-un cateter prin vasele de sânge ale pacientului.
Mulți oameni necesită îngrijire cardiacă specializată pe tot parcursul vieții, mai întâi cu un cardiolog pediatric și mai târziu cu un cardiolog congenital pentru adulți. Există mai mult de 1,8 milioane de adulți care trăiesc cu defecte cardiace congenitale.
Epidemiologie
Defectele cardiace sunt printre cele mai frecvente defecte congenitale , apărând la 1% din nașterile vii (2-3% inclusiv valva aortică bicuspidă). În 2013, 34,3 milioane de persoane aveau CHD. În 2010, au rezultat 223.000 de decese, în scădere față de 278.000 de decese în 1990.
Pentru defectele cardiace congenitale care apar fără antecedente familiale ( de novo ), riscul de recurență la descendenți este de 3-5%. Acest risc este mai mare în obstrucțiile tractului de ieșire ventriculară stângă, heterotaxie și defecte septale atrioventriculare.
Terminologie
Defectele cardiace congenitale sunt cunoscute printr-o serie de nume, inclusiv anomalii cardiace congenitale, boli cardiace congenitale, defecte cardiace și malformații cardiovasculare congenitale.
Vezi si
Referințe
linkuri externe
| Clasificare | |
|---|---|
| Resurse externe |
- Defect cardiac congenital la Curlie
- Informații despre boli cardiace congenitale pentru părinți.