Criptococoză - Cryptococcosis
| Criptococoza | |
|---|---|
| Alte nume | Boala Busse-Buschke, meningita criptococică, plămânul criptococozei, pielea criptococozei, Blastomicoza europeană, meningita torulară, toruloza |
 | |
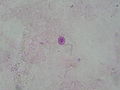
| Micrografie a criptococozei care prezintă capsula groasă caracteristică a criptococului. Pata de câmp . | |
| Pronunție | |
| Specialitate | Boală infecțioasă |
| Simptome |
|
| Cauze | Cryptococcus neoformans , Cryptococcus gattii |
| Factori de risc | HIV / SIDA |
| Metoda de diagnosticare | Biopsie , cultură |
| Tratament | Medicație antifungică |
| Medicament | |
Criptococoza este o infecție fungică potențial fatală în principal în plămâni , prezentându-se ca o pneumonie și creier , unde apare ca o meningită . Tuse , dificultăți de respirație , dureri în piept și febră sunt observate atunci când plămânii sunt infectați. Când creierul este infectat, simptomele includ dureri de cap , febră, dureri de gât , greață și vărsături , sensibilitate la lumină și confuzie sau modificări de comportament. Poate afecta și alte părți ale corpului, inclusiv pielea , unde poate apărea ca mai mulți noduli umpluți cu lichid cu țesut mort .
Aceasta este cauzată de fungi Cryptococcus neoformans sau mai puțin frecvent Cryptococcus gattii , și este achiziționată de respirație în a spori de aer. Aceste ciuperci se găsesc în întreaga lume în sol, lemn în descompunere, excremente de porumbei și în adânciturile unor specii de copaci. În timp ce C. neoformans infectează în general persoanele cu HIV / SIDA și pe cei care iau medicamente imunosupresoare și nu afectează de obicei persoanele în formă și sănătoase, C. gattii (care se găsește în unele părți din Canada și SUA) face acest lucru. Odată respirați, celulele de drojdie uscate colonizează plămânii, unde sunt fie curățați de celulele imune , stau latente, fie provoacă infecții și se răspândesc.
Diagnosticul se face prin izolarea Cryptococcus dintr-un eșantion de țesut afectat sau prin observarea directă a ciupercii prin utilizarea colorării fluidelor corporale. Poate fi cultivat dintr-un lichid cefalorahidian , spută și biopsie cutanată . Tratamentul este cu fluconazol sau amfotericină B .
Datele din 2009 au estimat că din cele aproape un milion de cazuri de meningită criptococică care au apărut anual la nivel mondial, 700.000 au avut loc în Africa subsahariană și 600.000 pe an au murit. Criptococoza a fost rară înainte de anii 1970, când s-a înregistrat o creștere a grupurilor cu risc cum ar fi persoanele cu transplant de organe sau medicamentele imunosupresoare . Numărul de cazuri a crescut la mijlocul anilor 1980, peste 80% apărând la persoanele cu HIV / SIDA .
Clasificare
Cryptococcus este, în general, clasificat în funcție de modul în care este dobândit și de locul său. De obicei, începe în plămâni înainte de a se răspândi în alte părți ale corpului, în special creierul și sistemul nervos. Tipul de piele este mai puțin frecvent.
semne si simptome
Tuse, dificultăți de respirație, dureri în piept și febră se văd atunci când plămânii sunt infectați, apărând ca o pneumonie. De asemenea, poate exista senzație de oboseală . Când creierul este infectat, simptomele includ dureri de cap, febră, dureri de gât, greață și vărsături, sensibilitate la lumină, confuzie sau schimbări de comportament. Poate afecta și alte părți ale corpului, inclusiv pielea, ochii, oasele și prostata. În piele, poate apărea ca mai mulți noduli umpluți cu lichid cu țesut mort . În funcție de locul infecției, alte caracteristici pot include pierderea vederii , vedere încețoșată , incapacitatea de a mișca un ochi și pierderea memoriei.
Debutul simptomelor este adesea brusc când plămânii sunt infectați și treptat timp de câteva săptămâni când sistemul nervos central este afectat.
Cauză
Criptococoza este o infecție oportunistă definitorie pentru SIDA și este a doua cea mai frecventă boală care definește SIDA în Africa . Alte afecțiuni care prezintă un risc crescut includ anumite limfoame (de exemplu, limfom Hodgkin ), sarcoidoză , ciroză hepatică și pacienți tratați cu corticosteroizi pe termen lung .
Distribuția se face la nivel mondial în sol. Prevalența criptococozei a crescut în ultimii 20 de ani din mai multe motive, inclusiv creșterea incidenței SIDA și utilizarea extinsă a medicamentelor imunosupresoare.
La om, C. neoformans provoacă trei tipuri de infecții:
- Wound sau cutanate criptococoză
- Criptococoză pulmonară
- Meningita criptococică .
Criptococoză cutanată primară
Criptococoza cutanată primară (PCC) este un diagnostic clinic distinct separat de criptococoza cutanată secundară care se răspândește de la infecția sistematică. Bărbații sunt mai predispuși să dezvolte infecția, iar un studiu din 2020 a arătat că tendința sexuală se poate datora unui hormon de creștere, produs de C. neoformans numit acid gibberelic (GA) care este reglat în sus de testosteron. Membrele superioare reprezintă majoritatea infecțiilor. Izolatele găsite în PCC includ Cryptococcus neoformans (cele mai frecvente), Cryptococcus gattii și Cryptococcus laurentii . Prognosticul pentru PCC este în general bun în afara infecției diseminate.
Descrierea morfologică a leziunilor prezintă papule ombilicate, noduli și plăci violacee care pot imita alte boli cutanate precum molluscum contagiosum și sarcomul Kaposi . Aceste leziuni pot fi prezente cu luni înainte de alte semne de infecție a sistemului la pacienții cu SIDA.
Se cunoaște că crescătorii de porumbei (sau crescătorii) au o incidență ridicată a infecțiilor criptococice, inclusiv PCC, datorită asocierii Cryptococcus cu excremente de porumbei.
Criptococoza pulmonară
Criptococul (atât C. neoformans, cât și C. gattii ) joacă un rol comun în micoza invazivă pulmonară observată la adulții cu HIV și alte afecțiuni imunodeprimate. De asemenea, afectează adulții sănătoși la o frecvență și o severitate mult mai mici, deoarece gazdele sănătoase nu pot avea simptome sau ușoare. Gazdele imune-competente pot să nu solicite sau să necesite tratament, dar poate fi importantă observarea atentă. Pneumonia criptococică are potențialul de diseminare în sistemul nervos central (SNC), în special la persoanele imunodeprimate.
Criptococoza pulmonară are o distribuție la nivel mondial și este de obicei subdiagnosticată din cauza limitărilor capacităților de diagnostic. Deoarece nodulii pulmonari sunt cea mai comună caracteristică radiologică, poate imita clinic și radiologic cancerul pulmonar, TBC și alte micoze pulmonare. Sensibilitatea culturilor și antigenul criptococic (CrAg) cu dispozitiv de curgere laterală pe ser sunt rareori pozitive în absența bolii diseminate. Mai mult, criptococoza pulmonară agravează prognosticul meningitei criptococice.
Meningita criptococică
Se crede că meningita criptococică (infecția meningelor , țesutul care acoperă creierul) rezultă din diseminarea ciupercii fie dintr-o infecție pulmonară observată, fie neapreciată. Deseori, există și diseminare silențioasă în tot creierul atunci când este prezentă meningita. Cryptococcus gattii provoacă infecții la persoane imunocompetente ( care funcționează pe deplin sistemul imunitar ), dar neoformans C. v. Grubii , și v. Neoformans determina de obicei numai infecții evidente clinic la persoanele cu o formă de defect în sistemele lor imunitar (persoanele cu imunitate compromisa). Persoanele cu defecte ale imunității lor mediată celular , de exemplu, persoanele cu SIDA , sunt deosebit de susceptibile la criptococoză diseminată. Criptococoza este adesea fatală, chiar dacă este tratată. Se estimează că rata mortalității la trei luni este de 9% în regiunile cu venituri mari, 55% în regiunile cu venituri mici / medii și 70% în Africa subsahariană. Începând cu 2009, la nivel global au existat aproximativ 958.000 de cazuri anuale și 625.000 de decese în termen de trei luni de la infecție.
Deși cea mai frecventă prezentare a criptococozei este infecția cu C. neoformans la o persoană imunocompromisă (cum ar fi persoanele care trăiesc cu SIDA), C. gattii este din ce în ce mai recunoscut ca agent patogen în ceea ce se presupune că sunt gazde imunocompetente, în special în Canada și Australia. Acest lucru se poate datora expunerii rare și patogenității ridicate sau defectelor izolate nerecunoscute ale imunității, specifice acestui organism.
Criptococul (atât C. neoformans, cât și C. gattii ) este agentul etiologic dominant și principal al meningitei la adulții cu HIV și este considerat o boală „emergentă” la adulții sănătoși. Deși rata infecției este în mod clar mai mare la indivizii imunocompromiși, unele studii sugerează o rată a mortalității mai mare la pacienții cu meningită non-HIV criptococică secundară rolului reacției și leziunilor mediate de celulele T. Celulele T CD4 + au roluri dovedite în apărarea împotriva Cryptococcus, dar poate contribui și la deteriorarea clinică datorită răspunsului său inflamator.
Diagnostic
În funcție de sindromul infecțios, simptomele includ febră, oboseală, tuse uscată, cefalee, vedere încețoșată și confuzie. Debutul simptomelor este adesea subacut, agravându-se progresiv în decurs de câteva săptămâni. Cele mai frecvente două prezentări sunt meningita (o infecție în și în jurul creierului) și infecția pulmonară (pulmonară).
Orice persoană despre care se constată că are criptococoză într-un loc în afara sistemului nervos central (de exemplu, criptococoză pulmonară), este indicată o puncție lombară pentru a evalua lichidul cefalorahidian (LCR) pentru evidența meningitei criptococice, chiar dacă nu au semne sau simptome ale bolii SNC. Detectarea antigenului criptococic (material capsular) prin cultură de LCR, spută și urină oferă un diagnostic definitiv. Hemoculturile pot fi pozitive în cazul infecțiilor grele. Cerneala indiană a LCR este o metodă microscopică tradițională de diagnostic, deși sensibilitatea este slabă la infecția timpurie și poate rata 15-20% dintre pacienții cu meningită criptococică pozitivă la cultură. Forme morfologice neobișnuite sunt rareori văzute. Antigenul criptococic din lichidul cefalorahidian este cel mai bun test pentru diagnosticarea meningitei criptococice din punct de vedere al sensibilității. În afară de metodele convenționale de detectare, cum ar fi microscopia directă și cultura, metode rapide de diagnosticare pentru detectarea antigenului criptococic prin test de aglutinare cu latex, test imunocromatografic cu flux lateral (LFA) sau imunoanaliză enzimatică (EIA). Un nou antigen criptococic LFA a fost aprobat de FDA în iulie 2011. Reacția în lanț a polimerazei (PCR) a fost utilizată pe specimenele de țesut.
Criptococoza poate să apară rar la persoanele neimunosupresate, în special la Cryptococcus gattii .
Prevenirea
Criptococoza este o infecție foarte subacută cu o fază subclinică prelungită care durează săptămâni până la luni la persoanele cu HIV / SIDA înainte de apariția meningitei simptomatice. În Africa Subsahariană, rata de prevalență a antigenului criptococic detectabil în sângele periferic este adesea de 4-12% la persoanele cu număr de CD4 mai mici de 100 de celule / mcL. Ecranul antigenului criptococic și tratamentul preventiv cu fluconazol sunt economii de costuri pentru sistemul de sănătate, evitând meningita criptococică. Organizația Mondială a Sănătății recomandă screening-ul antigenului criptococic la persoanele infectate cu HIV care intră în îngrijire cu CD4 <100 celule / μL. Această criptococică subclinică nedetectată (dacă nu este tratată preventiv cu terapie antifungică) va continua adesea să dezvolte meningită criptococică, în ciuda tratamentului cu HIV. Criptococoza reprezintă 20-25% din mortalitate după inițierea terapiei HIV în Africa. Ceea ce este un tratament preventiv eficient este necunoscut, cu recomandările actuale privind doza și durata pe baza opiniei experților. Screeningul în Statele Unite este controversat, ghidurile oficiale nu recomandă screening-ul, în ciuda eficienței costurilor și a unei prevalențe de 3% a antigenului criptococic american în CD4 <100 celule / μL.
Profilaxia antifungică, cum ar fi fluconazolul și itraconazolul, reduce riscul de a contracta criptococoză la cei cu număr scăzut de celule CD4 și riscul ridicat de a dezvolta o astfel de boală într-un cadru de teste de screening pentru antigenul criptococic nu sunt disponibile.
Tratament
Opțiunile de tratament la persoanele fără infecție cu HIV nu au fost bine studiate. Amfotericina B intravenoasă combinată cu flucitozina pe cale orală este recomandată pentru tratamentul inițial (terapia de inducție).
Persoanele care trăiesc cu SIDA au adesea o povară mai mare de boală și o mortalitate mai mare (30-70% la 10 săptămâni), dar terapia recomandată este cu amfotericină B și flucitozină . În cazul în care flucitozina nu este disponibilă (multe țări cu venituri mici și medii), fluconazolul trebuie utilizat cu amfotericină. Terapia de inducție bazată pe amfotericină are o activitate microbiologică mult mai mare decât monoterapia cu fluconazol, cu o supraviețuire cu 30% mai bună la 10 săptămâni. Pe baza unei revizuiri sistematice a datelor existente, cel mai rentabil tratament de inducție în setări cu resurse limitate pare a fi o săptămână de amfotericină B cuplată cu doze mari de fluconazol . După tratamentul inițial de inducție ca mai sus, terapia tipică de consolidare este cu fluconazol oral timp de cel puțin 8 săptămâni, utilizată cu profilaxie secundară cu fluconazol după aceea.
Decizia cu privire la momentul începerii tratamentului pentru HIV pare a fi foarte diferită de alte infecții oportuniste. Un studiu mare multi-site susține amânarea ART timp de 4-6 săptămâni a fost, în general, de preferat, cu o supraviețuire cu 15% mai bună la 1 an decât inițierea anterioară a ART la 1-2 săptămâni după diagnostic. O analiză Cochrane din 2018 susține, de asemenea, începutul întârziat al tratamentului până când criptococoza începe să se îmbunătățească cu tratamentul antifungic.
IRIS la cei cu funcție imună normală
Sindrom inflamator de reconstituire imună (IRIS) a fost descrisa in cei cu functie normala a sistemului imunitar cu meningita cauzate de C. gattii și C. grubii . La câteva săptămâni sau chiar luni după tratamentul adecvat, poate exista o deteriorare cu agravarea simptomelor meningitei și progresia sau dezvoltarea de noi simptome neurologice. IRIS este totuși mult mai frecvent la cei cu funcție imună slabă (~ 25% față de ~ 8%). Imagistica prin rezonanță magnetică arată creșterea dimensiunii leziunilor cerebrale, iar anomaliile LCR (număr de celule albe, proteine, glucoză) cresc. Aspectul radiografic al leziunilor cerebrale IRIS criptococice poate imita cel al toxoplasmozei cu leziuni care îmbunătățesc inelul pe tomografia computerizată a capului (CT). Cultura LCR este sterilă și nu există o creștere a titrului antigenului criptococic al LCR.
Inflamația în creștere poate provoca leziuni ale creierului sau poate fi fatală.
Mecanismul din spatele IRIS în meningita criptococică este în primul rând imunologic. Odată cu inversarea imunosupresiei, există o inflamație paradoxală crescută, deoarece sistemul imunitar în recuperare recunoaște ciuperca. În cazurile severe de IRIS, a fost utilizat tratamentul cu corticosteroizi sistemici - deși lipsesc datele bazate pe dovezi.
Epidemiologie
Datele din 2009 au estimat că din cele aproape un milion de cazuri de meningită criptococică care au avut loc la nivel mondial anual, 700.000 au avut loc în Africa subsahariană și 600.000 pe an au murit.
Alte animale
Criptococoza se observă și la pisici și, ocazional, la câini. Este cea mai frecventă boală fungică profundă la pisici, de obicei ducând la infecții cronice ale nasului și sinusurilor, precum și ulcere ale pielii. Pisicile pot dezvolta o umflătură peste puntea nasului din cauza inflamației locale a țesuturilor. Poate fi asociat cu infecția cu FeLV la pisici. Criptococoza este cea mai frecventă la câini și pisici, dar bovinele, ovinele, caprele, caii, animalele sălbatice și păsările pot fi, de asemenea, infectate. Solul, dejecțiile de păsări și excrementele porumbeilor sunt printre sursele de infecție.
Referințe
Lecturi suplimentare
- Perfect JR și colab. (2010). „Ghiduri de practică clinică pentru gestionarea bolilor criptococice: actualizare 2010 de către societatea de boli infecțioase din America” . Boli infecțioase clinice . 50 (3): 291-322. doi : 10.1086 / 649858 . PMC 5826644 . PMID 20047480 .
- Gullo FP și colab. (2013). „Criptococoză: epidemiologie, rezistență fungică și noi alternative de tratament”. Jurnalul European de Microbiologie Clinică și Boli Infecțioase . 32 (11): 1377–1391. doi : 10.1007 / s10096-013-1915-8 . PMID 24141976 . S2CID 11317427 .
- Perfect JR și colab. (2005). „Cryptococcus neoformans: un ucigaș acoperit cu zahăr cu gene de designer” . Imunologie FEMS și Microbiologie medicală . 45 (11): 395-404. doi : 10.1016 / j.femsim.2005.06.005 . PMID 16055314 . (Revizuire)
linkuri externe
| Clasificare | |
|---|---|
| Resurse externe |