Microscop de fluorescență - Fluorescence microscope
Un microscop cu fluorescență este un microscop optic care folosește fluorescența în loc de împrăștiere , reflexie și atenuare sau absorbție , pentru a studia proprietățile substanțelor organice sau anorganice . „Microscop cu fluorescență” se referă la orice microscop care folosește fluorescența pentru a genera o imagine, indiferent dacă este vorba despre un set simplu, cum ar fi un microscop cu epifluorescență sau un design mai complicat, cum ar fi un microscop confocal , care utilizează secționarea optică pentru a obține o rezoluție mai bună a imaginii de fluorescență. .
Principiu
Specimenul este iluminat cu lumină cu o lungime de undă specifică (sau lungimi de undă) care este absorbită de fluorofori , determinându-i să emită lumină cu lungimi de undă mai mari (adică, de o culoare diferită de lumina absorbită). Lumina de iluminare este separată de fluorescența emisă mult mai slabă prin utilizarea unui filtru de emisie spectrală. Componentele tipice ale unui microscop cu fluorescență sunt o sursă de lumină ( lampa cu arc de xenon sau lampa cu vapori de mercur sunt obișnuite; formele mai avansate sunt LED - uri și lasere de mare putere ), filtrul de excitație , oglinda dicroică (sau splitter de fascicul dicroic ) și emisia filtru (vezi figura de mai jos). Filtrele și distribuitorul de fascicule dicroice sunt alese pentru a se potrivi cu excitația spectrală și caracteristicile de emisie ale fluoroforului utilizat pentru etichetarea eșantionului. În acest mod, distribuția unui singur fluorofor (culoare) este reprezentată simultan. Imaginile multicolore ale mai multor tipuri de fluorofori trebuie compuse prin combinarea mai multor imagini monocolore.
Majoritatea microscoapelor cu fluorescență utilizate sunt microscopuri cu epifluorescență, unde excitația fluoroforului și detectarea fluorescenței se fac pe aceeași cale luminoasă (adică prin obiectiv). Aceste microscopuri sunt utilizate pe scară largă în biologie și stau la baza unor modele mai avansate de microscop, cum ar fi microscopul confocal și microscopul de fluorescență cu reflecție internă totală (TIRF).
Microscopie epifluorescentă
Majoritatea microscoapelor cu fluorescență, în special cele utilizate în științele vieții , sunt de designul epifluorescenței prezentat în diagramă. Lumina lungimii de undă de excitație luminează specimenul prin obiectivul obiectiv. Fluorescența emisă de specimenul este focalizat la detectorul de același obiectiv , care este utilizat pentru excitarea care de rezoluție mai mare va avea nevoie de lentile obiectiv cu mai mare deschidere numerică . Deoarece cea mai mare parte a luminii de excitație este transmisă prin eșantion, numai lumina de excitare reflectată atinge obiectivul împreună cu lumina emisă și metoda de epifluorescență oferă un raport semnal-zgomot ridicat. Distribuitorul de fascicule dicroice acționează ca un filtru specific lungimii de undă, transmițând lumina fluorescată către ocular sau detector, dar reflectând orice lumină de excitație rămasă înapoi spre sursă.
Surse de lumină
Microscopia cu fluorescență necesită o iluminare intensă, aproape monocromatică, pe care unele surse de lumină larg răspândite, cum ar fi lămpile cu halogen, nu le pot oferi. Sunt utilizate patru tipuri principale de surse de lumină, inclusiv lămpile cu arc de xenon sau lămpile cu vapori de mercur cu filtru de excitație , lasere , surse de supercontinuu și LED - uri de mare putere . Laserele sunt cele mai utilizate pe scară largă pentru tehnici de microscopie cu fluorescență mai complexe, cum ar fi microscopia confocală și microscopia cu fluorescență cu reflexie internă totală, în timp ce lămpile cu xenon și lămpile cu mercur și LED-urile cu filtru de excitație dicroică sunt utilizate în mod obișnuit pentru microscopii de epifluorescență cu câmp larg. Prin plasarea a două rețele de microlentile în calea de iluminare a unui microscop de epifluorescență în câmp larg, se poate realiza o iluminare foarte uniformă, cu un coeficient de variație de 1-2%.
pregătirea unei mostre
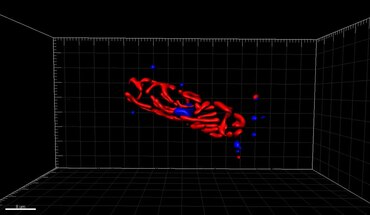
Afișează suprapuneri de la patru canale fluorescente
(b) Cyan: [fluorescența PLL-A546] - contracolor generic pentru vizualizarea suprafețelor celulelor eucariote
(c) Albastru: [Fluorescența Hoechst] - colorează ADN-ul, identifică nucleele
(d) Roșu: [autofluorescența clorofilei] - rezolvă cloroplastele

Pentru ca o probă să fie adecvată pentru microscopia fluorescentă, aceasta trebuie să fie fluorescentă. Există mai multe metode de creare a unei probe fluorescente; principalele tehnici sunt etichetarea cu pete fluorescente sau, în cazul probelor biologice, exprimarea unei proteine fluorescente . Alternativ, poate fi utilizată fluorescența intrinsecă a unei probe (adică autofluorescența ). În științele vieții microscopia fluorescentă este un instrument puternic care permite colorarea specifică și sensibilă a unui specimen pentru a detecta distribuția proteinelor sau a altor molecule de interes. Ca rezultat, există o gamă variată de tehnici pentru colorarea fluorescentă a probelor biologice.
Petele fluorescente biologice
Multe pete fluorescente au fost proiectate pentru o serie de molecule biologice. Unele dintre acestea sunt molecule mici, care sunt intrinsec fluorescente și leagă o moleculă biologică de interes. Exemple majore ale acestora sunt petele de acid nucleic precum DAPI și Hoechst (excitate de lumina cu lungimea de undă UV) și DRAQ5 și DRAQ7 (excitate optim de lumina roșie) care leagă șanțurile minore ale ADN-ului , marcând astfel nucleele celulelor. Altele sunt medicamente, toxine sau peptide care leagă structuri celulare specifice și au fost derivatizate cu un reporter fluorescent. Un exemplu major al acestei clase de colorare fluorescentă este faloidina , care este utilizată pentru colorarea fibrelor de actină din celulele mamiferelor . O nouă peptidă, cunoscută sub numele de peptidă de hibridizare a colagenului , poate fi, de asemenea, conjugată cu fluorofori și utilizată pentru colorarea fibrelor de colagen denaturate . Colorarea pereților celulelor plantei se realizează folosind pete sau coloranți care leagă celuloza sau pectina . Căutarea sondelor fluorescente cu o specificitate ridicată care să permită, de asemenea, imagistica în direct a celulelor vegetale este în curs de desfășurare.
Există multe molecule fluorescente numite fluorofori sau fluorocromi precum fluoresceina , Alexa Fluors sau DyLight 488 , care pot fi legate chimic de o moleculă diferită care leagă ținta de interes din cadrul probei.
Imunofluorescența
Imunofluorescența este o tehnică care folosește legarea foarte specifică a unui anticorp de antigenul său pentru a marca anumite proteine sau alte molecule din celulă. O probă este tratată cu un anticorp primar specific moleculei de interes. Un fluorofor poate fi conjugat direct cu anticorpul primar. Alternativ , poate fi utilizat un anticorp secundar , conjugat la un fluorofor, care se leagă în mod specific la primul anticorp. De exemplu, un anticorp primar crescut la un șoarece care recunoaște tubulina combinat cu un anticorp secundar anti-șoarece derivatizat cu un fluorofor ar putea fi utilizat pentru a marca microtubuli într-o celulă.
Proteine fluorescente
Înțelegerea modernă a geneticii și tehnicile disponibile pentru modificarea ADN-ului permit oamenilor de știință să modifice genetic proteinele pentru a purta și un reporter de proteine fluorescente. În probele biologice, acest lucru permite unui om de știință să producă în mod direct o proteină de interes fluorescentă. Localizarea proteinei poate fi apoi urmărită direct, inclusiv în celulele vii.
Limitări
Fluoroforii își pierd capacitatea de fluorescență, deoarece sunt iluminate într-un proces numit albire foto . Fotoblanșarea are loc pe măsură ce moleculele fluorescente acumulează daune chimice de la electronii excitați în timpul fluorescenței. Fotoblanșarea poate limita sever timpul în care o probă poate fi observată prin microscopie cu fluorescență. Există câteva tehnici pentru a reduce fotooxidare , cum ar fi utilizarea de fluorofori mai robuste, prin reducerea la minimum iluminarea, sau prin utilizarea de fotoprotectoare scavenger chimicale.
Microscopia cu fluorescență cu proteine fluorescente reporter a permis analiza celulelor vii prin microscopie cu fluorescență, totuși celulele sunt susceptibile la fototoxicitate, în special cu lumina cu lungime de undă scurtă. Mai mult, moleculele fluorescente au tendința de a genera specii chimice reactive atunci când sunt iluminate, ceea ce sporește efectul fototoxic.
Spre deosebire de tehnicile de microscopie cu lumină transmisă și reflectată, microscopia cu fluorescență permite doar observarea structurilor specifice care au fost etichetate pentru fluorescență. De exemplu, observarea unei probe de țesut preparată cu o pată de ADN fluorescent prin microscopie cu fluorescență nu relevă decât organizarea ADN-ului în celule și nu dezvăluie nimic altceva despre morfologiile celulare.
Tehnicile de calcul care propun estimarea semnalului fluorescent din imaginile non-fluorescente (cum ar fi câmpul luminos) pot reduce aceste preocupări. În general, aceste abordări implică antrenarea unei rețele neuronale convoluționale profunde pe celulele colorate și apoi estimarea fluorescenței pe probe ne colorate. Astfel, prin decuplarea celulelor supuse anchetei de celulele utilizate pentru a antrena rețeaua, imagistica poate fi efectuată mai rapid și cu fototoxicitate redusă.
Tehnici de sub-difracție
Natura undelor luminii limitează mărimea punctului către care poate fi focalizată lumina datorită limitei de difracție . Această limitare a fost descrisă în secolul al XIX-lea de Ernst Abbe și „limitează rezoluția unui microscop optic la aproximativ jumătate din lungimea de undă a luminii folosite”. Microscopia fluorescentă este esențială pentru multe tehnici care urmăresc să depășească această limită prin configurații optice specializate.
Mai multe îmbunătățiri ale tehnicilor de microscopie au fost inventate în secolul al XX-lea și au dus la o rezoluție sporită și contrast într-o oarecare măsură. Cu toate acestea, nu au depășit limita de difracție. În 1978 s-au dezvoltat primele idei teoretice pentru a sparge această barieră prin utilizarea unui microscop 4Pi ca microscop confocal cu scanare cu fluorescență cu laser în care lumina este focalizată în mod ideal din toate părțile către un focar comun care este folosit pentru a scana obiectul prin „punct cu punct”. excitație punct combinată cu detectare „punct cu punct”. Cu toate acestea, prima demonstrație experimentală a microscopului 4pi a avut loc în 1994. Microscopia 4Pi maximizează cantitatea de direcții de focalizare disponibile utilizând două lentile obiective opuse sau microscopia de excitație cu doi fotoni folosind lumina redshifted și excitația cu mai mulți fotoni.
Microscopia corelativă integrată combină un microscop cu fluorescență cu un microscop electronic. Acest lucru permite vizualizarea informațiilor ultrastructurale și contextuale cu microscopul electronic în timp ce se utilizează datele de la microscopul cu fluorescență ca instrument de etichetare.
Prima tehnică pentru a obține cu adevărat o rezoluție de sub-difracție a fost microscopia STED , propusă în 1994. Această metodă și toate tehnicile care urmează conceptului RESOLFT se bazează pe o interacțiune neliniară puternică între molecule de lumină și fluorescente. Moleculele sunt conduse puternic între stări moleculare distincte la fiecare locație specifică, astfel încât în cele din urmă lumina poate fi emisă doar la o mică parte din spațiu, deci o rezoluție crescută.
De asemenea, în anii 1990, a fost dezvoltată o altă metodă de microscopie cu rezoluție superioară bazată pe microscopie pe câmp larg. Rezoluția substanțial îmbunătățită a dimensiunii nanostructurilor celulare colorate cu un marker fluorescent a fost realizată prin dezvoltarea microscopiei de localizare SPDM și iluminarea laser structurată (iluminare modulată spațial, SMI). Combinarea principiului SPDM cu SMI a dus la dezvoltarea microscopului Vertico SMI . Detectarea cu o singură moleculă a coloranților fluorescenți intermitenți normali , cum ar fi proteina fluorescentă verde (GFP), poate fi realizată prin utilizarea unei dezvoltări ulterioare a SPDM așa-numita tehnologie SPDMphymod, care face posibilă detectarea și numărarea a două tipuri diferite de molecule fluorescente la nivel molecular (acest tehnologia este denumită microscopie de localizare în două culori sau 2CLM).
Alternativ, apariția microscopiei de localizare fotoactivată ar putea obține rezultate similare, bazându-se pe clipirea sau comutarea moleculelor unice, unde fracția moleculelor fluorescente este foarte mică de fiecare dată. Acest răspuns stocastic al moleculelor de pe lumina aplicată corespunde, de asemenea, unei interacțiuni extrem de neliniare, ducând la rezoluția subdiffracției.
Galeria de micrografii fluorescente
Imagistica epifluorescentă a celor trei componente dintr-o celulă de cancer umană care se divizează. ADN-ul este colorat în albastru, o proteină numită INCENP este verde, iar microtubulii sunt roșii. Fiecare fluorofor este imaginat separat utilizând o combinație diferită de filtre de excitație și de emisie, iar imaginile sunt capturate secvențial cu ajutorul unei camere digitale CCD , apoi suprapuse pentru a da o imagine completă.
Nucleul limfocitar uman colorat cu DAPI cu cromozomul 13 (verde) și 21 (roșu) sonde centromere hibridizate (hibridizare fluorescentă in situ (FISH))
Microscopie cu fluorescență a expresiei ADN-ului în tipul sălbatic uman și Palladin mutant P239S .
Vezi si
- Imagistica fluorescentă
- Fluorescența în științele vieții
- Microscopie corelativă cu lumină electronică
- Elizabeth Harry , pionier al tehnicilor de microscopie fluorescentă pentru vizualizarea proteinelor subcelulare bacteriene
- Proteina fluorescentă verde (GFP)
- Lampă cu vapori de mercur
- Microscop
- Microscop electronic cu scanare # Catodoluminescență
- Stokes schimbă
- Lampă cu arc xenon
Referințe
linkuri externe
|
Resurse de bibliotecă despre microscopia fluorescentă |
- Fluorophores.org , baza de date a coloranților fluorescenți
- Centrul de resurse pentru microscopie
- animații și explicații pentru diferite tipuri de microscopuri, inclusiv microscopuri fluorescente și confocale (Université Paris Sud)