Limfangioleiomiomatoza - Lymphangioleiomyomatosis
| Limfangioleiomiomatoza (LAM) | |
|---|---|
| Alte nume | limfangiomiomatoza, LAM |
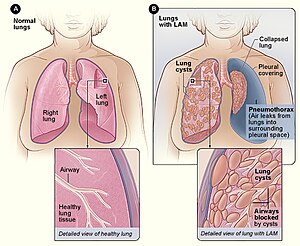 | |
| Figura A arată locația plămânilor și căilor respiratorii în corp. Imaginea inserată prezintă o secțiune transversală a unui plămân sănătos. Figura B prezintă o vedere a plămânilor cu LAM și a unui plămân prăbușit ( pneumotorax ). Imaginea inserată prezintă o secțiune transversală a unui plămân cu LAM. | |
| Specialitate |
Pneumologie |
Limfangioleiomiomatoza ( LAM ) este o boală rară, progresivă și sistemică, care are ca rezultat de obicei distrugerea pulmonară chistică . Afectează în principal femeile, în special în perioada fertilă. Termenul de LAM sporadic este utilizat pentru pacienții cu LAM care nu sunt asociați cu complexul de scleroză tuberoasă (TSC), în timp ce TSC-LAM se referă la LAM care este asociat cu TSC.
semne si simptome
Vârsta medie de debut este de la începutul până la mijlocul anilor 30. Dispneea de efort (scurtarea respirației) și pneumotoraxul spontan (colapsul pulmonar) au fost raportate ca prezentare inițială a bolii la 49% și, respectiv, 46% dintre pacienți.
Diagnosticul este întârziat de obicei de la 5 la 6 ani. Condiția este adesea diagnosticată greșit ca astm sau boală pulmonară obstructivă cronică . Primul pneumotorax sau colapsul pulmonar precede diagnosticul LAM la 82% dintre pacienți. Definiția clinică consensuală a LAM include multiple simptome:
- Oboseală
- Tuse
- Tuse de sânge (rareori masivă)
- Dureri în piept
- Complicații chiloase care decurg din obstrucția limfatică, inclusiv
- Chilotoraxul
- Ascita chiloasă
- Chilopericard
- Chiloptizie
- Chiluria
- Chyle în secreție vaginală
- Chyle în scaun.
- Angiomiolipomele (tumori renale grase) sunt prezente la aproximativ 30% dintre pacienții cu LAM sporadică și până la 90% dintre pacienții cu TSC-LAM. Angiomiolipomele pot sângera uneori spontan, provocând durere sau tensiune arterială scăzută .
- Limfangioamele chistice sau ganglionii limfatici cu centre hipodense, care imită limfoamele necrozante, cancerele ovariene sau renale sau alte tumori maligne pot apărea în retroperitoneu, pelvis sau mediastin.
Distrugerea plămânilor în LAM este o consecință a infiltrării difuze de către celulele neoplazice asemănătoare mușchilor netezi care invadează toate structurile pulmonare, inclusiv limfaticele , pereții căilor respiratorii, vasele de sânge și spațiile interstițiale . Consecințele obstrucției vaselor și căilor respiratorii includ acumularile de lichide chiloase, hemoptizia , obstrucția fluxului de aer și pneumotoraxul . Cursul tipic al bolii prezintă dispnee progresivă la efort, distanțată de pneumotorații recurente și la unii pacienți, revărsături pleurale chiloase sau ascită.
Majoritatea persoanelor au dispnee la efort cu activități zilnice la 10 ani de la apariția simptomelor. Mulți pacienți necesită oxigen suplimentar în acest interval.
Genetica
LAM apare în două setări: în complexul de scleroză tuberoasă a bolii (TSC-LAM) și într-o formă sporadică, la femeile care nu au TSC (LAM sporadic). În ambele situații, dovezile genetice indică faptul că LAM este cauzată de mutații inactivante sau de „pierdere a funcției” în genele TSC1 sau TSC2, care au fost clonate în 1997 și respectiv în 1993. Gena TSC1 este localizată pe brațul lung al cromozomului 9 (9q34), iar gena TSC2 este localizată pe brațul scurt al cromozomului 16 (16p13). TSC-LAM apare la femeile care au mutații ale liniei germinale fie în gena TSC1, fie în TSC2.
LAM sporadic este în primul rând asociat cu mutații genetice TSC2 somatice. Mutațiile germinale și somatice din LAM includ multe tipuri de mutații răspândite pe gene, fără „puncte fierbinți” clare, inclusiv modificări de sens, ștergeri în cadru și mutații fără sens. Datorită dimensiunii mari a genelor (împreună au mai mult de 60 de exoni) și deoarece mutațiile pot fi localizate practic oriunde în gene, detectarea mutațiilor este adesea provocatoare.
Pe o bază celulară, celulele LAM poartă inactivarea bi-alelică a genelor TSC2, în concordanță cu modelul genei supresoare tumorale „cu două lovituri”. Al doilea eveniment lovit în celulele LAM este adesea pierderea regiunii cromozomiale care conține copia de tip sălbatic a genei TSC2; aceasta este denumită pierderea heterozigoității sau LOH. LOH poate fi detectat în celulele LAM microdisecate, în angiomiolipomele și ganglionii limfatici de la femeile cu LAM și în celulele LAM circulante (celule din sânge și urină).
Angiomiolipomele și celulele LAM pulmonare de la femeile cu forma sporadică de LAM poartă mutații identice în TSC2. Acest lucru, împreună cu faptul că LAM recurent după transplantul pulmonar poartă aceleași mutații TSC2 ca LAM original, a condus la ipoteza „metastazei benigne” că celulele LAM pot migra sau metastaza de la un loc la altul.
Fiziopatologie
Un procent variabil de celule din leziunea LAM conține inactivarea mutațională a genelor supresoare tumorale ale complexului de scleroză tuberoasă (TSC1 sau TSC2). Mutațiile TSC1 provoacă un fenotip clinic mai puțin sever decât mutațiile TSC2. Descoperirea funcției genei TSC1 / 2 ca regulator negativ al țintei de mamifere a complexului 1 de rapamicină (mTORC1) a condus la utilizarea cu succes a sirolimusului analogic al rapamicinei în studiile clinice și la aprobarea de către FDA a sirolimusului pentru tratamentul LAM.
TSC1 și TSC2 formează un complex supresor tumoral care reglează complexul de semnalizare a rapamicinei (mTOR) la mamifere prin controlul direct al activității micului GTPase Rheb prin domeniul proteinei de activare GTPase (GAP) a TSC2. Rheb se leagă de Raptor și controlează activitatea complexului mTOR 1 (mTORC1) care fosforilează direct p70 S6 kinaza (S6K1) și 4E-BP1. mTOR formează două complexe multiproteice distincte din punct de vedere fizic și funcțional: mTORC1 sensibil la rapamicină și mTORC2 insensibil la rapamicină. MTORC1 constă din cinci proteine, inclusiv Raptor, care reglează pozitiv activitatea mTOR. MTORC2 constă din șase proteine, inclusiv mTOR și Rictor , care definește nivelul de activare al mTORC2 și modulează asamblarea citoscheletului actinic prin Rho GTPaze, iar Rac1 este necesar pentru activarea mTOR. În celulele LAM TSC2 nule și umane, activitatea Rho GTPase este necesară pentru aderența celulelor, motilitate, proliferare și supraviețuire. Pierderea TSC1 / TSC2 în LAM induce creșterea necontrolată a celulelor LAM și crește viabilitatea celulei LAM. Reglarea ascendentă a STAT1 și STAT3 și a autofagiei sunt mediatori cunoscuți ai viabilității și supraviețuirii celulelor LAM.
Celulele LAM se comportă, în multe feluri, ca celulele tumorale metastatice . Celulele LAM par să apară dintr-o sursă extrapulmonară și migrează către plămâni. Creșterea migrației și invazivității celulelor LAM este salvată prin reexprimarea TSC2. Mecanismele celulare și moleculare ale transformării neoplazice și ale distrugerii parenchimatoase pulmonare de către celulele LAM rămân necunoscute. Remodelarea pulmonară poate fi mediată de un dezechilibru între metaloproteinazele care degradează matricea (MMP) și inhibitorii lor endogeni TIMP. Fenotipul celular invaziv din LAM este asociat cu reglarea descendentă TIMP-3 și reglarea ascendentă a MMP dependente de TSC2.
Dovezile clinice și histopatologice demonstrează implicarea limfatică în LAM. Ipoteza predominantă este că leziunile LAM secretă factorul limfangiogen VEGF- D, recrutează celule endoteliale limfatice (LEC) care formează vase limfatice și induc chisturi pulmonare. Nivelurile serice VEGF-D sunt crescute în LAM comparativ cu alte boli pulmonare chistice, inclusiv histiocitoza celulară Langerhans pulmonară , emfizemul, sindromul Sjögren sau sindromul Birt-Hogg-Dubé . Nivelurile VEGF-D se corelează cu severitatea LAM, evaluată ca o măsură a gradului CT (abundența revărsărilor chiloase și a implicării limfatice). VEGF-D este o glicoproteină homodimerică secretată și un membru al familiei de factori de creștere VEGF, este cunoscut pentru rolul său în limfangiogeneza și metastaza cancerului . Prelucrarea proteolitică a VEGF-D afectează legarea cognată de VEGFR3. Histopatologic, leziunile LAM sunt înconjurate de celule care colorează VEGFR 3, receptorul 1 hialuronan endotelial al vasului limfatic (LYVE-1) și podoplanina . VEGF-D se leagă de proteinele receptorilor tirozin kinaze VEGFR-2 și VEGFR-349 la om și de VEGFR3 la șoareci. În mod surprinzător, eliminarea VEGF-D la șoareci are un efect redus asupra dezvoltării sistemului limfatic. Cu toate acestea, în timpul tumorigenezei, VEGF-D promovează formarea vaselor limfatice tumorale și facilitează răspândirea metastatică a celulelor canceroase. Cu toate acestea, se știe puțin despre rolul limfaticelor anormale și al VEGF-D în patogeneza LAM .
Diagnostic
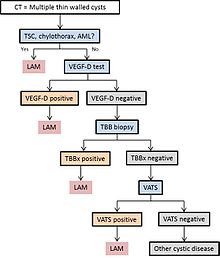
LAM poate ajunge la asistență medicală în mai multe moduri, dintre care majoritatea declanșează un CT toracic. Schimbarea chistică cu pereți subțiri în plămâni poate fi găsită incidental pe tomografiile computerizate ale inimii, pieptului sau abdomenului (pe tăieturile care includ baze pulmonare) obținute în alte scopuri. HRCT-urile pacienților cu TSC arată că aproximativ 20% dintre femei au modificări chistice până la vârsta de 20 de ani și aproximativ 80% dintre femei au modificări chistice după vârsta de 40 de ani. de multe ori scanarea CT nu este comandată (în Statele Unite) până când nu apar recidive. Dispneea progresivă la efort fără exacerbări și remisii care sunt caracteristice astmului sau BPOC uneori determină o CT toracică. O revizuire a CT de către un expert familiarizat cu LAM poate crește precizia diagnosticului. Chilotoraxul poate aduce și LAM în atenție.
În unele cazuri, un diagnostic LAM poate fi făcut cu încredere din motive clinice (fără biopsie ) la pacienții cu modificări chistice tipice la scanarea CT a plămânului cu rezoluție înaltă și constatări de scleroză tuberoasă, angiomiolipom , limfangioleiomiom, chilotorax sau ser VEGF-D> 800 pg / ml.
Dacă niciuna dintre aceste caracteristici clinice nu este prezentă, poate fi necesară o biopsie pentru a pune diagnosticul. Biopsia pulmonară toracoscopică asistată video este cea mai definitivă tehnică, dar biopsia transbronșică are un randament de peste 50% și poate fi, de asemenea, eficientă. Siguranța acestei din urmă proceduri la pacienții cu boală chistică difuză și abundența modificării chistice care prezice o biopsie informativă sunt totuși înțelese incomplet. Citologia fluidelor chiloase, a nodurilor abdominale aspirate sau a maselor limfatice poate fi, de asemenea, diagnostic.
Diagrama 1 prezintă un algoritm propus pentru diagnosticul LAM.
Radiografie toracică
Radiografia toracică poate să apară relativ normale, chiar și cu întârziere în boala, sau poate sugera doar hiperinflație. Pe măsură ce boala progresează, radiografia toracică demonstrează adesea opacități reticulonodulare difuze, bilaterale și simetrice, chisturi, bulle sau un aspect de „fagure de miere” (adică pseudo-fibrotice). Revărsatul pleural și pneumotoraxul pot fi evidente. Conservarea volumelor pulmonare în prezența marcajelor interstițiale crescute este un semn distinctiv radiografic al LAM care îl ajută să se distingă de majoritatea celorlalte boli pulmonare interstițiale, în care septul alveolar și expansiunea interstițială tind să crească proprietățile de recul elastic ale plămânului și să scadă volumele pulmonare.
Tomografie computerizata
De inalta rezolutie tomografie computerizata (HRCT) , scanare piept este mai bună decât radiografie toracică pentru a detecta boala parenchimului chistică și este aproape întotdeauna anormală la momentul diagnosticului, chiar și atunci când radiografia toracică și evaluările funcției pulmonare sunt normale. CT tipic prezintă chisturi difuze rotunde, bilaterale, cu pereți subțiri, de dimensiuni variate, de la 1 la 45 mm în diametru. Numărul de chisturi variază în LAM de la câteva la înlocuirea aproape completă a țesutului pulmonar normal. Profuzia de chisturi tinde să fie mai ușoară la pacienții cu TSC-LAM decât S-LAM, probabil explicată parțial, deoarece pacienții cu TSC-LAM primesc de obicei screening mai devreme. Revărsările pleurale sunt observate la CT la 12% dintre pacienții cu S-LAM și la 6% dintre pacienții cu TSC-LAM. Alte caracteristici ale CT includ densități liniare (29%), limfadenopatie hilară sau mediastinală (9%), pneumotorax, limfangiomiom și dilatarea canalului toracic. Opacitățile de sticlă macinată (12%) sugerează prezența edemului interstițial din cauza congestiei limfatice. La pacienții cu TSC, densitățile nodulare pe HRCT pot reprezenta hiperplazia pneumocitelor micronodulare multifocale (MMPH) formate din clustere de pneumocite de tip II hiperplazice. MMPH poate fi prezent la bărbați sau femei cu TSC în prezența sau absența LAM, dar nu și la pacienții cu S-LAM. MMPH nu este de obicei asociat cu consecințe fiziologice sau prognostice, dar a fost raportat un caz de insuficiență respiratorie datorată MMPH.
Scanări de ventilație-perfuzie
Într-un studiu , scanările de ventilație-perfuzie au fost anormale la 34 din 35 de pacienți cu LAM. Cea mai frecventă anomalie a fost eterogenitatea difuză nespecifică , de obicei asociată grosolan. Acești autori au descris, de asemenea, un „tip neobișnuit”, „model patinat” pe imaginile de perfuzie la 74% dintre pacienți, constând din „colecții mici, adesea periferice de radioizotop”.
Tomografie cu emisie de pozitroni
Leziunile LAM și AML nu prezintă de obicei o creștere a absorbției 18F-fluorodeoxiglucozei pe scanarea tomografiei cu emisie de pozitroni (PET). Prin urmare, alte neoplasme (sau surse de inflamație) ar trebui luate în considerare în cazurile LAM cunoscute sau suspectate în care rezultatele FDG-PET sunt pozitive.
Imagistica abdominală
Anomaliile privind imagistica abdominală, cum ar fi LMA renală și structurile limfatice mărite, sunt, de asemenea, frecvente în LAM. Densitatea grăsimilor în cadrul unei mase renale este patognomonică a LMA. LMA sunt mai răspândite și mai frecvent bilaterale și mari la pacienții cu TSC-LAM decât la pacienții cu S-LAM. Mărimea LMA se corelează cu prevalența chisturilor pulmonare la pacienții cu TSC. Un studiu CT a imaginat 256 de pacienți cu S-LAM și 67 cu TSC-LAM. LMA renale au fost prezente la 32% dintre pacienții cu S-LAM și 93% dintre pacienții cu TSC-LAM. LMA hepatice au fost prezente la 2% dintre pacienții cu S-LAM și 33% dintre pacienții cu TSC-LAM. Ascita a fost mai puțin frecventă, observată la mai puțin de 10% dintre pacienții cu LAM. Limfangiomatoza abdominală, conținând adesea atât componente chistice, cât și componente solide, a fost observată la 29% dintre pacienții cu S-LAM și 9% dintre pacienții cu TSC-LAM.
Imagistica sistemului nervos central
Anomaliile sistemului nervos central, cum ar fi tuberculii corticali sau subependimali și astrocitoamele , sunt frecvente la pacienții cu TSC, inclusiv la cei cu TSC-LAM, dar nu se găsesc la femeile cu S-LAM. Moss și asociații au raportat că femeile cu S-LAM și TSC-LAM pot avea o incidență crescută a meningiomului , dar semnificația acestei descoperiri a fost contestată.
Studii ale funcției pulmonare
Testarea funcției pulmonare la pacienții cu LAM poate fi normală sau poate dezvălui modele obstructive, restrictive sau mixte. Fiziologia obstructivă este cea mai frecventă anomalie. Datele funcției pulmonare controlate de calitate au fost colectate prospectiv de către Registrul NHLBI, un studiu de 5 ani pe pacienți cu LAM în centre din Statele Unite. Spirometria a relevat modificări obstructive la aproximativ 57% dintre pacienți și rezultate normale la 34%. Restricția, definită ca o capacitate pulmonară totală mai mică decât limita inferioară a normalului, a fost observată la 11%. Hiperinflația a fost prezentă în aproximativ 6%. Volumul mediu rezidual a fost de 125% din cel prevăzut atunci când a fost măsurat prin pletismografie, dar a fost doar 103% din cel prevăzut determinat prin metode de diluare a gazelor, sugerând o captare semnificativă a aerului în spațiile aeriene necomunicante. Aproximativ 25% dintre pacienții cu fiziologie obstructivă pot demonstra o reacție bronhodilatatoare, dar pot fi mai puțini în obstrucția mai severă. Defectul fiziologic obstructiv în LAM se atribuie în primul rând obstrucției fluxului de aer. Cea mai timpurie modificare a testării funcției pulmonare inițiale în diferite serii de cazuri a fost transferul anormal de gaze, evaluat prin capacitatea de difuzie a monoxidului de carbon (DLCO), descrisă la 82% până la 97% dintre pacienți. Nu este neobișnuit ca DLCO să fie redus în mod proporțional cu volumul expirator forțat în 1 secundă (FEV1). Reducerea DLCO și creșterea volumului rezidual sunt în general considerate a fi primele manifestări fiziologice ale LAM.
Testarea exercițiului cardiopulmonar la o cohortă mult mai mare de pacienți cu LAM a relevat un consum maxim redus de oxigen ( VO 2 max ) și un prag anaerob la 217 pacienți. Hipoxemia indusă de efort a fost găsită chiar și la pacienții care nu aveau anomalii de odihnă în FEV1 și DLCO. La majoritatea pacienților, exercițiul a fost considerat a fi limitat de ventilație, datorită obstrucției fluxului de aer și a creșterii ventilației în spațiul mort.
Progresia bolii este însoțită de obicei de un defect ventilator obstructiv progresiv. Declinul în FEV1 este cel mai frecvent utilizat parametru pentru a monitoriza progresia bolii. Deși hipertensiunea pulmonară în repaus pare a fi neobișnuită în LAM, presiunea arterială pulmonară crește adesea cu niveluri scăzute de exercițiu, legate parțial de hipoxemie. Un studiu a raportat o creștere a șunturilor intraparenchimale la pacienții dispneici cu LAM, care poate contribui la odihnă și la exerciții hipoxemice.
Patologie
Gros, plămânii LAM sunt mărite și difuz chistice, cu spații de aer dilatate de până la câțiva centimetri în diametru. Examinarea microscopică a plămânului relevă focare ale infiltrării celulare asemănătoare mușchilor netezi a parenchimului pulmonar, căilor respiratorii, limfaticelor și vaselor de sânge asociate cu zone de schimbare chistică cu pereți subțiri. Leziunile LAM conțin adesea o abundență de canale limfatice, formând o rețea anastomozantă a unor spații asemănătoare fantei căptușite de celule endoteliale . Celulele LAM extind în general spațiile interstițiale fără a încălca planurile țesuturilor, dar s-a observat că invadează căile respiratorii, artera pulmonară, diafragma, aorta și grăsimea retroperitoneală , pentru a distruge cartilajul bronșic și pereții arteriolari și pentru a ocluda lumenul arteriolelor pulmonare.
Există două morfologii celulare majore în leziunea LAM: celule mici în formă de fus și celule epitelioide cuboidale. Celulele LAM se colorează pozitiv pentru actina musculară netedă , vimentina , desminul și, adesea, receptorii de estrogen și progesteron. Celulele cuboidale din leziunile LAM reacționează și cu un anticorp monoclonal numit HMB-45, dezvoltat împotriva proteinei premelanosomale gp100, o enzimă din calea melanogenezei. Acest marker imunohistochimic este foarte util din punct de vedere diagnostic, deoarece alte leziuni predominante ale mușchilor netezi în plămâni nu reacționează cu anticorpul. Celulele în formă de fus ale leziunii LAM proliferează mai frecvent antigenul nuclear celular pozitiv decât celulele cuboidale, în concordanță cu un fenotip proliferativ. Comparativ cu celulele musculare netede normale în formă de trabuc, celulele LAM în formă de fus conțin citoplasmă mai puțin abundentă și sunt mai puțin eozinofile. Receptorii de estrogen și progesteron sunt de asemenea prezenți în leziunile LAM, dar nu și în țesutul pulmonar normal adiacent. Leziunile LAM exprimă markeri limfatici LYVE-1, PROX1, podoplanină și VEGFR-3. Celulele asemănătoare mușchiului neted ale LMA sunt similare morfologic și imunohistochimic cu celulele LAM, inclusiv reactivitatea cu anticorpi direcționați împotriva actinei, desminului, vimentinei și HMB-45, precum și a receptorilor de estrogen și progesteron. Spre deosebire de spațiile aeriene dilatate din emfizem, spațiile chistice găsite în LAM pot fi parțial căptușite cu celule hiperplazice de tip II.
Tratament
Un medicament aprobat de FDA pentru tratamentul LAM, inhibitorul mTOR sirolimus , este disponibil pentru stabilizarea declinului funcției pulmonare. Transplantul pulmonar rămâne ultima soluție pentru pacienții cu boală avansată.
Pneumotorax
Pneumotoracele la pacienții cu LAM tind să reapară, mai ales după un tratament conservator, cum ar fi observația, aspirația sau toracostomia cu tub simplu. Peste 65% dintre pacienții cu LAM dezvoltă pneumotorax în cursul bolii, în medie 3,5 pneumotorați la cei care au cel puțin un pneumotorax. LAM Foundation Pleural Consensus Group a susținut utilizarea unei proceduri de simfiză pleurală cu primul pneumotorax, având în vedere șansele de recidivă mai mari de 70%. Scleroza chimică, abraziunea mecanică, putrarea talcului și pleurectomia au fost eficiente la pacienții cu LAM, dar abraziunea mecanică este preferată pentru cei care ar putea necesita transplant pulmonar în viitor. Aproximativ jumătate dintre pacienții cu LAM care au fost supuși transplantului au avut o procedură de pleurodeză anterioară și mai mult de 75% dintre aceștia au avut o pleurodeză bilaterală anterioară . Deși pleurodeza nu este o contraindicație pentru transplant, poate duce la creșterea sângerării perioperatorii.
Chilotoraxul
Chyle nu provoacă în general inflamație pleurală sau fibroză. Micile efuziuni stabile chiloase rareori necesită intervenție odată ce diagnosticul LAM este pus. Respirația scurtă poate impune drenajul posibil. Sirolimus este eficient pentru revărsările chiloase și majoritatea experților consideră că ar trebui utilizat ca prima linie de terapie. Imaginarea sursei scurgerii cu RMN puternic ponderat T2 sau limfangiografie de contrast este recomandată pentru revărsările refractare. Unele scurgeri sunt susceptibile de embolizare prin catetere filetate de la ganglionii inghinali în canalul toracic . Ligarea canalului toracic poate fi luată în considerare, dar, din moment ce revărsările toracice provin uneori din ascita care este sifonată în piept prin acțiunea burdufului toracelui, este important să se excludă o sursă abdominală înainte de a lua în considerare această opțiune. Simfiza pleurală poate fi necesară pentru a preveni deficiențele nutriționale și limfocitare care pot rezulta din robinete repetate sau drenaj persistent. Pleurodeza chimică este, în general, o terapie eficientă pentru chilotorax, la fel ca și abraziunea mecanică și putrarea talcului.
Angiomiolipom
Renale angiomyolipomas (AMLs) pot necesita embolizare sau cauterizare pentru controlul hemoragiei, o complicație care este considerat a fi mai frecvente când diametrul tumorii mai mare de 4 cm. Gradul de modificare anevrismală poate determina riscul de sângerare. Imagistica abdominală în serie trebuie efectuată pentru a evalua dimensiunea LMA la intervale de 6 până la 12 luni, cel puțin până când tendințele de creștere sunt clare. Nefronul care economisește rezecții parțiale poate fi luat în considerare pentru tumorile foarte mari. Nefrectomia este uneori necesară pentru tumorile cu extensie intravasculară sau din alte motive, dar rareori este abordarea de alegere pentru LMA care poate fi gestionată prin mijloace mai puțin invazive. Everolimus este aprobat de Administrația SUA pentru Alimente și Medicamente (FDA) pentru tratamentul AML.
Limfangioleiomiom
Limfangioleiomiomatozele sunt structuri hipodense pline de lichid prezente în regiunile retroperitoneale ale abdomenului și pelvisului la aproximativ 30% dintre pacienții cu LAM. În general, nu necesită intervenție. Biopsia sau rezecția pot duce la scurgeri prelungite. Inhibitorii mTOR sunt eficienți în reducerea dimensiunii limfangioleiomiomatozei și pot duce la rezoluția totală.
Management-altele
Medicamentele care conțin estrogen pot exacerba LAM și sunt contraindicate. Agenții care antagonizează efectele estrogenului nu s-au dovedit a fi eficiente pentru tratament, dar nu s-au făcut studii adecvate. Un studiu cu bronhodilatatoare ar trebui luat în considerare la pacienții cu LAM, deoarece până la 17% până la 25% au obstrucție a fluxului de aer care răspunde bronhodilatatorului . Oxigenul trebuie administrat pentru a menține saturații cu oxihemoglobină mai mari de 90% cu odihnă, mișcare și somn. Densitometria osoasă trebuie luată în considerare la toți pacienții care sunt imobilizați și / sau urmează terapii antiestrogen și trebuie instituită o terapie adecvată pentru pacienții osteoporotici . O atenție adecvată trebuie acordată sănătății cardiovasculare în urma menopauzei naturale sau induse . Imunizările pentru pneumococ și gripă trebuie actualizate. Reabilitarea pulmonară pare a fi deosebit de plină de satisfacții la pacienții tineri, motivați, cu boli pulmonare obstructive, dar nu s-au făcut studii pentru a evalua efectul acestei intervenții asupra toleranței la exerciții, condiționării și calității vieții.
Medicament
Sirolimus este un inhibitor mTOR care stabilizează funcția pulmonară și îmbunătățește unele măsuri de viață la pacienții cu LAM. Este aprobat de FDA pentru utilizare în LAM, pe baza rezultatelor procesului multicentric internațional LAM Eficacitatea și siguranța Sirolimus (MILES). Datele MILES susțin utilizarea sirolimusului la pacienții care au funcții pulmonare anormale (de exemplu, FEV1 <70% prezis). Nu este clar dacă beneficiile tratamentului depășesc riscurile pentru pacienții LAM asimptomatici cu funcție pulmonară normală, dar unii medici consideră tratamentul pacienților în declin care se apropie de intervalul anormal pentru FEV1. Sirolimus pare a fi, de asemenea, eficient pentru tratamentul revărsărilor chiloase și al limfangioleiomiomatozei. Beneficiile sirolimus persistă numai în timp ce tratamentul continuă. Siguranța terapiei pe termen lung nu a fost studiată.
Efectele secundare potențiale ale inhibitorilor mTOR includ umflarea gleznelor, acneei, ulcerelor orale, dispepsie , diaree, creșterea colesterolului și a trigliceridelor , hipertensiune și cefalee. Pneumita Sirolimus și malignitatea latentă sunt preocupări mai grave, dar apar rar. Sirolimus inhibă vindecarea rănilor. Este important să opriți terapia cu medicamentul timp de 1-2 săptămâni înainte și după procedurile elective care necesită vindecarea optimă a rănilor. Trebuie luate măsuri de precauție pentru a evita expunerea prelungită la soare din cauza riscului crescut de cancer de piele .
Tratamentul cu un alt inhibitor mTOR, everolimus , a fost raportat într-un studiu mic, deschis, asociat cu îmbunătățirea FEV1 și distanța de mers pe jos de șase minute. Nivelurile serice de VEGF-D și colagen IV au fost reduse prin tratament. Evenimentele adverse au fost în general în concordanță cu cele cunoscute a fi asociate cu inhibitori mTOR, deși unele au fost grave și au inclus edem periferic , pneumonie, insuficiență cardiacă și infecție cu Pneumocystis jirovecii . Au fost utilizate doze escaladante de everolimus, până la 10 mg pe zi; mai mare decât ceea ce este de obicei utilizat clinic pentru LAM.
Concentrația serică de VEGF-D este un biomarker util, predictiv și prognostic. Nivelurile de bază mai ridicate ale VEGF-D prezic o progresie mai rapidă a bolii și un răspuns mai robust la tratament.
Abordările hormonale ale tratamentului nu au fost niciodată testate în studii adecvate. În absența unui beneficiu dovedit, terapia cu progesteron , agoniști GnRh (de exemplu, leuprorelină , goserelină ) și tamoxifen nu sunt recomandate în mod obișnuit. Doxiciclina nu a avut niciun efect asupra ratei scăderii funcției pulmonare într-un studiu dublu-orb.
Sirolimus este adesea eficient ca tratament de primă linie pentru chilotorax. Dacă scăderea chiloasă sau acumulările persistă în ciuda tratamentului, poate fi luată în considerare imagistica cu RMN ponderat T2, limfangiografie RMN sau limfangiografie cu canal toracic. Procedurile de fuziune pleurală pot fi luate în considerare în cazuri refractare.
Prognoză
Estimările supraviețuirii variază, în funcție de modul de prezentare sau de constatare, și au în general tendință ascendentă, probabil datorită recunoașterii anterioare prin utilizarea mai răspândită a scanării CT. Într-un studiu recent de cohortă bazat pe populație, s-a constatat că supraviețuirea mediană a fost de 29 de ani. Datele din seriile de cazuri mari anterioare au indicat că 38% până la 78% dintre pacienți erau în viață la 8,5 ani de la debutul bolii.
Pacienții dezvoltă de obicei obstrucție progresivă a fluxului de aer. Într-o cohortă de pacienți din Marea Britanie, la 10 ani de la apariția simptomelor, 55% din 77 de pacienți mergeau fără respirație pe un teren plat și 10% erau legați de casă. Rata medie anuală de scădere a FEV1 și DLCO la 275 de pacienți studiați într-un singur laborator cu funcție pulmonară la NHLBI a fost de 75 ± 9 ml și, respectiv, de 0,69 ± 0,07 ml / min / mm Hg. În alte serii din Europa, rata de scădere a FEV1 a fost considerabil mai mare, estimată la aproximativ 100 până la 120 ml / an. În studiul MILES, pacienții din grupul placebo au pierdut 134 cc / an. Au existat unele dovezi în aceste studii că rata declinului funcției pulmonare se corelează cu DLCO inițial, cu starea menopauzei și cu VEGF-D inițial ridicat.
Estimările de supraviețuire mediană variază de la 10 la 30 de ani, în funcție de studierea cohortelor spitalicești sau a populației.
Epidemiologie
LAM este aproape complet limitat la femei. În timp ce chisturile pulmonare în concordanță cu LAM sunt raportate la unii bărbați cu scleroză tuberoasă, foarte puțini dintre acești bărbați dezvoltă simptome. Prevalența LAM este estimată utilizând date din registre și grupuri de pacienți și este cuprinsă între 3,4 și 7,8 / milion de femei. Numărul de cazuri noi în fiecare an este cuprins între 0,23 și 0,31 / milion de femei / an în SUA, Marea Britanie și Elveția. Variația dintre țări și între statele adiacente din SUA sugerează că un număr semnificativ de femei cu LAM rămân fie nediagnosticate, fie simptomele lor sunt atribuite altor boli. Femeile adulte cu scleroză tuberoasă sunt mai predispuse să dezvolte LAM decât femeile fără scleroză tuberoasă. Cohorte de pacienți cu scleroză tuberoasă au fost examinați pentru LAM folosind scanarea CT. Într-un studiu retrospectiv al adulților cu scleroză tuberoasă, CT a demonstrat chisturi pulmonare la 42% din 95 de femei și 13% din 91 de bărbați. În general, chisturile pulmonare au fost mai mari și mai numeroase la femei decât la bărbați. Într-un alt studiu retrospectiv al femeilor cu TSC care au fost supuse scanării CT pentru a detecta LAM, 25% dintre cei de 20 de ani aveau chisturi pulmonare, în timp ce 80% dintre femeile de 40 de ani au fost afectate, sugerând că dezvoltarea LAM depinde de vârstă cel puțin în LAM legată de scleroza tuberoasă. Deși prevalența sclerozei tuberoase la 1 din 6000 de nașteri este mult mai mare decât cea a LAM, cele mai multe clinici pulmonare văd mai multe cazuri de scleroză tuberculoasă decât LAM: probabil datorită unei combinații de niveluri scăzute de screening pentru LAM în scleroza tuberoasă și în multe, absența simptomelor.
Sexul feminin și scleroza tuberoasă sunt singurii factori de risc cunoscuți. Deși utilizarea estrogenului suplimentar nu este asociată cu dezvoltarea LAM, un studiu a sugerat că utilizarea pilulelor contraceptive care conțin estrogen a fost asociată cu debutul anterior.
Apare la mai mult de 30% dintre femeile cu complex de scleroză tuberoasă (TSC-LAM), un sindrom ereditar care este asociat cu convulsii , tulburări cognitive și tumori benigne în mai multe țesuturi. Majoritatea pacienților cu LAM care se prezintă pentru evaluare medicală au forma sporadică a bolii (S-LAM), care nu este asociată cu alte manifestări ale complexului de scleroză tuberoasă.
Modificări chistice ușoare în concordanță cu LAM au fost descrise la 10-15% dintre bărbații cu TSC, dar LAM simptomatic la bărbați este rar. LAM sporadică apare exclusiv la femei, cu o excepție publicată până în prezent. Atât TSC-LAM, cât și S-LAM sunt asociate cu mutații în genele sclerozei tuberoase.
Sarcina
S-a raportat că sarcina exacerbează LAM în unele cazuri. Cu toate acestea, riscul nu a fost studiat riguros. Într-un sondaj efectuat la 318 de pacienți care au indicat că au avut cel puțin o sarcină, 163 au răspuns la un al doilea sondaj axat pe colapsul pulmonar. Un total de 38 de pacienți au raportat un pneumotorax în timpul sarcinii, în concordanță cu o incidență a pneumotoraxului în sarcină de cel puțin 10% (38 din 318). La o treime dintre pacienți, pneumotoraxul în timpul sarcinii a dus la diagnosticul LAM. Pneumotoracele au fost de aproape două ori mai frecvente în dreapta decât în stânga, iar patru femei au prezentat pneumotorax bilateral spontan. Majoritatea pneumotoracelor au avut loc în trimestrele II și III. Acest studiu și alții sugerează că sarcina este asociată cu complicații pleurale la pacienții cu LAM. Puține femei cu un diagnostic LAM cunoscut aleg să rămână gravide, iar pacienții la care LAM este diagnosticat în timpul sarcinii au rareori teste funcționale pulmonare inițiale, ceea ce complică rezolvarea acestei întrebări.
Societate
Fundația LAM a fost fondată în 1995 ca o organizație de bază pentru a oferi sprijin pentru pacienți și finanțarea cercetării. Astăzi, Fundația LAM oferă sprijin și educație pentru femeile cu LAM și familiile lor, angajează medici și oameni de știință să continue să afle mai multe despre boală și strânge fonduri pentru continuarea studiului LAM. Caută tratamente sigure și eficiente și, în cele din urmă, un remediu, pentru limfangioleiomiomatoză. Are sediul central în Cincinnati, Ohio.
În cultura populară
În „ Lucky Thirteen ”, al cincilea episod din al cincilea sezon al House , Spencer (Angela Gots) a fost diagnosticată cu LAM, deși mai târziu s-a constatat că este un caz de sindrom Sjögren .
Vezi si
Referințe
linkuri externe
| Clasificare | |
|---|---|
| Resurse externe |