Biogeneza mitocondrială - Mitochondrial biogenesis
Biogeneza mitocondrială este procesul prin care celulele cresc numărul mitocondrial . A fost descris pentru prima dată de John Holloszy în anii 1960, când s-a descoperit că antrenamentul de rezistență fizică a indus niveluri mai ridicate de conținut mitocondrial, ducând la o absorbție mai mare a glucozei de către mușchi. Biogeneza mitocondrială este activată de numeroase semnale diferite în perioadele de stres celular sau ca răspuns la stimuli de mediu, cum ar fi exercițiile aerobe .
fundal
Abilitatea pentru o mitocondrie de auto-replicare este înrădăcinată în istoria sa evolutivă. În mod obișnuit, se crede că mitocondriile coboară din celule care au format relații endosimbiotice cu α-protobacterii , acestea având propriul lor genom pentru replicare. Cu toate acestea, dovezi recente sugerează că mitocondriile ar fi putut evolua fără simbioză. Mitocondria este un regulator cheie al activității metabolice a celulei și este, de asemenea, un organit important atât în producția, cât și în degradarea radicalilor liberi. Se postulează că un număr mai mare de copii mitocondriale (sau o masă mitocondrială mai mare) este protector pentru celulă.
Mitocondriile sunt produse din transcrierea și traducerea genelor atât în genomul nuclear, cât și în genomul mitocondrial . Majoritatea proteinelor mitocondriale provin din genomul nuclear, în timp ce genomul mitocondrial codifică părți ale lanțului de transport al electronilor, împreună cu ARNr mitocondrial și ARNt . Biogeneza mitocondrială crește enzimele metabolice pentru glicoliză, fosforilarea oxidativă și în cele din urmă o capacitate metabolică mitocondrială mai mare. Cu toate acestea, în funcție de substraturile de energie disponibile și de starea REDOX a celulei, celula poate crește sau reduce numărul și dimensiunea mitocondriilor. În mod critic, numerele mitocondriale și morfologia variază în funcție de tipul celular și de cererea specifică contextului, prin care echilibrul dintre fuziunea / fisiunea mitocondrială reglementează distribuția, morfologia și funcția mitocondrială.
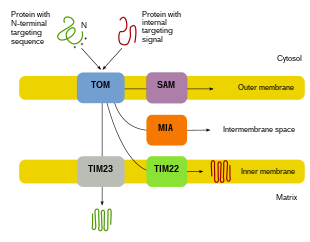
Importul de proteine
Deoarece majoritatea proteinelor mitocondriale provin din genomul nuclear, proteinele trebuie să fie direcționate în mod corespunzător și transportate în mitocondrii pentru a-și îndeplini funcțiile. În primul rând, ARNm este tradus în citosolul celulei. Proteinele precursoare derulate care vor rezulta vor putea apoi să ajungă în compartimentele lor mitocondriale respective. Proteinele precursoare vor fi transportate către una din cele patru zone ale mitocondriilor, care includ membrana exterioară, membrana interioară, spațiul intermembranar și matricea. Toate proteinele vor intra în mitocondrii printr-o translocază de pe membrana mitocondrială externă (TOM). Unele proteine vor avea un semnal de țintire N-terminal, iar aceste proteine vor fi detectate și transportate în matrice, unde vor fi apoi clivate și pliate. Alte proteine pot avea informații de direcționare în secvențele lor și nu vor include un semnal N-terminal. În ultimele două decenii, cercetătorii au descoperit peste treizeci de proteine care participă la importul de proteine mitocondriale. Pe măsură ce cercetătorii află mai multe despre aceste proteine și despre modul în care acestea ajung în respectivele compartimente mitocondriale care le utilizează, devine evident că există o multitudine de procese care funcționează împreună în celulă pentru a permite biogeneza mitocondrială.
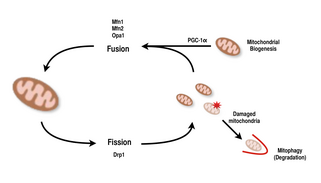
Fuziune și fisiune
Mitocondriile sunt extrem de versatile și își pot schimba forma prin evenimente de fisiune și fuziune. În mod definitiv, fisiunea este evenimentul unei singure entități care se separă, în timp ce fuziunea este evenimentul în care două sau mai multe entități se unesc pentru a forma un întreg. Procesele de fisiune și fuziune se opun reciproc și permit rețelei mitocondriale să se remodeleze constant. Dacă un stimul induce o schimbare a echilibrului de fisiune și fuziune într-o celulă, ar putea modifica semnificativ rețeaua mitocondrială. De exemplu, o creștere a fisiunii mitocondriale ar crea multe mitocondrii fragmentate, ceea ce s-a dovedit a fi util pentru eliminarea mitocondriilor deteriorate și pentru crearea de mitocondrii mai mici pentru transportul eficient către zonele care necesită energie. Prin urmare, realizarea unui echilibru între aceste mecanisme permite unei celule să aibă organizarea adecvată a rețelei sale mitocondriale în timpul biogenezei și poate avea un rol important în adaptarea musculară la stresul fiziologic.
La mamifere, fuziunea și fisiunea mitocondrială sunt ambele controlate de GTPaze din familia dinaminelor. Procesul fisiunii mitocondriale este dirijat de Drp1 , un membru al familiei dinaminelor citosolice. Această proteină formează o spirală în jurul mitocondriilor și se constrânge pentru a sparge atât membranele exterioare, cât și cele interne ale organului. Pe de altă parte, procesul de fuziune este dirijat de diferite proteine dinaminice ancorate la membrană la diferite niveluri ale mitocondriilor. Fuziunea la nivelul membranei mitocondriale exterioare este mediată de Mfn1 și Mfn2 (Mitofusinele 1 și 2), iar fuziunea la nivelul membranei mitocondriale interne este mediată de Opa1 . Studii multiple de cercetare au observat creșteri corelate între capacitatea respiratorie mitocondrială cu expresia genei Mfn1, Mnf2 și Drp1 după exerciții de rezistență. Prin urmare, se susține că reorganizarea rețelei mitocondriale în celulele musculare joacă un rol important ca răspuns la exerciții.
Regulament
PGC-1α , un membru al familiei de coactivatori transcripționali ai receptorului activat cu proliferatorul peroxizomului (PGC) , este regulatorul principal al biogenezei mitocondriale. Se știe că co-activează factorul respirator nuclear 2 (NRF2 / GABPA) și, împreună cu NRF-2, coactivează factorul respirator nuclear 1 ( NRF1 ). NRF-urile, la rândul lor, activează factorul de transcripție mitocondrială A (tfam) , care este direct responsabil pentru transcrierea proteinelor mitocondriale codificate nuclear. Aceasta include atât proteinele mitocondriale structurale, cât și cele implicate în transcrierea, traducerea și repararea ADNmt . PGC- 1β, o proteină care este similară structural cu PGC-1α , este, de asemenea, implicată în reglarea biogenezei mitocondriale, dar diferă prin faptul că nu crește ca răspuns la efort. În timp ce s-au înregistrat creșteri semnificative ale mitocondriilor în țesuturile în care PGC-1α este supraexprimat, deoarece cofactorul interacționează cu acești factori cheie de transcripție, șoarecii knockout cu PGC-1α perturbat sunt încă viabili și prezintă abundență mitocondrială normală. Astfel, PGC-1α nu este necesar pentru dezvoltarea normală a mitocondriilor la șoareci, dar atunci când sunt supuși stresului fiziologic, acești șoareci prezintă toleranță diminuată comparativ cu șoarecii cu niveluri normale de PGC-1α. În mod similar, la șoareci knockout cu PGC-1β întrerupt, șoarecii au prezentat în cea mai mare parte niveluri normale ale funcției mitocondriale cu capacitate scăzută de adaptare la stresul fiziologic. Cu toate acestea, un experiment de eliminare dublă a PGC-1α / β a creat șoareci care au murit în cea mai mare parte în 24 de ore din cauza defectelor în maturarea mitocondrială a țesutului cardiac. Aceste descoperiri sugerează că, în timp ce atât PGC-1α cât și PGC-1β nu stabilesc fiecare capacitatea unei celule de a efectua biogeneza mitocondrială, împreună sunt capabile să se completeze reciproc pentru o maturare și funcționare mitocondrială optimă în perioadele de stres fiziologic.
AMP-kinaza activată (AMPK) reglează, de asemenea, biogeneza mitocondrială prin fosforilarea și activarea PGC-1α la detectarea unui deficit de energie în mușchi. La șoarecii cu rapoarte ATP / AMP reduse care ar apărea în timpul efortului, sa demonstrat că epuizarea energiei se corelează cu activarea AMPK. Activarea AMPK a continuat apoi să activeze PGC-1α și NRF la acești șoareci și a fost stimulată biogeneza mitocondrială.
Îmbătrânire
S-a demonstrat că capacitatea de biogeneză mitocondrială scade odată cu înaintarea în vârstă și o astfel de funcție mitocondrială scăzută a fost asociată cu diabetul și bolile cardiovasculare. Îmbătrânirea și boala pot induce modificări ale nivelurilor de expresie ale proteinelor implicate în mecanismele de fisiune și fuziune ale mitocondriilor, creând astfel mitocondrii disfuncționale. O ipoteză pentru rezultatele dăunătoare ale îmbătrânirii este asociată cu pierderea telomerilor , segmentele finale ale cromozomilor care protejează informațiile genetice de degradare. Pierderea telomerilor a fost, de asemenea, asociată cu scăderea funcției mitocondriale. Deficitul de telomerază revers transcriptază (TERT) , o enzimă care joacă un rol în conservarea telomerilor, a fost corelat cu p53 activat, o proteină care suprimă PGC-1α. Prin urmare, pierderea telomerilor și TERT care vine odată cu îmbătrânirea a fost asociată cu afectarea biogenezei mitocondriale. De asemenea, s-a demonstrat că expresia AMPK scade odată cu vârsta, ceea ce poate contribui și la suprimarea biogenezei mitocondriale.
Referințe
Lecturi suplimentare
- Smith JA, Stallons LJ, Collier JB, Chavin KD, Schnellmann RG (februarie 2015). "Suprimarea biogenezei mitocondriale prin intermediul receptorului asemănător cu proteina kinază kinază activată mitogen-dependentă de 4 / semnalizarea extracelulară a semnalului kinazei reglementate în leziunea renală acută indusă de endotoxină" . Jurnalul de farmacologie și terapie experimentală . 352 (2): 346-57. doi : 10.1124 / jpet.114.221085 . PMC 4293437 . PMID 25503387 .
- Cameron RB, Beeson CC, Schnellmann RG (decembrie 2016). "Dezvoltarea terapiei care induce biogeneza mitocondrială pentru tratamentul bolilor degenerative acute și cronice" . Journal of Medicinal Chemistry . 59 (23): 10411–10434. doi : 10.1021 / acs.jmedchem.6b00669 . PMC 5564430 . PMID 27560192 .
- Whitaker RM, Corum D, Beeson CC, Schnellmann RG (2016). „Biogeneza mitocondrială ca țintă farmacologică: o nouă abordare a bolilor acute și cronice”. Revizuirea anuală a farmacologiei și toxicologiei . 56 : 229–49. doi : 10.1146 / annurev-pharmtox-010715-103155 . PMID 26566156 .