Vaccinul Moderna COVID-19 - Moderna COVID-19 vaccine
 Flacoane ale vaccinului Moderna COVID-19
| |
| Descrierea vaccinului | |
|---|---|
| Ţintă | SARS-CoV-2 |
| Tipul de vaccin | ARNm |
| Date clinice | |
| Pronunție | / M ə d ɜːr n ə / mə- DUR -nə |
| Denumiri comerciale | Spikevax |
| Alte nume | mRNA-1273, CX-024414, COVID-19 mRNA Vaccine Moderna, TAK-919, Moderna COVID-19 Vaccine, COVID-19 Vaccine Moderna, COVID-19 Vaccine Moderna Injecție intramusculară |
| AHFS / Drugs.com | Informații multum pentru consumatori |
| MedlinePlus | a621002 |
| Date despre licență | |
Categoria sarcinii |
|
| Căi de administrare |
Intramuscular |
| Codul ATC | |
| Statut juridic | |
| Statut juridic | |
| Identificatori | |
| Numar CAS | |
| DrugBank | |
| UNII | |
| KEGG | |
| Parte a unei serii pe |
| Covid-19 pandemie |
|---|
|
|
|
Moderna COVID-19 vaccin ( Pinn : elasomeran ), nume de cod ARNm-1273 și comercializat sub numele de brand Spikevax , este un vaccin COVID-19 dezvoltat de compania americana Moderna , Statele Unite ale Americii Institutul National de alergie si de Boli Infectioase (NIAID) si Autoritatea Biomedicale avansate de cercetare și dezvoltare (Barda). Este autorizat pentru utilizare la persoanele cu vârsta de doisprezece ani și peste în unele jurisdicții și pentru persoanele de optsprezece ani și peste în alte jurisdicții pentru a oferi protecție împotriva COVID-19 care este cauzată de infecția cu virusul SARS-CoV-2 . Este conceput pentru a fi administrat ca două sau trei doze de 0,5 ml administrate prin injecție intramusculară la un interval de cel puțin 28 de zile distanță.
Este un vaccin ARN compus din mARN modificat nucleozidic (modRNA) care codifică o proteină spike a SARS-CoV-2, care este încapsulată în nanoparticule lipidice .
Este autorizat pentru utilizare la un anumit nivel în multe țări.
La 15 martie 2021, Moderna a doua COVID-19 vaccin ( mARN-1283 ) a început faza I studiile clinice . Acest candidat vaccin poate fi păstrat în frigidere în loc de congelatoare, facilitând distribuția mai ales în țările în curs de dezvoltare.
La 6 octombrie 2021, o serie de țări europene au încetat să mai ofere vaccinul Moderna persoanelor mai tinere din cauza aparițiilor rare de miocardită .
Utilizări medicale
Vaccinul Moderna COVID-19 este utilizat pentru a oferi protecție împotriva infecției cu virusul SARS-CoV-2 pentru a preveni COVID-19.
Vaccinul se administrează prin injecție intramusculară în mușchiul deltoid . Cursul inițial constă din două doze. Organizația Mondială a Sănătății (OMS) recomandă un interval de 28 de zile între doze. Datele arată că eficacitatea primei doze persistă până la zece săptămâni. Prin urmare, pentru a evita decesele în care rezervele sunt limitate, OMS recomandă întârzierea celei de-a doua doze cu până la 12 săptămâni pentru a realiza o acoperire ridicată a primei doze în grupurile cu prioritate ridicată.
Nu există dovezi că o a treia doză de rapel este necesară pentru a preveni bolile severe la adulții sănătoși. O a treia doză poate fi adăugată după 28 de zile pentru persoanele imunodeprimate din unele țări.
Eficacitate
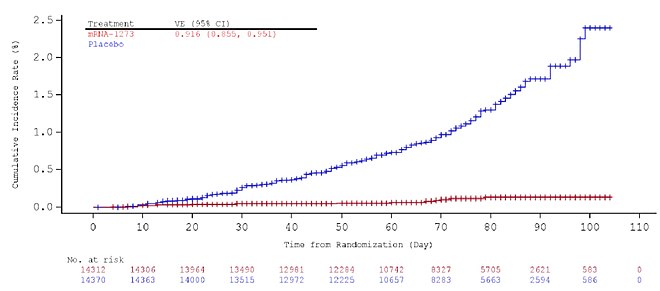
Dovezile eficacității vaccinului încep la aproximativ două săptămâni după prima doză. Eficacitatea ridicată se obține cu imunizarea completă, la două săptămâni după a doua doză și a fost evaluată la 94,1%: la sfârșitul studiului de vaccin care a condus la autorizarea de urgență în SUA, au existat unsprezece cazuri de COVID-19 în grupul de vaccinuri. (din 15.181 de persoane) versus 185 de cazuri în grupul placebo (15.170 de persoane). Mai mult, au existat zero cazuri de COVID-19 sever în grupul de vaccinuri, comparativ cu unsprezece în grupul cu placebo. Această eficacitate a fost descrisă drept „uimitoare” și „istorică la limită” pentru un vaccin cu virus respirator și este similară cu eficacitatea vaccinului Pfizer – BioNTech COVID-19 .
Estimările de eficacitate au fost similare între grupurile de vârstă, sexe, grupuri rasiale și etnice și participanții cu comorbidități medicale asociate cu un risc ridicat de COVID-19 sever. Au fost studiați doar persoanele cu vârsta de 18 ani sau mai mult. Sunt în curs studii pentru a evalua eficacitatea și siguranța la copii cu vârsta cuprinsă între 0-11 ani (KidCOVE) și 12-17 (TeenCOVE).
Un studiu suplimentar realizat de Centrele SUA pentru Controlul și Prevenirea Bolilor (CDC) între decembrie 2020 și martie 2021, pe aproape 4 mii de personal medical, primii respondenți și alți lucrători esențiali și de primă linie au concluzionat că, în condiții reale, ARNm eficacitatea vaccinului imunizării complete (14 zile sau mai mult după a doua doză) a fost de 90% împotriva infecțiilor cu SARS-CoV-2 , indiferent de simptome, iar eficacitatea vaccinului imunizării parțiale (14 zile sau mai mult după prima doză, dar înainte de a doua doză) a fost de 80 %.
Durata protecției oferite de vaccin nu este cunoscută din aprilie 2021 și este în curs un studiu de urmărire de doi ani pentru a determina durata.
Rezultatele preliminare ale unui studiu de fază III indică faptul că eficacitatea vaccinului este durabilă, rămânând la 93% la șase luni după a doua doză.
Eficacitatea ridicată a vaccinului deja după prima doză (adică cu titruri de anticorpi suboptimi), observația că imunogenitatea sa chiar la un sfert sau jumătate din doza standard este substanțială și relația observată a efectului secundar doză a dus la concepte de vaccinare personalizate: Modelarea epidemică utilizând caracteristicile vaccinului Moderna prezice că, într-un cadru de disponibilitate limitată a vaccinului, atunci când un val de variante de îngrijorare a virusului lovește o țară, beneficiul societății vaccinării poate fi sporit și accelerat printr-o strategie de dozare personalizată, adaptată la starea pandemie, date demografice, vârsta beneficiarilor, disponibilitatea vaccinurilor și riscul individual de boală severă. Utilizarea dozei standard la vârstnici va reduce boala severă și decesele, așa cum se arată în studiul pivot, doza redusă (înmulțind astfel numărul primitorilor precoce) la tinerii sănătoși care determină răspândirea pandemiei prin contacte sociale frecvente poate opri pandemia mai devreme în timp ce este încă obținerea unui răspuns imun suficient și administrarea unei doze de rapel suplimentare imunosupresate poate optimiza eficacitatea vaccinului în această subpopulație cunoscută pentru un răspuns imun slab la vaccinare.
Eficacitate
Un vaccin este, în general, considerat eficient dacă estimarea este ≥50%, cu o limită inferioară> 30% a intervalului de încredere de 95% . Eficacitatea se așteaptă, în general, să scadă încet în timp.
Datele preliminare dintr-un studiu din Minnesota sugerează că vaccinul rămâne eficient împotriva spitalizării și infecției asimptomatice de către varianta Delta. Din ianuarie până în iulie 2021, varianta dominantă din Minnesota a trecut de la Alpha în ianuarie, cu o prevalență de 85%, la Delta în iulie, cu o prevalență de 70%. Eficacitatea împotriva spitalizării prin orice variantă a scăzut ușor, de la92% ( IC 95% ,81 -97% ) pe întreaga perioadă până la81% (33 -96% ) în iulie. Eficacitatea împotriva infecției asimptomatice prin orice variantă a scăzut, de asemenea, doar ușor, de la86% (81 -91% ) pe toată perioada până la76% (58 -87% ) în iulie. Prin comparație, eficacitatea împotriva infecției asimptomatice prin orice variantă a scăzut și mai mult pentru vaccinul Pfizer-BioNTech , de la76% (69 -81% ) pe întreaga perioadă până la42% (13 -62% ) în iulie.
La 27 august, Centrele pentru Controlul și Prevenirea Bolilor au publicat un studiu care a raportat că eficacitatea împotriva infecției a scăzut91% (81 -96% ) la66% (26 -84% ) atunci când varianta Delta a devenit predominantă în SUA, ceea ce se poate datora confuziei nemăsurate și rezidualelegate de o scădere a eficacității vaccinului în timp.
| Doze | Severitatea bolii | Alfa | Beta | Gamma | Delta | Alții circulau anterior |
|---|---|---|---|---|---|---|
| 1 | Simptomatic | 61% (56 -66% ) | 43% (22 -59% ) | Nu a fost raportat | 61% (53 -67% ) | |
| Spitalizare | 59% (39 -73% ) | 56% (−9 la82% ) | Nu a fost raportat | 76% (46 -90% ) | ||
| 2 | Simptomatic | 90% (85 -94% ) | 88% (61 -96% ) | Nu a fost raportat | 93% (87 -96% ) | |
| Spitalizare | 94% (59 -99% ) | 100% | Nu a fost raportat | 90% (80 -100% ) | ||
Populații specifice
Sunt disponibile date limitate privind siguranța vaccinului Moderna COVID-19 pentru persoanele gravide. Studiul inițial a exclus femeile gravide sau le-a întrerupt din vaccinare la un test pozitiv de sarcină. Studiile la animale nu au constatat probleme de siguranță și sunt în curs studii clinice pentru a evalua siguranța și eficacitatea vaccinurilor COVID-19 la gravide. Observațiile din lumea reală prin intermediul programului de urmărire v-safe CDC nu au descoperit un număr neobișnuit de evenimente adverse sau rezultate de interes. Pe baza rezultatelor unui studiu preliminar, CDC SUA recomandă ca persoanele însărcinate să fie vaccinate cu vaccinul COVID-19.
Efecte adverse
Organizația Mondială a Sănătății (OMS) a declarat că „datele de siguranță susțin un profil de siguranță favorabil” și că profilul AE ( eveniment advers ) al vaccinului „nu sugerează nicio problemă specifică de siguranță”. Cele mai frecvente evenimente adverse au fost durerea la locul injectării, oboseală, cefalee, mialgie (durere musculară) și artralgie (durere articulară).
Centrele SUA pentru Controlul și Prevenirea Bolilor (CDC) au raportat anafilaxie (o reacție alergică severă) în 2,5 cazuri pe milion de doze administrate și au recomandat o perioadă de observație de 15 minute după injectare. Reacțiile cutanate întârziate la locurile de injectare care au dus la eriteme asemănătoare erupțiilor cutanate au fost, de asemenea, observate în cazuri rare, dar nu sunt considerate grave sau contraindicații pentru vaccinarea ulterioară. Rata incidenței eritemului advers local este de aproximativ 10,8%, în 1,9% din cazuri roșeața se poate extinde la o dimensiune de 100 mm sau mai mare.
La 23 iunie 2021, CDC SUA a confirmat că miocardita sau pericardita apare la aproximativ 13 din 1 milion de tineri, majoritatea bărbați și peste 16 ani, care au primit vaccinul Moderna sau Pfizer-BioNTech . Majoritatea persoanelor afectate se recuperează rapid cu un tratament adecvat și odihnă.
Farmacologie
Tehnologia Moderna folosește un compus de ARN messenger modificat nucleozidic (modRNA) denumit în cod mRNA-1273. Odată ce compusul se află în interiorul unei celule umane, ARNm se leagă de reticulul endoplasmatic al celulei . ARNm-1273 este codificat pentru a declanșa celula în producerea unei proteine specifice folosind procesul normal de fabricare a celulei. Vaccinul codifică o versiune a proteinei spike cu o modificare numită 2P, în care proteina include două mutații stabilizatoare în care aminoacizii originali sunt înlocuiți cu proline , dezvoltate de cercetătorii de la Universitatea Texas din Austin și Institutul Național de Alergie și Centrul de cercetare a vaccinului pentru bolile infecțioase . Odată ce proteina este expulzată din celulă, aceasta este în cele din urmă detectată de sistemul imunitar, care începe să genereze anticorpi eficienți. Sistemul de eliberare a medicamentului mARN-1273 utilizează un sistem de eliberare a medicamentelor cu nanoparticule lipidice PEGilate (LNP).
Chimie
Vaccinul conține următoarele ingrediente:
Ingredientul activ este o secvență de ARNm care conține un total de 4101 nucleotide care codifică glicoproteina SARS-CoV-2 cu vârf complet (S), cu două mutații (K986P și V987P) concepute pentru a stabiliza conformația pre-fuziune. Secvența este optimizată în continuare prin:
- toate uridinele (U) substituite cu N1-metilpseudouridină (U → m1Ψ),
- flancat de o regiune artificială de 5 ' netradusă (UTR) și o UTR de 3' derivată din gena umană alfa globină ( HBA1 ),
- introducerea a doi codoni de oprire suplimentari ,
- terminat de o coadă poli (A) de 3 '.
O secvență presupusă a vaccinului a fost publicată pe un forum pentru virologi profesioniști, obținută prin secvențierea directă a materialului rezidual al vaccinului în flacoanele folosite.
ARNm-ul vaccinului este dizolvat într-un tampon apos conținând trometamină , clorhidrat de trometamină , acetat de sodiu și zaharoză . ARNm este încapsulat în nanoparticule lipidice care stabilizează ARNm și facilitează intrarea acestuia în celule. Nanoparticulele sunt fabricate din următoarele lipide :
- 1,2-distearoil-sn-glicero-3-fosfocolina (DSPC),
- colesterol ,
- PEG2000-DMG (polietilen glicol (PEG) 2000-dimiristoil glicerol (DMG)) și
- SM-102
de fabricație
Moderna se bazează pe larg pe organizațiile de producție contractuale pentru a-și extinde procesul de fabricare a vaccinurilor. Primul pas al procesului - sinteza plasmidelor ADN (care urmează să fie utilizat ca șablon pentru sinteza ARNm) - a fost gestionat de un contractor numit Aldevron cu sediul în Fargo, Dakota de Nord . Pentru restul procesului, Moderna a contractat cu Lonza Group producerea vaccinului în instalațiile din Portsmouth, New Hampshire, în Statele Unite și în Visp, în Elveția, și a achiziționat excipienții lipidici necesari de la CordenPharma. În afară de CMO-uri, Moderna fabrică vaccinul și la propria instalație de producție din Norwood, Massachusetts .
Pentru sarcinile de umplere și ambalare a flacoanelor ( umplere și finisare ), Moderna a încheiat contracte cu Catalent în Statele Unite și Laboratorios Farmacéuticos Rovi în Spania. În aprilie 2021, Moderna și-a extins acordul cu Catalent pentru a crește producția de fabricație la uzina acestuia din Bloomington, Indiana . Extinderea va permite Catalent să producă până la 400 de flacoane pe minut și să umple încă 80 de milioane de flacoane pe an. Mai târziu în acea lună, Moderna și-a anunțat planurile de a cheltui miliarde de dolari pentru a crește producția de vaccinuri, triplând potențial producția în 2022, susținând, de asemenea, că va face nu mai puțin de 800 de milioane de doze în 2021. Creșterea producției este în parte atribuit îmbunătățirilor aduse de companie în metodele de fabricație.
Știrile despre Moderna au urmat rezultatele preliminare ale candidatului la vaccinul Pfizer - BioNTech , BNT162b2 , cu Moderna care demonstrează o eficacitate similară, dar necesită depozitare la temperatura unui frigider medical standard de 2-8 ° C (36-46 ° F) până la treizeci de ani zile sau −20 ° C (−4 ° F) timp de până la patru luni, în timp ce candidatul Pfizer-BioNTech necesită depozitare la congelator ultracold între −80 și −60 ° C (−112 și −76 ° F). Țările cu venituri mici au, de obicei , capacitatea lanțului de frig pentru depozitarea standard a frigiderului, nu pentru depozitarea congelatorului ultracold. În februarie 2021, restricțiile privind vaccinul Pfizer au fost relaxate atunci când Administrația SUA pentru Alimente și Medicamente (FDA) a actualizat autorizația de utilizare de urgență (EUA) pentru a permite transportul și depozitarea fiolelor congelate nediluate ale vaccinului între −25 și −15 ° C (−13 și 5 ° F) timp de până la două săptămâni înainte de utilizare. Vaccinul Moderna nu trebuie păstrat la o temperatură sub -50 ° C (-58 ° F).
În noiembrie 2020, Nature a raportat că „Deși este posibil ca diferențele în formulările LNP sau structurile secundare ale ARNm să poată explica diferențele de termostabilitate [între Moderna și BioNtech], mulți experți suspectează că ambele produse vaccinale se vor dovedi în cele din urmă că au cerințe de depozitare și durate de depozitare similare în diferite condiții de temperatură. "
Istorie
În ianuarie 2020, Moderna a anunțat dezvoltarea unui vaccin ARN , denumit în cod mRNA-1273, pentru a induce imunitatea la SARS-CoV-2.
Moderna a primit 955 milioane USD de la BARDA, un birou al Departamentului SUA pentru Sănătate și Servicii Umane . BARDA a finanțat 100% din costul aducerii vaccinului la licența FDA.
Guvernul Statelor Unite a furnizat finanțare totală de 2,5 miliarde USD pentru vaccinul Moderna COVID-19 (mRNA-1273). Donatorii privați au contribuit, de asemenea, la dezvoltarea vaccinului. Dolly Parton Covid-19 Fondul de cercetare a contribuit cu 1 milion $.
Studii clinice
Faza I – II
În martie 2020, faza I a studiului uman cu mRNA-1273 a început în parteneriat cu Institutul Național de Alergii și Boli Infecțioase din SUA . În aprilie, Autoritatea SUA pentru Cercetare și Dezvoltare Biomedică Avansată (BARDA) a alocat până la 483 milioane dolari pentru dezvoltarea vaccinului Moderna. Planurile pentru un studiu de fază II de dozare și eficacitate care să înceapă în luna mai au fost aprobate de Administrația SUA pentru Alimente și Medicamente (FDA). Moderna a semnat un parteneriat cu producătorul elvețian de vaccinuri Lonza Group , pentru a furniza 300 de milioane de doze pe an.
La 25 mai 2020, Moderna a început un studiu clinic de fază IIa care recrutează șase sute de participanți adulți pentru a evalua siguranța și diferențele în răspunsul anticorpilor la două doze de vaccinul său candidat, mRNA-1273, un studiu preconizat să se finalizeze în 2021.
La 14 iulie 2020, oamenii de știință din Moderna au publicat rezultatele preliminare ale studiului clinic de creștere a dozei de fază I cu mRNA-1273, care arată inducerea dependentă de doză a anticorpilor neutralizanți împotriva S1 / S2 încă din 15 zile după injectare. Reacții adverse ușoare până la moderate , cum ar fi febră , oboseală, cefalee, dureri musculare și dureri la locul injectării, au fost observate în toate grupele de dozare, dar au fost frecvente cu o doză crescută. Vaccinul în doze mici a fost considerat sigur și eficient pentru a avansa un studiu clinic de fază III utilizând două doze de 100 μg administrate la intervale de 29 de zile.
În iulie 2020, a anunțat într - un Moderna raport preliminar care sa Operațiunea Warp Speed candidat a condus la producerea de anticorpi neutralizanți la adulți sănătoși , în faza I teste clinice . "La doza de 100 micrograme, cea Moderna avansează în studii mai mari, toți cei 15 pacienți au prezentat efecte secundare, inclusiv oboseală, frisoane, cefalee, dureri musculare și dureri la locul injectării." Dozele mai mari supărătoare au fost eliminate în iulie din studiile viitoare.
Faza III
Moderna și Institutul Național de Alergii și Boli Infecțioase au început un studiu de fază III în SUA pe 27 iulie, cu un plan de înscriere și atribuire a treizeci și mii de voluntari la două grupuri - un grup primind două doze de 100 μg de vaccin mRNA-1273 iar celălalt primind un placebo de 0,9% clorură de sodiu. Începând cu 7 august, s-au înscris peste 4.500 de voluntari.
În septembrie 2020, Moderna a publicat planul de studiu detaliat pentru studiul clinic. La 30 septembrie, CEO-ul Stéphane Bancel a spus că, dacă procesul va avea succes, vaccinul ar putea fi disponibil publicului până la sfârșitul lunii martie sau începutul lunii aprilie 2021. Începând din octombrie 2020, Moderna a finalizat înscrierea a 30.000 de participanți necesari pentru Proces de fază III. Institutele Naționale de Sănătate din SUA au anunțat, la 15 noiembrie 2020, că rezultatele generale ale studiilor au fost pozitive.
Din septembrie 2020, Moderna a folosit testul Elecsys Anti-SARS-CoV-2 S de la Roche Diagnostics , autorizat de Administrația SUA pentru Alimente și Medicamente (FDA) în baza unei autorizații de utilizare de urgență (EUA) la 25 noiembrie 2020. Potrivit unui furnizor independent a testelor clinice în microbiologie, „acest lucru va facilita măsurarea cantitativă a anticorpilor SARS-CoV-2 și va ajuta la stabilirea unei corelații între protecția indusă de vaccin și nivelurile de anticorpi ai domeniului de legare a receptorilor (RBD)”. Parteneriatul a fost anunțat de Roche la 9 decembrie 2020.
O analiză efectuată de FDA în decembrie 2020, a rezultatelor intermediare ale studiului clinic de fază III cu mRNA-1273 a arătat că este sigur și eficient împotriva infecției cu COVID-19, rezultând emiterea unui EUA de către FDA.
În februarie 2021, rezultatele studiului clinic de fază III au fost publicate în New England Journal of Medicine , indicând o eficacitate de 94% în prevenirea infecției cu COVID-19. Efectele secundare au inclus simptome asemănătoare gripei, cum ar fi durerea la locul injectării, oboseala, durerea musculară și cefaleea. Studiul clinic este în desfășurare și urmează să se încheie la sfârșitul anului 2022.
Autorizații
Accelerat
Începând cu decembrie 2020, mRNA-1273 era în curs de evaluare pentru autorizarea utilizării de urgență (EUA) de mai multe țări, ceea ce ar permite lansarea rapidă a vaccinului în Regatul Unit, Uniunea Europeană, Canada și Statele Unite.
La 18 decembrie 2020, mRNA-1273 a fost autorizat de către US Food and Drug Administration (FDA) în baza unui EUA. Acesta este primul produs de la Moderna care a fost autorizat de FDA.
La 23 decembrie 2020, mRNA-1273 SARS-CoV-2 a fost autorizat de Health Canada .
La 5 ianuarie 2021, mRNA-1273 a fost autorizat pentru utilizare în Israel de către Ministerul Sănătății sale .
La 3 februarie 2021, mRNA-1273 a fost autorizat pentru utilizare în Singapore de către Autoritatea sa pentru științe ale sănătății .
La 30 aprilie 2021, Organizația Mondială a Sănătății (OMS) a acordat listarea utilizărilor de urgență.
La 5 mai 2021, mRNA-1273 a fost autorizat pentru utilizare de urgență în Filipine de către Filipine Food and Drug Administration .
La 21 mai 2021, injecția intramusculară modernă COVID-19 (anterior TAK-919) a fost autorizată pentru utilizare de urgență în Japonia.
La 29 iunie 2021, mRNA-1273 a fost autorizat pentru utilizare în India de către controlorul general al drogurilor din India . În aceeași zi, vaccinul a fost aprobat și de Ministerul Sănătății din Vietnam pentru utilizare de urgență în țară.
La 5 august 2021, Agenția Națională de Reglementare Farmaceutică din Malaezia (NPRA) a dat înregistrări condiționate pentru utilizarea de urgență a vaccinului în țară.
Standard
La 6 ianuarie 2021, Agenția Europeană pentru Medicamente (EMA) a recomandat acordarea autorizației condiționate de introducere pe piață, iar recomandarea a fost acceptată de Comisia Europeană în aceeași zi. La 6 iunie 2021, EMA a început să evalueze o cerere de extindere a utilizării vaccinului modern COVID-19 pentru a include persoanele cu vârste cuprinse între 12 și 17 ani.
La 12 ianuarie 2021, Swissmedic a acordat autorizație temporară pentru vaccinul Moderna COVID-19 mARN în Elveția.
La 31 martie 2021, Agenția de reglementare a medicamentelor și produselor medicale (MHRA) a acordat autorizație condiționată de introducere pe piață în Regatul Unit.
La 9 august 2021, Spikevax a primit aprobarea provizorie în Australia. Aprobarea a fost actualizată la 4 septembrie 2021, pentru a include persoanele în vârstă de doisprezece ani și peste.
Vaccinul Moderna Spikevax COVID-19 a fost autorizat în Canada la 16 septembrie 2021, pentru persoanele cu vârsta de 12 ani și peste.
Dezvoltare ulterioară
Rămâne necunoscut dacă vaccinul Moderna COVID-19 oferă imunitate pe tot parcursul vieții sau dacă sunt necesare vaccinări periodice de rapel. Femeile însărcinate și care alăptează au fost, de asemenea, excluse din studiile inițiale utilizate pentru obținerea autorizației de utilizare de urgență, deși se așteaptă ca studiile efectuate în aceste populații să fie efectuate în 2021.
În ianuarie 2021, Moderna a anunțat că va oferi o a treia doză de vaccin pentru persoanele care au fost vaccinate de două ori în studiul său de faza I. Boosterul va fi pus la dispoziția participanților la șase până la douăsprezece luni după ce au primit a doua doză. Compania a spus că ar putea studia, de asemenea, o a treia împușcare la participanții din studiul său de faza III, dacă datele privind persistența anticorpilor o justifică.
În 2020, Moderna a colaborat cu Takeda Pharmaceutical Company și cu Ministerul Sănătății, Muncii și Bunăstării din Japonia (MHLW). Vaccinul este cunoscut sub numele de "Injecție intramusculară modernă VACCIN COVID-19".
La 25 ianuarie 2021, Moderna a început dezvoltarea unei noi forme de vaccin, denumită mRNA-1273.351, care ar putea fi utilizată ca o lovitură de rapel împotriva variantei Beta (linia B.1.351). De asemenea, a început testarea pentru a vedea dacă o a treia lovitură din vaccinul existent ar putea fi folosită pentru a combate variantele de virus. La 24 februarie, Moderna a anunțat că a produs și a livrat cantități suficiente de mRNA-1273.351 către Institutele Naționale de Sănătate pentru a rula studii clinice de fază I. La 16 martie 2021, pentru a crește durata vaccinării dincolo de adulți, Moderna a început studiile clinice ale vaccinurilor pe copii cu vârsta cuprinsă între 6 luni și 11 ani în SUA și Canada (KidCove), pe lângă cele existente și studiu complet înscris pe copii cu vârsta cuprinsă între 12-17 ani (TeenCOVE).
Moderna investighează, de asemenea, un rapel multivalent, mRNA-1273.211, care combină un amestec de 50-50 de mRNA-1273 și mRNA-1273.351.
Vaccinarea omologă prime-boost
În august 2021, Administrația SUA pentru Alimente și Medicamente (FDA) și Centrele SUA pentru Controlul și Prevenirea Bolilor (CDC) au autorizat utilizarea unei doze suplimentare de vaccin ARNm pentru persoanele imunodeprimate.
În septembrie 2021, Comitetul pentru produse medicamentoase de uz uman (CHMP) al Agenției Europene pentru Medicamente (EMA) a început să evalueze utilizarea unei doze de rapel a vaccinului Moderna COVID-19 care trebuie administrată la cel puțin șase luni după a doua doză în persoane cu vârsta de doisprezece ani și peste.
La 4 octombrie 2021, Agenția Europeană a Medicamentului (EMA) a declarat că persoanele cu sistem imunitar „grav slăbit” pot primi o doză suplimentară fie din vaccinul Pfizer – BioNTech COVID-19, fie din vaccinul Moderna COVID-19 începând cu cel puțin 28 de zile după a doua lor doză.
Vaccinarea heterologă prime-boost
Societate și cultură
Nume de marcă
mRNA-1273 a fost numele de cod în timpul dezvoltării și testării, elasomeran este denumirea internațională proprie propusă (pINN), iar Spikevax este numele de marcă.
Economie
În iunie 2020, Singapore a semnat un acord de pre-cumpărare pentru Moderna, plătind o primă de preț pentru a asigura stocul timpuriu de vaccinuri, deși guvernul a refuzat să furnizeze prețul și cantitatea reală, citând sensibilități comerciale și clauze de confidențialitate.
La 11 august 2020, guvernul SUA a semnat un acord pentru cumpărarea a 100 de milioane de doze de vaccin anticipat de Moderna, despre care Financial Times a spus că Moderna intenționează să prețuiască la 50-60 USD pe curs. În noiembrie 2020, Moderna a declarat că va taxa guvernele care își cumpără vaccinul între 25 și 37 USD pe doză, în timp ce UE caută un preț sub 25 USD pe doză pentru cele 160 de milioane de doze pe care intenționează să le achiziționeze de la Moderna.
În 2020, Moderna a obținut acorduri de cumpărare pentru mRNA-1273 cu Uniunea Europeană pentru 160 de milioane de doze și cu Canada pentru până la 56 de milioane de doze. Pe 17 decembrie, un tweet al secretarului de stat al bugetului din Belgia a dezvăluit că UE va plăti 18 USD pe doză, în timp ce The New York Times a raportat că SUA ar plăti 15 USD pe doză.
În februarie 2021, Moderna a declarat că se așteaptă la 18,4 miliarde de dolari SUA în vânzările vaccinului său COVID-19.
Controverse
În mai 2020, după publicarea rezultatelor parțiale și non-peer-review pentru doar opt din cei 45 de candidați într-un proces uman preliminar preliminar de fază I direct pe piețele financiare, CEO-ul a anunțat pe CNBC o emisiune imediată de drepturi de 1,25 miliarde USD pentru a strânge fonduri pentru companiei, la o evaluare de 30 miliarde de dolari, în timp ce Stat a spus: „Experții în vaccinuri spun că Moderna nu a produs date critice pentru evaluarea vaccinului COVID-19”.
La 7 iulie 2020, s-au dezvăluit disputele dintre Moderna și oamenii de știință guvernamentali cu privire la refuzul companiei de a partaja date din studiile clinice.
Moderna s-a confruntat, de asemenea, cu critici pentru că nu a recrutat oameni de culoare în studiile clinice.
La 18 august 2021, Departamentul SUA pentru Sănătate și Servicii Umane a anunțat un plan de a oferi o doză de rapel la opt luni după a doua doză, citând dovezi ale protecției reduse împotriva bolilor ușoare și moderate și a posibilității unei protecții reduse împotriva bolilor severe, spitalizare, și moartea. Oamenii de știință și OMS au reafirmat lipsa de dovezi cu privire la necesitatea unei doze de rapel pentru persoanele sănătoase și că vaccinul rămâne eficient împotriva bolilor severe la câteva luni după administrare. Într-o declarație, OMS și SAGE au spus că, deși protecția împotriva infecțiilor poate fi diminuată, protecția împotriva bolilor severe va fi probabil păstrată din cauza imunității celulare . Cercetările privind sincronizarea optimă pentru rapeluri sunt încă în curs de desfășurare și un rapel prea devreme poate duce la o protecție mai puțin robustă.
La 26 august 2021, Japonia a suspendat utilizarea a peste 1,6 milioane de doze de vaccin Moderna după rapoarte de flacoane contaminate.
Presupuse dezavantaje
Vaccinul Moderna ar putea crește riscul de a suferi de boli de inimă pentru tineri. Din acest motiv, Suedia a oprit vaccinările Moderna pentru persoanele născute după 1991.
Dezinformare
Videoclipurile de pe platformele de partajare a videoclipurilor au circulat în jurul lunii mai 2021, arătând persoanelor cu magneți lipiți de brațe după ce au primit vaccinul, demonstrând teoria presupusă a conspirației conform căreia vaccinurile conțin microcipuri , dar aceste videoclipuri au fost dezmembrate.
Litigii privind brevetele
Sistemul de livrare a medicamentelor cu nanoparticule lipidice PEGilate (LNP) de mRNA-1273 a făcut obiectul unor litigii în curs de brevetare cu Arbutus Biopharma , de la care Moderna acordase anterior licență tehnologiei LNP. La 4 septembrie 2020, Nature Biotechnology a raportat că Moderna a pierdut o provocare cheie în cazul în curs.
Note
Referințe
Lecturi suplimentare
- Organizația Mondială a Sănătății (2021). Document de fond privind vaccinul mRNA-1273 (Moderna) împotriva COVID-19: document de bază la recomandările OMS intermediare pentru utilizarea vaccinului mRNA-1273 (Moderna), 3 februarie 2021 (Raport). Organizația Mondială a Sănătății (OMS). hdl : 10665/339218 . WHO / 2019-nCoV / vaccines / SAGE_recommendation / mRNA-1273 / background / 2021.1.
linkuri externe
| Scholia are un profil pentru vaccinul mRNA-1273 (Q87775025) . |
- „Elasomeran” . Portalul de informații despre droguri . Biblioteca Națională de Medicină din SUA.
- „Document de informare al sponsorului VRBPAC mRNA-1273” (PDF) . Moderna. 17 decembrie 2020.
- „Protocol de studiu clinic mRNA-1273-P301” (PDF) . Moderna .
- „Raport de evaluare COVID-19 Vaccine Moderna” (PDF) . Agenția Europeană pentru Medicamente (EMA) .
- „Cum funcționează Vaccinul Moderna” . New York Times .
- „Vaccinul Moderna COVID-19” . Centre for Disease Control and Prevention (CDC). 6 august 2021.
- „Actualizări de siguranță pentru Spikevax (anterior COVID-19 Vaccine Moderna)” . Agenția Europeană pentru Medicamente (EMA) .
- Raport de evaluare publică australian pentru Elasomeran (PDF) (Raport). Administrarea bunurilor terapeutice (TGA). Septembrie 2021.