Mycobacterium tuberculosis -Mycobacterium tuberculosis
| Mycobacterium tuberculosis | |
|---|---|

|
|
| M. colonii de tuberculoză | |
| Clasificarea științifică | |
| Domeniu: | |
| Filum: |
" Actinobacteriile "
|
| Clasă: | |
| Ordin: | |
| Familie: | |
| Gen: | |
| Specii: |
M. tuberculoza
|
| Nume binom | |
|
Mycobacterium tuberculosis Zopf 1883
|
|
| Sinonime | |
|
Bacilul tuberculozei Koch 1882 |
|
Mycobacterium tuberculosis (M. tb) este o specie de bacterii patogene din familia Mycobacteriaceae și agentul cauzal al tuberculozei . Descoperit pentru prima dată în 1882 de Robert Koch , M. tuberculosis are o acoperire neobișnuită, ceară pe suprafața celulei sale, în principal datorită prezenței acidului micolic . Această acoperire face celulele impermeabile la colorația Gram și, ca rezultat, M. tuberculosis poate apărea slab Gram-pozitiv. Pete rezistente la acizi, cum ar fi Ziehl–Neelsen saupete fluorescente, cum ar fi auraminasunt folosite în schimb pentru a identifica M. tuberculosis cu un microscop. Fiziologia M. tuberculosis este foarte aerobă și necesită niveluri ridicate de oxigen. În primul rând un agent patogen al sistemului respirator al mamiferelor , infectează plămânii. Cele mai frecvent utilizate metode de diagnostic pentru tuberculoză sunt testul cutanat cu tuberculină , colorarea acido-rezistentă , cultura și reacția în lanț a polimerazei .
M. tuberculosis genomului a fost secvențiat în 1998.
Microbiologie
M. tuberculosis a fost găsit în 2019 un complex care are cel puțin 9 membri: M. tuberculosis sensu stricto , M. africanum , M. Canetti , M. bovis , M. caprae , M. microti , M. pinnipedii , M. mungi , iar M. orygis . Are nevoie de oxigen pentru a crește , se discută dacă produce spori și nu este mobil . M. tuberculosis se divide la fiecare 18–24 de ore. Acest lucru este extrem de lent în comparație cu alte bacterii, care tind să aibă timpii de diviziune măsurați în minute ( Escherichia coli se poate împărți aproximativ la fiecare 20 de minute). Este un bacil mic care poate rezista la dezinfectanții slabi și poate supraviețui în stare uscată săptămâni întregi. Peretele său celular neobișnuit este bogat în lipide, cum ar fi acidul micolic, este probabil responsabil pentru rezistența sa la uscare și este un factor cheie de virulență .
Microscopie
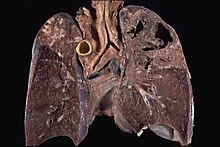
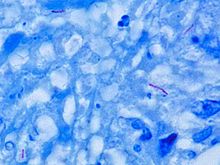
Alte bacterii sunt de obicei identificate cu un microscop prin colorarea lor cu colorație Gram . Cu toate acestea, acidul micolic din peretele celular al M. tuberculosis nu absoarbe pata. În schimb, se folosesc pete rezistente la acid, cum ar fi colorația Ziehl–Neelsen sau pete fluorescente, cum ar fi auramina . Celulele sunt curbate în formă de tijă și sunt adesea văzute înfășurate împreună, datorită prezenței acizilor grași în peretele celular care se lipesc. Acest aspect este denumit snur, ca fire de snur care alcătuiesc o frânghie. M. tuberculosis se caracterizează în țesut prin granuloame caseating care conțin celule gigantice Langhans , care au un model de nuclei „pocoavă”.
Cultură
M. tuberculosis poate fi cultivat în laborator. În comparație cu alte bacterii studiate în mod obișnuit, M. tuberculosis are o rată de creștere remarcabil de lentă, dublându-se aproximativ o dată pe zi. Mediile utilizate în mod obișnuit includ lichide precum Middlebrook 7H9 sau 7H12, medii solide pe bază de ou, cum ar fi Lowenstein-Jensen , și pe bază de agar solid, cum ar fi Middlebrook 7H11 sau 7H10 . Coloniile vizibile necesită câteva săptămâni pentru a crește pe plăci de agar. Se distinge de alte micobacterii prin producția de catalază și niacină . Alte teste pentru a-i confirma identitatea includ sondele genice și MALDI-TOF .
Fiziopatologia
Oamenii sunt singurele rezervoare cunoscute de M. tuberculosis . O concepție greșită este că M. tuberculosis se poate răspândi prin strângerea mâinii, contactul cu scaunele de toaletă, împărțirea alimentelor sau băuturii sau a periuțelor de dinți. Sărutul ar putea fi o posibilă cale de transmitere dacă persoana excretă multe micobacterii prin spută. Cu toate acestea, răspândirea majoră se face prin picăturile de aer provenite de la o persoană care are boala fie că tușește, strănută, vorbește sau cântă.
Când se află în plămâni, M. tuberculosis este fagocitată de macrofagele alveolare , dar acestea nu sunt capabile să omoare și să digere bacteria. Peretele său celular previne fuziunea fagozomului cu lizozomul , care conține o mulțime de factori antibacterieni. În mod specific, M. tuberculosis blochează molecula de legătură, autoantigenul 1 endozomal timpuriu ( EEA1 ); totuși, această blocare nu împiedică fuziunea veziculelor pline cu nutrienți. În consecință, bacteriile se înmulțesc necontrolate în interiorul macrofagului. Bacteriile poartă, de asemenea, gena UreC , care previne acidificarea fagozomului. În plus, producerea diterpenei izotuberculosinol împiedică maturarea fagozomului . Bacteriile se sustrage, de asemenea, de uciderea macrofagelor prin neutralizarea intermediarilor reactiv de azot. Mai recent, s- a demonstrat că M. tuberculosis secretă și se acoperă în 1-tuberculosiniladenozină (1-TbAd), o nucleozidă specială care acționează ca un antiacid , permițându-i să neutralizeze pH-ul și să inducă umflarea lizozomilor. 1-TbAd este codificat de gena Rv3378c .
În infecțiile cu M. tuberculosis , s-a constatat că nivelurile de PPM1A sunt supraregulate, iar acest lucru, la rândul său, ar avea un impact asupra răspunsului apoptotic normal al macrofagelor la patogenii curați, deoarece PPM1A este implicat în căile apoptotice intrinseci și extrinseci. Prin urmare, atunci când nivelurile PPM1A au fost crescute, expresia acestuia inhibă cele două căi apoptotice. Cu analiza kinome, s-a descoperit că calea de semnalizare JNK/AP-1 este un efector în aval în care PPM1A are un rol, iar calea apoptotică în macrofage este controlată în acest mod. Ca urmare a suprimării apoptozei, acesta oferă M. tuberculosis o nișă de replicare sigură și astfel bacteriile sunt capabile să mențină o stare latentă pentru un timp prelungit.
Granuloamele de protecție se formează datorită producției de citokine și reglării în creștere a proteinelor implicate în recrutare. Leziunile granulotomate sunt importante atât pentru reglarea răspunsului imun, cât și pentru minimizarea leziunilor tisulare. Mai mult, celulele T ajută la menținerea Mycobacterium în granuloame.
Abilitatea de a construi mutanți M. tuberculosis și de a testa produse genetice individuale pentru funcții specifice a avansat semnificativ înțelegerea patogenezei și a factorilor de virulență . Multe proteine secretate și exportate sunt cunoscute a fi importante în patogeneză. De exemplu, un astfel de factor de virulență este factorul cordonului (trehaloză dimicolat), care servește la creșterea supraviețuirii în interiorul gazdei sale. Tulpinile rezistente de M. tuberculosis au dezvoltat rezistență la mai mult de un medicament TB, din cauza mutațiilor în genele lor. În plus, medicamentele preexistente pentru tuberculoză de primă linie, cum ar fi rifampicina și streptomicina, au o eficiență scăzută în curățarea intracelulară a M. tuberculosis din cauza faptului că nu sunt capabile să pătrundă eficient în nișa macrofagelor.
JNK joacă un rol cheie în controlul căilor apoptotice - intrinseci și extrinseci. În plus, se găsește, de asemenea, că este un substrat al activității PPM1A, prin urmare fosforilarea JNK ar provoca apoptoza. Deoarece nivelurile PPM1A sunt crescute în timpul infecțiilor cu M. tuberculosis , prin inhibarea căilor de semnalizare PPM1A, ar putea fi o metodă terapeutică de a ucide macrofagele infectate cu M. tuberculosis prin restabilirea funcției normale apoptotice de apărare a agenților patogeni. Prin țintirea căii axei de semnalizare PPM1A-JNK, ar putea elimina macrofagele infectate cu M. tuberculosis .
Capacitatea de a restabili apoptoza macrofagelor la cei infectați cu M. tuberculosis ar putea îmbunătăți tratamentul actual de chimioterapie împotriva tuberculozei, deoarece medicamentele pentru tuberculoză pot obține un acces mai bun la bacteriile din nișă. scăzând astfel timpii de tratament pentru infecţiile cu M. tuberculosis .
Simptomele M. tuberculosis includ tuse care durează mai mult de trei săptămâni, hemoptizie , dureri în piept la respirație sau la tuse, scădere în greutate, oboseală, febră, transpirații nocturne, frisoane și pierderea poftei de mâncare. M. tuberculosis are, de asemenea, potențialul de a se răspândi în alte părți ale corpului. Acest lucru poate provoca sânge în urină dacă rinichii sunt afectați și dureri de spate dacă coloana vertebrală este afectată.
Variația tulpinii
Tiparea tulpinilor este utilă în investigarea focarelor de tuberculoză, deoarece oferă investigatorului dovezi pentru sau împotriva transmiterii de la persoană la persoană. Luați în considerare situația în care persoana A are tuberculoză și crede că a dobândit-o de la persoana B. Dacă bacteriile izolate de la fiecare persoană aparțin unor tipuri diferite, atunci transmiterea de la B la A este definitiv infirmată; totuși, dacă bacteriile sunt aceeași tulpină, atunci aceasta susține (dar nu dovedește definitiv) ipoteza că B a infectat-o pe A.
Până la începutul anilor 2000, tulpinile de M. tuberculosis au fost tipizate prin electroforeză pe gel în câmp pulsat . Acest lucru a fost acum înlocuit de un număr variabil de repetări în tandem (VNTR), care este mai ușor de realizat din punct de vedere tehnic și permite o mai bună discriminare între tulpini. Această metodă folosește prezența secvențelor ADN repetate în genomul M. tuberculosis .
Se notează trei generații de tipări VNTR pentru M. tuberculosis . Prima schemă, numită repetiție exactă în tandem, a folosit doar cinci loci, dar rezoluția oferită de acești cinci loci nu a fost la fel de bună ca PFGE. A doua schemă, numită unitate repetitivă intercalată micobacteriană, a avut o discriminare la fel de bună ca PFGE. A treia generație (unitatea repetitivă intercalată micobacteriană – 2) a adăugat încă nouă loci pentru a aduce totalul la 24. Acest lucru oferă un grad de rezoluție mai mare decât PFGE și este în prezent standardul pentru tiparea M. tuberculosis . Cu toate acestea, în ceea ce privește rămășițele arheologice, pot fi necesare dovezi suplimentare din cauza posibilei contaminări cu bacteriile din sol aferente.
Rezistența la antibiotice la M. tuberculosis apare de obicei datorită fie acumulării de mutații în genele vizate de antibiotic, fie unei modificări în titrarea medicamentului. M. tuberculosis este considerat a fi multirezistent (TB MDR) dacă a dezvoltat rezistență la medicamente atât la rifampicină, cât și la izoniazidă, care sunt cele mai importante antibiotice utilizate în tratament. În plus, M. tuberculosis rezistent la medicamente (XDR TB) este caracterizat prin rezistență atât la izoniazidă, cât și la rifampină, plus orice fluorochinolonă și cel puțin unul dintre cele trei medicamente injectabile de linia a doua (adică, amikacină, kanamicina sau capreomicina).
Genomul
Genomul tulpinii H37Rv a fost publicat în 1998. Dimensiunea sa este de 4 milioane de perechi de baze, cu 3.959 de gene; 40% dintre aceste gene au avut funcția caracterizată, cu o funcție posibilă postulată pentru încă 44%. În genom sunt, de asemenea, șase pseudogene .
Genomul conține 250 de gene implicate în metabolismul acizilor grași , 39 dintre acestea fiind implicate în metabolismul polichetidelor generând stratul de ceară. Un număr atât de mare de gene conservate arată importanța evolutivă a stratului de ceară pentru supraviețuirea agentului patogen. În plus, studiile experimentale au validat de atunci importanța unui metabolism lipidic pentru M. tuberculosis , constând în întregime din lipide derivate de gazdă, cum ar fi grăsimile și colesterolul. S-a demonstrat că bacteriile izolate din plămânii șoarecilor infectați folosesc preferabil acizii grași față de substraturile de carbohidrați. M. tuberculosis poate crește, de asemenea, pe colesterolul lipidic ca unică sursă de carbon, iar genele implicate în căile de utilizare a colesterolului au fost validate ca fiind importante în diferite etape ale ciclului de viață al infecției cu M. tuberculosis , în special în timpul fazei cronice. de infecție atunci când alți nutrienți probabil nu sunt disponibili.
Aproximativ 10% din capacitatea de codare este preluată de familiile de gene PE / PPE care codifică proteine acide bogate în glicină. Aceste proteine au un motiv N-terminal conservat, a cărui ștergere afectează creșterea macrofagelor și granuloamelor.
Nouă ARNs noncoding au fost caracterizate în M. tuberculosis , cu alte 56 prezise într-un ecran de bioinformatică .
În 2013, a fost realizat un studiu asupra genomului mai multor tulpini sensibile, ultrarezistente și multirezistente de M. tuberculosis pentru a studia mecanismele de rezistență la antibiotice. Rezultatele dezvăluie noi relații și gene de rezistență la medicamente neasociate anterior și sugerează că unele gene și regiuni intergenice asociate cu rezistența la medicamente pot fi implicate în rezistența la mai mult de un medicament. De remarcat este rolul regiunilor intergenice în dezvoltarea acestei rezistențe, iar majoritatea genelor propuse în acest studiu ca fiind responsabile pentru rezistența la medicamente au un rol esențial în dezvoltarea M. tuberculosis .
Evoluţie
M. tuberculosis complexă a evoluat în Africa și cel mai probabil , în Cornul Africii . În plus față de M. tuberculosis , M. tuberculosis complex (MTBC) are un număr de membri care infectează diferite specii de animale, acestea includ M. africanum , M. bovis (bacilul dassie lui), M. caprae , M. microti , M. mungi , M. orygis și M. pinnipedii . Acest grup poate include, de asemenea, clada M. canettii . Aceste tulpini de animale de MTBC nu merită strict statutul de specie, deoarece toate sunt strâns legate și încorporate în filogenia M. tuberculosis , dar din motive istorice, ele dețin în prezent statutul de specie.
M. canettii clade - care include M. prototuberculosis - este un grup de buna-colonie Mycobacterium specii. Spre deosebire de membrii stabiliți ai grupului M. tuberculosis , aceștia suferă recombinare cu alte specii. Majoritatea tulpinilor cunoscute ale acestui grup au fost izolate din Cornul Africii. Strămoșul M. tuberculosis pare să fie M. canettii , descris pentru prima dată în 1969.
Membrii stabiliți ai complexului M. tuberculosis sunt toți clonali în răspândirea lor. Principalele specii care infectează oamenii au fost clasificate în șapte linii. Traducând aceste descendențe în terminologia folosită pentru spoligotipizare, o metodologie de genotipizare foarte brută, descendența 1 conține tulpinile din Africa de Est - Indian (EAI), familia de tulpini Manila și unele tulpini Manu (indiene); descendența 2 este grupul Beijing ; descendența 3 include tulpinile din Asia Centrală (CAS); descendența 4 include tulpinile Ghana și Haarlem (H/T), America Latină - Mediterană (LAM) și tulpinile X; tipurile 5 și 6 corespund M. africanum și sunt observate predominant și la frecvențe înalte în Africa de Vest . Un al șaptelea tip a fost izolat din Cornul Africii. Celelalte specii ale acestui complex aparțin unui număr de spoligotipuri și, în mod normal, nu infectează oamenii.
Liniile 2, 3 și 4 au toate un eveniment de ștergere unic (tbD1) și formează astfel un grup monofiletic. Tipurile 5 și 6 sunt strâns legate de tulpinile animale de MTBC, care în mod normal nu infectează oamenii. Linia 3 a fost împărțită în două clade: CAS-Kili (găsită în Tanzania ) și CAS-Delhi (găsită în India și Arabia Saudită ).
Linia 4 este cunoscută și ca descendența euro-americană. Subtipurile din acest tip includ Marea Mediterană din America Latină, Uganda I, Uganda II, Haarlem, X și Congo.
Un studiu mult citat a raportat că M. tuberculosis a evoluat împreună cu populațiile umane și că cel mai recent strămoș comun al complexului M. tuberculosis a evoluat între 40.000 și 70.000 de ani în urmă. Cu toate acestea, un studiu ulterior, care a inclus secvențe de genom de la membrii complexului M. tuberculosis extrași din trei mumii peruviane vechi de 1.000 de ani, a ajuns la concluzii destul de diferite. Dacă cel mai recent strămoș comun al complexului M. tuberculosis ar avea 40.000 până la 70.000 de ani, acest lucru ar necesita o rată evolutivă mult mai mică decât orice estimări produse de analizele genomice ale probelor heterocrone.
O analiză a peste 3000 de tulpini de M. bovis din 35 de țări a sugerat o origine africană pentru această specie.
Co-evoluție cu oamenii moderni
În prezent, există două narațiuni în paralel cu privire la vârsta MTBC și modul în care s-a răspândit și a evoluat împreună cu oamenii de-a lungul timpului. Un studiu a comparat filogenia M. tuberculosis cu o filogenie a genomului mitocondrial uman și le-a interpretat ca fiind foarte asemănătoare. Pe baza acestui fapt, studiul a sugerat că M. tuberculosis , ca și oamenii, a evoluat în Africa și, ulterior, s-a răspândit cu oamenii moderni din punct de vedere anatomic din Africa din întreaga lume. Prin calibrarea ratei de mutație a M. tuberculosis pentru a se potrivi cu această narațiune, studiul a sugerat că MTBC a evoluat acum 40.000-70.000 de ani. Aplicând această scală de timp, studiul a constatat că dimensiunea efectivă a populației de M. tuberculosis sa extins în timpul tranziției demografice neolitice (acum aproximativ 10.000 de ani) și a sugerat că M. tuberculosis a fost capabil să se adapteze la schimbarea populațiilor umane și că succesul istoric al acestui agent patogen a fost determinată cel puțin parțial de creșterile dramatice ale densității populației gazde umane. De asemenea, s-a demonstrat că, după emigrarea de pe un continent pe altul, regiunea de origine a unei gazde umane este predictivă despre descendența TB pe care o poartă, ceea ce ar putea reflecta fie o asociere stabilă între populațiile gazdă și liniile specifice de M. tuberculosis și/sau interacțiuni sociale. care sunt modelate de istoriile culturale și geografice comune.
În ceea ce privește congruența dintre filogeniile umane și M. tuberculosis , un studiu bazat pe secvențele de ADN ale M. tuberculosis și ale cromozomului Y uman pentru a evalua în mod formal corelația dintre acestea a concluzionat că nu sunt congruente. De asemenea, un studiu mai recent care a inclus secvențe de genom de la membrii complexului M. tuberculosis extrași din trei mumii peruviane vechi de 1.000 de ani, a estimat că cel mai recent strămoș comun al complexului M. tuberculosis a trăit doar cu 4.000 – 6.000 de ani în urmă. Rata evolutivă a M. tuberculosis estimată de Bos et al. Studiul este susținut și de un studiu privind Lineage 4, bazat pe secvențe genomice de ADN de la mumii maghiare vechi de peste 200 de ani. În total, dovezile favorizează astfel această estimare mai recentă a vârstei celui mai recent strămoș comun MTBC și, astfel, că evoluția globală și răspândirea M. tuberculosis a avut loc în ultimii 4.000–6.000 de ani.
Dintre cele șapte filiații recunoscute de M. tuberculosis , doar două sunt cu adevărat globale în distribuția lor: Linia 2 și 4. Dintre acestea, Linia 4 este cea mai bine dispersată și domină aproape în totalitate în America. Linia 4 s-a demonstrat că a evoluat în sau în vecinătatea Europei și s-a răspândit la nivel global cu europenii începând cu secolul al XIII-lea. Acest studiu a mai constatat că tuberculoza Lineage 4 s-a răspândit în America la scurt timp după descoperirea europeană a continentului în 1492 și sugerează că aceasta a reprezentat prima introducere a tuberculozei umane pe continent (deși tulpini de animale au fost găsite în rămășițele umane precedând Columb. În mod similar, s-a descoperit că Lineage 4 sa răspândit din Europa în Africa în timpul Epocii Descoperirilor , începând cu începutul secolului al XV-lea.
S-a sugerat că micobacteriile ancestrale ar fi putut infecta hominidele timpurii din Africa de Est încă de acum trei milioane de ani.
Fragmente de ADN de la M. tuberculosis și indicații ale bolii tuberculozei au fost prezente în corpurile umane datând de acum 9250-8160 de ani, găsite la Atlit-Yam din Levant .
Rezistența la antibiotice (ABR)
M. tuberculosis este un organism clonal și nu face schimb de ADN prin transfer orizontal de gene . Acest lucru, posibil combinat cu o rată de evoluție relativ scăzută, ar putea explica de ce evoluția rezistenței a fost relativ lentă la specie în comparație cu alți alți patogeni bacterieni majori. Cu toate acestea, ABR este o provocare foarte serioasă și în creștere. Cele mai afectate sunt țările din fostele republici sovietice, unde ABR a evoluat și s-a răspândit la niveluri explozive după căderea Uniunii Sovietice. Un exemplu extrem este Belarus, unde o treime din toate cazurile noi de tuberculoză sunt multirezistente. Tuberculoza multirezistentă necesită tratament prelungit cu medicamente scumpe și adesea toxice, iar eșecul tratamentului este frecvent.
Tuberculoza multirezistentă (MDR-TB) este cauzată de un organism care este rezistent cel puțin la izoniazidă și rifampină , cele două medicamente cele mai puternice împotriva tuberculozei. Aceste medicamente sunt utilizate pentru a trata toate persoanele cu boală TBC. Majoritatea persoanelor cu TBC sunt vindecate printr-o rutină medicală de jumătate de an, strict urmată, care este oferită pacienților cu sprijin și supraveghere. Utilizarea inadecvată sau incorectă a medicamentelor antimicrobiene sau utilizarea planurilor ineficiente de medicamente și întreruperea prematură a tratamentului pot provoca rezistență la medicamente, care poate fi apoi transmisă, mai ales în medii aglomerate, cum ar fi închisorile și spitalele. În 2016, aproximativ 490.000 de persoane din întreaga lume au dezvoltat MDR-TB și alte 110.000 de persoane cu TB rezistentă la rifampicină au fost, de asemenea, nou eligibile pentru tratamentul MDR-TB. Țările cu cel mai mare număr de cazuri de TB-MDR (47% din totalul global) au fost China, India și Federația Rusă.
Cercetătorii susținuți de granturi de la NIH și NIAID au testat eficacitatea peptoizilor antimicrobieni împotriva firelor rezistente la antibiotice ale Mycobacterium tuberculosis. Peptoizii antimicrobieni demonstrează un mecanism de acțiune nespecific împotriva membranei bacteriene, unul care diferă de antibioticele cu molecule mici care se leagă de receptori specifici (și astfel sunt susceptibile la mutații sau modificări ale structurii bacteriene). Rezultatele preliminare au sugerat „activitate apreciabilă” împotriva firelor bacteriene sensibile la medicamente, ceea ce a condus la un apel pentru mai multe cercetări privind viabilitatea peptoizilor ca o nouă clasă de medicamente tuberculocide.
Genetica gazdei
Natura interacțiunii gazdă-patogen dintre oameni și M. tuberculosis este considerată a avea o componentă genetică. Un grup de tulburări rare numite susceptibilitate mendeliană la bolile micobacteriene a fost observat la un subgrup de indivizi cu un defect genetic care are ca rezultat o susceptibilitate crescută la infecția micobacteriană.
Studiile timpurii de caz și gemeni au indicat că componentele genetice sunt importante în susceptibilitatea gazdei la M. tuberculosis . Studiile recente de asociere la nivelul genomului (GWAS) au identificat trei loci de risc genetic, inclusiv la pozițiile 11p13 și 18q11. Așa cum este obișnuit în GWAS, variantele descoperite au dimensiuni moderate ale efectului.
Repararea ADN-ului
Ca agent patogen intracelular, M. tuberculosis este expus la o varietate de atacuri care dăunează ADN-ului, în primul rând de la radicalii toxici antimicrobieni generați de gazdă. Expunerea la specii reactive de oxigen și/sau specii reactive de azot provoacă diferite tipuri de leziuni ale ADN-ului, inclusiv oxidarea, depurinarea, metilarea și dezaminarea care pot da naștere la rupturi simple și duble catene (DSB).
Polimeraza DnaE2 este suprareglată în M. tuberculosis de către mai mulți agenți care dăunează ADN-ului, precum și în timpul infecției la șoareci. Pierderea acestei ADN polimeraze reduce virulența M. tuberculosis la șoareci. DnaE2 este o polimerază de reparare ADN predispusă la erori care pare să contribuie la supraviețuirea M. tuberculosis în timpul infecției.
Cele două căi majore utilizate în repararea DSB-urilor sunt repararea recombinațională omoloagă (HR) și îmbinarea la capăt neomolog (NHEJ). M. tuberculosis internalizat de macrofage este capabil să persiste dacă oricare dintre aceste căi este defectuoasă, dar este atenuată atunci când ambele căi sunt defecte. Acest lucru indică faptul că expunerea intracelulară a M. tuberculosis la oxigenul reactiv și/sau la speciile reactive de azot are ca rezultat formarea de DSB care sunt reparate de HR sau NHEJ. Cu toate acestea, deficiența reparației DSB nu pare să afecteze virulența M. tuberculosis la modelele animale.
Istorie
M. tuberculosis , cunoscut pe atunci sub numele de „ bacilul tuberculos ”, a fost descris pentru prima dată la 24 martie 1882 de Robert Koch , care a primit ulterior Premiul Nobel pentru Fiziologie sau Medicină pentru această descoperire în 1905; bacteria mai este cunoscută și sub numele de „bacilul lui Koch”.
M. tuberculosis a existat de-a lungul istoriei, dar numele s-a schimbat frecvent de-a lungul timpului. În 1720, însă, istoria tuberculozei a început să prindă contur în ceea ce se știe despre ea astăzi; așa cum a descris medicul Benjamin Marten în A Theory of Consumption , tuberculoza poate fi cauzată de mici creaturi vii transmise prin aer altor pacienți. Această boală transmisă prin aer este cea mai mortală boală infecțioasă din lume, afectând în prezent aproape 2 miliarde de oameni din întreaga lume. M. tuberculosi se trece cu ușurință prin aer prin strănut, tuse sau pur și simplu vorbind. O picătură contaminată poate infecta orice persoană și aceasta se poate contamina cu M. tuberculosis . Ei devin astfel parte din cei 1,8 miliarde de oameni din întreaga lume care se luptă în prezent cu această boală.
Vaccin
Vaccinul BCG (bacilul Calmette-Guerin), care a fost derivat din M. bovis, a avut un succes limitat în prevenirea tuberculozei. Acest vaccin este utilizat în țări care sunt renumite pentru a avea cazuri de M. tuberculosis , prin urmare nu este un vaccin recomandat în Statele Unite din cauza riscului scăzut de infecție. Pentru a primi acest vaccin în Statele Unite, o persoană trebuie să treacă printr-un proces de consultare cu un expert în M. tb și este administrat numai celor care îndeplinesc criteriile specifice.
BCG, potrivit unui articol din Kyodo News (14 aprilie 2020) intitulat „Vaccinul împotriva tuberculozei atrage atenția în lupta împotriva coronavirusului” indică o posibilă corelație între vaccinarea BCG și un răspuns imun mai bun la COVID-19.
Vezi si
Referințe
linkuri externe
| Scholia are un profil de subiect pentru Mycobacterium tuberculosis . |