Fosfatază cu lanț ușor miozină - Myosin-light-chain phosphatase
| Fosfatază cu lanț ușor miozină | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Structura complexului dintre PP1 și o porțiune din MYPT1, generată din 1s70
| |||||||||
| Identificatori | |||||||||
| CE nr. | 3.1.3.53 | ||||||||
| CAS nr. | 86417-96-1 | ||||||||
| Baze de date | |||||||||
| IntEnz | Vizualizare IntEnz | ||||||||
| BRENDA | Intrare BRENDA | ||||||||
| EXPASy | Vedere NiceZyme | ||||||||
| KEGG | Intrare KEGG | ||||||||
| MetaCyc | cale metabolică | ||||||||
| PRIAM | profil | ||||||||
| Structuri PDB | RCSB PDB PDBe PDBsum | ||||||||
| Ontologie genică | AmiGO / QuickGO | ||||||||
| |||||||||
Fosfataza cu lanț ușor miozină , mai frecvent numită miozin fosfatază ( EC 3.1.3.53 ), este o enzimă (în mod specific o fosfatază proteină specifică serinei / treoninei ) care defosforilează lanțul ușor de reglare al miozinei II . Această reacție de defosforilare are loc în țesutul muscular neted și inițiază procesul de relaxare a celulelor musculare. Astfel, miozina fosfatază anulează procesul de contracție musculară inițiat de kinaza cu lanț ușor a miozinei . Enzima este compusă din trei subunități: regiunea catalitică ( proteina fosfatază 1 sau PP1), subunitatea de legare a miozinei (MYPT1) și o a treia subunitate (M20) cu funcție necunoscută. Regiunea catalitică folosește doi ioni de mangan ca catalizatori pentru a defosforila lanțurile ușoare de pe miozină, ceea ce provoacă o schimbare conformațională a miozinei și relaxează mușchiul. Enzima este foarte conservată și se găsește în țesutul muscular neted al tuturor organismelor. În timp ce se știe că miozin fosfataza este reglată de protein kinaze asociate cu rho , există dezbateri actuale cu privire la faptul dacă alte molecule, cum ar fi acidul arahidonic și AMPc , reglează, de asemenea, enzima.
Funcţie
Țesutul muscular neted este în mare parte format din actină și miozină, două proteine care interacționează împreună pentru a produce contracție musculară și relaxare. Miozina II, cunoscută și sub numele de miozină convențională, are două lanțuri grele care constau din domeniile capului și cozii și patru lanțuri ușoare (două pe cap) care se leagă de lanțurile grele din regiunea „gâtului”. Când mușchiul trebuie să se contracte, ionii de calciu curg în citosol din reticulul sarcoplasmatic , unde activează calmodulina, care la rândul său activează kinaza cu lanț ușor a miozinei (kinaza MLC). MLC kinaza fosforilează lanțul ușor de miozină (MLC 20 ) la reziduul Ser-19. Această fosforilare provoacă o schimbare conformațională a miozinei, activând ciclul de trecere și provocând contracția mușchiului. Deoarece miozina suferă o schimbare conformațională, mușchiul va rămâne contractat chiar dacă concentrațiile de calciu și MLC kinază activate sunt aduse la niveluri normale. Schimbarea conformațională trebuie anulată pentru a relaxa mușchiul.
Când miozina fosfatază se leagă de miozină, elimină gruparea fosfat . Fără grup, miozina revine la conformația sa originală, în care nu poate interacționa cu actina și menține tensiunea musculară, astfel încât mușchiul se relaxează. Mușchiul va rămâne în această poziție relaxată până când miozina este fosforilată de MLC kinază și suferă o schimbare conformațională.
Structura
Fosfataza miozinei este formată din trei subunități. Subunitatea catalitică, PP1, este una dintre cele mai importante fosfataze Ser / Thr din celulele eucariote , deoarece joacă un rol în metabolismul glicogenului , transportul intracelular, sinteza proteinelor și diviziunea celulară , precum și contracția musculaturii netede. Deoarece este atât de important pentru funcțiile celulare de bază și pentru că există mult mai puține proteine fosfataze decât kinaze în celule, structura și funcția PP1 sunt foarte conservate (deși izoforma specifică utilizată în miozin fosfataza este izoforma δ, PP1δ). PP1 funcționează utilizând doi ioni de mangan ca catalizatori pentru defosforilare (vezi mai jos).
Înconjurați acești ioni este o fântână în formă de Y cu trei caneluri: un canal hidrofob, un acid și un canal C-terminal. Când PP1 nu este legat de nicio altă subunitate, nu este deosebit de specific. Cu toate acestea, atunci când se leagă de a doua subunitate a miozin fosfatazei, MYPT1 (MW ~ 130 kDa), această fisură catalitică schimbă configurația. Acest lucru are ca rezultat o creștere dramatică a specificității miozinei. Astfel, este clar că MYPT1 are o mare putere de reglementare asupra PP1 și miozin fosfatazei, chiar și fără prezența altor activatori sau inhibitori.
A treia subunitate, M20 (nu trebuie confundată cu MLC 20 , subunitatea de reglare critică a miozinei), este cea mai mică și cea mai misterioasă subunitate. În prezent, se știe puțin despre M20, cu excepția faptului că nu este necesar pentru cataliză, deoarece eliminarea subunității nu afectează cifra de afaceri sau selectivitatea. În timp ce unii cred că ar putea avea o funcție de reglementare, nimic nu a fost încă stabilit.
Mecanism
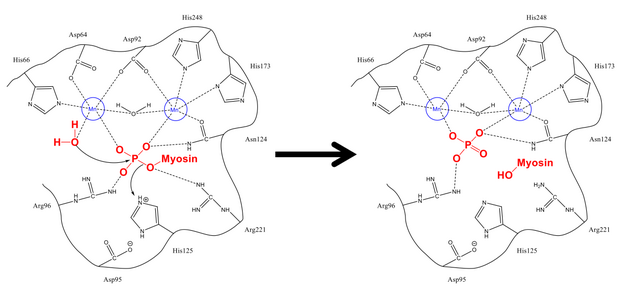
Mecanismul de îndepărtare a fosfatului din Ser-19 este foarte similar cu alte reacții de defosforilare din celulă, cum ar fi activarea glicogenului sintază . Subunitatea reglatoare a miozinei MLC 20 se leagă atât la canelurile hidrofobe, cât și la cele acide ale PP1 și MYPT1, site-ul de reglare al miozin fosfatazei. Odată ajuns în configurația adecvată, atât serina fosforilată, cât și o moleculă de apă liberă sunt stabilizate de reziduurile de legătură de hidrogen din situl activ, precum și de ionii încărcați pozitiv (care interacționează puternic cu grupul fosfat negativ). His-125 (pe miozin fosfatază) donează un proton Ser-19 MLC 20 ), iar molecula de apă atacă atomul de fosfor . După amestecarea protonilor pentru stabilizare (ceea ce se întâmplă rapid în comparație cu atacul asupra fosforului), se formează fosfatul și alcoolul și ambii părăsesc locul activ.
Reglementare și sănătate umană
Căile de reglare ale kinazei MLC au fost bine stabilite, dar până la sfârșitul anilor 1980, s-a presupus că miozin fosfataza nu a fost reglementată, iar contracția / relaxarea a fost în întregime dependentă de activitatea kinazei MLC. Cu toate acestea, din anii 1980, efectul inhibitor al proteinei kinazei asociate cu rho a fost descoperit și investigat cu atenție. RhoA GTP activează Rho-kinaza , care fosforilează MYPT1 la două situri inhibitoare majore, Thr-696 și Thr-866. Acest lucru demonstrează pe deplin valoarea MYPT1, nu numai pentru a crește viteza și specificitatea reacției, ci și pentru a încetini foarte mult reacția. Cu toate acestea, atunci când se adaugă telokin , acesta anulează efectul Rho-kinazei, chiar dacă nu defosforilează MYPT1.
O altă strategie de reglare propusă implică acidul arahidonic. Când acidul arahidonic este adăugat la țesutul muscular tensionat, acidul scade viteza de defosforilare (și deci relaxare) a miozinei. Cu toate acestea, nu este clar cum funcționează acidul arahidonic ca inhibitor . Două teorii concurente sunt că fie acidul arahidonic acționează ca un co-mesager în cascada rho-kinază menționat mai sus, fie că se leagă de terminalul c al MYPT1.
Când sistemele de reglementare ale miozin fosfatazei încep să eșueze, pot exista consecințe majore asupra sănătății. Deoarece mușchiul neted se găsește în sistemele respiratorii, circulatorii și de reproducere ale oamenilor (precum și în alte locuri), dacă mușchiul neted nu se mai poate relaxa din cauza reglării defectuoase, atunci există un număr mare de probleme, de la astm , hipertensiune și poate rezulta disfuncție erectilă .
Vezi si
Referințe
Lecturi suplimentare
- Pato MD, Adelstein RS (1983). "Purificarea și caracterizarea unei fosfataze multisubunitare de la mușchiul neted de curcani . J. Biol. Chem . 258 (11): 7047–54. doi : 10.1016 / S0021-9258 (18) 32330-5 . PMID 6304072 .
- Kimura K; și colab. (1996). „Reglarea fosfatazei miozinei de către Rho și kinaza asociată cu Rho (Rho-kinaza)”. Știință . 273 (5272): 245–248. Bibcode : 1996Sci ... 273..245K . doi : 10.1126 / science.273.5272.245 . PMID 8662509 . S2CID 37249779 .