Nucleus accumbens - Nucleus accumbens
| Nucleus accumbens | |
|---|---|
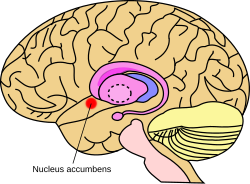 Localizarea aproximativă a nucleului accumbens în creier
| |
 Nucleul accumbens al creierului șoarecelui
| |
| Detalii | |
| O parte din |
Calea mesolimbică Ganglionii bazali ( striatum ventral ) |
| Părți | Nucleus accumbens shell Nucleus accumbens nucleu |
| Identificatori | |
| latin | nucleu accumbens septi |
| Acronime) | NAc sau NAcc |
| Plasă | D009714 |
| NeuroNames | 277 |
| ID NeuroLex | birnlex_727 |
| TA98 | A14.1.09.440 |
| TA2 | 5558 |
| FMA | 61889 |
| Termeni anatomici ai neuroanatomiei | |
Nucleul accumbens ( NAc sau -NACC , de asemenea , cunoscut sub numele de nucleul accumbens , sau anterior ca nucleul accumbens septi , latin pentru „ nucleu adiacent sept “) este o regiune în bazal forebrain - rostral la zona preoptic a hipotalamusului . Nucleul accumbens și tuberculul olfactiv formează colectiv striatul ventral . Striatul ventral și striatul dorsal formează colectiv striatul , care este componenta principală a ganglionilor bazali . De neuronilor dopaminergici din calea mezolimbic proiect pe GABAergic neuronii mediu spinoase ale nucleului accumbens și tuberculul olfactiv. Fiecare emisferă cerebrală are propriul său nucleu accumbens, care poate fi împărțit în două structuri: nucleul accumbens nucleu și coaja nucleului accumbens. Aceste substructuri au morfologie și funcții diferite.
Diferite subregiuni NAcc (nucleu vs coajă) și subpopulații de neuroni din cadrul fiecărei regiuni ( neuroni spini medii de tip D1 vs D2 ) sunt responsabili pentru funcții cognitive diferite . În ansamblu, nucleul accumbens are un rol semnificativ în procesarea cognitivă a motivației , aversiunii , recompensei (adică evidențierea stimulentului , plăcerea și întărirea pozitivă ) și învățarea de întărire (de exemplu, transferul pavlovian-instrumental ); prin urmare, are un rol semnificativ în dependență . În plus, o parte a nucleului accumbens este implicată central în inducerea somnului cu undă lentă . Nucleul accumbens joacă un rol mai mic în procesarea fricii (o formă de aversiune), a impulsivității și a efectului placebo . Este implicat și în codificarea noilor programe motorii .
Structura
Nucleul accumbens este un agregat de neuroni care este descris ca având o coajă exterioară și un miez interior.
Intrare
Intrările glutamatergice majore în nucleul accumbens includ cortexul prefrontal (în special cortexul prelimbic și cortexul infralimbic ), amigdala basolaterală , hipocampul ventral , nucleii talamici (în mod specific nucleii talamici ai liniei medii și nucleii intralaminari ai talamusului ) și proiecțiile glutamatergice ventral zona (VTA). Nucleul accumbens primește intrări dopaminergice din zona tegmentală ventrală, care se conectează prin calea mezolimbică . Nucleul accumbens este adesea descris ca o parte a unei bucle cortico-bazale ganglion-talamo-corticale .
Intrările dopaminergice din VTA modulează activitatea neuronilor GABAergici din nucleul accumbens. Acești neuroni sunt activați direct sau indirect de medicamente euforizante (de exemplu, amfetamină , opiacee etc.) și participând la experiențe plină de satisfacții (de exemplu, sex, muzică, exerciții fizice etc.).
O altă sursă majoră de intrare vine de la CA1 și subiculul ventral al hipocampului către zona dorsomedială a nucleului accumbens. Depolarizările ușoare ale celulelor din nucleul accumbens se corelează cu pozitivitatea neuronilor hipocampului, făcându-le mai excitabile. Celulele corelate ale acestor stări excitate ale neuronilor medii spinoși din nucleul accumbens sunt împărțite în mod egal între subicul și CA1. Se constată că neuronii subiculului se hiperpolarizează (cresc negativitatea) în timp ce neuronii CA1 „ondulează” (foc> 50 Hz) pentru a realiza această amorsare.
Nucleul accumbens este una dintre puținele regiuni care primesc proiecții histaminergice din nucleul tuberomamilar (singura sursă de neuroni histaminici din creier).
Ieșire
Neuronii de ieșire ai nucleului accumbens trimit proiecții axonale către ganglionii bazali și analogul ventral al globului pallidus , cunoscut sub numele de ventral pallidum (VP). VP, la rândul său, se proiectează către nucleul dorsal medial al talamusului dorsal , care se proiectează către cortexul prefrontal, precum și înapoi spre ventral și către striatul dorsal . Alte eferente din nucleul accumbens includ conexiuni cu coada zonei tegmentale ventrale , substantia nigra și formarea reticulară a ponsului .
Coajă
Nucleul accumbens shell ( shell NACC ) este o substructură a nucleului accumbens. Coaja și miezul formează împreună întregul nucleu accumbens.
Localizare: Cochilia este regiunea exterioară a nucleului accumbens și - spre deosebire de miez - este considerată a face parte din amigdala extinsă , situată la polul său rostral.
Tipuri de celule: neuronii din nucleul accumbens sunt în principal neuroni spini medii (MSN) care conțin în principal receptori dopaminici de tip D1 (adică DRD1 și DRD5 ) sau de tip D2 (adică DRD2 , DRD3 și DRD4 ) . O subpopulație de MSN conține atât receptori de tip D1, cât și receptori de tip D2, cu aproximativ 40% din MSN striatale care exprimă atât ARNm DRD1, cât și DRD2 . Aceste MSN-uri NAcc de tip mixt atât cu receptorii de tip D1, cât și cu receptorii de tip D2 sunt în mare parte limitați la shell-ul NAcc. Neuronii din cochilie, în comparație cu nucleul, au o densitate mai mică de spini dendritici , segmente terminale mai puține și segmente ramificate mai puține decât cele din nucleu. Neuronii învelișului se proiectează către partea subcomisurală a palidului ventral , precum și zona tegmentală ventrală și spre zone extinse din hipotalamus și amigdala extinsă.
Funcție: Coaja nucleului accumbens este implicată în procesarea cognitivă a recompensei , inclusiv reacții subiective de „plăcere” la anumiți stimuli plăcuți , evidență motivațională și întărire pozitivă . S-a demonstrat, de asemenea, că NAcc mediază transferul specific pavlovian-instrumental , fenomen în care un stimul condiționat clasic modifică comportamentul operant . Un „hotspot hedonic” sau centru de plăcere care este responsabil pentru componenta plăcută sau „plăcută” a unor recompense intrinseci este, de asemenea, situat într-un compartiment mic din interiorul cochiliei NAcc mediale. Medicamentele dependente au un efect mai mare asupra eliberării dopaminei în coajă decât în nucleu.
Miezul
Nucleul accumbens core ( -NACC core ) este substructura interior al nucleului accumbens.
Localizare: Nucleul nucleului accumbens face parte din striatul ventral , situat în ganglionii bazali. Tipuri de celule: nucleul NAcc este alcătuit în principal din neuroni spinoși medii care conțin în principal receptori de dopamină de tip D1 sau D2. Neuronii mediu spinoși de tip D1 mediază procesele cognitive legate de recompensă, în timp ce neuronii spinoși de tip D2 mediază cognitivitatea legată de aversiune. Neuronii din nucleu, în comparație cu neuronii din cochilie, au o densitate crescută de spini dendritici, segmente ramificate și segmente terminale. Din nucleu, neuronii se proiectează către alte zone sub-corticale, cum ar fi globul palid și substanța neagră. GABA este unul dintre principalii neurotransmițători din NAcc, iar receptorii GABA sunt, de asemenea, abundenți.
Funcția: nucleul nucleului accumbens este implicat în procesarea cognitivă a funcției motorii legate de recompensă și întărire și reglarea somnului cu unde lente . Mai exact, nucleul codifică noi programe motorii care facilitează achiziția unei recompense date în viitor. Calea indirectă (de exemplu, tipul D2) neuronii din nucleul NAcc care co-exprimă activarea receptorilor adenozinei A 2A , în mod dependent, promovează somnul cu undă lentă. De asemenea, s-a demonstrat că nucleul NAcc mediază transferul general pavlovian-instrumental , fenomen în care un stimul condiționat clasic modifică comportamentul operant.
Tipuri de celule
Aproximativ 95% dintre neuronii din NAcc sunt neuroni GABAergici cu spini mediu (MSN) care exprimă în primul rând receptorii de tip D1 sau D2; aproximativ 1-2% din tipurile neuronale rămase sunt interneuroni colinergici aspinici mari și alți 1-2% sunt interneuroni GABAergici. În comparație cu MSN-urile GABAergic din coajă, cele din nucleu au o densitate crescută de spini dendritici, segmente de ramură și segmente terminale. Din nucleu, neuronii se proiectează către alte zone sub-corticale, cum ar fi globul palid și substanța neagră. GABA este unul dintre principalii neurotransmițători din NAcc, iar receptorii GABA sunt, de asemenea, abundenți. Acești neuroni sunt, de asemenea, principalii neuroni de proiecție sau de ieșire ai nucleului accumbens.
Neurochimie
Unii dintre neurotransmițători, neuromodulatori și hormoni care semnalizează prin receptorii din nucleul accumbens includ:
Dopamina : Dopamina este eliberată în nucleul accumbens după expunerea la stimuli plini de satisfacție , inclusiv medicamente recreative precum amfetamine substituite , cocaină , nicotină și morfină .
Fenetilamină și tiramină : Fenetilamina și tiramina sunt amine urme care sunt sintetizate în neuroni care exprimă enzima aromatică aminoacid hidroxilază (AADC), care include toți neuronii dopaminergici. Ambii compuși funcționează ca neuromodulatori dopaminergicicare reglează recaptarea și eliberarea dopaminei în Nacc prin interacțiuni cu VMAT2 și TAAR1 în axonul terminal al neuronilor dopaminergici mesolimbici.
Glucocorticoizi și dopamină: Receptorii glucocorticoizi sunt singurii receptori de corticosteroizi din coaja nucleului accumbens. L-DOPA , steroizii și în special glucocorticoizii sunt în prezent cunoscuți ca fiind singurii compuși endogeni cunoscuți care pot induce probleme psihotice, astfel încât înțelegerea controlului hormonal asupra proiecțiilor dopaminergice în ceea ce privește receptorii glucocorticoizi ar putea duce la noi tratamente pentru simptomele psihotice. Un studiu recent a demonstrat că suprimarea receptorilor glucocorticoizi a dus la o scădere a eliberării de dopamină, ceea ce poate duce la cercetări viitoare care implică medicamente anti-glucocorticoizi pentru ameliorarea potențială a simptomelor psihotice.
GABA: Un studiu recent pe șobolani care au folosit agoniști și antagoniști GABA a indicat faptul că receptorii GABA A din coaja NAcc au control inhibitor asupra comportamentului de rotație influențat de dopamină, iar receptorii GABA B au un control inhibitor asupra comportamentului de rotație mediat de acetilcolină .
Glutamat : Studiile au arătat că blocada locală a receptorilor glutamatergici NMDA din nucleul NAcc a afectat învățarea spațială. Un alt studiu a demonstrat că atât NMDA, cât și AMPA (ambii receptori ai glutamatului ) joacă roluri importante în reglarea învățării instrumentale.
Serotonina (5-HT): Per ansamblu, sinapsele 5-HT sunt mai abundente și au un număr mai mare de contacte sinaptice în coaja NAcc decât în nucleu. De asemenea, acestea sunt mai mari și mai groase și conțin vezicule cu miez dens mai mare decât omologii lor din miez.
Funcţie
Recompensă și întărire
Nucleul accumbens, fiind o parte a sistemului de recompensare, joacă un rol important în procesarea stimulilor recompensatori, întărirea stimulilor (de exemplu, alimente și apă) și a celor care sunt atât recompensatori, cât și consolidatori (droguri dependente, sex și exerciții fizice). Răspunsul predominant al neuronilor din nucleul accumbens la recompensa zaharoză este inhibarea; opusul este adevărat ca răspuns la administrarea de chinină aversivă . Dovezi substanțiale din manipularea farmacologică sugerează, de asemenea, că reducerea excitabilității neuronilor din nucleul accumbens este plină de satisfacții, așa cum, de exemplu, ar fi adevărat în cazul stimulării receptorilor μ-opioizi . Semnalul dependent de nivelul de oxigen din sânge (BOLD) în nucleul accumbens este crescut în mod selectiv în timpul percepția, imagini plăcute suscită emoțional și în timpul imagini mentale de scene plăcute, emoționale. Cu toate acestea, deoarece BOLD este considerat a fi o măsură indirectă a excitației nete regionale până la inhibare, nu se cunoaște măsura în care BOLD măsoară procesarea dependentă de valență. Datorită abundenței intrărilor NAcc din regiunile limbice și a ieșirilor puternice ale NAcc către regiunile motorii, nucleul accumbens a fost descris de Gordon Mogensen ca interfața dintre sistemul limbic și motor.

Nucleul accumbens este legat cauzal de experiența plăcerii. Microinjecțiile agoniștilor μ-opioizi, agoniștilor δ-opioizi sau agoniștilor κ-opioizi din cadranul rostrodorsal al învelișului medial sporesc „simțul”, în timp ce mai multe injecții caudale pot inhiba reacțiile de dezgust, reacțiile de simț sau ambele. Regiunile nucleului accumbens cărora li se poate atribui un rol cauzal în producerea plăcerii sunt limitate atât din punct de vedere anatomic, cât și din punct de vedere chimic, deoarece, pe lângă agoniștii opioizi, doar endocanabinoizii pot spori plăcerea. În nucleul accumbens în ansamblu, dopamina, agonistul receptorului GABA sau antagoniștii AMPA modifică doar motivația, în timp ce același lucru este valabil și pentru opioide și endocanabinoizi în afara punctului fierbinte din coaja medială. Există un gradient rostro-caudal pentru îmbunătățirea răspunsurilor apetitive față de cele temătoare, din care se crede că în mod tradițional necesită doar funcția receptorului D1, iar prima dintre care necesită funcția D1 și D2. O interpretare a acestei constatări, ipoteza dezinhibiției, susține că inhibarea MSN-urilor accumbens (care sunt GABAergic) dezinhibă structurile din aval, permițând exprimarea comportamentelor apetisante sau consumative. Efectele motivaționale ale antagoniștilor AMPA și, într-o măsură mai mică, ale agoniștilor GABA, sunt flexibile din punct de vedere anatomic. Condițiile stresante pot extinde regiunile care induc frica, în timp ce un mediu familiar poate reduce dimensiunea regiunii care induce frica. Mai mult, aportul cortical din cortexul orbitofrontal (OFC) influențează răspunsul către cel al comportamentului apetitiv , iar aportul infralimbic , echivalent cu cortexul cingulat subgenual uman, suprimă răspunsul indiferent de valență.
Nucleul accumbens nu este nici necesar, nici suficient pentru învățarea instrumentală, deși manipulările pot afecta performanța în sarcinile de învățare instrumentală. O sarcină în care efectul leziunilor NAcc este evident este transferul pavlovian-instrumental (PIT), unde o reper asociată cu o recompensă specifică sau generală poate spori răspunsul instrumental. Leziunile din nucleul NAcc afectează performanța după devalorizare și inhibă efectul PIT general. Pe de altă parte, leziunile la nivelul cochiliei afectează doar efectul PIT specific. Se consideră că această distincție reflectă răspunsuri condiționate consumatorii și apetisante în coaja NAcc și respectiv în nucleul NAcc.
În striatul dorsal, s-a observat o dihotomie între D1-MSN și D2-MSN, primele fiind întărirea și intensificarea locomoției, iar cele din urmă fiind aversive și reducătoare. O astfel de distincție s-a presupus în mod tradițional că se aplică și nucleului accumbens, dar dovezile din studiile farmacologice și optogenetice sunt contradictorii. Mai mult, un subgrup de MSN NAcc exprimă atât MSN D1 cât și D2, iar activarea farmacologică a receptorilor D1 versus D2 nu trebuie să activeze neapărat populațiile neuronale exact. În timp ce majoritatea studiilor nu prezintă niciun efect al stimulării optogenetice selective a MSN D1 sau D2 asupra activității locomotorii, un studiu a raportat o scădere a locomoției bazale cu stimularea D2-MSN. În timp ce două studii au raportat efecte de întărire reduse ale cocainei cu activarea D2-MSN, un studiu nu a raportat niciun efect. Activarea NAcc D2-MSN a fost, de asemenea, raportată pentru a spori motivația, așa cum a fost evaluată de PIT, iar activitatea receptorului D2 este necesară pentru efectele de întărire ale stimulării VTA. Un studiu din 2018 a raportat că activarea D2 MSN a îmbunătățit motivația prin inhibarea palidului ventral, dezinhibând astfel VTA.
Comportamentul matern
Un studiu fMRI efectuat în 2005 a constatat că, atunci când șobolanii mama erau în prezența puilor lor, regiunile creierului implicate în consolidare, inclusiv nucleul accumbens, erau extrem de active. Nivelurile de dopamină cresc în nucleul accumbens în timpul comportamentului matern, în timp ce leziunile din această zonă deranjează comportamentul matern. Atunci când femeilor li se prezintă imagini cu sugari fără legătură, RMN-urile arată o activitate cerebrală crescută în nucleul accumbens și nucleul caudat adiacent, proporțional cu gradul în care femeile consideră acești sugari „drăguți”.
Aversiune
Activarea MSN de tip D1 în nucleul accumbens este implicată în recompensă, în timp ce activarea MSN de tip D2 în nucleul accumbens promovează aversiunea .
Somn cu undă lentă
La sfârșitul anului 2017, studiile pe rozătoare care utilizate optogenetic și chemogenetic metode a constatat ca calea indirectă (adică, D2-tip) neuroni mediu spiny in nucleul accumbens nucleu care coexprimă adenozină 2A receptori și proiect la ventral pallidum sunt implicate în reglarea somnului cu unde lente . În special, activarea optogenetică a acestor căi indirecte, neuronii nucleului NAcc induce somnul cu undă lentă, iar activarea chimiogenetică a aceloriași neuroni crește numărul și durata episoadelor de somn cu undă lentă. Inhibarea chimiogenetică a acestor neuroni nucleici NAcc suprimă somnul. În schimb, neuronii spini de tip D2 din coaja NAcc care exprimă receptorii adenozinei A 2A nu au rol în reglarea somnului cu unde lente.
Semnificația clinică
Dependență
Modelele actuale de dependență de consumul de droguri cronice implică modificări ale expresiei genelor în proiecția mezocorticolimbică . Cei mai importanți factori de transcripție care produc aceste modificări sunt osFosB , proteina de legare a elementului de răspuns al adenozinei monofosfat ciclic ( AMPc ) ( CREB ) și factorul nuclear kappa B ( NFκB ). OsFosB este cel mai semnificativ factor de transcripție genetică în dependență, deoarece supraexprimarea sa virală sau genetică în nucleul accumbens este necesară și suficientă pentru multe dintre adaptările neuronale și efectele comportamentale (de exemplu, creșteri dependente de expresie în autoadministrare și sensibilizare la recompensă ) observate în dependența de droguri. Expresia osFosB a fost implicată în dependențe de alcool (etanol) , canabinoizi , cocaină , metilfenidat , nicotină , opioide , fenciclidină , propofol și amfetamine substituite , printre altele. Creșteri ale nucleului accumbens Expresia JunD poate reduce sau, cu o creștere mare, chiar poate bloca majoritatea modificărilor neuronale observate în abuzul cronic de droguri (adică modificările mediate de ΔFosB).
OsFosB joacă, de asemenea, un rol important în reglarea răspunsurilor comportamentale la recompensele naturale, cum ar fi mâncarea plăcută, sexul și exercițiile fizice. Recompensele naturale, la fel ca drogurile de abuz, induc ΔFosB în nucleul accumbens, iar achiziția cronică a acestor recompense poate duce la o stare de dependență patologică similară prin supraexprimarea ΔFosB. În consecință, osFosB este factorul cheie de transcripție implicat și în dependențele de recompense naturale; în special, osFosB în nucleul accumbens este esențial pentru efectele întăritoare ale recompensei sexuale. Cercetările privind interacțiunea dintre recompensele naturale și cele medicamentoase sugerează că psihostimulanții și comportamentul sexual acționează asupra unor mecanisme biomoleculare similare pentru a induce osFosB în nucleul accumbens și posedă efecte de sensibilizare încrucișată care sunt mediate prin osFosB.
Similar cu recompensele medicamentoase, recompensele non-medicamentoase cresc și nivelul dopaminei extracelulare din coaja NAcc. Eliberarea de dopamină indusă de droguri în carcasa NAcc și nucleul NAcc nu este de obicei predispusă la obișnuință (adică dezvoltarea toleranței la medicamente : o scădere a eliberării de dopamină din expunerea viitoare la medicamente ca urmare a expunerii repetate la medicamente); dimpotrivă, expunerea repetată la medicamente care induc eliberarea de dopamină în carcasa și nucleul NAcc are ca rezultat de obicei o sensibilizare (adică, cantitatea de dopamină care este eliberată în NAcc din expunerea viitoare la medicamente crește ca urmare a expunerii repetate la medicamente). Sensibilizarea eliberării de dopamină în carcasa NAcc după expunerea repetată la medicamente servește la întărirea asociațiilor stimul-medicament (adică condiționarea clasică care apare atunci când consumul de droguri este asociat în mod repetat cu stimuli de mediu) și aceste asociații devin mai puțin predispuse la dispariție (adică „dezvățarea” aceste asocieri condiționate clasic între consumul de droguri și stimulii de mediu devin mai dificile). După împerechere repetată, acești stimuli de mediu condiționați clasic (de exemplu, contexte și obiecte care sunt frecvent asociate cu consumul de droguri) devin adesea indicii de droguri care funcționează ca întăritori secundari ai consumului de droguri (adică, odată stabilite aceste asociații, expunerea la un stimul de mediu asociat declanșează pofta sau dorința de a utiliza medicamentul cu care au devenit asociați ).
Spre deosebire de medicamente, eliberarea de dopamină în carcasa NAcc de către multe tipuri de stimuli non-medicamente recompensatori suferă de obicei obișnuință după expunerea repetată (adică, cantitatea de dopamină care este eliberată din expunerea viitoare la un stimul recompensant non-medicamentos scade în mod normal ca urmare a expunerii repetate la acel stimul).
| Forma de neuroplasticitate sau plasticitate comportamentală |
Tipul întăritorului | Surse | |||||
|---|---|---|---|---|---|---|---|
| Opiacee | Psihostimulanți | Alimente bogate în grăsimi sau zahăr | Raport sexual |
Exercițiu fizic (aerob) |
Îmbogățirea mediului |
||
|
Expresia osFosB în nucleul accumbens MSN de tip D1 |
↑ | ↑ | ↑ | ↑ | ↑ | ↑ | |
| Plasticitatea comportamentală | |||||||
| Escalarea aportului | da | da | da | ||||
| Sensibilizare încrucișată psiho -stimulantă |
da | Nu se aplică | da | da | Atenuat | Atenuat | |
| Psihostimulante de auto-administrare |
↑ | ↑ | ↓ | ↓ | ↓ | ||
| Preferință psihostimulantă condiționată de loc |
↑ | ↑ | ↓ | ↑ | ↓ | ↑ | |
| Restabilirea comportamentului de căutare a drogurilor | ↑ | ↑ | ↓ | ↓ | |||
| Plasticitatea neurochimică | |||||||
|
Fosforilarea CREB în nucleul accumbens |
↓ | ↓ | ↓ | ↓ | ↓ | ||
| Răspunsul sensibilizat la dopamină în nucleul accumbens |
Nu | da | Nu | da | |||
| Semnalizarea dopaminei striatale modificate | ↓ DRD2 , ↑ DRD3 | ↑ DRD1 , ↓ DRD2 , ↑ DRD3 | ↑ DRD1 , ↓ DRD2 , ↑ DRD3 | ↑ DRD2 | ↑ DRD2 | ||
| Semnalizare opioidă striatală modificată | Nici o modificare sau receptorii ↑ μ-opioizi |
↑ p-opioizi ↑ receptorii opioizi κ- |
↑ receptorii μ-opioizi | ↑ receptorii μ-opioizi | Nicio schimbare | Nicio schimbare | |
| Modificări ale peptidelor opioide striatale | ↑ dinorfină Nicio modificare: encefalină |
↑ dinorfină | ↓ encefalină | ↑ dinorfină | ↑ dinorfină | ||
| Plasticitatea sinaptică mezocorticolimbică | |||||||
| Numărul de dendrite din nucleul accumbens | ↓ | ↑ | ↑ | ||||
|
Coloanei vertebrale dendritică densitate de nucleul accumbens |
↓ | ↑ | ↑ | ||||
Depresie
În aprilie 2007, două echipe de cercetare au raportat că au introdus electrozi în nucleul accumbens pentru a utiliza stimularea creierului profund pentru a trata depresia severă . În 2010, experimentele au raportat că stimularea creierului profund al nucleului accumbens a avut succes în scăderea simptomelor depresiei la 50% dintre pacienții care nu au răspuns la alte tratamente, cum ar fi terapia electroconvulsivă . Nucleus accumbens a fost, de asemenea, utilizat ca țintă pentru tratarea grupurilor mici de pacienți cu tulburare obsesiv-compulsivă refractară la terapie.
Ablația
Pentru a trata dependența și în încercarea de a trata bolile mintale, a fost efectuată o ablație prin radiofrecvență a nucleului accumbens. Rezultatele sunt neconcludente și controversate.
Efectul placebo
Activarea NAcc s-a dovedit a avea loc în anticiparea eficacității unui medicament atunci când unui utilizator i se administrează un placebo , indicând un rol care contribuie la nucleul accumbens în efectul placebo .
Imagini suplimentare
Vezi si
Referințe
linkuri externe
- Rolul nucleului accumbens în circuitul recompensei. Parte din „Creierul de sus în jos”. la thebrain.mcgill.ca
- Nucleus Accumbens - Baza de date centrată pe celulă
- Imagini colorate în felii de creier care includ „nucleul% 20accumbens” la proiectul BrainMaps






