Feocromocitom - Pheochromocytoma
| Feocromocitom | |
|---|---|
| Alte nume | Feocromocitom, tumoare suprarenală medulară, tumori cu celule cromafine, paragangliom |
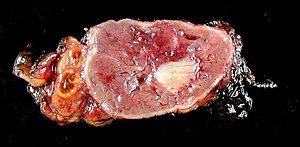 | |
| Glandă suprarenală normală rămasă (stânga) cu feocromocitom (dreapta) care implică medula suprarenală | |
| Pronunție | |
| Specialitate | Endocrinologie , oncologie |
| Simptome | Hipertensiune , tahicardie , transpirație, cefalee , paloare |
| Complicații | Criza hipertensivă |
| Metoda de diagnosticare | Metanefrine fără plasmă crescute , catecolamine plasmatice sau catecolamine urinare |
| Tratament | Chirurgie, chimioterapie, radiații și agenți farmacologici |
| Frecvență | 0,8 la 100.000 de ani-persoană |
Feocromocitomul ( PHEO sau PCC ) este o tumoare rară a medularei suprarenale compusă din celule cromafine , cunoscute și sub numele de feocromocite. Când o tumoră compusă din aceleași celule ca feocromocitom se dezvoltă în afara glandei suprarenale, aceasta este denumită paragangliom . Aceste tumori neuroendocrine sunt capabile să producă și să elibereze cantități masive de catecolamine , metanefrine sau metoxitiramină, care au ca rezultat cele mai frecvente simptome, inclusiv hipertensiune arterială (hipertensiune arterială), tahicardie (ritm cardiac rapid) și diaforeză (transpirație). Cu toate acestea, nu toate aceste tumori vor secreta catecolamine. Cei care nu fac acest lucru sunt denumiți biochimic silențioși și sunt localizați predominant în cap și gât . În timp ce pacienții cu boli silențioase din punct de vedere biochimic nu vor suferi de manifestările tipice ale bolii descrise mai sus, tumorile cresc și comprim structurile înconjurătoare ale capului și gâtului și pot duce la tinitus pulsabil (zgomote ale urechii), pierderea auzului, plinătate auditivă, dispnee (dificultăți de respirație) și răgușeală. În timp ce tumorile capului și gâtului sunt parasimpatice, omologii lor simpatici sunt localizați predominant în abdomen și pelvis, în special concentrate la organul Zuckerkandl .
semne si simptome
De semne și simptome ale unui feocromocitom sunt cele legate de simpatic sistemului nervos hiperactivitate . Triada clasică include dureri de cap (probabil legate de tensiune arterială crescută sau hipertensiune arterială ), tahicardie / ritm cardiac crescut și diaforeză (transpirație excesivă, în special noaptea, cunoscută și sub numele de hiperhidroză ). Cu toate acestea, este puțin probabil ca pacienții să prezinte simptome continue. Datorită naturii paroxistice a sintezei și eliberării catecolaminei, pacienții pot prezenta „atacuri” sau „vrăji” unde sunt brusc copleșiți de semne și simptome ale tumorii lor. Atacurile pot apărea spontan (fără avertisment) sau pot fi declanșate de o varietate de agenți farmaceutici, alimente, manipulare tumorală intraoperatorie, intubație sau în timpul inducției anestezice.

| Mod de viata | Medicamente | Dietă |
|---|---|---|
| Efort fizic | Histamina | Brânză |
| Anxietate / stres | Metoclopramidă | Vin fermentat / bere |
| Traumatism / Durere | Glucagon | Roșii |
| Micțiune | ACTH | Boabe de cafea |
În timp ce simptomele de mai sus sunt clasice, alte manifestări clinice comune au fost raportate și includ (în nici o ordine specială)
- Paloare
- Intoleranta la caldura
- Pierdere în greutate
- Disconfort toracic și / sau abdominal
- Greață / Vărsături
- Constipație
-
Hipotensiune ortostatică
- Definit medical ca o scădere a tensiunii arteriale sistolice (numărul de sus) de 20 mm Hg sau a tensiunii arteriale diastolice (numărul de jos) de 10 mm Hg după o schimbare de poziție de la culcat sau așezat în poziție în picioare
- Senzație de a deveni ușor sau amețit după schimbarea rapidă a pozițiilor
- Manifestări psihiatrice
- Hiperglicemie (nivel ridicat de zahăr din sânge)
Complicații
În timp ce simptomele unui feocromocitom sunt destul de frecvente, boala a fost denumită „marele mimic”. Literatura de specialitate raportează că doar 0,1% dintre pacienții cu hipertensiune sunt diagnosticați cu această afecțiune endocrină rară, iar pacienții simptomatici sunt adesea confundați cu boli mult mai frecvente. Deoarece simptomele sunt adesea paroxistice (episodice / sporadice), este posibil ca pacienții să nu caute imediat tratament, deoarece problema „dispare de la sine”. Mai mult, atunci când este prezentat în scenariul clinic ideal (o femeie mai în vârstă la mijlocul anilor '50), atacurile spontane de înroșire, transpirație și inimă în cursă pot fi confundate cu bufeuri legate de pre-menopauză . Feocromocitomul necontrolat este periculos și poate duce la complicații grave, inclusiv la moarte. Sistemul cardiovascular este cel mai frecvent implicat.
Sistemul cardiovascular
- Criza hipertensivă : Urgențele hipertensive legate de feocromocitom sunt una dintre cele mai temute manifestări clinice. Atacurile sunt aleatorii și pot apărea secundar unui declanșator (vezi Semnele și simptomele de mai sus) sau spontan după o creștere a catecolaminei. Simptomul predominant este tensiunea arterială sistolică crescută (> 200 mmHg), care nu răspunde la regimurile tradiționale de tratament și amenință deteriorarea organelor finale . Pacienții necesită tratament imediat, care salvează viața, pentru a preveni deteriorarea ulterioară a altor organe și / sau moartea.
- Ischemie miocardică / infarct: un atac de cord este adesea cauzat de o acumulare semnificativă de placă ( ateroscleroză ) învasele coronare . Pacienții cu feocromocitom prezintă infarcturi miocardice, în ciuda lipsei generale de acumulare a plăcii, indicând un mecanism diferit pentru infarctul miocardic. Cercetările actuale fac ipoteza că tumora secretă cantități masive de catecolamine, care interacționează direct cuțesutul miocardic (inima) și exercită efecte negative, inclusiv privarea de oxigen, ducând la cicatrici accelerateși moarte celulară.
- Miocardită toxică : chiar și la pacienții fără leziuni miocardice , catecolaminele excesive pot duce la modificări ST anormale la un ECG . Se presupune că noradrenalina (o catecolamină) duce la deteriorarea țesutului cardiac prin inhibarea fluxului sanguin coronarian și privarea celulelor de oxigen, rezultând astfel țesut ischemic . Din fericire, după excizia tumorii și înlăturarea ulterioară a catecolaminelor, daunele s-au dovedit reversibile.
- Cardiomiopatie : feocromocitomul a fost implicat în diferite tipuri de cardiomiopatie, inclusiv (miocardită, vezi mai sus), cardiomiopatie dilatată și cardiomiopatie indusă de stres sau Takotsubo . La fel ca și în cazul altor complicații cardiovasculare, excesul de catecolamine este responsabil pentru creșterea sarcinii miocardice și a stresului fiziologic semnificativ. Literatura actuală indică faptul că majoritatea leziunilor provocate de catecolamină sunt reversibile, consolidând astfel argumentul pentru un diagnostic precoce și precis pentru a permite remodelarea cardiacă și a preveni distrugerea ulterioară.
- Aritmii : tahicardia sinusală este cel mai frecvent ritm cardiac anormal asociat cu un feocromocitom și este experimentat de pacienți ca sentimentul unei "inimi fluturante" sau palpitații . De asemenea, au fost raportatemulte alte tahiaritmii (ritm cardiac rapid).
Sistem nervos
- Accident cerebrovascular ( accident vascular cerebral): Rapoarte multiple au detaliat atacuri ischemice tranzitorii sau accidente vasculare cerebrale la pacienții cu feocromocitom. Într-un studiu pe 130 de pacienți cu feocromocitom, 7 pacienți au fost diagnosticați cu un atac ischemic tranzitor (deficitul neurologic complet rezolvat) și 3 pacienți au prezentat un accident vascular cerebral cu simptome persistente.
- Cefalee : durerile de cap sunt una dintre manifestările clinice de bază ale feocromocitomului și pot duce la dureri debilitante. Majoritatea pacienților studiați au raportat că durerea lor a început și s-a încheiat brusc fără avertisment și a descris durerea ca pe un puls puternic bilateral (deși scara severității nu a fost publicată). În timp ce 71% dintre pacienții studiați au raportat dureri de cap, puțin peste 20% dintre pacienții afectați au susținut greață , vărsături, fotofobie sau fonofobie asociate, care sunt de obicei asociate cu migrene .
Sistem urinar
- Insuficiență renală acută : mai multe rapoarte au prezentat rabdomioliză detaliată(defalcarea rapidă a mușchilor scheletici) care duce la leziuni renale acute și la necesitatea dializei tranzitoriila pacientul cu feocromocitom nediagnosticat ca prim simptom de prezentare. Insuficiența renală este cauzată de leziuni musculare induse de catecolamină. Noradrenalina determină îngustarea vaselor, limitând astfel fluxul sanguin și inducând ischemie.
Sindromul disfuncției organelor multiple (MODS) : cauzat de un răspuns inflamator crescut, disfuncția multiplă a organelor este o urgență severă, care pune viața în pericol, cu o mortalitate crescândă pe baza numărului de sisteme implicate. MODS asociate cu feocromocitomul sunt asociate cu insuficiență multiplă de organe, hipertermie > 40 grade Celsius, manifestări neurologice și instabilitate cardiovasculară, rezultând fie hipo, fie hipertensiune. Spre deosebire de o criză hipertensivă, MODS asociate cu feocromocitom pot să nu răspundă la agenții tradiționali ai receptorilor alfa și pot necesita o excizie chirurgicală emergentă dacă nu se atinge stabilitatea clinică.
Genetica
Estimările actuale prezic că peste 40% din toate feocromocitoamele sunt legate de o mutație de susceptibilitate a liniei germinale moștenite . Din restul de 60% din tumori, mai mult de 30% sunt asociate cu o mutație somatică . Având în vedere asocierea ridicată cu moștenirea genetică, Societatea Endocrină din Statele Unite recomandă ca toți pacienții diagnosticați cu feocromocitom să fie supuși unei evaluări cu un consilier genetic pentru a lua în considerare testarea genetică . Cele mai recente date indică faptul că există 25 de gene de sensibilitate la feocromocitom; cu toate acestea, doar 12 sunt recunoscuți ca parte a unui sindrom bine cunoscut. Determinarea stării genetice a unui pacient cu feocromocitom este crucială - fiecare genă este moștenită într-un model diferit, asociat cu caracteristici specifice ale bolii și poate răspunde mai favorabil anumitor opțiuni de tratament. Mai mult, identificarea timpurie poate ghida medicii cu privire la recomandările de screening pentru rudele de gradul întâi ale pacienților cu feocromocitom. Nu există un consens actual cu privire la modul și momentul în care ar trebui evaluați purtătorii asimptomatici (individ care are o variantă genetică asociată cu feocromocitom, dar nu există dovezi actuale ale bolii). Conversațiile ar trebui să aibă loc la nivel individual cu pacientul și furnizorul acestora pentru a dezvolta un plan de screening personalizat care alternează între o evaluare biochimică (prelucrarea sângelui) și imagistica întregului corp pentru a monitoriza progresia bolii.
Considerații pediatrice
Practicile suplimentare pot ajuta la menținerea bunăstării emoționale și psihologice a minorului. Screeningul include o echipă multidisciplinară ( endocrinolog , oncolog , psiholog , genetician , părinte și copil) unde accentul principal este susținerea copilului.
- Un rezultat pozitiv al testării în timpul zilelor de sărbătoare observate de familie poate masca fericirea asociată cu aceste evenimente în viitor.
- Testarea unui frate pediatric la un moment dat permite familiei să-și restrângă atenția atunci când rezultatele sunt returnate și să sprijine fiecare frate în mod individual.
- Un rezultat negativ poate fi supărarea pentru un copil dacă frații lor au fost pozitivi; posibilitatea de a pune întrebări și de a procesa rezultatele poate fi de ajutor.
Sindroame ereditare
Tabelul (tabelele) următor detaliază caracteristicile clinice ale bine-cunoscutelor variante genetice ale feocromocitomului ereditar
| Gene | Moştenire | Pătrunderea | Potențial metastatic | 1 o Caracteristicile bolii | |
|---|---|---|---|---|---|
| MEN2 | RET | Dominant autosomal | 40-50% | <5% | Carcinom tiroidian medular , hiperparatiroidism , habitus marfanoid , feocromocitom |
| VHL | VHL | 10-30% | 5% | Carcinom cu celule renale , NET pancreatic , retangian și hemangioblastom al SNC , feocromocitom | |
| NF1 | NF1 | 1-5% | 12% | Neurofibroame , macule cafe-au-lait , noduli lisch , tulburări cognitive, feocromocitom |
MEN2 (neoplazie endocrină multiplă-2); VHL (von-Hippel Lindau); NF1 (Neurofibromatoza-1); NET (tumoră neuroendocrină); CNS (sistemul nervos central)
| Gene | Moştenire | Pătrunderea | Potențial metastatic | 1 o Caracteristicile bolii | |
|---|---|---|---|---|---|
| PGL1 | SDHD | Dominant autosomal | 90% | <5% | Paragangliomul capului și gâtului, feocromocitom, tumoare stromală gastro-intestinală |
| PGL2 | SDHAF2 | 100% | Scăzut | Paragangliomul capului și gâtului | |
| PGL3 | SDHC | Dominant autosomal | Incoerent | Incoerent | Feocromocitom, paragangliom al capului și gâtului, tumoare stromală gastro-intestinală |
| PGL4 | SDHB | 30-50% | 30-70% | Paragangliomul capului și gâtului, feocromocitom, tumoare stromală gastro-intestinală | |
| PGL5 | SDHA | 10-15% | Scăzut | Feocromocitom, paragangliom al capului și gâtului, tumoare stromală gastro-intestinală |
SDHx (subunitate de succinat dehidrogenază x)
| Moştenire | Pătrunderea | Potențial metastatic | 1 o Caracteristicile bolii | |
|---|---|---|---|---|
| MAX | Dominant autosomal | Incoerent | <5% | Feocromocitom bilateral |
| TMEM127 | Incoerent | Scăzut | Feocromocitom, paragangliom al capului și gâtului |
MAX (factorul asociat MYC X); TMEM127 (Proteina transmembranară 127)
Alte variante genetice
Au fost publicate mai multe rapoarte de caz ale altor gene rare de susceptibilitate asociate cu feocromocitom:
-
Sindromul Pacak-Zhuang
- Factorul 2 alfa inductibil de hipoxie ( HIF2A )
- Policitemia
- duodenal somatostatinoma
- Modificări vasculare retiniene și coroidiene
- Paragangliom / feocromocitom
- Feocromocitom și tumoră celulară gigantică a osului
-
Cariad Triad
- Tumoră stromală gastro-intestinală
- Condromul pulmonar
- Paragangliom
- Sindromul Carney-Stratakis
- Tumoră stromală gastro-intestinală
- Paragangliom
Au fost descrise mai multe variante de gene suplimentare, dar informațiile furnizate sunt inconsistente și nu s-a ajuns la un consens în comunitate dacă aceste mutații sunt cu adevărat gene de susceptibilitate la feocromocitom.
Diagnostic
Diferenţial
Dacă un pacient are semne caracteristice si simptome ale unei feocromocitom și este luat decizia de a urmări biochimice suplimentare (analize de sange) de evaluare, diagnosticul diferențial este importantă , deoarece este mult mai probabil să fie ceva altul decât un feocromocitom , având în vedere frecvența relativă de 0,8 la 100.000 de ani-persoană.
| Endocrin | Cardiovascular | Neurologic | Psihiatric | Alte |
|---|---|---|---|---|
| Hipertiroidism | Insuficienta cardiaca | Migrenă | Anxietate | Porfiria |
| Sindromul carcinoid | Aritmii | Accident vascular cerebral | Tulburare de panica | Medicamente |
| Hipoglicemie | Boală cardiacă ischemică | Epilepsie | Consumul de substanțe | |
| Sindromul menopauzei | Eșecul Baroreflex | Meningiom | Tulburare factioasă | |
| Carcinom tiroidian medular | - | VASE | - |
Note
Evaluarea biochimică
Standarde de aur
Metanefrinele fără plasmă crescute sunt considerate diagnosticul standard de aur pentru feocromocitom. Peste 10 studii au confirmat că sensibilitatea și specificitatea acestui test sunt de 97% și respectiv 93%; cu toate acestea, există încă îngrijorare pentru rezultatele fals pozitive în scenariul clinic corect. Atunci când interpretează o analiză biochimică pentru feocromocitom, furnizorul trebuie să acorde o atenție deosebită (1) condițiilor colecției, (2) tuturor medicamentelor pe care le ia pacientul și (3) dieta lor.
- Condiții de colectare: spre deosebire de multe teste de laborator de rutină care pot fi trase la un moment dat, există mai multe recomandări care trebuie respectate pentru a asigura condițiile ideale și o probă exactă. Cercetările actuale indică faptul că prelevarea sângelui ar trebui făcută numai după ce un pacient a stat în repaus în decubit dorsal (plat pe spate) timp de 30 de minute înainte de recoltare. În acest scenariu ar trebui folosite valori specifice de referință în decubit. Asigurarea acestor condiții este dificilă și poate fi cost-prohibitivă la majoritatea instituțiilor. În aceste cazuri, o remiză în repaus, în decubit dorsal poate fi repetată după un rezultat pozitiv într-o poziție așezată pentru a elimina rezultatele fals pozitive.
- Interferența farmaceutică: Multe substanțe eliberate pe bază de prescripție medicală, fără prescripție medicală și ilicite pot interfera cu colectarea adecvată a metanefrinelor plasmatice și pot duce la rezultate fals pozitive. Furnizorii trebuie să revizuiască în detaliu lista medicamentelor unui pacient și să poarte o discuție dacă este posibilă întreruperea temporară a oricăruia dintre medicamentele care interferează. Cele mai raportate medicamente care duc la metanefrine ridicate în mod fals includ: blocante ale β-adrenoceptorilor , fenoxibenzamină , antidepresive triciclice , inhibitori ai monoaminoxidazei , inhibitori ai recaptării serotoninei norepinefrinei ( SNRI ) și metildopa . Deoarece majoritatea acestor medicamente sunt prescrise în mod obișnuit pentru afecțiuni psihiatrice, poate fi necesară o conversație cu medicul pentru a facilita opțiunile terapeutice alternative în timp ce pacientul este supus evaluării unui feocromocitom. După ce s-au ținut posibile medicamente eliberate pe bază de prescripție medicală, este important să se revizuiască orice medicament / supliment fără prescripție medicală, precum și acetaminofenul și pseudoefedrina utilizate în mod obișnuit cauzează creșteri false ale nivelurilor de metanefrină. În cele din urmă, este important să avem discuții deschise, fără judecată, despre consumul de substanțe recreative al pacientului. Amfetaminele , nicotina și cocaina pot duce la niveluri marcate de norepinefrină în plasmă.
- Stil de viață și dietă: la fel ca în majoritatea lucrărilor de laborator, pacientul ar trebui să se abțină de la mâncare (post) după miezul nopții din noaptea dinaintea colectării. Cu toate acestea, există alte recomandări specifice unei colecții de metanefrine, inclusiv abținerea de la nicotină, alcool și exerciții fizice timp de cel puțin 12 ore înainte de extragerea lor de laborator. Pacientul trebuie, de asemenea, să evite alimentele care conțin catecolamină (fructe, băuturi din fructe, ciocolată, cofeină, roșii, fasole, nuci și cartofi) timp de minimum 24 de ore înainte de colectare.
În timp ce condițiile de mai sus (3) sunt susceptibile să contribuie la rezultate fals pozitive dacă nu sunt controlate, orice valoare mai mare de 3 până la 4 ori limita superioară de referință normală ar trebui considerată diagnostic pentru feocromocitom.
Teste alternative
Metanefrinele urinare de 24 de ore sunt o alternativă acceptabilă în cazul în care testul plasmatic nu este disponibil. Alte biomarkeri suplimentare pot fi de ajutor pentru a ajuta la diagnosticul de feocromocitom, de asemenea, cel mai notabil este chromogranin A . În comparație cu specificitatea catecolaminelor crescute la pacientul cu feocromocitom, cromogranina A este o polipeptidă nespecifică care este ridicată într-o varietate de tumori neuroendocrine. Cu toate acestea, un raport din 2006 din Italia a constatat că peste 90% dintre pacienții cu feocromocitom studiați au demonstrat niveluri crescute de cromogranină A. Dacă valorile metanefrinei sunt echivoce, cromogranina A poate fi utilizată ca marker adjuvant pentru a prezice prezența unei tumori.
Metanefrinele crescute la limită prezintă o provocare de diagnostic pentru medic - primul pas este repetarea laboratoarelor, luând măsuri de precauție suplimentare pentru a urmări diagnosticul standard de aur descris mai sus, inclusiv condițiile de colectare, interferența farmaceutică și orice potențiale diete și obiceiuri de viață care ar putea modificați rezultatele. Dacă medicamentele contravenționale nu pot fi întrerupte sau laboratoarele repetate au rămas aceleași, luați în considerare administrarea unui test de suprimare a clonidinei . În anii 1970, medicamentul cloridina clonidină a măturat piața ca un agent nou pentru hipertensiune ; cu toate acestea, efectele secundare raportate ( greață , vărsături , somnolență , uscăciunea ochilor și gurii, constipație și slăbiciune generalizată) limitează conformitatea și au prescripții foarte reduse. În timp ce efectele secundare adverse ale clonidinei sunt incomode, cel mai periculos aspect al clonidinei este hipertensiunea de retragere - adică, atunci când medicamentul este întrerupt brusc, tensiunea arterială poate reveni rapid sau poate depăși valoarea inițială. Cu toate acestea, o doză unică, bazată pe greutate, poate fi utilizată în setări limitate pentru a ajuta la determinarea stării bolii. După post peste noapte, pacientul se va prezenta la locul de testare pentru prelevarea inițială a sângelui de metanefrine și administrarea de clonidină. Acestea vor rămâne în decubit culcat timp de (3) ore și se va efectua o extragere repetată a sângelui. Un rezultat pozitiv (indicând un feocromocitom) va apărea dacă nivelurile plasmatice de metanefrină rămân crescute după administrarea clonidinei. Dacă rezultatele sunt aceleași sau cad, testul este negativ și pacientul nu are feocromocitom. Este important să rețineți că, dacă un pacient nu are feocromocitom, acesta poate deveni extrem de hipotensiv în urma clonidinei. Pacienții nu trebuie să depindă de ei înșiși pentru transport în urma acestui test.
Metoxitiramina plasmatică este un produs de descompunere a catecolaminei, dopamina . Paraganglioamele capului și gâtului secretă în mod obișnuit dopamină, dar sunt denumite „silențioase din punct de vedere biochimic”, deoarece nu cauzează simptomele caracteristice asociate cu feocromocitomul. Cu toate acestea, metoxitiramina poate fi utilizată pentru a detecta tumorile capului și gâtului. Cercetări suplimentare indică faptul că biomarkerul este, de asemenea, un indicator util al bolii metastatice - care este singura dovadă biochimică actuală a metastazelor până în prezent.
Fenotipuri biochimice
În timp ce diagnosticul, valorile de laborator pot oferi medicului informații importante despre tipul, localizarea, mărimea și genotipul tumorii asociate . Există (3) fenotipuri biochimice majore, bine recunoscute, care pot fi utilizate de furnizorii de servicii medicale pentru a direcționa îngrijirea pacientului.
-
Adrenergic ( epinefrină și metanefrină )
- Este mai probabil să indice o tumoare suprarenală
- Când nivelurile plasmatice de metanefrină au fost crescute la mai mult de 15% din nivelurile combinate de normetanefrină și metanefrină, se poate prezice o tumoare suprarenală sau recurența unei tumori suprarenale care a fost deja excizată.
- Este mai probabil ca pacienții să prezinte simptomele clasice, paroxistice (episodice) descrise mai sus
-
Noradrengeric ( noradrenalină și normetanefrină )
- Este mai probabil să indice o tumoare extra-suprarenală
- Pacienții sunt mai predispuși să prezinte simptome continue, persistente legate de feocromocitom ( hipertensiune arterială și tahicardie ) comparativ cu cele cu episod clasic cu fenotip adrenergic
- Frecvente la pacienții cu variante genetice ale subunității X a von-Hippel Lindau și succinat dehidrogenază
-
Dopaminergic ( dopamină și 3-metoxitiramină)
- Este mai probabil să indice o tumoare extra-suprarenală a capului și gâtului
- Este mai probabil ca pacienții să fie asimptomatici; cu toate acestea, acestea pot prezenta semne nespecifice de greață , vărsături , dureri abdominale, diaree și scădere în greutate secundare stimulării receptorilor de dopamină pe tot tractul gastro-intestinal.
- Prevalent în special la pacienții cu variante genetice ale subunității B succinate dehidrogenază
Atât pe un fenotip adrenergic, cât și pe unul noradrenergic, cu cât este mai mare suma concentrațiilor plasmatice sau urinare de metanefrină și normetanefrină, cu atât diametrul tumorii este mai mare.
Localizarea tumorii
Imagistica anatomică
Imagistica anatomică se referă la tomografie computerizată (CT) [scanare CAT] sau scanare imagistică prin rezonanță magnetică (RM). Aceste modalități de imagistică servesc la localizarea inițială a tumorii și oferă informații detaliate despre dimensiune, morfologie și relația structurală cu structurile interne adiacente. În mod tradițional, un pacient prezintă medicului său simptomele legate de feocromocitom, ceea ce determină o evaluare biochimică. Dacă rezultatele sunt pozitive, pacientul este trimis pentru imagini anatomice cu o scanare CT sau RM. Cu toate acestea, pe măsură ce imagistica anatomică devine mai ușor disponibilă, pacienții sunt direcționați către un endocrinolog după ce un nodul suprarenal incidental (constatare neprevăzută) este găsit pe o scanare comandată din alt motiv. De exemplu, „Pacientul M” se prezintă la camera de urgență locală pentru dureri abdominale și o CT este ordonată să excludă apendicita; cu toate acestea, radiologul observă că există o masă suprarenală dreaptă de 3,5 centimetri.
Deși nu a existat un consens cu privire la faptul dacă CT sau RM este modalitatea preferată de imagistică în feocromocitom, fiecare metodă are punctele forte și punctele sale slabe asociate. Ca CT expune pacientul la ionizante radiații , MR este de preferat la copii și femeile gravide. Mai mult, contrastul intravenos utilizat în CT poate provoca leziuni la rinichi și, prin urmare, trebuie evitat la pacienții cu leziuni preexistente. Cu toate acestea, pacienții care se luptă să se afle în spații restrânse pentru perioade lungi de timp ( claustrofobie ) nu pot tolera adesea o RM, deoarece mașina este închisă în comparație cu designul deschis al unui CT. Când pacienții devin anxioși și încep să se miște în mașină, acest lucru provoacă un artefact de mișcare, care apare mai puțin în imaginile bazate pe CT.
Comparativ cu CT și RM, ultrasunetele nu sunt o modalitate preferată de imagistică și ar trebui evitată la pacientul cu feocromocitom. Cu toate acestea, în populații specifice de pacienți în care evitarea radiațiilor ionizante este prioritatea maximă (copii, femei însărcinate), ultrasunetele pot fi utilizate ca metodă adjuvantă atunci când MR poate fi indisponibil sau pacientul este incapabil să finalizeze scanarea. Mai mult, dacă se suspectează o hemoragie suprarenală acută la un pacient cu feocromocitom, ultrasunetele sunt o modalitate rapidă, nedureroasă, fără radiații și ieftină pentru o „primă trecere” înainte ca modalitățile de imagistică sau intervenția chirurgicală de mai sus să fie utilizate pentru a confirma diagnosticul.
Imagistica funcțională
Modalitățile de imagistică discutate mai jos sunt pentru caracterizarea tumorii, confirmarea bolii metastatice și planificarea tratamentului - nu sunt utilizate pentru a discerne localizarea tumorii sau pentru a ajuta echipa chirurgicală să se pregătească pentru excizie. Pentru majoritatea pacienților cu feocromocitom, imagistica funcțională va urma CT sau RM. Dacă imagistica anatomică demonstrează doar o tumoare suprarenală fără dovezi de boală în altă parte a corpului și nivelurile de metanefrină sunt evident crescute, imagistica funcțională poate fi renunțată în favoarea exciziei chirurgicale rapide. În ultimul deceniu, au existat cinci tehnici funcționale utilizate pentru evaluarea pacientului cu feocromocitom (1) tomografie cu emisie de pozitroni 18F- fluorodeoxiglucoză ( 18 F-FDG PET ), denumită în mod obișnuit scanarea PET, (2) iod-123 meta- iodobenzilguanadină ( 123 I-MIBG), (3) 18F-flurodihidroxifenilalanină ( 18 F- FDOPA ), (4) analogi de somatostatină cuplați 68Ga-DOTA ( 68 Ga- DOTA ), (5) 11C-hidroxi efedrină (HED-PET). Începând cu acest moment, aceste modalități de formare a imaginii vor fi menționate în denumirile lor abreviate găsite între paranteze.

Prima tehnică de imagistică funcțională utilizată la pacienții cu feocromocitom a fost 123 I- MIBG scintigrafie (Imagine dreapta). Având în vedere structura similară a compușilor cu norepinefrina de catecolamină (secretată de feocromocitoame), MIBG a fost adecvat pentru absorbția majorității tumorilor neuroendocrine . Mai mult, dacă s-a constatat că un pacient a fost pozitiv la o scanare MIBG, acesta a fost eligibil pentru tratamentul MIBG, oferind căi suplimentare pentru cei care suferă de boli metastatice răspândite. Cu toate acestea, investigațiile ulterioare au relevat că, în timp ce MIBG a excelat cu leziuni suprarenale, acesta a fost mult mai puțin superior la pacienții cu paraganglioame extra-suprarenale, în special cu variante genetice specifice , cum ar fi subunitatea succinat dehidrogenază X ( SDHx). Pe măsură ce au fost dezvoltate scanările cu tomografie cu emisie de pozitroni , MIBG și-a pierdut încet favoarea pentru pacientul cu feocromocitom.

Dintre cele patru modalități menționate mai sus, 18 F- FDG PET este cea mai comună și ușor disponibilă tehnică de imagistică funcțională la majoritatea sistemelor spitalicești, dar cea mai puțin specifică tumorilor neuroendocrine (Imaginea din stânga). În 2012, peste 200 de pacienți au participat la un studiu care a comparat standardul de aur actual al timpului (MIBG / CT / RMN) cu romanul PET FDG. Comparativ cu omologul său funcțional, FDG a depășit MIBG în detectarea metastazelor țesuturilor moi și osoase cu specificitate mai mare la pacienții cu tumori biochimic active.
După dezvoltarea FDG-PET, au început să apară scanări PET specifice neuroendocrine. Una dintre primele modalități imagistice favorabile a fost 18 F- FDOPA , care a demonstrat o sensibilitate ridicată în detectarea paraganglioamelor capului și gâtului, precum și a bolii nemetastatice în afara capului și gâtului. Din păcate, în cazurile de boală metastatică , în special legate de mutațiile succinate dehidrogenazei subunității B ( SDHB ) , 18 F- FDOPA au scăzut inferior FDG-PET tradițional. Cu toate acestea, pentru pacienții cu variante genetice în alte gene susceptibile la feocromocitom ( NF1 , VHL , RET ) 18 F- FDOPA a devenit agentul radiofarmaceutic preferat.
Cea mai nouă modalitate PET implică imagistica receptorului de receptorul somatostatinei de tip doi cu 68 de analogi Ga- DOTA . În ultimul deceniu, cercetările suplimentare continuă să indice superioritatea acestei modalități funcționale de imagistică într-o gamă largă de scenarii clinice, depășind chiar imagistica anatomică ( CT / MR ) la pacienții copii cu mutații succinate dehidrogenază ( SDHx) . În timp ce FDOPA a detectat inconsecvent boala metastatică, 68 de analogi Ga- DOTA au demonstrat localizarea superioară a feocromocitomului metastatic. Când se compară direct într - un studiu cap-la-cap în 2019, 68 Ga DOTA analogi ai FDOPA depășit, în special în detectarea leziunilor osoase metastatice. Un beneficiu suplimentar al analogilor DOTA este capacitatea de tratament cu terapia radionuclidică a receptorului peptidic, care va fi discutată în secțiunea de tratament de mai jos.
De asemenea, HED-PET s-a dovedit a fi un instrument precis pentru diagnosticarea și excluderea feocromocitomului în scenarii clinice complexe și pentru caracterizarea tumorilor suprarenale echivoce.
Management
Interventie chirurgicala
Rezecția chirurgicală este singura opțiune curativă pentru feocromocitom începând cu 2019. O excizie reușită este un efort multidisciplinar care implică endocrinologul și pacientul preoperator (discutat mai jos) și echipa chirurgicală și anestezistul intraoperator. Fără o comunicare frecventă și adecvată între toate echipele menționate mai sus, un rezultat favorabil este mult mai dificil. Statele Unite ale Americii Societatea endocrine 2014 Practica clinice Orientarea pentru feocromocitom recomanda un laparoscopice adrenalectomia (tehnica minim invaziva) pentru cele mai multe tumori suprarenale, cu excepția cazului în care sunt invazive sau sunt mai mari de 6,0 centimetri. Este important de reținut că tumorile mai mari pot fi încercate cu o abordare minim invazivă, dar echipa ar trebui să fie pregătită să se transforme într-o procedură deschisă, dacă este necesar. O procedură deschisă (tehnica chirurgicală tradițională) este în prezent preferată pentru boala extra-suprarenală, cu excepția cazului în care tumora este mică, neinvazivă și într-o locație ușor de manevrat. În timp ce datele anterioare indicau necesitatea unei abordări minim invazive cu boli maligne și / sau metastatice , cercetările actuale indică faptul că o operație de succes este fezabilă și duce la o ședere mai scurtă la spital. Literatura din ultimul deceniu a demonstrat, de asemenea, că tehnica robotică poate fi utilizată cu succes pentru tumorile suprarenale .
De obicei, se efectuează suprarenalectomie completă sau totală; cu toate acestea, o tehnică denumită „cortical-economisitoare” poate lăsa o rămășiță (bucată) a glandei suprarenale în speranța de a evita înlocuirea steroizilor pe tot parcursul vieții dacă glandele suprarenale stângi și drepte trebuie îndepărtate. Problema este deosebit de important la pacienții cu MEN și VHL - boli legate, care are o șansă mai mare de feocromocitoamele bilaterale. Riscul de a părăsi țesutul suprarenal este o boală recurentă (tumoarea revine). Un studiu de cohortă din 2019 a raportat că, în ciuda unei rate recurente de 13% la pacienții care au suferit o suprarenalectomie cu economie corticală pentru feocromocitom, nu a existat o scădere a supraviețuirii în comparație cu omologii lor adrenalectomia totală.
Management preoperator
Probabil că cea mai importantă parte a unui plan chirurgical de feocromocitom este o blocare preoperatorie adecvată. Catecolaminele în exces au fost descrise ca un vulcan latent, gata să erupă oricând, făcând ravagii catastrofale asupra corpului. În timp ce o erupție poate apărea în orice moment, doi dintre cei mai frecvenți factori declanșatori sunt anestezia și manipularea directă a tumorii, ceea ce face din chirurgie unul dintre cele mai periculoase momente pentru un pacient cu feocromocitom, dacă nu este pregătit corespunzător. Pentru a ajuta la eludarea unei crize de catecolamină, Societatea Endocrină din Statele Unite recomandă ca toți pacienții cu tumori funcționale (hormonale active) să fie inițiați cu un blocaj pre-operator alfa-adrenoceptor cu cel puțin șapte zile înainte de operație. Există mai multe opțiuni de medicație în funcție de scenariul clinic, fiecare cu propriile puncte tari și puncte slabe asociate.
Blocada alfa
Dacă tensiunea arterială a pacientului este moderat crescută, este un agent preferat un antagonist alfa-1 adrenoceptor selectiv, cu acțiune scurtă ( doxazosin , prazosin , terazosin ). Cu toate acestea, pacientul ar trebui să fie avertizat cu privire la potențialul efect secundar cunoscut sub numele de „ fenomenul primei doze ”. Atunci când pacienții sunt inițial expuși la unul dintre agenții de mai sus, acestea pot deveni amețită , amețeală și greață , în special atunci când transferul dintr - o așezat în poziția în picioare din cauza unei rapide scădere a tensiunii arteriale . Aceste efecte vor scădea cu timpul, dar furnizorii pot încerca să le evite începând cu o doză mică și crescând încet până ajung la cantitatea dorită. La pacienții cu hipertensiune arterială necontrolată , ar trebui utilizat antagonistul non-selectiv alfa-1 și 2 al adrenoceptorilor ( fenoxibenzamină ). Din păcate, comparativ cu agenții selectivi enumerați mai sus, fenoxibenzamina este mult mai scumpă și este posibil să nu fie ușor disponibilă pentru unii pacienți. Frecvente efecte secundare includ uscăciunea gurii , congestie nazală , și cu deficiențe de ejaculare de sex masculin , toate care nu încetează cu timpul și pot limita pacientului conformitatea . Deși sunt mai puțin frecvente, pacienții pot avea un feocromocitom activ hormonal și o tensiune arterială normală. O comparație din 2014 a constatat că o doză mică de blocant al canalelor de calciu (cum ar fi amlodipina ) poate fi utilizată pre-operator la unii oameni. Acest lucru nu va reduce drastic tensiunea arterială a pacienților și îi va face hipotensivi , dar va ajuta echipele chirurgicale și de anestezie dacă există instabilitate hemodinamică în timpul operației.
Blocarea beta
O frecvență cardiacă crescută ( tahicardie ) și senzația de inimă în cursă ( palpitații ) pot urma după inițierea unui antagonist alfa-adrenoceptor . În acest caz, este prescris un antagonist beta-adrenoceptor pentru a controla ritmul cardiac. La fel ca în cazul antagoniștilor alfa, există antagoniști adrenoceptori selectivi (beta-1) și neselectivi (beta-1 și beta-2). Agenții selectivi ( atenolol , metoprolol ) sunt preferați agenților neselectivi ( propranolol ). Există mai mulți ( labetalol , carvedilol ) combinați antagoniști alfa-beta-adrenoceptor. Acești agenți trebuie evitați ori de câte ori este posibil, deoarece există peste șapte ori mai mult antagonism beta-adrenoceptor decât alfa, care poate agrava hipertensiunea și poate duce la o criză de catecolamină.
Complicații
Antagoniștii beta-adrenoceptor nu trebuie administrați singuri la un pacient cu feocromocitom - acest lucru poate duce la consecințe severe. În 1995, o echipă de medici din Londra a descris moartea unei persoane care fusese recent diagnosticată cu feocromocitom după inițierea propranololului , un beta-blocant neselectiv . Ea a dezvoltat rapid o criză hipertensivă care duce la șoc , infarct miocardic , insuficiență cardiacă și hemiplegie dreaptă densă . În ciuda încercărilor de resuscitare, persoana a murit câteva zile mai târziu. Această complicație este legată de impactul pe care antagoniștii alfa și beta-adrenoceptor îl au asupra vaselor de sânge combinat cu acțiunile catecolaminelor . Vasul normal de sânge este deschis, permițând un flux sanguin adecvat. Când catecolaminele activează receptorul alfa, vasul se constrânge (se micșorează), ceea ce duce la hipertensiune . Cu toate acestea, atunci când catecolaminele activează receptorul beta, vasul de sânge se dilată (se mărește) și permite creșterea fluxului sanguin, reducând tensiunea arterială. Dacă un pacient cu feocromocitom este început doar cu un antagonist beta-adrenoceptor, acest lucru inversează vasodilatația de protecție și agravează hipertensiunea pacienților.
Controversă
În timp ce blocajul pre-operator alfa și beta discutat mai sus este recunoscut în mod covârșitor ca standard de îngrijire, în special în Statele Unite, s-a discutat la nivel internațional dacă este necesară o blocadă. În 2017, o echipă de cercetători din Germania a publicat o serie de cazuri observaționale care a pus la îndoială recomandările actuale pentru o blocadă. Studiul a examinat presiunea arterială sistolică maximă intraoperatorie la persoanele cu și fără blocaj alfa-adrenoceptor și nu a constatat nicio diferență în complicațiile dintre cele două grupuri. Anul următor, un grup din Franța a publicat un articol similar cu un avertisment împotriva așteptării unei săptămâni întregi pentru a începe alfa-blocada. Cercetătorii francezi au solicitat intervenția chirurgicală imediată și luarea în considerare a măsurilor pentru atenuarea oricărei crize intraoperatorii de catecolamină. Aceste articole au dus la respingerea unor echipe de cercetare din Statele Unite, dar nu s-a ajuns încă la un consens internațional.
Starea lichidului perioperator
Catecolaminele în exces determină o scădere a volumului total de sânge , făcând un pacient vulnerabil la hipotensiune în timpul operației. Prin urmare, o dietă bogată în sodiu cu aport adecvat de lichide ar trebui încurajată înainte de operație. Unele instituții din Statele Unite vor admite pacienți chiar în noaptea anterioară intervenției chirurgicale pentru înlocuirea lichidului intravenos începând cu miezul nopții până la momentul operației. Cu toate acestea, un mic studiu din 2009 nu a raportat nicio diferență a mortalității la pacienții tratați cu fluide intravenoase preoperatorii, comparativ cu cei care nu au făcut-o.
Într-un sondaj din 2010 realizat de 40 de endocrinologi de către cercetători de la Centrul Medical Cedars-Sinai din Los Angeles, California, aproape toți au indicat importanța resuscitării volumului preoperator (având ca pacient să ia multe lichide înainte de operație). Cu toate acestea, după revizuirea datelor despre pacienți, peste 60% din aceiași medici nu au reușit să discute despre încărcarea sării și hidratarea adecvată. Când pacienții au fost stratificați în funcție de vârstă, cei mai tineri au primit sfatul de hidratare , dar pacienții mai în vârstă nu. S-a emis ipoteza că furnizorii au ales să renunțe la reîncărcarea volumului la populația de pacienți în vârstă, de teama potențialelor lor comorbidități ( insuficiență cardiacă ) în care excesul de lichid este periculos. Deși nu există încă un consens recunoscut sau un standard de aur, furnizorii ar trebui să individualizeze decizia pe baza stării nutriționale percepute a pacientului, a stării volumului , a comorbidităților și a capacității de autohidratare.
Management postoperator
Cele mai frecvente complicații post-operatorii, cauze probabile și opțiuni de tratament sunt:
- Hipertensiune arterială : la pacientul cu feocromocitom, hipertensiunea postoperatorie ar putea indica rezecția tumorală incompletă sau o altă tumoare de localizare necunoscută. Cu toate acestea, trebuie luate în considerare și cauzele tradiționale, nespecifice ale hipertensiunii postoperatorii, inclusiv durerea, supraîncărcarea lichidelor și hipertensiunea esențială . O criză hipertensivă perioperatorie este tratată mai întâi cu un bolus intravenos de fentolamină de 5,0 miligrame (mg) , cu o doză suplimentară de 5,0 mg la fiecare zece minute până când tensiunea arterială se încadrează într-un interval acceptabil. Dacă tensiunea arterială este doar minim crescută, pacientul își poate relua antagonistul alfa și beta-adrenoceptor înainte de operație.
- Hipotensiune arterială : Există mai multe motive pentru care un pacient poate avea tensiune arterială scăzută în perioada post-operatorie. În primul rând, tumora (și abundența sa de catecolamine care cauzează tensiune arterială crescută) a fost eliminată. Mai mult, pacientul poate experimenta în continuare efectele antagonistului alfa-adrenoceptor , care determină scăderea tensiunii arteriale. Tratamentul de primă linie pentru hipotensiunea postoperatorie este resuscitarea agresivă a fluidelor , motiv pentru care asigurarea pacientului este bine hidratată (vezi mai sus) înainte de operație este atât de imperativă. Pot fi necesari vasopresori dacă tensiunea arterială nu răspunde la lichide.
- Hiperglicemie : catecolaminele previn secreția de insulină - un hormon responsabil de scăderea glicemiei (zahărului) din organism . Nivelurile de glucoză din sânge trebuie verificate frecvent în perioada perioperatorie și insulina trebuie administrată după cum este necesar dacă nivelurile sunt crescute. După rezecție, este posibil ca hiperglicemia asociată tumorii să se rezolve.
- Hipoglicemie : după îndepărtarea tumorii, insulina nu mai este inhibată, ceea ce poate duce la scăderea periculoasă a glicemiei. Simptomele includ tremor , anxietate , palpitații , transpirație , stare mentală alterată (confuzie), amețeli și vedere încețoșată . O analiză retrospectivă a beta-blocantului a constatat că o anumită utilizare a beta-blocantelor poate determina oamenii să fie mai predispuși la hipoglicemie și să nu experimenteze aceste simptome, ceea ce ar putea întârzia diagnosticul.
-
Insuficiență suprarenală: în urma unei suprarenalectomii bilaterale (stânga și dreapta), pacientul nu mai este capabil să secrete hormonii necesari pentru a-și menține corpul funcțional. Este posibil să fie necesară suplimentarea orală pe toată durata vieții ( hidrocortizon și fludrocortizon ) pentru a se asigura că nu dezvoltă insuficiență suprarenală. Când corpul este stresat (în timpul intervenției chirurgicale), glandele suprarenale produc în mod natural mai mulți steroizi; cu toate acestea, dacă glandele au fost îndepărtate, acestea nu pot face acest lucru. Prin urmare, sunt necesari steroizi cu „dozare a stresului” și ar trebui să înceapă intraopertiv pentru a imita fiziologia naturală a glandelor suprarenale. Regimul tipic în care se crede că insuficiența suprarenală postoperatorie este probabilă:
- 50 miligrame (mg) hidrocortizon intravenos în sala de operație înainte de anestezie
- Se repetă administrarea de 25-50 mg de hidrocortizon intravenos la fiecare opt ore timp de maxim 72 de ore (3 zile) după operație. Treceți la terapia de substituție orală de îndată ce pacientul este capabil să ia medicamente pe cale orală
- Pacienții trebuie trecuți la o doză normală de întreținere (regulată, zilnică) de steroizi înainte de externare și îndrumați la endocrinologie pentru o titrare și un tratament adecvat. În funcție de suprafața corporală totală a pacientului, doza zilnică tipică totală de hidrocortizon este între 15 și 25 mg zilnic (împărțită în pastile de dimineață și după-amiază).
- Cei care și-au pierdut ambele glande suprarenale vor necesita, de asemenea, un alt steroid ( înlocuitor de mineralcorticoizi ). Doza zilnică tipică este cuprinsă între 50 și 200 micrograme de fludrocortizon
Au fost raportate multe alte complicații ( insuficiență renală , insuficiență cardiacă , pseudo-obstrucție intestinală ) după rezecția tumorii. Cu toate acestea, cele de mai sus sunt mai susceptibile de a fi întâlnite, motiv pentru care managementul acestora a fost specificat în mod specific aici în acest articol.
Boala metastatică
Diagnosticul și localizarea
Feocromocitomul metastatic este definit ca prezența celulelor tumorale ( țesutul cromafinei ) unde nu se găsesc în mod normal. Pacienții cu paragangliom sunt mai predispuși să dezvolte metastaze decât cei cu feocromocitom. Cele mai frecvente situri extra-suprarenale ale metastazelor sunt ganglionii limfatici , plămânul , ficatul și osul . Au fost studiați mai mulți factori de risc asociați cu dezvoltarea bolii metastatice - în timp ce mediul genetic al pacienților joacă un rol important, vârsta inițială de prezentare și dimensiunea tumorii duc la rezultate negative. Dintre toate variantele genetice, mutațiile succinate dehidrogenazei subunității B (SDHB) au cele mai mari rate de dezvoltare a bolii metastatice. Un alt studiu a raportat creșterea mortalității asociate cu sexul masculin și metastazele sincrone. Metastazele sunt împărțite în sincron și metacron; cele care sunt sincrone s-au dezvoltat în câteva luni de la tumora primară, în timp ce metastazele metacronice nu apar pentru o perioadă semnificativă de timp.
Abordarea laparoscopică a bolii originale, în special în tumorile mari, a fost desemnată ca un factor de risc important pentru însămânțarea tumorală.
În ciuda tuturor opțiunilor de tratament potențiale de mai jos, literatura recentă evidențiază faptul că (pentru majoritatea pacienților) feocromocitomul metastatic este în creștere lentă. La pacienții cu o sarcină minimă a bolii, este favorabilă o abordare „ urmăriți și așteptați ” cu imagistică frecventă pentru a monitoriza boala, reținând tratamentul până când se vizualizează dovezi ale progresiei.
Tratament
Feocromocitomul metastatic este cel mai bine gestionat cu o echipă multidisciplinară de oncologi , chirurgi , radiologi , medici de medicină nucleară și endocrinologi . Există mai multe opțiuni de tratament disponibile pacienților, în funcție de cantitatea și localizarea bolii:
Chirurgie - În mod normal, scopul chirurgiei este chirurgia citoreductivă completă ; nu lăsați nicio rămășiță de boală. Cu toate acestea, cu o boală metastatică răspândită, acest lucru nu este întotdeauna fezabil. Prin urmare, un chirurgical debulking procedura se realizeaza (indepartarea cat mai mult din tesutul canceros este posibil) , în scopul de a reduce simptomele pacientului prin îndepărtarea sursei de catecolamine, pentru a îmbunătăți răspunsul la chimio sau terapie radionuclid, sau pur și simplu reduce dimensiunea tumorii. Din păcate, scutirea intenționată a procedurii este adesea de scurtă durată, mai ales dacă pacientul are boli în afara abdomenului. Un studiu din 2013 al Institutului Național de Sănătate a raportat că majoritatea pacienților au suferit de dovezi biochimice recurente ale bolii în decurs de un an de la operație și mai puțin de 30% au continuat să fie indemne de boală din punct de vedere biochimic după cinci ani.
Spre deosebire de o operație pentru boala non-metastatică, poate fi preferată o procedură deschisă în locul unei tehnici minim invazive, pentru a ocoli răspândirea potențială a tumorii. Acest lucru ajută, de asemenea, vizualizarea chirurgicală și oferă cea mai bună oportunitate de a identifica și a elimina ganglionii limfatici metastatici. Rapoartele au indicat, de asemenea, utilitatea administrării unui agent de radionuclizi cum ar fi iod-123 meta-iodobenzilguanadină ( 123 I-MIBG) înainte de intervenția chirurgicală și apoi scanarea pacientului intraoperator cu o sondă pentru a detecta boala care poate fi ratată cu ochiul liber.
Radioterapie - În ceea ce privește feocromocitomul, tehnicile de radiații sunt utilizate în primul rând pentru controlul durerii, în special în ceea ce privește metastazele osoase , controlul local al bolii și pentru a limita compresia măduvei spinării . O echipă multidisciplinară de la Clinica Mayo a analizat retrospectiv toți pacienții lor care au fost supuși radioterapiei cu fascicul extern în perioada 1973-2015 și au raportat că 94% dintre pacienți au recunoscut îmbunătățirea simptomatică și peste 80% dintre pacienți nu au prezentat dovezi de boală recurentă la 5 ani după terapie. Un alt raport al aceleiași instituții a analizat aproape două decenii de pacienți cărora li s-a efectuat o ablație , crioablare sau injectare percutanată de etanol radiofrecvent pentru feocromocitom metastatic și a raportat că controlul local a fost realizat în peste 85% din leziunile vizate și că 92% din proceduri au fost asociate cu durere redusă și / sau simptome de exces de catecolamină .
Chimioterapie - Cel mai frecvent regim de chimioterapie pentru feocromocitomul metastatic este ciclofosfamida , vincristina și dacarbazina , cunoscute în mod colectiv sub numele de BCV. Răspunsul la terapie se măsoară printr-o reducere a volumului tumorii totale, precum și prin ameliorarea simptomatică, raportată de pacient. O analiză sistematică și meta-analiză a pacienților cu feocromocitom netratificat care au fost supuși terapiei BCV a arătat că 37% dintre pacienți au avut o reducere semnificativă a volumului tumoral, în timp ce 40% dintre pacienți au prezentat o sarcină mai mică a catecolaminei. Deși nu a existat nicio diferență în supraviețuirea globală între pacienții ale căror tumori s-au micșorat față de cei fără răspuns (fără reducere a sarcinii tumorale prin imagistică), chiar și la cei care nu au răspuns, pacienții au raportat că se simt mai bine, tensiunea arterială a fost mai mică și unii pacienți au fost chiar capabili să fie supus unei intervenții chirurgicale în urma stabilizării bolii cu BCV. Atunci când pacienții sunt studiați pe diferite categorii, cercetările au sugerat că femeile sunt mai puțin susceptibile de a avea o supraviețuire extinsă cu chimioterapia BCV comparativ cu omologii lor masculini. Sa demonstrat că statutul genetic are un impact semnificativ asupra răspunsului la BCV. O echipă de cercetători de la Institutul Național de Sănătate a raportat că pacienții cu mutații succinate dehidrogenază subunitatea B (SDHB) nu numai că au mai multe șanse de a răspunde inițial la BCV, dar au experimentat și peste 30 de luni de supraviețuire fără progresie (timpul până la revenirea tumorii) ) cu administrare continuă.
Cu toate acestea, BCV nu este singurul regim chimioterapeutic dovedit la pacientul cu feocromocitom. Un raport din 2018 a demonstrat răspunsul remarcabil al a doi pacienți cu SDHB care nu au reușit chimioterapia BCV (boala a progresat în ciuda medicației), dar au fost apoi tratați cu temozolomidă (TMZ) și au avut o supraviețuire fără progresie de 13 și 27 de luni, indicând faptul că TMZ poate fi considerat un regim alternativ de tratament la cei care au progresat pe BCV. Mai multe studii au raportat de atunci răspunsuri de succes cu TMZ, în special în subpopulația SDHB .
Terapia cu radionuclizi
- Iod-131 meta-iodobenzilguanadină (MIBG)
- După cum sa menționat în secțiunea de imagistică funcțională de mai sus, MIBG este util nu numai în localizarea prezenței bolii metastatice, ci și ca modalitate de tratament disponibilă. În 2019, un studiu multicentric de fază 2 a analizat siguranța și eficacitatea terapiei MIBG la pacienții cu feocromocitom metastatic sau nerezecabil (care nu favorizează intervenția chirurgicală) și rezultatele au fost promițătoare. Supraviețuirea globală medie a fost de 36,7 luni și 92% dintre pacienți au avut cel puțin un răspuns parțial pozitiv (contracție tumorală) sau boală stabilă fără progresie în primul an de studiu. Mai mult, peste un sfert dintre pacienți au reușit să își scadă medicamentele antihipertensive și au raportat îmbunătățiri simptomatice. Există mai mulți pacienți care nu sunt eligibili pentru tratamentul MIBG, inclusiv femeile însărcinate (expunerea la radiații este dăunătoare pentru făt ), femeile care alăptează activ , pacienții cu insuficiență renală și cei care nu se așteaptă să trăiască mai mult de 3- luni. Deoarece terapia MIBG poate distruge tiroida , medicamentele de protecție ( iodură de potasiu ) sunt începute înainte de tratament și trebuie continuate cel puțin 3 săptămâni după încheierea terapiei. Asociate efecte secundare ( slăbiciune musculară , greață , vărsături și hematologice ( de sange) toxicitate , sunt frecvente, dar de multe ori minime, și pot fi atenuate cu dozare lent, constant.
-
Terapia cu radionuclizi a receptorului peptidic (PRRT)
- Cea mai nouă dintre opțiunile de tratament, PRRT utilizează analogii DOTA 68-Ga menționați mai sus în secțiunea de imagistică funcțională. Tratamentul cu 177 Lu-DOTATATE a demonstrat mai întâi succesul la pacienții cu tumori neuroendocrine nediferențiate și apoi au început studiile cu pacienți cu feocromocitom metastatic. În 2019, Vyakaranam și colab. Au publicat rezultate favorabile pentru cei 22 de pacienți care au suferit PRRT, cu răspuns parțial la 2 pacienți și boală stabilă (fără progresie) la restul de 20 de pacienți. Toxicitatea generală a fost scăzută, fără raportarea de leziuni hematologice (sanguine) sau renale de înaltă calitate. La sfârșitul aceluiași an, o revizuire sistemică a analizat toate articolele publicate (12) în care pacienții cu feocromocitom metastatic au suferit PRRT și au constatat că evenimentele adverse legate de tratament sunt minime, doar 5 din 102 pacienți alegând să inițieze voluntar întreruperea tratamentului. Rapoarte mai noi au detaliat utilitatea combinării 90 Y- DOTATATE cu analogul 177 Lu studiat în mod tradițional și diferitele posibilități și opțiuni noi de tratament pe care aceste combinații le vor aduce pe teren. În timp ce efectele secundare raportate în ansamblu au fost promițătoare, este important În timp ce efectele secundare raportate în ansamblu au fost promițătoare, este important de menționat că un efort de colaborare între Institutele Naționale de Sănătate și Centrul Medical al Universității Radboud a raportat două cazuri nefericite de progresie rapidă a bolii în urma unui răspuns remarcabil, aproape complet la PRRT. În timp ce etiologia recurenței lor este necunoscută, echipa a speculat că un marker tumoral crescut ( Ki-67 ) ar putea fi o indicație a unui răspuns slab la PRRT și a solicitat evaluări pre-PRRT pentru a include valorile Ki-67 pentru a ajuta la individualizarea tratamentului pacientului. planuri.
Prognoză
Potrivit Institutului Național al Cancerului , prognosticul este definit ca rezultatul probabil al unei boli SAU, șansa de recuperare sau reapariție. Aceasta este o întrebare extrem de dificilă atunci când vine vorba de feocromcitom, iar răspunsul depinde de starea genetică a pacienților, de prezența bolii metastatice și de localizarea tumorii lor primare. Un articol despre prognostic publicat în 2000 a raportat o rată de supraviețuire la 5% de 91% în populația lor de pacienți; cu toate acestea, este important să rețineți că peste 86% dintre pacienții lor au avut tumori sporadice (nu se cunosc mutații genetice), care au de obicei un potențial malign scăzut. În 2019, un consorțiu format din aproape douăzeci de centre medicale europene a analizat prognosticul feocromocitomului malign și datele variază puternic de la raportul tumorilor unice sporadice, cu o supraviețuire mediană de 6,7 ani. Supraviețuirea generală s-a îmbunătățit dacă pacientul a avut (1) boală a capului și gâtului comparativ cu abdomenul, (2) sub 40 de ani, (3) și dacă biochimia lor a fost mai mică de cinci ori limita superioară de referință a normalului.
Literatura recentă a detaliat mai mulți factori care prezic progresia accelerată a bolii și rate mai ridicate de mortalitate, inclusiv pacienții care aleg să renunțe la rezecția chirurgicală a tumorii lor primare, tumori mai mari la prezentarea inițială, vârsta mai mare la diagnosticul inițial și un timp scurtat de la tumora primară la prezența metastazelor. Localizarea efectivă a metastazelor poate indica, de asemenea, prognostic, leziunile osoase (osoase) având o evoluție mai bună decât omologii lor de țesut moale ( plămân , ficat ).
Epidemiologie
Potrivit Societății de Tumori Neuroendocrine din America de Nord, prevalența feocromocitomului este cuprinsă între 1: 2500 și 1: 6500, ceea ce înseamnă că pentru fiecare 2.500 - 6.500 de persoane, există (în medie) o persoană cu feocromocitom. În Statele Unite, acest lucru echivalează cu o incidență anuală (cazuri noi pe an) de 500 până la 1600 de cazuri. Cu toate acestea, aproximările la începutul anilor 2000 au raportat că peste 50% din diagnosticele de feocromocitom sunt la autopsie ; prin urmare, estimările de mai sus pot fi mai mici decât se așteptau. Într-o serie de cazuri de autopsie de 50 de ani, Mayo Clinic a analizat 54 de cazuri de feocromocitom între 1928-1977 și a descoperit că doar 24% dintre pacienți au fost diagnosticați corect înainte de moartea lor. În afara Statelor Unite, mai multe țări și-au documentat propriile studii epidemiologice și le-au comparat cu ceea ce este cunoscut în America de Nord . În primul studiu național, epidemiologic pe bază de populație din Asia, utilizând datele Serviciului Național de Asigurări de Sănătate din Coreea , prevalența feocromocitomului a fost raportată la 2,13 la 100.000 de persoane, cu o incidență de 0,18 la 100.000 de persoane-ani. Aceasta este mai mică decât apariția raportată din Rochester, Minnesota (0,8 la 100.000 de persoane-ani) într-un studiu realizat în perioada 1950-1979. Cu toate acestea, Țările de Jos au efectuat, de asemenea, un studiu utilizând un registru la nivel național și au raportat rezultate ale incidenței de 0,57 la 100.000 de ani-persoană din 2011-2015, ceea ce a reprezentat o creștere semnificativă față de 0,37 cazurile lor la 100.000 de ani-persoană raportate din 1995-1999. Ipotezele actuale pentru care incidența feocromocitomului crește în populația olandeză indică apariția evaluării imagistice moderne și capacitatea de a detecta aceste tumori înainte de moarte. În timp ce fiecare dintre studiile de mai sus a raportat valori diferite de incidență și prevalență, toate au indicat că vârsta medie la diagnosticul inițial este cuprinsă între a treia și a cincea decadă de viață. Atunci când pacienții mai tineri sunt diagnosticați cu feocromocitom, ar trebui să existe o mare suspiciune pentru boala ereditară, deoarece anticiparea genetică (debutul precoce al bolii cu fiecare generație) este asociată cu unele mutații.
Clasic, „regulile de 10” ale feocromocitomului au fost predate, în special studenților la medicină:
- 10% dintre pacienți au boli maligne
- 10% dintre pacienți au boli bilaterale (atât glandele suprarenale stânga, cât și dreapta)
- 10% dintre pacienți au boală extra-suprarenală (paragangliom)
- 10% dintre pacienți au moștenit (boală familială)
În ciuda importanței în multe manuale respectate, aceste linii directoare au fost stabilite ca fiind inexacte și nu sunt utilizate în discuțiile epidemiologice actuale.
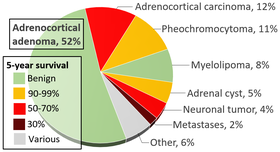
Așa cum s-a sugerat mai sus, imagistica incidentală a devenit un jucător major în diagnosticul pacienților cu feocromocitom, estimările actuale între 10-49% din toate cazurile diagnosticate după imagistică au fost obținute din alt motiv. Când se descoperă un nodul suprarenalian (tumoare potențială) prin tomografie computerizată sau imagistică prin rezonanță magnetică, există între 5 și 10% șanse ca leziunea să fie un feocromocitom. Incidența tumorilor suprarenale se găsește în infografia de mai sus, cu feocromocitom notat în galben în colțul din dreapta sus.
Istorie
În 1800, un medic irlandez (Charles Sugrue) a scris un raport de caz către London Medical and Physical Journal în care descria cazul particular al unui pacient de 8 ani care suferise de crize aparent aleatorii de durere concentrate în abdomen însoțite de „o agitat la același nivel marcate distinct pe fiecare obraz“ , cu o«profuze constantă și universală transpirație .» După moartea sa, un grup de medici au efectuat o autopsie pentru a determina cauza decesului și au descoperit o tumoare alungită de 6 inci compusă dintr-o „substanță de culoare galben-ish” necunoscută provenită din capsula renalis (ceea ce este acum cunoscut sub numele de glanda suprarenală) . Aceasta ar deveni prima descriere clinică cunoscută a feocromocitomului, dar, deoarece nu au fost descrise caracteristici ale tumorii în sine, se acordă un credit complet germanului Felix Fraenkel, care a furnizat o imagine clinică și morfologică a acestei tumori. În timp ce diverși medici recunosceau simptomele și tratau pacienții, biologul ceh Alfred Kohn a raportat descoperirea sistemului paragangliei , care va deveni ulterior crucial pentru diagnosticul acestor tumori. Mai mult, el a introdus și termenul de " cromafină " , permițând patologilor să recunoască tumorile care au apărut din glanda suprarenală .
În 1908, doi patologi , Henri Alezais și Felix Peyron, au introdus comunitatea științifică în „ paragangliom ” după ce au descoperit țesut extra-suprarenal care reacționa la sărurile de crom, care imitau reacția medularei suprarenale. Doar patru ani mai târziu, patologul german Ludwig Pick a inventat termenul „feocromocitom” după ce a observat schimbarea consistentă a culorii în tumorile asociate medularei suprarenale . Mulți chirurgi au încercat să îndepărteze aceste tumori în următorul deceniu, dar pacienții lor au murit intraoperator de șoc. În 1926, Charles Mayo (fondator al Clinicii Mayo ) a devenit primul medic care a excizat cu succes un feocromocitom. Cu toate acestea, Mayo probabil nu știa despre diagnostic înainte de operație. Abia în 1929 un feocromocitom nu a fost recunoscut preoperator. La începutul anilor 1900, rata de mortalitate operativă pentru un feocromocitom a variat între 30-45%. Seriile retrospective au postulat că aceste rate de mortalitate alarmant de mari s-au datorat lipsei unei blocade pre-operatorii cu antagonist alfa și beta-adrenoceptor și nevoia de practici moderne de anestezie. Din acest moment înainte, medicii-oameni de știință au recunoscut tiparele la pacienții cu feocromocitom și au identificat asociații genetice și diferite sindroame.
Societate și cultură
Deși este o boală rară, au existat mai multe referințe la feocromocitom în cultura populară și în mass-media, în special în dramele de televiziune medicale . În plus, există o comunitate online puternică de susținere a pacienților care lucrează pentru a conecta pacienții cu boli rare și le permite să se întâlnească cu alte persoane care se confruntă cu diagnostice și strategii de tratament similare.
Cultura Zebra
În comunitatea medicală, elevii sunt deseori învățați „când auzi bătăile copitelor în Texas, gândește-te la cai, nu la zebre”. Cu alte cuvinte, diagnosticele obișnuite sunt frecvente, astfel încât profesioniștii din domeniul sănătății ar trebui să excludă mai întâi ceea ce este cel mai așteptat (caii) înainte de a se scufunda în etiologiile rare, care sunt mult mai puțin probabil să fie corecte (zebrele). Cu toate acestea, simbolul zebră a devenit din ce în ce mai puternic pentru comunitatea bolilor rare și a dus la mai multe organizații, societăți și evenimente speciale ( Ziua bolilor rare ) pentru a atrage atenția asupra celei mai puțin frecvente opțiuni, uneori fiind diagnosticul corect.
Organizatia Nationala pentru tulburari rare este o organizație mamă de advocacy Statele Unite ale Americii pe bază cu scopul de a promova oportunități de sensibilizare și de cercetare pentru a vindeca bolile rare. Astfel de grupuri încurajează pacienții să devină proprii avocați și să schimbe agenții în procesele lor de luare a deciziilor în domeniul asistenței medicale.
Mass-media
În iulie 2012, un pacient cu feocromocitom, Tannis Brown, fost vicepreședinte al trupelor PheoPara, a fost prezentat în programul Discovery Fit & Health Network Diagnostic: Dead or Alive. Spectacolul a evidențiat lupta ei personală cu boala diagnosticată greșit, deoarece mulți medici au simțit că durerile de cap episodice și hipertensiunea arterială (hipertensiune arterială) sunt legate de stres.
În al șaptelea și al optulea anotimp al lui Greys Anatomy , seria regulată Henry are o mutație Von Hippel-Lindau (VHL) care a dus la un feocromocitom. Arc poveste a fost întâmpinată cu opinii mixte din comunitatea de boli rare. Apoi, directorul executiv al Alianței VHL a fost mulțumit de reprezentarea unui pacient VHL în mass-media, dar a subliniat că din cele patru scripturi pe care le știa cu un pacient VHL, trei au implicat un feocromocitom, care apare de fapt în mai puțin de o cincime din toți pacienții cu VHL.
Referințe
linkuri externe
- „ Informații generale despre feocromocitom și paragangliom ” de la Institutul Național al Cancerului
- Feocromocitom și paragangliom de la Societatea Americană de Oncologie Clinică
- Feocromocitom ; Baza de date a bolilor rare de la Organizația Națională pentru Tulburări Rare
- Ce trebuie să știți despre feocromocitom din Medical News Today
- MedlinePlus Prezentare generală feocromocitom
- GeneReviews intrare pe „ Sindroame ereditare paragangliom-feocromocitom ”
| Clasificare | |
|---|---|
| Resurse externe |