Sistem de recompensare - Reward system
Sistemul de recompensă (circuitul mezocorticolimbic) este un grup de structuri neuronale responsabile pentru evidențierea stimulentelor (adică „dorința”; dorința sau dorința de a primi o recompensă și motivație), învățarea asociativă (în primul rând întărirea pozitivă și condiționarea clasică ) și valențarea pozitivă emoții , în special cele care implică plăcerea ca componentă de bază (de exemplu, bucurie , euforie și extaz ). Recompensa este proprietatea atractivă și motivațională a unui stimul care induce un comportament apetitiv, cunoscut și sub denumirea de comportament de abordare și comportament consumativ. Un stimul satisfăcător a fost descris ca „orice stimul, obiect, eveniment, activitate sau situație care are potențialul de a ne face să ne apropiem și să-l consumăm este, prin definiție, o recompensă”. În condiționarea operantă , stimulii recompensatori funcționează ca întăritori pozitivi ; cu toate acestea, afirmația inversă este valabilă și: întăritorii pozitivi sunt plini de satisfacții.
| Glosar de dependență și dependență | |
|---|---|
| |
Sistemul de recompensare motivează animalele să se apropie de stimuli sau să se angajeze într-un comportament care crește condiția fizică (sexul, alimentele dense în energie etc.). Supraviețuirea pentru majoritatea speciilor de animale depinde de maximizarea contactului cu stimuli benefici și de minimizarea contactului cu stimuli dăunători. Cunoașterea recompenselor servește la creșterea probabilității de supraviețuire și reproducere, provocând învățarea asociativă, provocând abordarea și comportamentul consumativ și declanșând emoții cu valoare pozitivă . Astfel, recompensa este un mecanism care a evoluat pentru a ajuta la creșterea capacității adaptive a animalelor. În dependența de droguri , anumite substanțe supraactivează circuitul de recompensă, ducând la un comportament compulsiv de căutare a substanțelor rezultat din plasticitatea sinaptică din circuit.
Recompensele primare sunt o clasă de stimuli plină de satisfacții care facilitează supraviețuirea sinelui și a descendenților și includ recompense homeostatice (de exemplu, mâncare gustoasă ) și reproductive (de exemplu, contact sexual și investiții parentale ). Recompensele intrinseci sunt recompense necondiționate care sunt atractive și motivează comportamentul deoarece sunt inerent plăcute. Recompensele extrinseci (de exemplu, banii sau vizionarea unei echipe sportive preferate câștigând un joc) sunt recompense condiționate care sunt atractive și motivează comportamentul, dar nu sunt în mod inerent plăcute. Recompensele extrinseci își derivă valoarea motivațională ca urmare a unei asocieri învățate (adică condiționare) cu recompense intrinseci. Recompensele extrinseci pot provoca, de asemenea, plăcere (de exemplu, euforia de a câștiga mulți bani într-o loterie) după ce au fost condiționate clasic cu recompense intrinseci.
Definiție
În neuroștiințe, sistemul de recompensă este o colecție de structuri cerebrale și căi neuronale care sunt responsabile pentru cunoașterea legată de recompensă, incluzând învățarea asociativă (în primul rând condiționarea clasică și întărirea operantului ), evidențierea stimulentului (adică motivația și „dorința”, dorința sau pofta de recompensă) și emoții cu valoare pozitivă , în special emoții care implică plăcere (adică „plăcere” hedonică).
Termenii care sunt utilizați în mod obișnuit pentru a descrie comportamentul legat de „dorința” sau componenta dorinței recompensei includ comportamentul apetitiv, comportamentul de abordare, comportamentul pregătitor, comportamentul instrumental, comportamentul anticipativ și căutarea. Termenii care sunt utilizați în mod obișnuit pentru a descrie comportamentul legat de „plăcere” sau componenta plăcerii recompensei includ comportamentul consumativ și comportamentul de asimilare.
Cele trei funcții principale ale recompenselor sunt capacitatea lor de a:
- produce învățare asociativă (adică condiționare clasică și întărire operantă );
- afectează luarea deciziilor și induc comportamentul de abordare (prin atribuirea unei evidențe motivaționale stimulilor recompensați);
- obține în mod pozitiv-valenced emoții, în special plăcere.
Neuroanatomie
Prezentare generală
Structurile cerebrale care alcătuiesc sistemul de recompensă sunt localizate în primul rând în bucla cortico-bazală ganglion-talamo-corticală ; bazale ganglionul porțiunea din bucla conduce activitatea în cadrul sistemului de recompense. Majoritatea căilor care leagă structurile din cadrul sistemului de recompensă sunt interneuroni glutamatergici , neuroni GABAergici medii spinoși (MSN) și neuroni de proiecție dopaminergici , deși contribuie alte tipuri de neuroni de proiecție (de exemplu, neuroni de proiecție orexinergici ). Sistemul de recompensă include zona tegmentală ventrală , striatul ventral (adică nucleul accumbens și tuberculul olfactiv ), striatul dorsal (adică nucleul caudat și putamenul ), substantia nigra (adică pars compacta și pars reticulata ), cortexul prefrontal , cortex cingulat anterior , cortex insular , hipocamp , hipotalamus (în special, nucleul orexinergic din hipotalamusul lateral ), talamus (nuclei multipli), nucleu subtalamic , globus pallidus (atât extern cât și intern ), pallidum ventral , nucleu parabrahial , amigdala și restul amigdalei extinse . Dorsal nucleului liniei de unire și cerebelos par a modula unele forme de cunoaștere legate de recompensa ( de exemplu, învățarea asociativă , proeminenta motivațional , și emoțiile pozitive ) și comportamente, de asemenea. Laterodorsal tegumentului nucleu (LTD) , pedunculopontine nucleul (PPTg) și habenula lateral (LHB) (atât direct , cât și indirect , prin intermediul rostromedial tegmental nucleu ) sunt de asemenea capabile să inducă proeminenta aversiv și proeminenta stimulare prin proiecțiile lor către ventral tegmental zonă ( VTA). LDT și PPTg ambele trimit proiecții glutaminergice către VTA care sinapsează asupra neuronilor dopaminergici, ambele putând produce o evidență stimulativă. LHb trimite proiecții glutaminergice, dintre care majoritatea sinapsă asupra neuronilor GABAergic RMTg care, la rândul lor, determină inhibarea neuronilor dopaminergici VTA, deși unele proiecții LHb se termină pe interneuronii VTA. Aceste proiecții LHb sunt activate atât de stimuli aversivi, cât și de absența unei recompense așteptate, iar excitația LHb poate induce aversiune.
Majoritatea căilor dopaminei (de exemplu, neuronii care utilizează neurotransmițătorul dopamină pentru a comunica cu alți neuroni) care se proiectează în afara zonei tegmentale ventrale fac parte din sistemul de recompensă; în aceste căi, dopamina acționează asupra receptorilor asemănători D1 sau a receptorilor asemănători D2 pentru a stimula (asemănător D1) sau a inhiba (asemănător D2) producția de AMPc . The GABAergic neuroni mediu spinoase ale striatum sunt componente ale sistemului de recompense, de asemenea. Nucleii de proiecție glutamatergică din nucleul subtalamic, cortexul prefrontal, hipocampul, talamusul și amigdala se conectează la alte părți ale sistemului de recompensare prin căi de glutamat. Pachetul median de creier anterior , care este un set de multe căi neuronale care mediază recompensa de stimulare a creierului (adică recompensa derivată din stimularea electrochimică directă a hipotalamusului lateral ), este, de asemenea, o componentă a sistemului de recompensă.
Există două teorii în ceea ce privește activitatea nucleului accumbens și generației care îi place și vrea. Ipoteza inhibiției (sau hiperpolarizării) propune că nucleul accumbens exercită efecte inhibitoare tonice asupra structurilor din aval, cum ar fi palidul ventral, hipotalamusul sau zona tegmentală ventrală și că în inhibarea MSN din nucleul accumbens (NAcc), aceste structuri sunt excitate ". eliberarea „comportamentului legat de recompensă. În timp ce agoniștii receptorilor GABA sunt capabili să provoace atât reacții de „plăcere”, cât și „dorință” în nucleul accumbens, intrările glutaminergice din amigdala basolaterală , hipocampul ventral și cortexul prefrontal medial pot stimula evidența. Mai mult, în timp ce majoritatea studiilor constată că neuronii NAcc reduc declanșarea ca răspuns la recompensă, o serie de studii găsesc răspunsul opus. Acest lucru a condus la propunerea ipotezei dezinhibării (sau depolarizării), care propune că neuronii de excitație sau NAcc, sau cel puțin anumite subseturi, determină comportamentul legat de recompensă.
După aproape 50 de ani de cercetări privind recompensa de stimulare a creierului, experții au certificat că zeci de site-uri din creier vor menține auto-stimularea intracraniană . Regiunile includ hipotalamusul lateral și pachetele medievale de creier, care sunt deosebit de eficiente. Stimularea activează acolo fibre care formează căile ascendente; căile ascendente includ calea mezolimbică a dopaminei , care se proiectează din zona tegmentală ventrală către nucleul accumbens . Există mai multe explicații cu privire la motivul pentru care calea dopaminei mezolimbice este centrală în circuitele care mediază recompensa. În primul rând, există o creștere semnificativă a eliberării de dopamină din calea mezolimbică atunci când animalele se angajează în auto-stimulare intracraniană. În al doilea rând, experimentele indică în mod constant că recompensa de stimulare a creierului stimulează întărirea căilor care sunt în mod normal activate de recompense naturale , iar recompensa de droguri sau auto-stimulare intracraniană pot exercita o activare mai puternică a mecanismelor de recompensare centrală deoarece activează centrul de recompensă direct, mai degrabă decât prin a nervilor periferici . În al treilea rând, atunci când animalelor li se administrează droguri dependente sau se angajează în comportamente pline de satisfacții naturale, cum ar fi hrănirea sau activitatea sexuală, există o eliberare marcată de dopamină în nucleul accumbens. Cu toate acestea, dopamina nu este singurul compus de recompensă din creier.
Calea cheie
Zona tegmentală ventrală
- Zona tegmentală ventrală (VTA) este importantă în răspunsul la stimuli și indicii care indică prezența unei recompense. Stimulii recompensatori (și toate drogurile dependente) acționează asupra circuitului declanșând VTA pentru a elibera semnale de dopamină către nucleul accumbens , fie direct, fie indirect. VTA are două căi importante: calea mezolimbică care se proiectează către regiunile limbice (striatale) și care stă la baza comportamentelor și proceselor motivaționale, și calea mezocorticală care se proiectează spre cortexul prefrontal, care stă la baza funcțiilor cognitive, cum ar fi învățarea indicilor externi etc.
- Neuronii dopaminergici din această regiune transformă aminoacizii tirozină în DOPA folosind enzima tirozin hidroxilază , care este apoi convertită în dopamină utilizând enzima dopa-decarboxilază .
Striat (Nucleus Accumbens)
- Striatul este implicat în general în dobândirea și obținerea comportamentelor învățate ca răspuns la un indiciu plin de satisfacții. VTA se proiectează către striat și activează neuronii spini medii GABA-ergici prin receptorii D1 și D2 din striatul ventral (Nucleus Accumbens) și dorsal.
- Ventrală corpii striați (nucleus accumbens) este implicată în linii mari în achiziționarea de comportament atunci când alimentat în de VTA și suscita un comportament când alimentat în de PFC. Coaja NAc se proiectează către palid și VTA, reglând funcțiile limbice și autonome. Aceasta modulează proprietățile de întărire ale stimulilor și aspectele recompensei pe termen scurt. Nucleul NAc se proiectează către substanța neagră și este implicat în dezvoltarea comportamentelor de căutare a recompensei și exprimarea acestuia. Este implicat în învățarea spațială, răspunsul condiționat și alegerea impulsivă; elementele de recompensă pe termen lung.
- Striatul dorsal este implicat în învățare, striatul medial dorsal în învățarea direcționată către obiective și striatul lateral dorsal în învățarea stimul-răspuns fundamentale ale răspunsului pavlovian. La activarea repetată de către stimuli, nucleul Accumbens poate activa striatul dorsal printr-o buclă intrastriatală. Trecerea semnalelor de la NAc la DS permite indicii asociate recompensei pentru a activa DS fără ca recompensa în sine să fie prezentă. Acest lucru poate activa pofta și comportamentele de căutare a recompensei (și este responsabil pentru declanșarea recăderii în timpul abstinenței în dependență).
Cortexul frontal
- Neuronii dopaminergici VTA se proiectează către PFC, activând neuronii glutaminergici care se proiectează către mai multe alte regiuni, inclusiv striatul dorsal și NAc, permițând în cele din urmă PFC să medieze comportamentele saliente și condiționate ca răspuns la stimuli.
- În special, abstinența de la dependența de droguri activează PFC, proiecția glutamatergică către NAc, ceea ce duce la pofte puternice și modulează reintegrarea comportamentelor de dependență rezultate din abstinență. PFC interacționează, de asemenea, cu VTA prin calea mezocorticală și ajută la asocierea indicilor de mediu cu recompensa.
Hipocamp
- Hipocampul are mai multe funcții, inclusiv în crearea și stocarea amintirilor. În circuitul de recompensă, servește la amintiri contextuale și indicii asociate. În cele din urmă, se sprijină restabilirea comportamentelor de căutare a recompensei prin indicii și declanșatoare contextuale.
Amigdala
- AMY primește intrări de la VTA și iese la NAc. Amigdala este importantă în crearea unor amintiri emoționale puternice , și probabil stă la baza creării unor amintiri puternice asociate tacului. De asemenea, este important în medierea efectelor de anxietate ale sevrajului și a consumului crescut de droguri în dependență.
Centre de plăcere
Plăcerea este o componentă a recompensei, dar nu toate recompensele sunt plăcute (de exemplu, banii nu provoacă plăcere decât dacă acest răspuns este condiționat). Stimulii care sunt plăcuți în mod natural și, prin urmare, atrăgători, sunt cunoscuți sub numele de recompense intrinseci , în timp ce stimulii care sunt atrăgători și motivează comportamentul de abordare, dar nu sunt în mod inerent plăcuți, sunt numiți recompense extrinseci . Recompensele extrinseci (de exemplu, banii) sunt satisfăcătoare ca urmare a unei asociații învățate cu o recompensă intrinsecă. Cu alte cuvinte, recompensele extrinseci funcționează ca niște magneți motivaționali care provoacă reacții „doritoare”, dar nu „plăcute” odată ce au fost dobândite.
Sistemul de recompensă conține centre de plăcere sau puncte fierbinți hedonice - adică structuri cerebrale care mediază plăcere sau reacții de „plăcere” din recompense intrinseci. Începând cu octombrie 2017, punctele fierbinți hedonice au fost identificate în subcompartimente din coaja nucleului accumbens , palidul ventral , nucleul parabrahial , cortexul orbitofrontal (OFC) și cortexul insular . Punctul fierbinte din coaja nucleului accumbens este situat în cadranul rostrodorsal al învelișului medial, în timp ce punctul rece hedonic este situat într-o regiune mai posterioară. Palidul ventral posterior conține, de asemenea, un punct fierbinte hedonic, în timp ce palidul ventral anterior conține un punct rece hedonic. Microinjecțiile de opioide , endocannabinoizi și orexină sunt capabile să sporească gustul în aceste puncte fierbinți. Punctele fierbinți hedonice situate în OFC anterioară și insulă posterioară s-au demonstrat că răspund la orexină și opioide, la fel ca pata rece hedonică suprapusă în insulă anterioară și OFC posterioară. Pe de altă parte, sa demonstrat că hotspotul nucleului parabrahial răspunde la agoniștii receptorilor benzodiazepinici.
Hotspoturile hedonice sunt legate funcțional, deoarece activarea unui hotspot are ca rezultat recrutarea celorlalte, așa cum este indicat de expresia indusă a c-Fos , o genă imediată timpurie . În plus, inhibarea unui hotspot are ca rezultat diminuarea efectelor activării unui alt hotspot. Prin urmare, activarea simultană a fiecărui hotspot hedonic din cadrul sistemului de recompensă este considerată necesară pentru a genera senzația unei euforii intense .
Dorind și plăcând

Evidențierea stimulativă este atributul „dorință” sau „dorință”, care include o componentă motivațională, care este atribuită unui stimul plin de satisfacție de către coaja nucleului accumbens (coaja NAcc). Gradul de neurotransmisie a dopaminei în învelișul NAcc din calea mezolimbică este puternic corelat cu magnitudinea nivelului de stimulare pentru stimuli recompensați.
Activarea regiunii dorsorostrale a nucleului accumbens se corelează cu creșterea dorinței fără creșteri concomitente ale gustului. Cu toate acestea, neurotransmisia dopaminergică în cochilia nucleului accumbens este responsabilă nu numai pentru apariția motivațională apetitivă (adică, evidența stimulativă) față de stimuli recompensați, ci și pentru evidența motivațională aversivă, care direcționează comportamentul departe de stimulii nedoriti. În striatul dorsal, activarea MSN-urilor care exprimă D1 produce o apariție stimulativă apetisivă, în timp ce activarea MSN-urilor care exprimă D2 produce aversiune. În NAcc, o astfel de dihotomie nu este la fel de clară și activarea MSN-urilor D1 și D2 este suficientă pentru a spori motivația, probabil prin dezinhibarea VTA prin inhibarea palidului ventral.
Teoria de stimulare-sensibilizare a lui Robinson și Berridge din 1993 propunea că recompensa conține componente psihologice separabile: dorința (stimulent) și plăcerea (plăcerea). Pentru a explica creșterea contactului cu un anumit stimul, cum ar fi ciocolata, există doi factori independenți la locul de muncă - dorința noastră de a avea ciocolată (dorind) și efectul de plăcere al ciocolatei (plăcere). Potrivit lui Robinson și Berridge, dorința și plăcerea sunt două aspecte ale aceluiași proces, astfel încât recompensele sunt de obicei dorite și plăcute în același grad. Cu toate acestea, dorința și plăcerea se schimbă, de asemenea, independent, în anumite circumstanțe. De exemplu, șobolanii care nu mănâncă după ce au primit dopamină (se confruntă cu o pierdere a dorinței de hrană) acționează ca și când le-ar plăcea în continuare mâncarea. Într-un alt exemplu, electrozii activi de auto-stimulare din hipotalamusul lateral al șobolanilor cresc apetitul, dar provoacă și mai multe reacții adverse la gusturi precum zahărul și sarea; aparent, stimularea crește dorind, dar neplăcând. Astfel de rezultate demonstrează că sistemul de recompensare al șobolanilor include procese independente de dorință și plăcere. Componenta dorită este considerată a fi controlată de căile dopaminergice , în timp ce componenta plăcută este considerată a fi controlată de sistemele de opiacee-benzodiazepine.
Sistem anti-recompensă
Koobs și Le Moal au propus că există un circuit separat responsabil pentru atenuarea comportamentului de urmărire a recompenselor, pe care l-au numit circuitul anti-recompensă. Această componentă acționează ca frâne pe circuitul de recompensă, prevenind astfel căutarea excesivă a hranei, sexului etc. Acest circuit implică mai multe părți ale amigdalei (nucleul patului stria terminalis, nucleul central), nucleul Accumbens și semnalul molecule incluzând noradrenalina, factorul de eliberare a corticotropinei și dinorfina. Acest circuit este, de asemenea, ipotezat pentru a media componentele neplăcute ale stresului și, prin urmare, se crede că este implicat în dependență și retragere. În timp ce circuitul de recompensare mediază întărirea pozitivă inițială implicată în dezvoltarea dependenței, circuitul anti-recompensă care domină ulterior prin consolidare negativă este cel care motivează urmărirea stimulilor recompensatori.
Învăţare
Stimulii recompensatori pot conduce învățarea atât sub formă de condiționare clasică (condiționare pavloviană), cât și condiționare operantă (condiționare instrumentală) . În condiționarea clasică, o recompensă poate acționa ca un stimul necondiționat care, atunci când este asociat cu stimulul condiționat, determină stimulul condiționat să obțină atât răspunsuri musculo-scheletice (sub formă de abordări simple și comportamente de evitare), cât și răspunsuri vegetative. În condiționarea operantă, o recompensă poate acționa ca un întăritor prin faptul că crește sau susține acțiunile care duc la ea însăși. Comportamentele învățate pot fi sau nu sensibile la valoarea rezultatelor la care conduc; comportamentele care sunt sensibile la contingența unui rezultat asupra efectuării unei acțiuni, precum și la valoarea rezultatului sunt orientate spre obiectiv , în timp ce acțiunile susținute care sunt insensibile la contingență sau valoare sunt numite obiceiuri . Se consideră că această distincție reflectă două forme de învățare, model liber și bazat pe model. Învățarea gratuită a modelului implică simpla stocare în cache și actualizarea valorilor. În schimb, învățarea bazată pe model implică stocarea și construirea unui model intern de evenimente care permite inferență și predicție flexibilă. Deși condiționarea pavloviană este, în general, presupusă a fi lipsită de model, evidențierea stimulentelor atribuite unui stimul condiționat este flexibilă în ceea ce privește schimbările din stările motivaționale interne.
Sistemele neuronale distincte sunt responsabile pentru asocierea învățării dintre stimuli și rezultate, acțiuni și rezultate, și stimuli și răspunsuri. Deși condiționarea clasică nu se limitează la sistemul de recompensare, îmbunătățirea performanței instrumentale prin stimuli (de exemplu, transferul pavlovian-instrumental ) necesită nucleul accumbens. Învățarea instrumentală obișnuită și orientată spre obiectiv depinde de striatul lateral și respectiv de striatul medial.
În timpul învățării instrumentale, opuse schimbărilor în raportul dintre AMPA pentru NMDA receptorii și fosforilate ERK are loc în D 1 tip și D 2 tip care constituie MSN - uri cai directe și indirecte , respectiv. Aceste schimbări în plasticitatea sinaptică și învățarea însoțitoare depind de activarea receptorilor striatali D1 și NMDA. Cascada intracelulară activată de receptorii D1 implică recrutarea protein kinazei A și prin fosforilarea rezultată a DARPP-32 , inhibarea fosfatazelor care dezactivează ERK. Receptorii NMDA activează ERK printr-o cale diferită, dar interdependentă, Ras-Raf-MEK-ERK . Activarea ERK mediată de NMDA singură este autolimitată, deoarece activarea NMDA inhibă, de asemenea, inhibarea mediată de PKA a fosfatazelor dezactivând ERK. Cu toate acestea, atunci când cascadele D1 și NMDA sunt co-activate, acestea funcționează sinergic, iar activarea rezultată a ERK reglează plasticitatea sinaptică sub formă de restructurare a coloanei vertebrale, transportul receptorilor AMPA, reglarea CREB și creșterea excitabilității celulare prin inhibarea Kv4.2
Tulburări
Dependență
ΔFosB (DeltaFosB) - un factor de transcripție a genei - supraexpresia in tip D1 neuronii mediu spinoase ale nucleului accumbens este crucială factor comun între practic toate formele de dependență ( de exemplu, dependențe comportamentale si dependenta de droguri ) pe care un comportament induce dependenta-legate și plasticitatea neuronală . În special, osFosB promovează autoadministrarea , recompensează sensibilizarea și recompensează efectele de sensibilizare încrucișată în rândul drogurilor și comportamentelor dependente specifice. Anumite modificări epigenetice ale cozilor de proteine histonice (adică modificări histonice) în regiuni specifice ale creierului sunt, de asemenea, cunoscute că joacă un rol crucial în baza moleculară a dependențelor .
Drogurile și comportamentele dependente sunt satisfăcătoare și consolidante (adică sunt dependente ) datorită efectelor lor asupra căii de recompensare a dopaminei .
Hipotalamusul lateral și fasciculul frontal medial a fost cel mai frecvent- a studiat site - creier-stimulare recompensa, în special în studiile privind efectele medicamentelor asupra recompensa stimularea creierului. Sistemul neurotransmițător care a fost cel mai clar identificat cu acțiunile de formare a obiceiurilor de droguri de abuz este sistemul de dopamină mezolimbică, cu țintele sale eferente în nucleul accumbens și aferentele sale locale GABAergic . Acțiunile relevante pentru recompensă ale amfetaminei și cocainei se află în sinapsele dopaminergice ale nucleului accumbens și poate în cortexul prefrontal medial . Șobolanii învață, de asemenea, să apese pârghia pentru injecții de cocaină în cortexul prefrontal medial, care funcționează prin creșterea volumului de dopamină în nucleul accumbens. Nicotina infuzată direct în nucleul accumbens îmbunătățește, de asemenea, eliberarea locală de dopamină, probabil printr-o acțiune presinaptică asupra terminalelor dopaminergice din această regiune. Receptorii nicotinici se localizează în corpurile celulelor dopaminergice, iar injecțiile locale de nicotină cresc focul de celule dopaminergice, care este esențial pentru recompensa nicotinică. Unele medicamente suplimentare care formează obișnuințe sunt, de asemenea, susceptibile de a reduce producția de neuroni spini medii ca o consecință, în ciuda activării proiecțiilor dopaminergice. Pentru opiacee, cel mai mic prag al efectului recompensei implică acțiuni asupra neuronilor GABAergici din zona tegmentală ventrală , un site secundar al acțiunilor recompensatoare de opiacee asupra neuronilor cu ieșire spinoasă medie a nucleului accumbens. Astfel, următoarele formează nucleul circuitelor de recompensare a medicamentelor caracterizate în prezent; GABAergic Aferentele la neuronii dopaminergici mezolimbic (substrat primar al recompensa opiacee), neuronii dopaminergici mezolimbic înșiși (substrat primar al psihomotorii stimulent recompensa) si efferents GABAergic neuronilor dopaminergici mezolimbic (un site - ul secundar de recompensa opiacee).
Motivație
Evidența motivațională disfuncțională apare într-o serie de simptome și tulburări psihiatrice. Anhedonia , definită în mod tradițional ca o capacitate redusă de a simți plăcerea, a fost reexaminată ca reflectând o evidență a stimulentului tăiată, deoarece majoritatea populațiilor anedonice prezintă „plăcere” intactă. La celălalt capăt al spectrului, intensitatea sporită a stimulentului, care este restrânsă pentru stimuli specifici, este caracteristică dependențelor comportamentale și de droguri. În cazul fricii sau paranoiei, disfuncția poate sta într-o stare de evidență aversivă crescută .
Studiile de neuroimagistică în diagnosticele asociate cu anhedonia au raportat o activitate redusă în OFC și în striatul ventral. O metaanaliză a raportat că anhedonia a fost asociată cu un răspuns neuronal redus pentru a recompensa anticiparea în nucleul caudat, putamen, nucleul accumbens și cortexul prefrontal medial (mPFC).
Tulburări de dispoziție
Anumite tipuri de depresie sunt asociate cu o motivație redusă, după cum se evaluează prin disponibilitatea de a cheltui eforturi pentru recompensă. Aceste anomalii au fost provizoriu legate de activitatea redusă în zonele striatului și, în timp ce se presupune că anomaliile dopaminergice joacă un rol, majoritatea studiilor care testează funcția dopaminei în depresie au raportat rezultate inconsistente. Deși studiile postmortem și neuroimagistică au găsit anomalii în numeroase regiuni ale sistemului de recompensă, puține constatări sunt reproduse în mod constant. Unele studii au raportat reducerea activității NAcc, hipocampului, cortexului prefrontal medial (mPFC) și a cortexului orbitofrontal (OFC), precum și a activității crescute a amigdalei basolaterale și a cortexului cingulat subgenual (sgACC) în timpul sarcinilor legate de recompensă sau stimuli pozitivi. Aceste anomalii de neuroimagistică sunt completate de puțină cercetare post mortem, dar ceea ce puține cercetări au fost făcute sugerează reducerea sinapselor excitatorii în mPFC. Activitatea redusă în mPFC în timpul sarcinilor legate de recompensă pare a fi localizată în mai multe regiuni dorsale (adică cortexul cingulat pregenual ), în timp ce sgACC mai ventral este hiperactiv în depresie.
Încercările de a investiga circuitele neuronale subiacente la modelele animale au dat, de asemenea, rezultate contradictorii. Două paradigme sunt utilizate în mod obișnuit pentru a simula depresia, înfrângerea socială cronică (CSDS) și stresul cronic ușor (CMS), deși există multe. CSDS produce o preferință redusă pentru zaharoză, interacțiuni sociale reduse și imobilitate crescută în testul de înot forțat. CMS reduce în mod similar preferința zaharozei și disperarea comportamentală, astfel cum a fost evaluată prin suspensia cozii și testele de înot forțat. Animalele susceptibile la CSDS prezintă o tragere VTA fazică crescută, iar inhibarea proiecțiilor VTA-NAcc atenuează deficiențele comportamentale induse de CSDS. Cu toate acestea, inhibarea VTA- mPFC proiecțiilor exacerbează de retragere socială. Pe de altă parte, reducerile asociate CMS ale preferinței zaharozei și imobilității au fost atenuate și exacerbate de excitația și respectiv inhibarea VTA. Deși aceste diferențe pot fi atribuite unor protocoale de stimulare diferite sau unor paradigme tradiționale slabe, rezultatele variabile se pot afla și în funcționalitatea heterogenă a regiunilor legate de recompensă.
Stimularea optogenetică a mPFC în ansamblu produce efecte antidepresive. Acest efect apare localizat la omologul rozătoarelor pgACC (cortexul prelimbic), deoarece stimularea omologului rozătoarelor sgACC (cortexul infralimbic) nu produce efecte comportamentale. Mai mult, stimularea creierului profund în cortexul infralimbic, despre care se crede că are un efect inhibitor, produce și un efect antidepresiv. Această constatare este congruentă cu observația că inhibarea farmacologică a cortexului infralimbic atenuează comportamentele depresive.
Schizofrenie
Schizofrenia este asociată cu deficite de motivație, grupate în mod obișnuit sub alte simptome negative, cum ar fi vorbirea spontană redusă . Experiența „plăcerii” este raportată frecvent ca fiind intactă, atât din punct de vedere comportamental, cât și neuronal, deși rezultatele pot fi specifice anumitor stimuli, cum ar fi recompensele monetare. Mai mult, învățarea implicită și sarcinile simple legate de recompensă sunt, de asemenea, intacte în schizofrenie. Mai degrabă, deficitele din sistemul de recompensă sunt evidente în timpul sarcinilor legate de recompensă care sunt complexe din punct de vedere cognitiv. Aceste deficite sunt asociate atât cu activitatea anormală striatală, cât și cu activitatea OFC, precum și cu anomalii în regiunile asociate cu funcții cognitive, cum ar fi cortexul prefrontal dorsolateral (DLPFC).
Tulburare de hiperactivitate cu deficit de atenție
La cei cu ADHD , aspectele de bază ale sistemului de recompensă sunt subactive, ceea ce face dificilă obținerea recompensei din activități regulate. Cei cu tulburare experimentează un impuls de motivație după ce un comportament cu stimulare ridicată declanșează eliberarea de dopamină. În urma acelei creșteri și recompense, revenirea la nivelurile de bază are ca rezultat o scădere imediată a motivației.
Se spune că deficiențele funcției dopaminergice și serotoninergice sunt factori cheie în ADHD. Aceste deficiențe pot duce la disfuncții executive, cum ar fi nereglementarea procesării recompensei și disfuncție motivațională, inclusiv anedonie.
Istorie
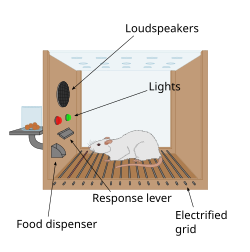
Primul indiciu al prezenței unui sistem de recompensă în creier a venit cu o descoperire accidentală de James Olds și Peter Milner în 1954. Au descoperit că șobolanii vor efectua comportamente precum apăsarea unei bare, pentru a administra o scurtă explozie de stimulare electrică la anumite site-urile din creierul lor. Acest fenomen se numește auto-stimulare intracraniană sau recompensă de stimulare a creierului . De obicei, șobolanii vor apăsa o pârghie de sute sau mii de ori pe oră pentru a obține această stimulare a creierului, oprindu-se doar când sunt epuizați. În timp ce încercați să învățați șobolanii cum să rezolve problemele și să facă labirinturi, stimularea anumitor regiuni ale creierului în care a fost găsită stimularea părea să dea plăcere animalelor. Au încercat același lucru cu oamenii și rezultatele au fost similare. Explicația pentru care animalele se angajează într-un comportament care nu are valoare pentru supraviețuirea lor sau a speciei lor este că stimularea creierului activează sistemul care stă la baza recompensei.
Într-o descoperire fundamentală făcută în 1954, cercetătorii James Olds și Peter Milner au descoperit că stimularea electrică de joasă tensiune a anumitor regiuni ale creierului șobolanului a acționat ca o recompensă în învățarea animalelor să ruleze labirinturi și să rezolve probleme. Se părea că stimularea acelor părți ale creierului le oferea animalelor plăcere și, în lucrările ulterioare, oamenii au raportat senzații plăcute de la o astfel de stimulare. Când șobolanii au fost testați în cutii Skinner unde puteau stimula sistemul de recompensare prin apăsarea unei pârghii, șobolanii au apăsat ore în șir. Cercetările din următoarele două decenii au stabilit că dopamina este una dintre principalele substanțe chimice care ajută la semnalizarea neuronală în aceste regiuni, iar dopamina a fost sugerată a fi „substanța chimică de plăcere” a creierului.
Ivan Pavlov a fost un psiholog care a folosit sistemul de recompense pentru a studia condiționarea clasică . Pavlov a folosit sistemul de recompensare recompensând câinii cu mâncare după ce au auzit un clopot sau un alt stimul. Pavlov recompensa câinii, astfel încât câinii să asocieze hrana, recompensa, cu clopotul, stimulul. Edward L. Thorndike a folosit sistemul de recompensă pentru a studia condiționarea operantă. El a început prin a pune pisicile într-o cutie de puzzle și a așezat mâncarea în afara cutiei, astfel încât pisica a vrut să scape. Pisicile au muncit pentru a ieși din cutia puzzle-ului pentru a ajunge la mâncare. Deși pisicile au mâncat mâncarea după ce au scăpat din cutie, Thorndike a aflat că pisicile au încercat să scape din cutie fără recompensa mâncării. Thorndike a folosit recompensele hranei și libertății pentru a stimula sistemul de recompensare al pisicilor. Thorndike a folosit acest lucru pentru a vedea cum pisicile au învățat să scape de cutie.
Alte specii
Animalele învață rapid să apese o bară pentru a obține o injecție de opiacee direct în tegmentul creierului mediu sau în nucleul accumbens . Aceleași animale nu funcționează pentru a obține opiacee dacă neuronii dopaminergici ai căii mezolimbice sunt inactivați. În această perspectivă, animalele, ca și oamenii, se angajează în comportamente care sporesc eliberarea de dopamină.
Kent Berridge , un cercetator in afective Neuroscience , a constatat că dulce ( plăcut ) și amare ( placuti ) gusturi produse distincte expresii orofacial , iar aceste expresii au fost expuse în mod similar de nou - nascuti umane, urangutani și șobolani. Aceasta a fost o dovadă că plăcerea (în mod specific, plăcerea ) are trăsături obiective și a fost în esență aceeași în diferite specii de animale. Majoritatea studiilor de neuroștiințe au arătat că, cu cât este mai multă dopamină eliberată de recompensă, cu atât este mai eficientă recompensa. Aceasta se numește impact hedonic, care poate fi schimbat prin efortul pentru recompensă și recompensa în sine. Berridge a descoperit că blocarea sistemelor de dopamină nu pare să schimbe reacția pozitivă la ceva dulce (măsurat prin expresia feței). Cu alte cuvinte, impactul hedonic nu s-a modificat pe baza cantității de zahăr. Acest lucru a redus ipoteza convențională conform căreia dopamina mediază plăcerea. Chiar și cu modificări mai intense ale dopaminei, datele păreau să rămână constante. Cu toate acestea, un studiu clinic din ianuarie 2019 care a evaluat efectul unui precursor al dopaminei ( levodopa ), al antagonistului ( risperidonă ) și al unui placebo privind răspunsurile la recompense la muzică - inclusiv gradul de plăcere experimentat în timpul frisoanelor muzicale , măsurat prin modificări ale electrodermului activitate , precum și evaluări subiective - a constatat că manipularea neurotransmisiei dopaminei reglează bidirecțional cunoașterea plăcerii (în mod specific, impactul hedonic al muzicii ) la subiecții umani. Această cercetare a demonstrat că neurotransmiterea crescută a dopaminei acționează ca o condiție sine qua non pentru reacții hedonice plăcute la muzică la oameni.
Berridge a dezvoltat ipoteza de evidență a stimulentelor pentru a aborda aspectul dorit al recompenselor. Acesta explică utilizarea compulsivă a drogurilor de către dependenții de droguri chiar și atunci când medicamentul nu mai produce euforie și pofta experimentată chiar și după ce individul a terminat retragerea. Unii dependenți răspund la anumiți stimuli care implică modificări neuronale cauzate de droguri. Aceasta sensibilizare in creier este similar cu efectul dopaminei , deoarece doresc și simpatie apar reacții. Creierele și comportamentele umane și animale experimentează schimbări similare în ceea ce privește sistemele de recompensă, deoarece aceste sisteme sunt atât de proeminente.
Vezi si
Referințe
- Tânăr, Jared W .; Anticevic, Alan; Barch, Deanna M. (2018). „Neuroștiința cognitivă și motivațională a tulburărilor psihotice”. În Charney, Dennis S .; Sklar, Pamela; Buxbaum, Joseph D .; Nestler, Eric J. (eds.). Neurobiologia bolilor mentale a lui Charney și Nestler (ediția a 5-a). New York: Oxford University Press. ISBN 9780190681425.
linkuri externe
- Brain Reward Pathways - o descriere a sistemului de recompensă publicată de Laboratorul Nestler , Departamentul de Neuroștiințe, Școala de Medicină Icahn
- Recompensă Scholarpedia
- Semnale de recompensă Scholarpedia