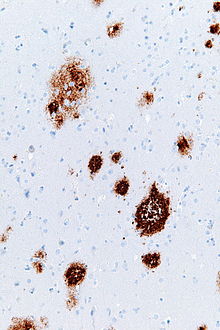
Plăci amiloide - Amyloid plaques
Plăci amiloide ( de asemenea , cunoscut sub numele de plăci nevritice , plăcile de Ap sau plăci senile ) sunt extracelulare depozite ale beta - amiloid (Ap) , proteina principal în materia cenușie a creierului. Elementele neuronale degenerative și abundența microgliei și astrocitelor pot fi asociate cu plăcile amiloide. Unele plăci apar în creier ca urmare a senescenței (îmbătrânirii), dar un număr mare de plăci și încurcături neurofibrilare sunt trăsături caracteristice bolii Alzheimer . Neuritele anormale din plăcile amiloide sunt axonii și dendritele întortocheate, adesea umflate . Neriții conțin o varietate de organite și resturi celulare, iar multe dintre ele includ filamente elicoidale pereche caracteristice , componenta ultrastructurală a încurcăturilor neurofibrilare. Plăcile sunt foarte variabile ca formă și dimensiune; în secțiunile de țesut imunocurat pentru Aβ, acestea cuprind o curbă de distribuție a dimensiunii log-normale cu o suprafață medie a plăcii de 400-450 micrometri pătrați (µm²). Cele mai mici plăci (mai puțin de 200 µm²), care constau deseori din depozite difuze de Aβ, sunt deosebit de numeroase. Dimensiunea aparentă a plăcilor este influențată de tipul de pată utilizat pentru a le detecta și de planul prin care sunt secționate pentru analiză la microscop. Plăcile se formează atunci când Aβ se pliază greșit și se agregă în oligomeri și polimeri mai lungi , dintre care aceștia sunt caracteristici amiloidului . Aβ pliat greșit și agregat este considerat a fi neurotoxic , în special în starea sa oligomerică.
Istorie
În 1892 Paul Blocq și Gheorghe Marinescu au descris pentru prima dată prezența plăcilor în substanța cenușie. Aceștia s-au referit la plăci drept „noduli ai sclerozei neurogliale”. În 1898, Emil Redlich a raportat plăci la trei pacienți, dintre care doi au verificat clinic demența . Redlich a folosit termenul „scleroză miliară” pentru a descrie plăcile, deoarece el credea că seamănă cu semințele de mei și el a fost primul care s-a referit la leziuni ca „plăci”. La începutul secolului al XX-lea, Oskar Fischer a remarcat asemănarea lor cu actinomyces „Drusen” (leziuni asemănătoare geodei), determinându-l să numească procesul degenerativ „drusige Nekrose”. Alois Alzheimer este adesea creditat cu prima legare a plăcilor de demență într-o prezentare din 1906 (publicată în 1907), dar acest scurt raport s-a axat în principal pe încurcăturile neurofibrilare, iar plăcile au fost menționate doar pe scurt. Prima descriere de fond a plăcilor Alzheimer a apărut în 1911. În schimb, Oskar Fischer a publicat o serie de investigații cuprinzătoare ale plăcilor și demenței în 1907, 1910 și 1912. Până în 1911 Max Bielschowsky a propus natura amiloidă a depozitelor de plăci. Acest lucru a fost confirmat ulterior de Paul Divry, care a arătat că plăcile care sunt colorate cu colorantul roșu Congo prezintă proprietatea optică a birefringenței , care este caracteristică amiloidelor în general. În 1911, Teofil Simchowicz a introdus termenul „plăci senile” pentru a denota prezența lor frecventă în creierul persoanelor în vârstă. În 1968, o analiză cantitativă a lui Gary Blessed, Bernard Tomlinson și Martin Roth a confirmat asocierea plăcilor senile cu demența . Henryk Wisniewski și Robert Terry au inventat termenul „plăci neuritice” în 1973 pentru a desemna plăci care includ procese neuronale anormale (neurite). Un avans important în 1984 și 1985 a fost identificarea Aβ ca proteină care formează nucleele plăcilor. Această descoperire a condus la generarea de noi instrumente pentru studierea plăcilor, în special a anticorpilor împotriva Aβ, și a prezentat o țintă moleculară pentru dezvoltarea unor terapii potențiale pentru boala Alzheimer. Cunoașterea de aminoacizi secvența de Ap , de asemenea , a permis oamenilor de știință să descopere mutatii genetice care cauzeaza autosomal dominanta a bolii Alzheimer, toate care cresc probabilitatea ca Ap va cumula în creier.
Generația de beta amiloid
Amiloidul beta (Aβ) este o proteină mică, de cel mai adesea 40 sau 42 de aminoacizi în lungime, care este eliberată dintr-o proteină mamă mai lungă numită proteina precursor Aβ (APP). APP este produs de multe tipuri de celule din corp, dar este deosebit de abundent în neuroni . Este o proteină transmembranară cu o singură trecere , adică trece o dată prin membranele celulare . Segmentul Aβ al APP este parțial în membrană și parțial în afara membranei. Pentru a elibera Aβ, APP este scindată secvențial de două enzime : în primul rând, de beta secretază (sau enzimă de scindare β-amiloidă (BACE)) în afara membranei și, în al doilea rând, de gamma secretază (γ-secretază), un complex enzimatic din membrană . Acțiunile secvențiale ale acestor secretaze au ca rezultat fragmente de proteine Aβ care sunt eliberate în spațiul extracelular Descărcarea de Aβ este crescută de activitatea sinapselor . În plus față de peptidele Aβ care au 40 sau 42 de aminoacizi, se generează și câteva fragmente Aβ mai puțin abundente. Aβ poate fi modificat chimic în diferite moduri, iar lungimea proteinelor și modificările chimice pot influența atât tendința sa de agregare, cât și toxicitatea acesteia.
Identificare

Plăcile amiloide sunt vizibile cu microscopul cu lumină folosind o varietate de tehnici de colorare, inclusiv pete de argint , roșu Congo , tioflavină , violet crezil , reacție PAS și oligotiofeni luminescenți conjugați (LCO). Aceste metode adesea colorează diferite componente ale plăcilor și variază în sensibilitatea lor Plăcile pot fi, de asemenea, vizualizate imunohistochimic cu anticorpi direcționați împotriva Aβ sau a altor componente ale leziunilor. Petele imunohistochimice sunt utile în special, deoarece sunt sensibile și specifice pentru antigenele asociate plăcilor.
Compoziţie
Depozitele Aβ care cuprind plăci amiloide sunt variabile ca mărime și aspect. La microscopul cu lumină, acestea variază de la acumulări mici, ciudate, care au câțiva microni în diametru, până la mase mult mai mari, dense sau difuze. Așa-numitele „plăci clasice” constau dintr-un miez compact Aβ-amiloid care este înconjurat de o coroană de Aβ oarecum mai puțin densă. Plăcile clasice includ, de asemenea, procese neuronale anormale, umflate ( neurite ) care provin din mai multe tipuri diferite de neuroni, împreună cu astrocite și microglie activate . Neuritele anormale și celulele gliale activate nu sunt tipice pentru majoritatea plăcilor difuze și s-a sugerat că depozitele difuze sunt un stadiu incipient în dezvoltarea plăcilor.
Distribuția anatomică
Dietmar Thal și colegii săi au propus o secvență de etape de formare a plăcii în creierul pacienților cu Alzheimer. În faza 1, plăcile apar în neocortex ; în faza 2, ele apar în alocortex , formațiunea hipocampală și amigdala ; în faza 3, ganglionii bazali și diencefalul sunt afectați; în faza 4, plăcile apar în creierul central și medulla oblongată ; iar în faza 5, ele apar în pons și cerebel . Astfel, în stadiul final al bolii Alzheimer, plăcile pot fi găsite în majoritatea părților creierului. Sunt mai puțin frecvente în măduva spinării .
Formare și răspândire
Funcția normală a Aβ nu este sigură, dar plăcile apar atunci când proteina se pliază greșit și începe să se acumuleze în creier printr-un proces de modelare moleculară („însămânțare”). Mathias Jucker și Lary Walker au comparat acest proces cu formarea și răspândirea prionilor în boli cunoscute sub numele de encefalopatii spongiforme sau boli prionice . Conform paradigmei prionice, anumite proteine se pliază greșit în forme care sunt bogate în structura secundară a foii beta . În această stare, ele determină alte proteine de același tip să adopte aceeași structură anormală bogată în foaie beta. Proteinele pliate greșit se lipesc unele de altele, în cele din urmă stivuindu-se împreună pentru a forma oligomeri care se îmbină pentru a face fibrilele amiloide care sunt tipice plăcilor mature.
Implicarea în boli
Plăcile Aβ abundente, împreună cu încurcăturile neurofibrilare constând din proteine tau agregate , sunt cele două leziuni care sunt necesare pentru diagnosticul neuropatologic al bolii Alzheimer. Deși numărul de încurcături neurofibrilare se corelează mai puternic cu gradul de demență decât numărul de plăci, descoperirile genetice și patologice indică faptul că Aβ joacă un rol central în riscul, debutul și progresia bolii Alzheimer. O deosebită importanță este specia mai lungă (42 aminoacizi) de Aβ cunoscută sub numele de Aβ42. Nivelurile crescute de Aβ, precum și o creștere a raportului de Aβ42 la forma de 40-aminoacizi (Aβ40), sunt evenimente timpurii importante în patogeneza bolii Alzheimer.
Până de curând, diagnosticul bolii Alzheimer necesita o analiză microscopică a plăcilor și a încurcăturilor din țesutul cerebral, de obicei la autopsie. Cu toate acestea, plăcile Aβ (împreună cu angiopatia Aβ-amiloidă cerebrală ) pot fi acum detectate în creierul subiecților vii. Acest lucru se realizează prin pregătirea agenților radio-marcați care se leagă selectiv de depozitele de Aβ din creier după ce au fost perfuzate în fluxul sanguin. De liganzi traversează bariera hematoencefalică și atașați la agregate pA și păstrarea acestora în creier este evaluată prin tomografie cu emisie de pozitroni (PET). În plus, prezența plăcilor și a încurcăturilor poate fi estimată prin măsurarea cantităților de proteine Aβ și tau în lichidul cefalorahidian .
Apariție
Probabilitatea de a avea plăci în creier crește odată cu înaintarea în vârstă. De la vârsta de 60 de ani (10%) până la vârsta de 80 de ani (60%), proporția persoanelor cu plăci senile crește liniar. Femeile sunt puțin mai susceptibile de a avea plăci decât bărbații. Ambele plăci și boala Alzheimer sunt, de asemenea, mai frecvente la persoanele în vârstă cu trisomie -21 ( sindrom Down ). Se crede că acest lucru rezultă din producția în exces de Aβ, deoarece gena APP se află pe cromozomul 21, care există ca trei copii în sindromul Down.
Plăcile amiloide apar în mod natural în creierul îmbătrânit al speciilor neumane, de la păsări la maimuțe mari. La primatele neumane, care sunt cele mai apropiate rude biologice ale oamenilor, au fost găsite plăci la toate speciile examinate până acum. Încurcăturile neurofibrilare sunt rare, totuși și nu s-a dovedit că nicio specie neumană are demență împreună cu neuropatologia completă a bolii Alzheimer.
Cercetare
Cercetările au fost direcționate către înțelegerea caracteristicilor biochimice , citologice și inflamatorii ale plăcilor, determinarea modului în care plăcile apar și proliferează în creier, identificarea factorilor de risc genetici și de mediu, descoperirea metodelor de detectare a acestora în creierul viu și dezvoltarea de strategii terapeutice pentru prevenirea sau înlăturându-le. Cercetările privind formarea și proliferarea plăcilor de amiloid au fost accelerate de dezvoltarea modelelor de șoareci modificate genetic . În ciuda unor limitări, aceste modele au contribuit și la descoperirea de noi strategii terapeutice. De exemplu, o varietate tot mai mare de tratamente care reduc nivelurile de Aβ și numărul de plăci din creier au fost identificate cu ajutorul modelelor de rozătoare transgenice . Aceste strategii includ abordări imunoterapeutice și inhibitori ai secretazelor care eliberează Ap din APP. Astfel de tratamente sunt acum evaluate clinic pentru tratamentul bolii Alzheimer. Descoperirile de până acum indică faptul că îndepărtarea plăcilor la pacienții cu demență are un beneficiu redus, posibil pentru că creierul este grav afectat de momentul în care apar semnele și simptomele bolii Alzheimer. Formarea plăcii mediate de microglia poate fi de fapt benefică prin încapsularea Aβ în miezuri de plăci dense. Din acest motiv, mulți cercetători consideră că este necesară inhibarea mai timpurie a agregării Aβ și formarea plăcii pentru a încetini sau preveni tauopatia și demența bolii Alzheimer. Alte cercetări sunt direcționate spre înțelegerea inflamației care este adesea asociată cu plăcile sau identificarea factorilor de risc de mediu, fiziologici și genetici pentru formarea plăcii și a bolii Alzheimer.
Vezi si
Referințe
- ^ a b Cras P; Kawai M; Lowery D; Gonzalez-DeWhitt P; Greenberg B; Perry G (septembrie 1991). „Neviții plăcii senile din boala Alzheimer acumulează proteine precursoare amiloide” . Lucrările Academiei Naționale de Științe din Statele Unite ale Americii . 88 (17): 7552-6. Cod Bib : 1991PNAS ... 88.7552C . doi : 10.1073 / pnas.88.17.7552 . PMC 52339 . PMID 1652752 .
- ^ Purves, Dale; Augustin, George J .; Fitzpatrick, David; Hall, William C .; LaManita, Anthony-Samuel; White, Leonard E .; Mooney, Richard D .; Platt, Michael L. (2012). Neuroștiințe (ed. A V-a). Sunderland, MA: Sinauer Associates. p. 713. ISBN 978-0-87893-695-3.
- ^ a b c d Dickson DW (1997). „Patogeneza plăcilor senile” . J Neuropathol Exp Neurol . 56 (4): 321–339. doi : 10.1097 / 00005072-199704000-00001 . PMID 9100663 .
- ^ a b c d e f g h i j k l m n o Walker LC (2020). „Plăci Aβ” . Neuropatologie gratuită . 1 (31): 31. doi : 10.17879 / freeneuropathology-2020-3025 . PMC 7745791 . PMID 33345256 .
- ^ Ballard, C; Gauthier, S; Corbett, A; Brayne, C; Aarsland, D; Jones, E (19 martie 2011). "Boala Alzheimer". Lancet . 377 (9770): 1019–31. doi : 10.1016 / S0140-6736 (10) 61349-9 . PMID 21371747 . S2CID 20893019 .
- ^ Hyman BT; West HL; Rebeck GW; Buldyrev SV; Mantegna RN; Ukleja M; Havlin S; Stanley HE (1995). "Analiza cantitativă a plăcilor senile în boala Alzheimer: observarea distribuției mărimii log-normale și a epidemiologiei moleculare a diferențelor asociate cu genotipul apolipoproteinei E și trisomiei 21 (sindromul Down)" . Lucrările Academiei Naționale de Științe din Statele Unite ale Americii . 92 (8): 3586–3590. Cod Bib : 1995PNAS ... 92.3586H . doi : 10.1073 / pnas.92.8.3586 . PMC 42212 . PMID 7724603 .
- ^ a b c Röhr D, Boon BD și colab. (Decembrie 2020). „Imagistica vibrațională fără etichete a diferitelor tipuri de plăci Aβ în boala Alzheimer relevă evenimente secvențiale în dezvoltarea plăcii” . Comunicări Acta Neuropathologica . 8 (1): 222. doi : 10.1186 / s40478-020-01091-5 . PMC 7733282 . PMID 33308303 .
- ^ Haass C; Selkoe DJ (2007). "Oligomerii de proteine solubile în neurodegenerare: lecții din beta-peptida amiloidă Alzheimer". Nat Rev Mol Cell Biol . 8 (2): 101-112. doi : 10.1038 / nrm2101 . PMID 17245412 . S2CID 32991755 .
- ^ Blocq, Paul; Marinesco, Georges (1892). Sur lesions and la pathogenie de l'epilepsie dite essentielle . pp. 445-6. OCLC 492619936 .
- ^ Buda O; Arsen D; Ceausu M; Dermengiu D; Curca GC (ianuarie 2009). „Georges Marinesco și cercetarea timpurie în neuropatologie”. Neurologie . 72 (1): 88-91. doi : 10.1212 / 01.wnl.0000338626.93425.74 . PMID 19122036 . S2CID 45428057 .
- ^ Redlich E (1898). "Ueber miliare Sklerose der Hirnrinde bei seniler Atrophie". Jahrbücher für Psychiatrie und Neurologie . 17 : 208–216.
- ^ a b c Goedert M (2009). „Oskar Fischer și studiul demenței” . Creier . 132 (4): 1102–1111. doi : 10.1093 / brain / awn256 . PMC 2668940 . PMID 18952676 .
- ^ Alzheimer, A (1907). „Uber einen eigenartige Erkranung der Hirnrinde”. Allgemeine Zeitschrift für Psychiatrie und Psychisch-Gerichtlich Medizin . 64 : 146-8.
- ^ Divry P (1927). „Etude histo-chimique des plaques séniles”. Journal Belge de Neurologie et de Psychiatrie . 9 : 643-657.
- ^ Buxbaum JN; Linke RP (2012). „O istorie moleculară a amiloidozelor”. Journal of Molecular Biology . 421 (2-3): 142-159. doi : 10.1016 / j.jmb.2012.01.024 . PMID 22321796 .
- ^ Simchowicz T .: Histologische Studien über die senile Demenz. în: Nissl F., Alzheimer A. (Hrsg.): Histologische und histopathologische Arbeiten über die Grosshirnrinde mit besonderer Berücksichtigung der pathologischen Anatomie der Geisteskrankheiten . Jena: G. Fischer, 1911, p. 267–444.
- ^ Ohry A; Buda O (2015). „Teofil Simchowicz (1879-1957): om de știință care a inventat plăci senile în neuropatologie”. Revista Română de Morfologie și Embriologie . 56 (4): 1545-1548. PMID 26743308 .
- ^ Grzybowski A; Pieta A; Pugaczewska M (2017). „Teofil Simchowicz (1879-1957)” . Journal of Neurology . 264 (8): 1831–1832. doi : 10.1007 / s00415-017-8460-9 . PMC 5533842 . PMID 28315959 .
- ^ Fericitul G; Tomlinson BE; Roth M (1968). "Asocierea dintre măsurile cantitative ale demenței și ale modificării senile în substanța cenușie cerebrală a subiecților vârstnici". British Journal of Psychiatry . 114 (512): 797-811. doi : 10.1192 / bjp.114.512.797 . PMID 5662937 .
- ^ Wisniewski, Henryk M .; Terry, Robert D. (1973). „Capitolul 1: Reexaminarea patogenezei plăcii senile”. În Zimmerman, HM (ed.). Progres în neuropatologie, volumul 2 . Grune și Stratton. pp. 1–26. ISBN 978-0-808-90775-6.
- ^ Glenner GG; Wong CW (1984). „Boala Alzheimer: raport inițial de purificare și caracterizare a unei noi proteine amiloide cerebrovasculare”. Comunicări de cercetare biochimică și biofizică . 120 (3): 885–890. doi : 10.1016 / s0006-291x (84) 80190-4 . PMID 6375662 .
- ^ Glenner GG; Wong CW (1984). „Boala Alzheimer și sindromul Down: împărtășirea unei proteine fibrilice amiloide cerebrovasculare unice”. Comunicări de cercetare biochimică și biofizică . 122 (3): 1131–1135. doi : 10.1016 / 0006-291x (84) 91209-9 . PMID 6236805 .
- ^ Masters CL; Simms G; Weinman NA; Multhaup G; McDonald BL; Beyreuther K (1985). "Proteina de bază a plăcii amiloide în boala Alzheimer și sindromul Down" . Proceedings of the National Academy of Sciences USA . 82 (12): 4245-4249. Cod Bib : 1985PNAS ... 82.4245M . doi : 10.1073 / pnas.82.12.4245 . PMC 397973 . PMID 3159021 .
- ^ a b c Walsh DM; Selkoe DJ (2020). "Beta-proteina amiloidă și nu numai: calea înainte în boala Alzheimer". Opinia curentă în Neurobiologie . 61 : 116–124. doi : 10.1016 / j.conb.2020.02.003 . PMID 32197217 . S2CID 214600892 .
- ^ a b c d e f Long JM; Holtzman DM (2019). "Boala Alzheimer: o actualizare privind patobiologia și strategiile de tratament" . Celula . 179 (2): 312–339. doi : 10.1016 / j.cell.2019.09.001 . PMC 6778042 . PMID 31564456 .
- ^ Walker LC (2015). „Tulpinile proteopatice și eterogenitatea bolilor neurodegenerative” . Revizuirea anuală a geneticii . 50 : 329-346. doi : 10.1146 / annurev-genet-120215-034943 . PMC 6690197 . PMID 27893962 .
- ^ Selkoe, DJ (1999). „Capitolul 19: Biologia proteinelor precursoare β-amiloide și mecanismul bolii Alzheimer”. În Terry, RD; Katzman, R; Bick, KL; Sisodia, SS (eds.). Boala Alzheimer . Lippincott Williams și Wilkins. pp. 293-310. ISBN 0-7817-1503-2.
- ^ a b c Haass C; Kaether C; Thinakaran G; Sisodia S (2012). "Traficul și prelucrarea proteolitică a APP" . Perspectivele Cold Spring Harbor în medicină . 2 (5: a006270): a006270. doi : 10.1101 / cshperspect.a006270 . PMC 3331683 . PMID 22553493 .
- ^ Suh YH; Checler F (septembrie 2002). "Proteina precursoare amiloidă, preseniline și alfa-sinucleină: patogenie moleculară și aplicații farmacologice în boala Alzheimer". Revizuiri farmacologice . 54 (3): 469-525. doi : 10.1124 / pr.54.3.469 . PMID 12223532 . S2CID 86686003 .
- ^ Dunys J; Valverde A; Checler F (2018). "Sunt N- și C-speciile Aβ trunchiate terminal cheie declanșatoare patologice în boala Alzheimer?" . Jurnalul de chimie biologică . 293 (40): 15419–15428. doi : 10.1074 / jbc.R118.003999 . PMC 6177599 . PMID 30143530 .
- ^ MP Kummer; Heneka MT (2014). „Specii beta-amiloide trunchiate și modificate” . Cercetare și terapie Alzheimer . 6 (3): 28. doi : 10.1186 / alzrt258 . PMC 4055046 . PMID 25031638 .
- ^ Lamy C, Duyckaerts C, Delaere P și colab. (1989). "Comparația a șapte metode de colorare pentru plăci senile și încurcături neurofibrilare într-o serie prospectivă de 15 pacienți vârstnici". Neuropatologie și neurobiologie aplicată . 15 (6): 563-78. doi : 10.1111 / j.1365-2990.1989.tb01255.x . PMID 2482455 . S2CID 25220224 .
- ^ Klingstedt T; Nilsson KPR (2012). "Poli- și oligo-tiofeni luminescenți conjugați: liganzi optici pentru atribuirea spectrală a unei multitudini de agregate proteice". Tranzacțiile societății biochimice . 40 (4): 704-710. doi : 10.1042 / BST20120009 . PMID 22817720 .
- ^ Mavrogiorgou P; Gertz HJ; Ferszt R; Lupul R; Bär KJ; Juckel G (decembrie 2011). Sunt metodele de rutina suficient de bune pentru a pata placi senile si incurcaturi neurofibrilare in diferite regiuni ale creierului pacientilor dementi? (PDF) . Psihiatria Danubina . 23 (4): 334-9. PMID 22075733 . Arhivat din original (PDF) la 11.08.2017 . Adus 22-06-2014 .
- ^ Braak H; Thal DR; Ghebremedhin E; Del Tredici K (2011). "Etapele procesului patologic în boala Alzheimer: categorii de vârstă de la 1 la 100 de ani" . Jurnalul de Neuropatologie și Neurologie Experimentală . 70 (11): 960–969. doi : 10.1097 / NEN.0b013e318232a379 . PMID 22002422 .
- ^ Thal DR; Rüb O; Orantes M; Braak H (2002). „Fazele depunerii Abeta în creierul uman și relevanța sa pentru dezvoltarea AD”. Neurologie . 58 (12): 1791–1800. doi : 10.1212 / wnl.58.12.1791 . PMID 12084879 . S2CID 41133337 .
- ^ Thal DR; Walter J; Saido TC; Fändrich M (2015). "Neuropatologia și biochimia Aβ și agregatele sale în boala Alzheimer" . Acta Neuropathologica . 129 (2): 167–182. doi : 10.1007 / s00401-014-1375-y . PMID 25534025 . S2CID 19701015 .
- ^ a b Jucker, M; Walker, LC (2013). "Auto-propagarea agregatelor de proteine patogene în bolile neurodegenerative" . Natura . 501 (7465): 45-51. Cod Bib : 2013Natur.501 ... 45J . doi : 10.1038 / nature12481 . PMC 3963807 . PMID 24005412 .
- ^ Walker LC; Jucker M (2015). „Boli neurodegenerative: extinderea conceptului prion” . Revista anuală a neuroștiinței . 38 : 87–103. doi : 10.1146 / annurev-neuro-071714-033828 . PMC 4803040 . PMID 25840008 .
- ^ Prusiner SB (1998). „Prioni” . Proceedings of the National Academy of Sciences USA . 95 (23): 13363–13383. Cod Bib : 1998PNAS ... 9513363P . doi : 10.1073 / pnas.95.23.13363 . PMC 33918 . PMID 9811807 .
- ^ Eisenberg D; Jucker M (2015). „Starea amiloidă a proteinelor în bolile umane” . Celula . 148 (6): 1188-1203. doi : 10.1016 / j.cell.2012.02.022 . PMC 3353745 . PMID 22424229 .
- ^ Nelson PT, Alafuzoff I, Bigio EH și colab. (2012). "Corelația modificărilor neuropatologice ale bolii Alzheimer cu starea cognitivă: o revizuire a literaturii" . Jurnalul de Neuropatologie și Neurologie Experimentală . 71 (5): 362–381. doi : 10.1097 / NEN.0b013e31825018f7 . PMC 3560290 . PMID 22487856 .
- ^ a b Findeis MA (noiembrie 2007). "Rolul beta peptidei amiloide 42 în boala Alzheimer". Farmacologie și terapie . 116 (2): 266-86. doi : 10.1016 / j.pharmthera.2007.06.006 . PMID 17716740 .
- ^ Thal DR, Ronisz A, Tousseyn T și colab. (2019). "Diferite aspecte ale patologiei β-peptidei amiloide legate de boala Alzheimer și relația lor cu imagistica tomografică cu emisie de pozitroni amiloizi și demență" . Comunicări Acta Neuropathologica . 7 (1): 178. doi : 10.1186 / s40478-019-0837-9 . PMC 6854805 . PMID 31727169 .
- ^ Mathis CA; Lopresti BJ; Ikonomovic MD; Klunk WE (2017). „Tracere PET cu molecule mici pentru proteinopatii imagistice” . Seminarii de medicină nucleară . 47 (5): 553-575. doi : 10.1053 / j.semnuclmed.2017.06.003 . PMC 5657567 . PMID 28826526 .
- ^ Ritchie C; Smailagic N; Noel-Storr AH; Ukoumunne O; Ladds EC; Martin S (2017). „LCR LCA și raportul LCA LCA / ABeta pentru diagnosticul demenței bolii Alzheimer și a altor demențe la persoanele cu insuficiență cognitivă ușoară (MCI)” . Baza de date Cochrane de recenzii sistematice . 3 (3): CD010803. doi : 10.1002 / 14651858.CD010803.pub2 . PMC 6464349 . PMID 28328043 .
- ^ Hansson O; Lehmann S; Otto M; Zetterberg H; Lewczuk P (2019). "Avantajele și dezavantajele utilizării raportului 42/40 beta-amiloid CSF (Abeta) în diagnosticul bolii Alzheimer" . Cercetare și terapie Alzheimer . 11 (1): 34. doi : 10.1186 / s13195-019-0485-0 . PMC 6477717 . PMID 31010420 .
- ^ a b Stam FC; Wigboldus JM; Smeulders AW (1986). „Incidența vârstei amiloidozei senile cerebrale” (PDF) . Patologie - Cercetare și practică . 181 (5): 558-562. doi : 10.1016 / S0344-0338 (86) 80149-2 . PMID 3786248 .
- ^ Franke, M (1976). „Statistische Untersuchungen über die senilen Drusen im menschlichen Gehirn / Thesen” . Berlin, Germania: Neuropathologische Abteilung. Arhivat din original la 19.07.2011.
- ^ a b Cap E; Powell D; Aur BT; Schmitt FA (2012). „Boala Alzheimer în sindromul Down” . European Journal of Neurodegenerative Disease . 1 (3): 353–364. PMC 4184282 . PMID 25285303 .
- ^ Heuer E; Rosen RF; Cintron A; Walker LC (2012). "Modele neumane de primate de proteopatie cerebrală asemănătoare Alzheimerului" . Proiectare farmaceutică actuală . 18 (8): 1159–1169. doi : 10.2174 / 138161212799315885 . PMC 3381739 . PMID 22288403 .
- ^ Walker LC; Jucker M (2017). „Vulnerabilitatea excepțională a oamenilor la boala Alzheimer” . Tendințe în medicina moleculară . 23 (6): 534-545. doi : 10.1016 / j.molmed.2017.04.001 . PMC 5521004 . PMID 28483344 .
- ^ Jucker M (2010). "Beneficiile și limitările modelelor animale pentru cercetarea translațională în bolile neurodegenerative". Medicina naturii . 16 (11): 1210–1214. doi : 10.1038 / nm.2224 . PMID 21052075 . S2CID 30167302 .
- ^ Myers A; McGonigle P (2010). "Prezentare generală a modelelor transgenice de șoarece pentru boala Alzheimer". Protocoale actuale în Neuroștiințe . 89 (1: e81): 1210–1214. doi : 10.1002 / cpns.81 . PMID 31532917 . S2CID 202024310 .
- ^ Huang Y, Happonen KE (aprilie 2021). „Microglia utilizează receptori TAM pentru a detecta și înghiți plăcile β amiloide” . Imunologia naturii . 8 (1): 222. doi : 10.1186 / s40478-020-01091-5 . PMC 7733282 . PMID 33308303 .
- ^ Heppner FL; Ransohoff RM; Becher B (2015). „Atac imunitar: rolul inflamației în boala Alzheimer”. Nature Review Neuroscience . 16 (6): 358-372. doi : 10.1038 / nrn3880 . PMID 25991443 . S2CID 6116253 .
- ^ De Strooper B; Karran E (2016). „Faza celulară a bolii Alzheimer” . Celula . 164 (4): 603-615. doi : 10.1016 / j.cell.2015.12.056 . PMID 26871627 .
- ^ Killin LOJ; Starr JM; Shiue IJ; Russ TC (2016). "Factorii de risc de mediu pentru demență: o revizuire sistematică" . BMC Geriatrie . 16 (1): 175. doi : 10.1186 / s12877-016-0342-y . PMC 5059894 . PMID 27729011 .
Lecturi suplimentare
- Jellinger KA (2005). „Neurodegenerative Erkrankungen (ZNS) - Eine aktuelle Übersicht” (PDF) . Journal für Neurologie, Neurochirurgie und Psychiatrie . 6 (1): 9–18.
- Cruz L, Urbanc B, Buldyrev SV și colab. (Iulie 1997). „Agregarea și dezagregarea plăcilor senile în boala Alzheimer” . Lucrările Academiei Naționale de Științe din Statele Unite ale Americii . 94 (14): 7612-6. Cod Bib : 1997PNAS ... 94.7612C . doi : 10.1073 / pnas.94.14.7612 . PMC 23870 . PMID 9207140 .