Sindromul Sjögren - Sjögren syndrome
| Sindromul Sjögren | |
|---|---|
| Alte nume | Sindromul Sjögren, sindromul sicca |
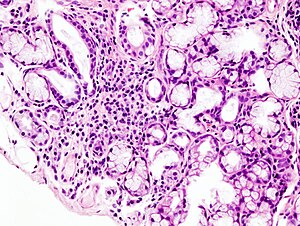 | |
| Imagine cu microscopul infiltrării limfoide focale în glanda salivară minoră asociată cu sindromul Sjögren. | |
| Pronunție | |
| Specialitate |
Imunologie , reumatologie |
| Simptome | Gură uscată , ochi uscați , alte zone de uscăciune |
| Complicații | Limfom |
| Debut obișnuit | Varsta mijlocie |
| Durată | Termen lung |
| Cauze | Boala autoimună (cauză necunoscută) |
| Metoda de diagnosticare | Biopsie tisulară , analize de sânge |
| Diagnostic diferentiat | Efecte secundare ale medicamentului, anxietate , sarcoidoză , amiloidoză |
| Tratament | Lacrimi artificiale , medicamente pentru reducerea inflamației, intervenții chirurgicale |
| Prognoză | Speranța de viață normală |
| Frecvență | ~ 0,7% |
Sindromul Sjögren ( SjS , SS ) este o boală autoimună pe termen lung care afectează glandele producătoare de umiditate (lacrimale și salivare) ale organismului și afectează adesea în mod serios alte sisteme de organe, cum ar fi plămânii, rinichii și sistemul nervos. Simptomele primare sunt uscăciunea ( gura uscată și ochii uscați ), durerea și oboseala . Alte simptome pot include pielea uscată , uscăciunea vaginală, tuse cronică, amorțeală la nivelul brațelor și picioarelor, senzație de oboseală , dureri musculare și articulare și probleme cu tiroida . Cei afectați prezintă, de asemenea, un risc crescut (15%) de limfom .
Deși cauza exactă este neclară, se crede că implică o combinație de genetică și un factor de declanșare a mediului, cum ar fi expunerea la un virus sau bacterie . Poate apărea independent de alte probleme de sănătate (sindromul Sjögren primar) sau ca urmare a unei alte tulburări a țesutului conjunctiv (sindromul Sjögren secundar). Sindromul Sjögren poate fi asociat cu alte boli autoimune, inclusiv artrita reumatoidă (RA), lupus eritematos sistemic (LES) sau scleroză sistemică. Inflamatia care duce progresiv daune glandelor. Diagnosticul se face prin biopsia glandelor producătoare de umiditate și teste de sânge pentru anticorpi specifici . La biopsie, există de obicei limfocite în glande.
În timp ce sindromul Sjögren este una dintre cele mai frecvente boli autoimune, nu are teste de diagnostic specifice și neinvazive, iar tratamentul este orientat spre gestionarea simptomelor persoanei . Pentru ochii uscați, pot fi încercate lacrimi artificiale , medicamente pentru reducerea inflamației, dopuri punctale sau intervenții chirurgicale pentru închiderea canalelor lacrimale . Pentru o gură uscată, se poate folosi gumă de mestecat (de preferință fără zahăr), sorbind apă sau un înlocuitor de salivă . La cei cu dureri articulare sau musculare, poate fi utilizat ibuprofen . Medicamentele care pot provoca uscăciune, cum ar fi antihistaminice , pot fi, de asemenea, oprite. Cel mai specific test de diagnostic existent necesită biopsie a buzelor.
Boala a fost descrisă în 1933 de Henrik Sjögren , după care este numit; cu toate acestea, există o serie de descrieri anterioare ale persoanelor cu simptome. Între 0,2 și 1,2% din populație este afectată, jumătate având forma primară și jumătate forma secundară. Femelele sunt afectate de aproximativ 10 ori mai des decât bărbații. Deși boala începe de obicei la vârsta mijlocie , oricine poate fi afectat. Dintre cei fără alte tulburări autoimune, speranța de viață este neschimbată.
semne si simptome
Simptomul distinctiv al sindromului Sjögren este gura uscată și keratoconjunctivita sicca (uscăciunea ochilor). De asemenea, pot apărea uscăciunea vaginală , pielea uscată și nasul uscat . Alte organe ale corpului pot fi, de asemenea, afectate, inclusiv rinichii, vasele de sânge, plămânii, ficatul, pancreasul și creierul.
Uscăciunea pielii la unele persoane cu SS poate fi rezultatul infiltrării limfocitare în glandele pielii . Simptomele se pot dezvolta insidios, diagnosticul adesea nefiind luat în considerare de câțiva ani, deoarece sicca poate fi atribuită medicamentelor, unui mediu uscat sau îmbătrânirii sau poate fi considerată a nu fi de o gravitate care să garanteze nivelul de investigație necesar pentru a stabili prezența tulburarea autoimună de bază.
Sindromul Sjögren poate afecta organele vitale , cu simptome care se pot agrava sau se pot agrava sau pot intra în remisie , ca și în cazul altor boli autoimune. Unele persoane pot prezenta doar simptomele ușoare ale uscăciunii ochilor și gurii, în timp ce altele prezintă simptome de boală severă. Mulți pacienți pot trata problemele simptomatic . Alții au o vedere încețoșată , un disconfort constant la ochi, infecții bucale recurente , glande parotide umflate , disfonie ( tulburări vocale, inclusiv răgușeală) și dificultăți la înghițire și mâncare. Oboseala debilitantă și durerile articulare pot afecta grav calitatea vieții. Unii pacienți pot dezvolta afectarea rinichilor ( nefrită tubulointerstițială autoimună ) ducând la proteinurie (exces de proteine în urină), defect de concentrare urinară și acidoză tubulară renală distală .
Complicații
Printre complicațiile discutate mai sus, femeile cu anticorpi anti-Ro / SS-A și anti-La / SS-B care rămân însărcinate au o rată crescută de lupus eritematos neonatal cu bloc cardiac congenital care necesită un stimulator cardiac . Crioglobulinemia de tip I este o complicație cunoscută a sindromului Sjögren.
Sindromul Sjögren poate afecta organe precum ficatul, pancreasul, rinichii, plămânii și sistemul nervos central.
Condiții asociate
Sindromul Sjögren este asociat cu o serie de alte afecțiuni medicale, dintre care multe sunt tulburări autoimune sau reumatice , cum ar fi boala celiacă , fibromialgia , LES (lupus) , tiroidita autoimună , scleroza multiplă și spondiloartropatia și mai multe afecțiuni maligne , în principal limfom non-Hodgkin. .
Cauze
Cauza sindromului Sjögren este necunoscută, dar poate fi influența unei combinații de factori genetici, de mediu și alți factori, așa cum este cazul multor alte tulburări autoimune. Ar putea fi implicați în jur de 20 de autoanticorpi.
Genetica
Observarea unor rate ridicate de tulburări autoimune la familiile cu antecedente de sindrom Sjögren este legată de o predispoziție genetică la sindrom. Studii privind polimorfisme ale antigenului leucocitar uman (HLA) -Dr și HLA-DQ genei regiuni din pacientii Sjögren arata sensibilitate diferențială a sindromului ca urmare a diferitelor tipuri de rezultat autoanticorp producție.
Hormoni
Deoarece sindromul Sjögren este asociat cu o prevalență ridicată la femei, se crede că hormonii sexuali , în special estrogenii , afectează răspunsurile imune umorale și mediate de celule care afectează susceptibilitatea la sindrom. Androgenii sunt considerați în general pentru a preveni autoimunitatea. Studiile pe modele de șoareci sugerează că deficiența de estrogen stimulează prezentarea autoantigenelor , inducând simptome asemănătoare lui Sjögren.
Microcimerism
Microcimerismul celulelor fetale (celulele limfoide ale descendenților în circulația maternă ) poate genera autoimunitate la femeile care au fost anterior însărcinate . Generarea unui potențial autoimune prin microchimerism poate duce la o trecere de la o formă tăcută de autoimunitate cu scădere dependentă de vârstă în auto-toleranță .
Mediu inconjurator
Proteinele virale , moleculele înghițite sau auto-structurile degradate pot iniția autoimunitatea prin mimică moleculară și pot crește șansele de dezvoltare a sindromului Sjögren. Virusul Epstein-Barr , hepatita C și virusul leucemiei cu celule T umane-1 sunt printre cei mai studiați agenți infecțioși în sindromul Sjögren. Până în prezent, nu au fost identificate relații directe de cauze și efecte între acești agenți patogeni și dezvoltarea sindromului Sjögren. Auto-structurile deteriorate vizate pentru apoptoză pot fi expuse greșit la sistemul imunitar, declanșând autoimunitatea în glandele exocrine , care sunt adesea predispuse la răspunsuri autoimune.
Patogenie
Cele patogenice mecanismele de sindromul Sjögren nu au fost pe deplin elucidat, având ca rezultat lipsa de fiziopatologia cunoaștere a managementului acestei autoimune exocrinopatia . Deși numeroșii factori care contribuie la progresia acestei boli au făcut dificilă descoperirea originii exacte și a cauzei, progresele majore din ultimul deceniu au contribuit la un set propus de evenimente patogene care apar înainte de diagnosticul sindromului Sjögren.
Sindromul Sjögren a fost inițial propus ca o pierdere specifică, auto-perpetuantă , mediată de sistemul imunitar, a glandelor exocrine, în special a celulelor acinare și ductale . Deși acest lucru explică simptomele mai evidente (cum ar fi lipsa de salivă și lichid lacrimal ), nu explică efectele sistemice mai răspândite observate în progresia bolii.
În prezența unui fundal genetic susceptibil , se crede că atât factorii de mediu , cât și cei hormonali sunt capabili să declanșeze infiltrarea limfocitelor, în special a celulelor T CD4 + , a celulelor B și a celulelor plasmatice , provocând disfuncții glandulare în glandele salivare și lacrimale.
Sindromul Sjögren este asociat cu niveluri crescute de lichid cefalorahidian (LCR) de IL-1RA , un antagonist al interleukinei 1 . Acest lucru sugerează că boala începe cu o activitate crescută în sistemul interleukinei 1, urmată de o reglare automată a IL-1RA pentru a reduce legarea cu succes a interleukinei 1 de receptorii săi. Interleukina 1 este probabil markerul pentru oboseală, dar IL-1RA crescută se observă în LCR și este asociată cu oboseală crescută prin comportamentul de boală indus de citokine . Cu toate acestea, sindromul Sjögren se caracterizează prin scăderea nivelului de IL-1ra în salivă, care ar putea fi responsabilă de inflamația și uscăciunea gurii. Pacienții cu sindrom Sjögren secundar prezintă deseori semne și simptome ale tulburărilor reumatice primare, cum ar fi lupus eritematos sistemic , artrită reumatoidă sau scleroză sistemică .
Predispozitie genetica
Locus genetic asociat cel mai semnificativ cu SS primar este histocompatibilitate majoră complex / antigenul leucocitar uman (MHC / HLA) regiune, după cum demonstrează rezultatele preliminare ale primului studiu de asociere la nivel genomului . Acest studiu a inclus date dintr-o cohortă de descoperire a 395 de pacienți cu ascendență europeană cu sindrom Sjögren primar și 1.975 de persoane sănătoase de control și dintr-un studiu de replicare care a cuprins 1.234 de cazuri și 4.779 de controale sănătoase. Au fost, de asemenea, depistate asocieri cu polimorfisme situate la șase loci independenți; IRF5 , STAT4 , BLK , IL12A , TNIP1 , și CXCR5 . Acest lucru a sugerat, de asemenea, activarea sistemului imunitar înnăscut , în special prin sistemul IFN, activarea celulelor B prin recrutarea direcționată de CXCR5 către foliculii limfoizi și activarea receptorului de celule B (BCR) care implică BLK și activarea celulelor T datorită susceptibilității HLA și axa IL-12-IFN-γ.
Pacienții cu origini etnice diferite au alele susceptibile la HLA diferite , dintre care HLA-DR și HLA-DQ sunt implicate în patogeneza sindromului Sjögren. De exemplu, pacienții din Europa de Nord și de Vest și din America de Nord prezintă o prevalență ridicată a genelor B8, DRw52 și DR3 . Alelele HLA clasa II sunt asociate cu prezența unor subgrupuri specifice de autoanticorpi , mai degrabă decât cu boala însăși. Autoanticorpii se referă la pierderea toleranței celulelor B, ceea ce duce la producerea de anticorpi direcționați împotriva diverselor antigene organice specifice și organe nespecifice. Asocierea dintre HLA și SS este limitată la pacienții cu anticorpi anti-SSA / Ro sau anti-SSB / La. Seropozitivitatea pentru anti-Ro și anti-La este asociată cu o severitate mai mare și o durată mai lungă a bolii, iar constatările abundenței lor ridicate din glandele salivare ale pacienților Sjögren sugerează rolul lor imperativ în patogeneza SS.
Dincolo de genetică, anomalia epigenetică legată de metilarea ADN , acetilarea histonei sau expresia microARN are probabil un rol cheie în patogeneza bolilor autoimune, inclusiv a sindromului Sjögren, deși cercetările în acest domeniu sunt foarte limitate.
Declanșatorii de mediu
Factorii de mediu, cum ar fi infecția virală glandulară , ar putea determina celulele epiteliale să activeze sistemul imunitar înnăscut independent de HLA prin intermediul receptorilor asemănători . Deși un număr de agenți infecțioși, exogeni , au fost implicați în patogeneza sindromului Sjögren, cum ar fi virusul Epstein-Barr (EBV), virusul T limfotrop 1 uman și virusul hepatitei C , asocierea lor cu sindromul Sjögren pare slabă. În timp ce EBV este prezent în glandele salivare ale indivizilor normali, a fost raportată o incidență ridicată a reactivării EBV la pacienții Sjögren, cu niveluri crescute de ADN EBV . Aceasta indică reactivarea virală și incapacitatea infiltratelor limfoide de a controla replicarea EBV în sindromul Sjögren, ducând la inițierea sau perpetuarea unui răspuns imun în organele țintă. Cu toate acestea, rămâne de clarificat exact modul în care este indusă reactivarea EBV la leziunile pacienților cu sindrom Sjögren și care mecanisme moleculare specifice sunt implicate în procesul de reactivare virală.
Inflamaţie
Celulele epiteliale din leziunile sindromului Sjögren sunt participanți activi la inducerea și perpetuarea procesului inflamator. Se crede că factorii de mediu și hormonali, în concordanță cu un fundal genetic adecvat, declanșează sindromul Sjögren, care disregulează celulele epiteliale și permite homerizarea aberantă și activarea celulelor dendritice (DC), a celulelor T și a celulelor B. Celulele dendritice sunt celule care prezintă antigen care procesează materialul antigen și îl prezintă altor celule T. După migrarea limfocitelor în glande ca răspuns la chemokine și molecule de aderență specifice , celulele T interacționează cu celulele epiteliale. Celulele epiteliale sunt activate în continuare de citokinele proinflamatorii (IL-1β, IFN-γ și TNF), care sunt produse de celulele T adiacente. Acumularea timpurie a celulelor dendritice plasmacitoide în țesuturile țintă, care produc niveluri ridicate de IFN de tip 1, pare importantă, deoarece aceste celule pot regla și mai mult răspunsul imun prin retenția anormală a limfocitelor în țesuturi și activarea lor ulterioară. IFN-α stimulează producerea factorului de activare a celulelor B (BAFF) de către celulele epiteliale, DC și celulele T. BAFF stimulează maturarea aberantă a celulelor B, ducând la apariția celulelor B auto-reactive, care produc autoanticorpi la nivel local, într-o structură asemănătoare centrului germinativ ( asemănător GC), care este și locația limfomagenezei (originea limfomului ).
Moarte celulară programată
Desregularea apoptozei (moartea celulară programată) se crede că joacă un rol în patogeneza unei varietăți de boli autoimune, deși rolul său în sindromul Sjögren este controversat. Atât Fas și Fas ligand proteinele sunt supraexprimați la pacientii Sjögren primar, în timp ce expresia BCL-1 , care este cunoscut apoptoza downregulate, a fost găsit redus semnificativ în acinare și ductale celulele epiteliale ale pacienților Sjögren comparativ cu persoanele sănătoase. Studiile in situ nu au arătat apoptoza crescută în rândul celulelor epiteliale glandulare, dar au arătat apoptoza redusă în rândul celulelor mononucleare infiltrante. Apoptoza redusă a fost implicată și în acumularea de celule B autoreactive găsite în glande. Relația autoanticorpilor exprimați în sindromul Sjögren cu apoptoza este încă cercetată.
Factori hormonali
Hormonii sexuali par să influențeze răspunsul imun umoral și mediat celular, estrogenul fiind considerat unul dintre cei mai mari factori responsabili pentru dimorfismul imunologic sexual . Deficitul de estrogen pare să joace un rol în dezvoltarea sindromului Sjögren. S-a emis ipoteza că administrarea de androgeni pe suprafața oculară poate servi ca terapie eficientă pentru uscarea ochilor.
Diagnostic
Diagnosticarea sindromului Sjögren (SS) este complicată de gama de simptome pe care o poate manifesta un pacient și de similitudinea dintre simptomele sindromului Sjögren și cele ale altor afecțiuni. De asemenea, pacienții cu simptome SS abordează diferite specialități pentru tratament, ceea ce poate îngreuna diagnosticul. Deoarece ochii uscați și gura uscată sunt simptome foarte frecvente și apar frecvent la persoanele de peste 40 de ani, persoanele afectate pot crede că simptomele sunt legate de vârstă, deci ignorați-le. Unele medicamente pot provoca simptome similare cu cele ale sindromului Sjögren. Combinația mai multor teste, care se pot face într-o serie, poate diagnostica în cele din urmă sindromul Sjögren.
Testele de sânge pot fi făcute pentru a determina dacă un pacient are niveluri ridicate de anticorpi care indică starea, cum ar fi anticorpul antinuclear (ANA) și factorul reumatoid (deoarece sindromul Sjögren apare frecvent secundar artritei reumatoide), care sunt asociate cu boli autoimune. . Tiparele tipice SS ANA sunt SSA / Ro și SSB / La , dintre care anti-SSB / La este mult mai specific; anti-SSA / Ro este asociat cu numeroase alte condiții autoimune, dar este adesea prezent în SS, dar testele anti-SSA și anti-SSB nu sunt adesea pozitive în SS.
Testul de trandafir bengal folosește o pată care măsoară starea și funcția glandelor lacrimale . Acest test implică plasarea vopselei netoxice de trandafir bengal pe ochi. Culoarea distinctivă a colorantului ajută la determinarea stării și funcționării filmului lacrimal și a ratei de evaporare a lacrimii. Orice modificare distinctivă a culorii poate indica SS, dar confirmarea stării necesită multe instrumente de diagnosticare conexe .
Testul Schirmer măsoară producția de lacrimi: o bandă de hârtie de filtru este ținută în interiorul pleoapei inferioare timp de cinci minute, iar umezeala sa este apoi măsurată cu o riglă. Producerea mai puțin de 5 mm (0,20 in) de lichid este de obicei indicativă a SS. Această analiză de măsurare variază în funcție de oameni, în funcție de alte afecțiuni legate de ochi și de medicamentele utilizate în momentul efectuării testului. O examinare a lămpii cu fante poate dezvălui uscăciunea la suprafața ochiului.
Simptomele uscăciunii gurii și uscăciunii în cavitatea bucală sunt cauzate de producția redusă de salivă din glandele salivare ( glanda parotidă , glanda submandibulară și glanda sublinguală ). Pentru a verifica starea glandelor salivare și producția de salivă, se efectuează un test al debitului salivar, în care persoana este rugată să scuipe cât de mult poate într-o ceașcă, iar proba de salivă rezultată este colectată și cântărită. Rezultatele acestui test pot determina dacă glandele salivare funcționează adecvat. Nici o cantitate suficientă de salivă ar putea însemna că persoana are SS. Un test alternativ este colectarea întregului flux de salivă nestimulat, în care persoana scuipă într-o eprubetă în fiecare minut timp de 15 minute. O colectare rezultată de mai puțin de 1,5 ml (0,053 imp fl oz; 0,051 US fl oz) este considerată un rezultat pozitiv.
O biopsie a buzelor / glandei salivare prelevează un eșantion de țesut care poate dezvălui limfocite grupate în jurul glandelor salivare și poate deteriora aceste glande din cauza inflamației. Acest test implică îndepărtarea unei probe de țesut de pe buzele interioare / glanda salivară a unei persoane și examinarea acesteia la microscop . În plus, se efectuează o sialogramă , un test special cu raze X , pentru a vedea dacă există vreun blocaj în canalele glandei salivare (adică canalul parotid ) și cantitatea de salivă care curge în gură.
O procedură radiologică este disponibilă ca test fiabil și precis pentru sindromul Sjögren. Un agent de contrast este injectat în conducta parotidă, care se deschide de pe obraz în vestibulul gurii opus gâtului celui de-al doilea molar superior . Studiile de histopatologie ar trebui să prezinte sialadenită limfocitară focală . Dovezile obiective ale implicării glandei salivare sunt testate prin examinări cu ultrasunete , nivelul fluxului salivar întreg nestimulat, o sialografie parotidă sau scintigrafie salivară și autoanticorpi împotriva antigenelor Ro (SSA) și / sau La (SSB).
Sindromul Sjögren poate fi exclus de la persoanele cu radioterapie trecută a capului și gâtului , sindromul imunodeficienței dobândite , limfom preexistent , sarcoidoză , boală grefă contra gazdă și utilizarea medicamentelor anticolinergice .
Prevenirea
Nu există niciun mecanism de prevenire pentru sindromul Sjögren (SS) din cauza complexității sale ca tulburare autoimună, dar modificările stilului de viață pot reduce factorii de risc legați de dezvoltarea SS sau pot reduce severitatea afecțiunii pentru pacienții care au fost deja diagnosticați. Dieta este puternic asociată cu inflamația observată în multe boli autoimune, inclusiv SS. Un studiu experimental a concluzionat că pacienții cu SS prezintă adesea o sensibilitate ridicată la gluten, care se referă direct la inflamație. Exercițiul moderat este, de asemenea, util la pacienții cu SS, reducând în principal efectul inflamației pulmonare.
Tratament
Se știe că nici un tratament, nici un tratament specific pentru sindromul Sjögren nu restabilesc definitiv secreția glandei . În schimb, tratamentul este în general simptomatic și de susținere.
Îngrijirea ochilor
Terapiile de înlocuire a umidității, cum ar fi lacrimile artificiale, pot ușura simptomele uscăciunii ochilor. Unii pacienți cu probleme mai severe utilizează ochelari de protecție pentru a crește umiditatea locală sau au introduse dopuri punctuale pentru a ajuta la reținerea rupturilor pe suprafața oculară pentru o perioadă mai lungă de timp.
În plus, ciclosporina (Restasis) este disponibilă pe bază de prescripție medicală pentru a trata ochiul uscat cronic prin suprimarea inflamației care perturbă secreția lacrimală. De asemenea, sunt disponibile medicamente eliberate pe bază de rețetă care ajută la stimularea fluxului salivar, cum ar fi cevimelina (Evoxac) și pilocarpina. Salagenul , o formă fabricată de pilocarpină , poate fi utilizat pentru a ajuta la producerea lacrimilor, precum și a salivei în gură și intestine. Este derivat din planta jaborandi .
Uscăciune vaginală
La femeile cu sindrom Sjögren, se raportează deseori uscăciunea vaginală, vulvodinia și dispareunia ( actul sexual dureros ); lubrifianții personale sunt recomandate pentru a ajuta la reduce iritarea sau durere , care poate duce la uscarea in vaginale si vulvare zone.
Musculo-scheletice
Medicamentele antiinflamatoare nesteroidiene (AINS) pot fi utilizate pentru tratarea simptomelor musculo-scheletice. Pentru persoanele cu complicații severe , pot fi prescrise corticosteroizi sau medicamente imunosupresoare și, uneori, imunoglobuline intravenoase . De asemenea, medicamentele antireumatice care modifică boala, cum ar fi metotrexatul, pot fi utile. Hidroxiclorochina (Plaquenil) este o altă opțiune și este în general considerată mai sigură decât metotrexatul. Cu toate acestea, aceste medicamente prescrise au o serie de efecte secundare, cum ar fi greață , pierderea poftei de mâncare , amețeli , căderea părului , dureri de stomac / crampe , cefalee , toxicitate hepatică și risc crescut de infecții . De asemenea, cei care iau medicamente pentru suprimarea sistemului imunitar sunt mai predispuși să dezvolte cancer ulterior.
Sistemic
Pentru simptome sistemice, inclusiv oboseală, dureri articulare, miozită și neuropatie , sunt adesea utilizate medicamente imunosupresoare biologice precum rituximab și belimumab care funcționează prin patologia celulelor B și au profiluri mai puțin toxice decât regimurile imunosupresoare tradiționale.
Ingrijire dentara
Tratamentul dentar preventiv este, de asemenea, necesar (și adesea trecut cu vederea de pacient), deoarece lipsa de salivă asociată cu xerostomia creează un mediu ideal pentru proliferarea bacteriilor care cauzează cariile . Tratamentele includ aplicarea topică de fluor la domiciliu pentru întărirea smalțului dinților și curățarea frecventă a dinților de către un igienist dentar. Cavitățile existente trebuie, de asemenea, tratate, deoarece cavitățile care se extind în dinte nu pot fi tratate eficient doar prin curățarea dinților și prezintă un risc ridicat de răspândire în pulpa dintelui , ducând la pierderea vitalității și la necesitatea extracției sau a rădăcinii terapie de canal . Acest regim de tratament este același ca pentru toți pacienții cu xerostomie, cum ar fi pentru cei supuși radioterapiei capului și gâtului, care afectează adesea glandele salivare; aceste glande sunt mai susceptibile la radiații decât sunt alte țesuturi ale corpului.
Prognoză
Studiile publicate privind supraviețuirea pacienților cu sindrom Sjögren sunt limitate în diferite privințe, probabil din cauza dimensiunilor eșantionului relativ mici și a faptului că sindromul Sjögren secundar este asociat cu alte boli autoimune. Rezultatele unui număr de studii indică faptul că, comparativ cu alte boli autoimune, sindromul Sjögren este asociat cu o incidență deosebit de mare a limfomului malign non-Hodgkin , un cancer al globulelor albe din sânge. Aproximativ 5% dintre pacienții cu SS dezvoltă o formă de malignitate limfoidă . Pacienții cu cazuri severe sunt mult mai predispuși să dezvolte limfoame decât pacienții cu cazuri ușoare sau moderate. Cele mai frecvente limfoame sunt limfoamele cu celule B extranodale marginale salivare ( limfoame MALT în glandele salivare) și limfoamele cu celule B mari difuze .
Limfomageneza la pacienții cu sindrom Sjögren primar este considerată ca un proces cu mai multe etape, primul pas fiind stimularea cronică a celulelor B autoimune, în special a celulelor B care produc factor reumatoid la locurile vizate de boală. Acest lucru crește frecvența mutației oncogene , ducând la orice disfuncție la punctele de control ale activării autoimune a celulelor B pentru a se transforma în malignitate. Constatarea unui studiu a concluzionat stimularea continuă a celulelor B autoimune, ducând la anomalii germinale subtile la gene cu consecințe specifice în celulele B, care stau la baza susceptibilității la limfom.
În afară de această incidență deosebit de mare de NHL malign, pacienții Sjögren prezintă doar o deteriorare modestă sau nesemnificativă din punct de vedere clinic a funcției specifice organelor, ceea ce explică singurele creșteri ușoare ale ratelor de mortalitate ale pacienților Sjögren în comparație cu restul populației.
Sindromul Sjögren este asociat cu o povară ridicată a bolii și s-a demonstrat că reduce semnificativ calitatea vieții (QoL), cu un impact semnificativ asupra capacității de muncă, rezultat din rate crescute de handicap. Reducerea QoL este similară cu cea observată în alte afecțiuni cronice, cum ar fi artrita reumatoidă , lupusul și fibromialgia .
Epidemiologie
Sindromul Sjögren (SS) este a doua cea mai frecventă tulburare autoimună reumatică, în spatele artritei reumatoide și a lupusului eritematos sistemic . Nu există diferențe geografice în ratele SS. Sindromul Sjögren a fost raportat în toate zonele lumii, deși ratele regionale nu au fost bine studiate. În funcție de criteriile pentru determinarea prevalenței, studiile estimează prevalența SS între 500.000 și două milioane de persoane în Statele Unite. Studiile mai largi privind prevalența SS variază pe scară largă, cu unele rapoarte de până la o prevalență de 3% din populație. Câteva studii au raportat că incidența sindromului variază între trei și șase la 100.000 pe an.
Nouă din 10 pacienți cu SS sunt femei. În plus față de prevalența la femei, având o rudă de gradul I cu o boală autoimună și sarcini anterioare au fost identificați ca factori de risc epidemiologic. În ciuda riscului mai mic pentru bărbați, SS primare la bărbați tinde să reprezinte o formă mai severă a bolii. Rolul rasei și al etniei în prevalența bolii este necunoscut.
Deși sindromul Sjögren apare la toate grupele de vârstă, vârsta medie de debut este cuprinsă între 40 și 60 de ani, deși până la jumătate din toate cazurile pot fi lăsate nediagnosticate sau nedeclarate. Prevalența SS crește în general odată cu vârsta.
Sindromul Sjögren este raportat la 30-50% dintre persoanele cu poliartrită reumatoidă și la 10-25% cu lupus eritematos sistemic.
Istorie
Jan Mikulicz-Radecki (1850–1905) primește în general prima descriere a SS. În 1892, el a descris un bărbat în vârstă de 42 de ani cu mărirea glandelor parotide și lacrimale asociate cu un infiltrat cu celule rotunde și atrofie acinară . Cu toate acestea, criteriile stabilite de Mikulicz pentru diagnostic au dus adesea la diagnosticarea greșită a sindromului Mikulicz . Multe afecțiuni, cum ar fi tuberculoza , infecțiile, sarcoidoza și limfomul prezintă afecțiuni similare cu cele atribuite sindromului Mikulicz. Cu toate acestea, termenul „sindrom Mikulicz” este încă folosit ocazional pentru a descrie apariția infiltratelor limfocitare pe biopsiile glandei salivare.
În 1930, Henrik Sjögren (1899–1986), oftalmolog din Jönköping , Suedia , a observat un pacient cu secreții scăzute din glandele lacrimale și salivare. Sjögren a introdus termenul de cheratoconjunctivită sicca pentru simptomul ochilor uscați ( cheratoconjunctivită ). În 1933, și-a publicat teza de doctorat care descrie 19 femei, dintre care majoritatea erau în postmenopauză și aveau artrită, prezentând manifestări clinice și patologice ale sindromului. Sjögren a clarificat că keratoconjunctivita sicca, rezultată din deficiența de apă, nu avea nicio legătură cu xeroftalmia , rezultată din deficitul de vitamina A. Teza lui Sjögren nu a fost bine primită, deoarece Consiliul examinatorilor a criticat unele aspecte clinice.
După cercetări ample și colectarea datelor, Sjögren a publicat o lucrare esențială în 1951, care descrie 80 de pacienți cu keratoconjunctivită sicca , dintre care 50 aveau și artrită. Următoarele sale călătorii de conferință legate de lucrarea sa au dus la un interes internațional pentru sindromul Sjögren. Termenul "keratoconjunctivitis sicca" a fost inventat de Sjögren însuși și a început să fie identificat ca sindrom Sjögren în literatură, deși acum poate avea o utilizare mai generală.
Cercetare

Cercetarea bolilor autoimune multifactoriale, cum ar fi SS, se concentrează pe extinderea cunoștințelor din jurul tulburării, îmbunătățirea instrumentelor de diagnostic și găsirea modalităților de prevenire, gestionare și vindecare a tulburării. Marea Britanie Sindromul Registrul Sjögren, un țesut biobank de probe prelevate pentru cercetare, sustinuta de Medical Research Council, Marea Britanie , a fost înființată în 2010. Acesta susține studiile clinice și studiile genetice ale sindromului Sjogren si este deschis pentru cei care doresc să participe la studii de cercetare și cercetătorilor care studiază boala.
Ca și în cazul altor boli autoimune, susceptibilitatea la sindromul Sjögren este influențată în mare măsură de antigenul leucocitar uman. Alelele DQA1 * 05: 01, DQB1 * 02: 01 și DRB1 * 03: 01 au fost identificate ca factori de risc , în timp ce alelele DQA1 * 02: 01, DQA1 * 03: 01 și DQB1 * 05: 01 s-au dovedit a fi factori de protecție pentru boală. A fost stabilită și relația dintre alele și rasa specifică. HLA-DQ2 și HLA-B8 se găsesc în general la pacienții caucazieni , în timp ce HLA-DR5 este legat de pacienții greci și israelieni . Scanări multiple de asociere la nivel de genom pot fi efectuate în viitor pentru a identifica variantele cheie de risc.
Virușii care au fost asociați cu sindromul Sjögren includ virusul limfotrop T uman 1 ( HTLV-1 ), virusul Epstein-Barr (EBV), virusul imunodeficienței umane (HIV), virusul hepatitei delta (HDV) și virusul hepatitei C (HCV) .
Unele cercetări au arătat că lipsa vitaminei A și a vitaminei D este asociată cu boala. S-a constatat că deficiența de vitamina D este legată de manifestările neurologice și de prezența limfomului la pacienți, dar nivelurile de vitamina A au fost asociate invers cu manifestările extraglandulare ale bolii.
Saliva este un instrument de diagnostic potențial pentru sindromul Sjögren, deoarece componenta salivară se schimbă după debutul bolii. Cu noua tehnologie de miniaturizare , numită laborator pe un cip , diagnosticul poate fi mai convenabil.
În ceea ce privește terapeutica, anticorpii monoclonali multipli au fost în curs de investigare în 2007. Cel mai promițător părea să fie anti- CD20 rituximab și anti- CD22 epratuzumab , în timp ce anti -TNF-α și IFN-α păreau mai puțin eficiente.
În 2014, Sjögren's Syndrome Foundation a anunțat un obiectiv pe cinci ani de reducere la jumătate a timpului mediu de diagnostic al bolii.
Cazuri notabile
- Shannon Boxx ( fotbalist olimpic american) are atât sindromul Sjögren, cât și lupusul .
- Carrie Ann Inaba (cântăreață-actriță) este ambasadorul național de sensibilizare și purtătorul de cuvânt al Fundației Sjögren's Syndrome Foundation.
- Venus Williams ( jucătoare de tenis campioană mondială ) a fost diagnosticată cu sindromul Sjögren și a spus că s-a luptat cu oboseala de ani de zile.
- Stephen McPhail (fotbalist profesionist pentru Irlanda, Leeds și Cardiff City) a fost diagnosticat cu limfom și sindrom Sjögren la vârsta de 29 de ani.
Referințe
- O parte din textul original al acestui articol a fost obținut dintr-o resursă de domeniu public de la NIH
linkuri externe
- Sindromul Sjögren la NHS Choices
- Sindromul Sjögren - Institutul Național de Artrită și Boli Musculo-scheletice și ale Pielii din SUA
- Fundația SUA Sjögren
- Preț, EJ; Rauz, S; Tappuni, AR; Sutcliffe, N; Hackett, KL; Barone, F; Granata, G; Ng, WF; Fisher, BA; Bombardieri, M; Astorri, E; Empson, B; Larkin, G; Crampton, B; Bowman, SJ; Societatea britanică pentru standarde de reumatologie, linii directoare și audit, grup. (1 octombrie 2017). „Ghidul Societății Britanice pentru Reumatologie pentru managementul adulților cu sindrom Sjögren primar” . Reumatologie . 56 (10): e24 – e48. doi : 10.1093 / reumatology / kex166 . PMID 28957550 .
| Clasificare | |
|---|---|
| Resurse externe |


