Capacitate termică specifică - Specific heat capacity
În termodinamică , capacitatea de căldură specifică (simbolul c p ) al unei substanțe este capacitatea de căldură a unei probe de substanță împărțită la masa probei. Căldura specifică este denumită uneori și capacitate de căldură masică . În mod informal, este cantitatea de căldură care trebuie adăugată la o unitate de masă a substanței pentru a determina o creștere a unei unități de temperatură . Unitatea SI de capacitate termică specifică este joule per kelvin per kilogram , J⋅kg −1 ⋅K −1 . De exemplu, căldura necesară pentru creșterea temperaturii de1 kg de apă până la1 K este4184 jouli , deci capacitatea specifică de căldură a apei este4184 J⋅kg −1 ⋅K −1 .
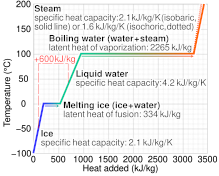
Capacitatea specifică de căldură variază adesea în funcție de temperatură și este diferită pentru fiecare stare a materiei . Apa lichidă are una dintre cele mai mari capacități specifice de căldură dintre substanțele comune, aproximativ4184 J⋅kg −1 ⋅K −1 la 20 ° C; dar cea a gheții, chiar sub 0 ° C, este numai2093 J⋅kg −1 ⋅K −1 . Capacitățile termice specifice fierului , granitului și hidrogenului gazos sunt de aproximativ 449 J⋅kg −1 ⋅K −1 , 790 J⋅kg −1 ⋅K −1 și, respectiv, 14300 J⋅kg −1 ⋅K −1 . În timp ce substanța trece printr-o tranziție de fază , cum ar fi topirea sau fierberea, capacitatea sa specifică de căldură este infinită din punct de vedere tehnic , deoarece căldura își schimbă starea, mai degrabă decât crește temperatura.
Capacitatea de căldură specifică a unei substanțe, în special a unui gaz, poate fi semnificativ mai mare atunci când este lăsată să se extindă pe măsură ce este încălzită (capacitate de căldură specifică la presiune constantă ) decât atunci când este încălzită într-un vas închis care împiedică expansiunea (capacitate de căldură specifică la volum constant ). Aceste două valori sunt de obicei notate cu și , respectiv; coeficientul lor este raportul capacității termice .
Termenul de căldură specifică se poate referi, de asemenea, la raportul dintre capacitățile de căldură specifice ale unei substanțe la o temperatură dată și ale unei substanțe de referință la o temperatură de referință, cum ar fi apa la 15 ° C; mult după gravitația specifică . Capacitatea termică specifică este, de asemenea, legată de alte măsuri intensive ale capacității termice cu alți numitori. Dacă cantitatea de substanță este măsurată ca număr de moli , se obține în schimb capacitatea de căldură molară , a cărei unitate SI este joule per kelvin per mol, J⋅mol −1 ⋅K −1 . Dacă se consideră că volumul eșantionului (așa cum se face uneori în inginerie), se obține capacitatea de căldură volumetrică , a cărei unitate SI este joule per kelvin pe metru cub , J⋅m −3 ⋅K −1 .
Unul dintre primii oameni de știință care a folosit conceptul a fost Joseph Black , un medic din secolul al XVIII-lea și profesor de medicină la Universitatea Glasgow . El a măsurat capacitățile specifice de căldură ale multor substanțe, folosind termenul de capacitate pentru căldură .
Definiție
Capacitatea termică specifică a unei substanțe, de obicei notată cu sau s , este capacitatea termică a unei probe de substanță, împărțită la masa probei:
unde reprezintă cantitatea de căldură necesară pentru a crește uniform temperatura eșantionului cu un mic increment .
Ca și capacitatea de căldură a unui obiect, capacitatea de căldură specifică a unei substanțe poate varia, uneori substanțial, în funcție de temperatura de pornire a eșantionului și de presiunea aplicată acestuia. Prin urmare, ar trebui considerată o funcție a celor două variabile.
Acești parametri sunt de obicei specificați atunci când se dă capacitatea termică specifică unei substanțe. De exemplu, „Apă (lichid): = 4187 J⋅kg −1 ⋅K −1 (15 ° C)” Când nu este specificat, valorile publicate ale capacității de căldură specifice sunt valabile în general pentru unele condiții standard de temperatură și presiune .
Cu toate acestea, dependența de temperatura și presiunea de pornire poate fi adesea ignorată în contexte practice, de exemplu atunci când se lucrează în intervale înguste ale acelor variabile. În aceste contexte, omite de obicei calificativul și se aproxima capacitatea de căldură specifică cu o constantă adecvată pentru acele intervale.
Capacitatea termică specifică este o proprietate intensivă a unei substanțe, o caracteristică intrinsecă care nu depinde de mărimea sau forma cantității luate în considerare. (Calificativul „specific” din fața unei proprietăți extinse indică adesea o proprietate intensivă derivată din aceasta.)
Variații
Injecția de energie termică într-o substanță, pe lângă creșterea temperaturii sale, determină de obicei o creștere a volumului și / sau a presiunii sale, în funcție de modul în care este limitată proba. Alegerea făcută despre acesta din urmă afectează capacitatea de căldură specifică măsurată, chiar și pentru aceeași presiune de pornire și temperatură de pornire . Două alegeri speciale sunt utilizate pe scară largă:
- Dacă presiunea este menținută constantă (de exemplu, la presiunea atmosferică ambiantă), iar proba este lăsată să se extindă, expansiunea generează funcționare pe măsură ce forța din presiune deplasează incinta sau fluidul din jur. Această muncă trebuie să provină din energia termică furnizată. Capacitatea termică specifică astfel obținută se spune să fie măsurată la presiune constantă (sau izobară ) și este adesea notat , , etc.
- Pe de altă parte, dacă extinderea este împiedicată - de exemplu printr-o incintă suficient de rigidă sau prin creșterea presiunii externe pentru a contracara cea internă - nu se generează nici o lucrare, iar energia termică care ar fi intrat în ea trebuie să contribuie în schimb la energia internă a probei, inclusiv creșterea temperaturii cu o cantitate suplimentară. Capacitatea specifică de căldură astfel obținută se spune să fie măsurat la volum constant (sau izocoră ) și notate , , , etc.
Valoarea lui este de obicei mai mică decât valoarea lui . Această diferență este deosebit de notabilă în gazele în care valorile sub presiune constantă sunt de obicei cu 30% până la 66,7% mai mari decât cele cu volum constant. Prin urmare, raportul capacității termice a gazelor este de obicei între 1,3 și 1,67.
Aplicabilitate
Capacitatea termică specifică poate fi definită și măsurată pentru gaze, lichide și solide cu o compoziție și o structură moleculară destul de generale. Acestea includ amestecuri de gaze, soluții și aliaje sau materiale eterogene, cum ar fi lapte, nisip, granit și beton, dacă sunt considerate la o scară suficient de mare.
Capacitatea termică specifică poate fi definită și pentru materialele care schimbă starea sau compoziția pe măsură ce temperatura și presiunea se schimbă, atâta timp cât modificările sunt reversibile și treptate. Astfel, de exemplu, conceptele sunt definibile pentru un gaz sau lichid care se disociază pe măsură ce temperatura crește, atâta timp cât produsele disocierii se recombină prompt și complet atunci când scade.
Capacitatea specifică de căldură nu este semnificativă dacă substanța suferă modificări chimice ireversibile sau dacă există o schimbare de fază , cum ar fi topirea sau fierberea, la o temperatură ascuțită în intervalul de temperaturi cuprinse în măsurătoare.
Măsurare
Capacitatea termică specifică a unei substanțe este de obicei determinată conform definiției; și anume, prin măsurarea capacității de căldură a unei probe de substanță, de obicei cu un calorimetru , și împărțirea la masa probei. Mai multe tehnici pot fi aplicate pentru estimarea capacității termice a unei substanțe, cum ar fi, de exemplu, calorimetria cu scanare diferențială rapidă .
Capacitățile de căldură specifice gazelor pot fi măsurate la volum constant, prin închiderea probei într-un recipient rigid. Pe de altă parte, măsurarea capacității de căldură specifice la volum constant poate fi prohibitiv dificilă pentru lichide și solide, deoarece adesea ar fi nevoie de presiuni impracticabile pentru a preveni expansiunea care ar fi cauzată chiar de creșteri mici ale temperaturii. În schimb, practica obișnuită este de a măsura capacitatea de căldură specifică la presiune constantă (permițând materialului să se extindă sau să se contracte după cum dorește), să se determine separat coeficientul de expansiune termică și compresibilitatea materialului și să se calculeze capacitatea de căldură specifică la constantă. volumul din aceste date conform legilor termodinamicii.
Unități
Sistem internațional
Unitatea SI pentru capacitatea de căldură specifică este joule per kelvin per kilogram ((J / K) / kg, J / (kg⋅K), J⋅K −1 ⋅kg −1 etc.). Deoarece o creștere a temperaturii de un grad Celsius este aceeași cu o creștere de un kelvin, este același lucru cu joule pe grad Celsius pe kilogram (J⋅kg −1 ⋅ ° C −1 ). Uneori gramul este folosit în loc de kilogram pentru unitatea de masă: 1 J⋅g −1 ⋅K −1 = 0,001 J⋅kg −1 ⋅K −1 .
Capacitatea termică specifică a unei substanțe (pe unitate de masă) are dimensiunea L 2 ⋅Θ −1 ⋅T −2 sau (L / T) 2 / Θ. Prin urmare, unitatea SI J⋅kg −1 ⋅K −1 este echivalentă cu metru pătrat pe secundă pătrat pe kelvin (m 2 ⋅K −1 ⋅s −2 ).
Unități de inginerie imperiale
Profesioniști în construcții , inginerie civilă , inginerie chimică , și alte discipline tehnice, în special în Statele Unite , pot utiliza unități de limba engleză Engineering , inclusiv Imperial lira (lb = 0.45359237 kg) ca unitate de în masă, gradul Fahrenheit sau Rankine (° F = 5/9 K, aproximativ 0,555556 K) ca unitate de creștere a temperaturii și unitatea termică britanică (BTU ≈ 1055,06 J), ca unitate de căldură.
În aceste contexte, unitatea de capacitate termică specifică este BTU⋅ ° F −1 ⋅lb −1 = 4177,6 J⋅kg −1 ⋅K −1 . BTU a fost inițial definit astfel încât capacitatea medie specifică de căldură a apei să fie de 1 BTU⋅ ° F −1 ⋅lb −1 .
Calorii
În chimie, cantitățile de căldură au fost adesea măsurate în calorii . În mod confuz, două unități cu acel nume, denumite „cal” sau „Cal”, au fost utilizate în mod obișnuit pentru a măsura cantitățile de căldură:
- „calorii mici” (sau „gram-calorii”, „cal”) este exact 4.184 J. A fost inițial definit astfel încât capacitatea specifică de căldură a apei lichide să fie de 1 cal⋅ ° C −1 ⋅g −1 .
- „Caloria mare” (de asemenea „kilocalorie”, „kilogram-calorie” sau „calorie alimentară”; „kcal” sau „Cal”) este de 1000 de calorii mici, adică 4184 J, exact. A fost inițial definit astfel încât capacitatea specifică de căldură a apei să fie de 1 Cal⋅ ° C −1 ⋅kg −1 .
În timp ce aceste unități sunt încă utilizate în anumite contexte (cum ar fi kilogramul de calorii în nutriție ), utilizarea lor este acum depreciată în domeniile tehnic și științific. Când se măsoară căldura în aceste unități, unitatea capacității de căldură specifice este de obicei
- 1 cal⋅ ° C −1 ⋅g −1 („calorie mică”) = 1 Cal⋅ ° C −1 ⋅kg −1 = 1 kcal⋅ ° C −1 ⋅kg −1 („calorie mare”) = 4184 J ⋅kg −1 ⋅K −1 .
În ambele unități, capacitatea termică specifică a apei este de aproximativ 1. Combinațiile cal⋅ ° C −1 ⋅kg −1 = 4.184 J⋅kg −1 ⋅K −1 și kcal⋅ ° C −1 ⋅g −1 = 4.184.000 J⋅kg −1 ⋅K −1 nu par a fi utilizate pe scară largă.
Baza fizică a capacității termice specifice
Temperatura unui eșantion de substanță reflectă energia cinetică medie a particulelor sale constitutive (atomi sau molecule) în raport cu centrul său de masă. Cu toate acestea, nu toată energia furnizată unui eșantion de substanță va intra în creșterea temperaturii sale, exemplificată prin teorema echipației .
Gazele monatomice
Mecanica cuantică prezice că, la temperatura camerei și la presiunile obișnuite, un atom izolat într-un gaz nu poate stoca nicio cantitate semnificativă de energie decât sub forma energiei cinetice. Astfel, capacitatea de căldură per mol este aceeași pentru toate gazele monatomice (cum ar fi gazele nobile). Mai precis, și , unde este unitatea de gaz ideală (care este produsul constantei de conversie Boltzmann de la unitatea de energie microscopică kelvin la unitatea de energie macroscopică joule și numărul Avogadro ).
Prin urmare, capacitatea specifică de căldură (pe unitate de masă, nu pe mol) a unui gaz monatomic va fi invers proporțională cu greutatea sa atomică (adimensională) . Adică, aproximativ,
Pentru gazele nobile, de la heliu la xenon, aceste valori calculate sunt
| Gaz | El | Ne | Ar | Kr | Xe |
|---|---|---|---|---|---|
| 4.00 | 20.17 | 39,95 | 83,80 | 131,29 | |
| (J⋅K −1 ⋅kg −1 ) | 3118 | 618.3 | 312.2 | 148,8 | 94,99 |
| (J⋅K −1 ⋅kg −1 ) | 5197 | 1031 | 520.3 | 248,0 | 158.3 |
Gazele poliatomice
Pe de altă parte, o moleculă de gaz poliatomică (formată din doi sau mai mulți atomi legați împreună) poate stoca energia termică în alte forme, în afară de energia cinetică. Aceste forme includ rotația moleculei și vibrația atomilor față de centrul său de masă.
Aceste grade suplimentare de libertate sau „moduri” contribuie la capacitatea specifică de căldură a substanței. Și anume, atunci când energia termică este injectată într-un gaz cu molecule poliatomice, doar o parte din aceasta va crește energia cinetică și, prin urmare, temperatura; restul vor merge în acele alte grade de libertate. Pentru a obține aceeași creștere a temperaturii, va trebui să se furnizeze mai multă energie termică unui mol din substanța respectivă decât unui mol de gaz monatomic. Prin urmare, capacitatea termică specifică a unui gaz poliatomic depinde nu numai de masa sa moleculară, ci și de numărul de grade de libertate pe care le au moleculele.
Mecanica cuantică mai spune că fiecare mod de rotație sau vibrație poate lua sau pierde energie doar într-o anumită cantitate discretă (cuantă). În funcție de temperatură, energia termică medie pe moleculă poate fi prea mică în comparație cu cuantele necesare pentru a activa unele dintre aceste grade de libertate. Se spune că aceste moduri sunt „înghețate”. În acest caz, capacitatea specifică de căldură a substanței va crește odată cu temperatura, uneori într-un mod asemănător cu pașii, pe măsură ce mai multe moduri devin înghețate și încep să absoarbă o parte din energia termică de intrare.
De exemplu, capacitatea de căldură molară a azotului N
2la volum constant este (la 15 ° C, 1 atm), care este . Aceasta este valoarea așteptată din teorie dacă fiecare moleculă avea 5 grade de libertate. Acestea se dovedesc a fi trei grade ale vectorului vitezei moleculei, plus două grade de la rotația sa în jurul unei axe prin centrul de masă și perpendicular pe linia celor doi atomi. Datorită celor două grade suplimentare de libertate, capacitatea specifică de căldură a N
2(736 J⋅K −1 ⋅kg −1 ) este mai mare decât cea a unui gaz monoatomic ipotetic cu aceeași masă moleculară 28 (445 J⋅K −1 ⋅kg −1 ), cu un factor de5/3.
Această valoare pentru capacitatea specifică de căldură a azotului este practic constantă de sub -150 ° C până la aproximativ 300 ° C. În acest interval de temperatură, cele două grade suplimentare de libertate care corespund vibrațiilor atomilor, care se întind și comprimă legătura, sunt încă „înghețate”. Aproximativ la acea temperatură, acele moduri încep să „dezghețe” și, ca rezultat, începe să crească rapid la început, apoi mai lent, deoarece tinde spre o altă valoare constantă. Este de 35,5 J⋅K −1 ⋅mol −1 la 1500 ° C, 36,9 la 2500 ° C și 37,5 la 3500 ° C. Ultima valoare corespunde aproape exact valorii prezise pentru 7 grade de libertate pe moleculă.
Derivări ale capacității termice
Relația dintre capacitățile de căldură specifice
Pornind de la relația termodinamică fundamentală, se poate arăta,
Unde,
- este coeficientul de dilatare termică ,
- este compresibilitatea izotermă și
- este densitatea .
O derivare este discutată în articolul Relații între călduri specifice .
Pentru un gaz ideal , dacă este exprimat ca densitate molară în ecuația de mai sus, această ecuație se reduce pur și simplu la relația lui Mayer ,
unde și sunt proprietăți de căldură cu proprietăți intensive exprimate pe bază de mol la presiune constantă și, respectiv, la volum constant.
Capacitate termică specifică
Capacitatea termică specifică a unui material pe bază de masă este
care în absența tranzițiilor de fază este echivalent cu
Unde
- este capacitatea termică a unui corp realizat din materialul în cauză,
- este masa corpului,
- este volumul corpului și
- este densitatea materialului.
Pentru gaze și, de asemenea, pentru alte materiale sub presiune ridicată, este necesar să se facă distincția între diferite condiții limită pentru procesele luate în considerare (deoarece valorile diferă semnificativ între diferite condiții). Procesele tipice pentru care se poate defini o capacitate termică includ procese izobarice (presiune constantă ) sau izocorice (volum constant ). Capacitățile de căldură specifice corespunzătoare sunt exprimate ca
Un parametru în legătură este , capacitatea calorică volumetrică . În practica inginerească, pentru solide sau lichide semnifică adesea o capacitate de căldură volumetrică, mai degrabă decât una cu volum constant. În astfel de cazuri, capacitatea de căldură în masă specifică este adesea scris explicit cu subscriptului , după cum . Desigur, din relațiile de mai sus, pentru solide se scrie
Pentru compușii chimici omogeni puri cu masă moleculară sau molară stabilită sau se stabilește o cantitate molară , capacitatea de căldură ca proprietate intensivă poate fi exprimată pe o bază pe mol în loc de o bază pe masă prin următoarele ecuații similare cu ecuațiile pe masă:
unde n = numărul de moli din corp sau din sistemul termodinamic . Se poate face referire la o astfel de cantitate per mol ca capacitate termică molară pentru a o distinge de capacitatea termică specifică pe bază de masă.
Capacitate de căldură poltropică
Politropic Capacitatea termică se calculează la procese dacă toate proprietățile termodinamice (presiune, volum, temperatură) schimbare
Cele mai importante procese poltropice rulează între funcțiile adiabatică și izotermă, indicele poltropic este între 1 și exponentul adiabatic ( γ sau κ )
Capacitate de căldură fără dimensiuni
Adimensională Capacitatea termică a unui material este
Unde
- C este capacitatea termică a unui corp realizat din materialul în cauză (J / K)
- n este cantitatea de substanță din corp ( mol )
- R este constanta gazului (J⋅K −1 ⋅mol −1 )
- N este numărul de molecule din corp. (adimensional)
- k este constanta Boltzmann (J⋅K −1 )
Din nou, unitățile SI sunt prezentate de exemplu.
Citiți mai multe despre cantitățile dimensiunii unu la BIPM
În gaz ideal articol, capacitatea de căldură adimensionala este exprimată ca .
Capacitate termică la zero absolut
Din definiția entropiei
entropia absolută poate fi calculată prin integrarea de la temperatura zero kelvin la temperatura finală T f
Capacitatea de căldură trebuie să fie zero la temperatura zero pentru ca integrala de mai sus să nu producă o entropie absolută infinită, încălcând astfel a treia lege a termodinamicii . Unul dintre punctele forte ale modelului Debye este că (spre deosebire de modelul precedent al lui Einstein) prezice forma matematică adecvată a apropierii capacității de căldură spre zero, pe măsură ce se apropie temperatura zero absolută.
Faza solidă
Capacitatea maximă teoretică de căldură pentru gaze multi-atomice din ce în ce mai mari la temperaturi mai ridicate se apropie, de asemenea, de limita Dulong-Petit de 3 R , atâta timp cât aceasta este calculată pe mol de atomi, nu pe molecule. Motivul este că gazele cu molecule foarte mari, în teorie, au aproape aceeași capacitate de căldură la temperaturi ridicate ca solidele, lipsită doar de contribuția (mică) a capacității de căldură care provine din energia potențială care nu poate fi stocată între molecule separate într-un gaz.
Limita Dulong – Petit rezultă din teorema echipartiției și, ca atare, este valabilă doar în limita clasică a unui continuu de microstate , care este o limită de temperatură ridicată. Pentru elementele ușoare și nemetalice, precum și pentru majoritatea solidelor moleculare obișnuite bazate pe compuși de carbon la temperatura ambiantă standard , efectele cuantice pot juca, de asemenea, un rol important, așa cum se întâmplă în gazele multi-atomice. Aceste efecte se combină , de obicei , pentru a da cąldurii mai mici decât 3 R per mol de atomi în substanța solidă, deși în solide moleculare, cąldurii calculate per mol de molecule în solide moleculare pot fi mai mult de 3 R . De exemplu, capacitatea de căldură a gheții de apă la punctul de topire este de aproximativ 4,6 R per mol de molecule, dar doar 1,5 R per mol de atomi. Numărul mai mic de 3 R „per atom” (cum este cazul diamantului și beriliei) rezultă din „înghețarea” posibilelor moduri de vibrație pentru atomii de lumină la temperaturi adecvate scăzute, la fel ca în multe gaze cu atomi de masă redusă la temperaturile camerei. Datorită energiilor mari de legare a cristalelor, aceste efecte se văd în solide mai des decât lichidele: de exemplu, capacitatea de căldură a apei lichide este de două ori mai mare decât cea a gheții la aproape aceeași temperatură și este din nou aproape de 3 R per mol de atomi de maximul teoretic Dulong – Petit.
Pentru o analiză mai modernă și mai precisă a capacităților de căldură ale solidelor, în special la temperaturi scăzute, este util să se utilizeze ideea de fononi . Vezi modelul Debye .
Estimarea teoretică
Metoda integrală de cale Monte Carlo este o abordare numerică pentru determinarea valorilor capacității de căldură, bazată pe principii dinamice cuantice. Cu toate acestea, se pot face aproximări bune pentru gaze în multe state folosind metode mai simple descrise mai jos. Pentru multe solide compuse din atomi relativ grei (număr atomic> fier), la temperaturi necriogene, capacitatea de căldură la temperatura camerei se apropie de 3R = 24,94 jouli per kelvin per mol de atomi (legea Dulong – Petit, R este constanta gazului) . Aproximările temperaturii scăzute atât pentru gaze, cât și pentru solide la temperaturi mai mici decât temperaturile caracteristice ale lor Einstein sau temperaturile Debye pot fi realizate prin metodele lui Einstein și Debye discutate mai jos. Apă (lichid): CP = 4185,5 J⋅K −1 ⋅kg −1 (15 ° C, 101,325 kPa) Apă (lichid): CVH = 74,539 J⋅K −1 ⋅mol −1 (25 ° C) Pentru lichide și gaze, este important să cunoaștem presiunea la care se referă datele date privind capacitatea termică. Majoritatea datelor publicate sunt date pentru presiunea standard. Cu toate acestea, diferite condiții standard pentru temperatură și presiune au fost definite de diferite organizații. Uniunea Internațională de Chimie Pură și Aplicată (IUPAC) și-a schimbat recomandarea de la o atmosferă la valoarea rotundă 100 kPa (≈750.062 Torr).
Calculul de la primele principii
Metoda integrală de cale Monte Carlo este o abordare numerică pentru determinarea valorilor capacității de căldură, bazată pe principii dinamice cuantice. Cu toate acestea, se pot face aproximări bune pentru gaze în multe state folosind metode mai simple descrise mai jos. Pentru multe solide compuse din atomi relativ grei (număr atomic> fier), la temperaturi necriogene, capacitatea de căldură la temperatura camerei se apropie de 3 R = 24,94 jouli pe kelvin per mol de atomi ( legea Dulong – Petit , R este constanta gazului ). Aproximările la temperaturi scăzute atât pentru gaze, cât și pentru solide la temperaturi mai mici decât temperaturile caracteristice ale lor Einstein sau temperaturile Debye pot fi făcute prin metodele lui Einstein și Debye discutate mai jos.
Relația dintre capacitățile de căldură
Măsurarea capacității de căldură specifice la un volum constant poate fi dificil de prohibitiv pentru lichide și solide. Adică, micile schimbări de temperatură necesită de obicei presiuni mari pentru a menține un lichid sau solid la volum constant, ceea ce implică faptul că vasul care conține trebuie să fie aproape rigid sau cel puțin foarte puternic (vezi coeficientul de expansiune termică și compresibilitate ). În schimb, este mai ușor să măsori capacitatea de căldură la presiune constantă (permițând materialului să se extindă sau să se contracte liber) și să rezolvi capacitatea de căldură la volum constant folosind relații matematice derivate din legile termodinamice de bază.
Raportul capacității de căldură sau indicele adiabatic este raportul dintre capacitatea de căldură la presiune constantă și capacitatea de căldură la volum constant. Uneori este cunoscut și ca factor de expansiune izentropică.
Gaz ideal
Pentru un gaz ideal , evaluând derivații parțiali de mai sus conform ecuației de stare , unde R este constanta gazului , pentru un gaz ideal
Înlocuind
această ecuație se reduce pur și simplu la relația lui Mayer :
Diferențele de capacități termice definite de relația Mayer de mai sus sunt exacte doar pentru un gaz ideal și ar fi diferite pentru orice gaz real.
Capacitate termică specifică
Capacitatea termică specifică a unui material pe bază de masă este
care în absența tranzițiilor de fază este echivalent cu
Unde
- este capacitatea termică a unui corp realizat din materialul în cauză,
- este masa corpului,
- este volumul corpului,
- este densitatea materialului.
Pentru gaze și, de asemenea, pentru alte materiale sub presiune ridicată, este necesar să se facă distincția între diferite condiții limită pentru procesele luate în considerare (deoarece valorile diferă semnificativ între diferite condiții). Procesele tipice pentru care se poate defini o capacitate termică includ procese izobarice (presiune constantă ) sau izocorice (volum constant ). Capacitățile de căldură specifice corespunzătoare sunt exprimate ca
Din rezultatele secțiunii anterioare, împărțirea prin masă dă relația
Un parametru legat de acesta este , capacitatea de căldură volumetrică . În practica inginerească, pentru solide sau lichide semnifică adesea o capacitate de căldură volumetrică, mai degrabă decât una cu volum constant. În astfel de cazuri, căldura specifică este adesea scris explicit cu subscriptului , după cum . Desigur, din relațiile de mai sus, pentru solide se scrie
Pentru compușii chimici omogeni puri cu masă moleculară sau molară stabilită sau cu o cantitate molară , capacitatea de căldură ca proprietate intensivă poate fi exprimată pe bază de mol în loc de pe bază de masă prin următoarele ecuații analoage ecuațiilor pe masă:
unde n este numărul de moli din corp sau din sistemul termodinamic . Se poate face referire la o astfel de cantitate per mol ca capacitate de căldură molară pentru a o distinge de capacitatea de căldură specifică pe bază de masă.
Capacitate de căldură poltropică
Politropic Capacitatea termică se calculează la procese dacă toate proprietățile termodinamice (presiune, volum, temperatură) schimbarea:
Cele mai importante procese poltropice se desfășoară între funcțiile adiabatică și izotermă, indicele poltropic este între 1 și exponentul adiabatic ( γ sau κ ).
Capacitate de căldură fără dimensiuni
Adimensională Capacitatea termică a unui material este
Unde
- este capacitatea termică a unui corp realizat din materialul în cauză (J / K),
- n este cantitatea de substanță din corp ( mol ),
- R este constanta gazului (J / (K⋅mol)),
- N este numărul de molecule din corp (adimensional),
- k este constanta lui Boltzmann (J / (K⋅molecule)).
În articolul cu gaz ideal , capacitatea de căldură adimensională este exprimată ca și este legată acolo direct de jumătate din numărul de grade de libertate pe particulă. Acest lucru este valabil pentru gradele pătratice de libertate, o consecință a teoremei echipației .
Mai general, capacitatea de căldură adimensională corelează creșterea logaritmică a temperaturii cu creșterea entropiei adimensionale pe particulă , măsurată în naturi .
Alternativ, folosind logaritmi de bază-2, * corelează creșterea logaritmică a temperaturii de bază-2 cu creșterea entropiei adimensionale măsurată în biți .
Capacitate termică la zero absolut
Din definiția entropiei
entropia absolută poate fi calculată prin integrarea de la zero la temperatura finală T f :
Derivarea termodinamică
În teorie, capacitatea specifică de căldură a unei substanțe poate fi, de asemenea, derivată din modelarea sa termodinamică abstractă printr-o ecuație de stare și o funcție de energie internă .
Starea materiei într-un eșantion omogen
Pentru a aplica teoria, se ia în considerare eșantionul substanței (solid, lichid sau gazos) pentru care se poate defini capacitatea termică specifică; în special, că are o compoziție omogenă și o masă fixă . Să presupunem că evoluția sistemului este întotdeauna suficient de lentă pentru ca presiunea internă și temperatura să fie considerate uniforme pe tot parcursul. Presiunea ar fi egală cu presiunea aplicată acesteia de către incintă sau de un fluid din jur, cum ar fi aerul.
Starea materialului poate fi apoi specificată prin trei parametri: temperatura , presiunea și volumul său specific , unde este volumul probei. (Această cantitate este reciprocă a densității materialului .) Ca și , volumul specific este o proprietate intensivă a materialului și a stării sale, care nu depinde de cantitatea de substanță din probă.
Aceste variabile nu sunt independente. Stările permise sunt definite printr-o ecuație de stare care leagă aceste trei variabile: Funcția depinde de materialul luat în considerare. Energia internă specifică stocată intern în eșantion, pe unitate de masă, va fi apoi o altă funcție a acestor variabile de stare, care este, de asemenea, specifică materialului. Energia internă totală din eșantion va fi atunci .
Pentru unele materiale simple, cum ar fi un gaz ideal , se poate deriva din teoria de bază ecuația stării și chiar energia internă specifică În general, aceste funcții trebuie determinate experimental pentru fiecare substanță.
Conservarea Energiei
Valoarea absolută a acestei mărimi este nedefinită și (în sensul termodinamicii) starea „zero energie internă” poate fi aleasă în mod arbitrar. Cu toate acestea, prin legea conservării energiei , orice creștere infinitesimală a energiei interne totale trebuie să fie potrivită cu fluxul net de energie termică în eșantion, plus orice energie mecanică netă furnizată acestuia de incintă sau de mediul înconjurător pe aceasta. Acesta din urmă este , unde este schimbarea volumului eșantionului în acel pas infinitesimal. Prin urmare
de aici
Dacă volumul eșantionului (deci volumul specific al materialului) este menținut constant în timpul injectării cantității de căldură , atunci termenul este zero (nu se face nicio lucrare mecanică). Apoi, împărțind la ,
unde este schimbarea de temperatură care a rezultat din aportul de căldură. Partea stângă este capacitatea specifică de căldură la volum constant al materialului.
Pentru capacitatea de căldură la presiune constantă, este util să se definească entalpia specifică a sistemului ca sumă . O schimbare infinitesimală în entalpia specifică va fi atunci
prin urmare
Dacă presiunea este menținută constantă, al doilea termen din partea stângă este zero și
Partea stângă este capacitatea specifică de căldură la presiune constantă a materialului.
Conexiunea la ecuația de stare
În general, cantitățile infinitesimale sunt constrânse de ecuația de stare și de funcția specifică de energie internă. Și anume,
Aici denotă derivata (parțială) a ecuației de stare în raport cu argumentul său , păstrând fix celelalte două argumente, evaluate la starea în cauză. Celelalte derivate parțiale sunt definite în același mod. Aceste două ecuații pe cele patru trepte infinitesimale le constrâng în mod normal la un spațiu subspatiu liniar bidimensional cu posibile schimbări de stare infinitesimale, care depinde de material și de stare. Schimbările de volum constant și de presiune constantă sunt doar două direcții particulare în acest spațiu.
Această analiză deține, de asemenea, indiferent de modul în care creșterea energetică este injectată în probă, și anume prin conducerea căldurii , iradiere, inducție electromagnetică , dezintegrare radioactivă etc.
Relația dintre capacitățile de căldură
Pentru orice volum specific , indicați funcția care descrie modul în care presiunea variază în funcție de temperatură , așa cum este permis de ecuația de stare, când volumul specific al materialului este menținut constant la forță . În mod similar, pentru orice presiune , să fie funcția care descrie modul în care volumul specific variază cu temperatura, când presiunea este menținută constantă la . Și anume, aceste funcții sunt astfel încât
- și
pentru orice valori de . Cu alte cuvinte, graficele și sunt felii de suprafață definite de ecuația de stare, tăiate de planuri de constantă , respectiv constantă .
Apoi, din relația termodinamică fundamentală rezultă că
Această ecuație poate fi rescrisă ca
Unde
- este coeficientul de dilatare termică ,
- este compresibilitatea izotermă ,
ambele în funcție de stat .
Raportul capacității de căldură , sau indicele adiabatic, este raportul dintre capacitatea de căldură la presiune constantă și capacitatea de căldură la volum constant. Uneori este cunoscut și ca factor de expansiune izentropică.
Calculul de la primele principii
Metoda integrală de cale Monte Carlo este o abordare numerică pentru determinarea valorilor capacității de căldură, bazată pe principii dinamice cuantice. Cu toate acestea, se pot face aproximări bune pentru gaze în multe state folosind metode mai simple descrise mai jos. Pentru multe solide compuse din atomi relativ grei (număr atomic> fier), la temperaturi necriogene, capacitatea de căldură la temperatura camerei se apropie de 3 R = 24,94 jouli per kelvin per mol de atomi ( legea Dulong-Petit , R este constanta gazului ). Aproximările temperaturii scăzute atât pentru gaze, cât și pentru solide la temperaturi mai mici decât temperaturile caracteristice ale lor Einstein sau temperaturile Debye pot fi realizate prin metodele lui Einstein și Debye discutate mai jos. Cu toate acestea, ar trebui să se acorde atenție consistenței acestor considerente ab-initio atunci când sunt utilizate împreună cu o ecuație de stare pentru materialul considerat.
Gaz ideal
Pentru un gaz ideal , evaluând derivații parțiali de mai sus conform ecuației de stare , unde R este constanta gazului , pentru un gaz ideal
Înlocuind
această ecuație se reduce pur și simplu la relația lui Mayer :
Diferențele de capacități termice definite de relația Mayer de mai sus sunt exacte doar pentru un gaz ideal și ar fi diferite pentru orice gaz real.
Vezi si
- Căldura specifică de topire (entalpia de fuziune)
- Căldura specifică de vaporizare (Entalpia de vaporizare)
- Linia Frenkel
- Raportul capacității termice
- Ecuația căldurii
- Coeficient de transfer termic
- Istoria termodinamicii
- Metoda Joback (estimarea capacităților de căldură)
- Căldură latentă
- Proprietățile materialului (termodinamică)
- Mecanica statistică cuantică
- Valoarea R (izolație)
- Căldură specifică de vaporizare
- Căldură specifică de topire
- Mecanica statistică
- Masă termică
- Baze de date termodinamice pentru substanțe pure
- Ecuații termodinamice
- Capacitate de căldură volumetrică
Note
Referințe
Lecturi suplimentare
- Emmerich Wilhelm & Trevor M. Letcher, Eds., 2010, Heat Capacities: Liquids, Solutions and Vapors , Cambridge, Marea Britanie: Royal Society of Chemistry, ISBN 0-85404-176-1 . O schiță foarte recentă a anumitor aspecte tradiționale ale subiectului titlului, inclusiv o recentă introducere de specialitate a teoriei sale, Emmerich Wilhelm, „Capacități de căldură: introducere, concepte și aplicații selectate” (capitolul 1, pp. 1-27), capitole despre metode experimentale tradiționale și mai contemporane, cum ar fi metode fotoacustice , de exemplu, Jan Thoen și Christ Glorieux, „Tehnici fototermice pentru capacități de căldură” și capitole despre noi interese de cercetare, inclusiv despre capacitățile de căldură ale proteinelor și ale altor sisteme polimerice (Cap. 16, 15), de cristale lichide (Cap. 17) etc.





































































































![{\ displaystyle \ left \ {{\ begin {array} {lcl} \ displaystyle \ mathrm {d} T {\ frac {\ partial F} {\ partial T}} (T, P, V) + \ mathrm {d } P {\ frac {\ partial F} {\ partial P}} (T, P, V) + \ mathrm {d} V {\ frac {\ partial F} {\ partial V}} (T, P, V ) & = & 0 \\ [2ex] \ displaystyle \ mathrm {d} T {\ frac {\ partial U} {\ partial T}} (T, P, V) + \ mathrm {d} P {\ frac {\ partial U} {\ partial P}} (T, P, V) + \ mathrm {d} V {\ frac {\ partial U} {\ partial V}} (T, P, V) & = & \ mathrm { d} U \ end {array}} \ right.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cc8cf5749fa03699f3476f5ee6027f8cdc8d5791)







![{\ displaystyle c_ {P} (T, P, V) -c_ {V} (T, P, V) = T \ left [{\ frac {\ mathrm {d} p_ {V}} {\ mathrm {d } T}} (T) \ right] \ left [{\ frac {\ mathrm {d} v_ {P}} {\ mathrm {d} T}} (T) \ right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/04f90f594f938b14485e0150c149c2087ed85b3a)

