Spermatogeneza - Spermatogenesis
| Spermatogeneza | |
|---|---|
 Tubul seminifer cu spermatozoizi maturizați. Pata H&E .
| |
 Un spermatozoid uman matur
| |
| Identificatori | |
| Plasă | D013091 |
| Terminologie anatomică | |
Spermatogeneza este procesul prin care spermatozoizii haploizi se dezvoltă din celulele germinale din tubulii seminiferi ai testiculului . Acest proces începe cu divizarea mitotică a celulelor stem situate aproape de membrana bazală a tubulilor. Aceste celule sunt numite celule stem spermatogoniale . Diviziunea mitotică a acestora produce două tipuri de celule. Celulele de tip A completează celulele stem, iar celulele de tip B se diferențiază în spermatocite primare . Spermatocitul primar se împarte meiotic ( Meioza I) în două spermatocite secundare; fiecare spermatocit secundar se împarte în două spermatide haploide egale prin Meioza II. Spermatidele sunt transformate în spermatozoizi (spermatozoizi) prin procesul de spermiogeneză . Acestea se dezvoltă în spermatozoizi maturi, cunoscuți și ca spermatozoizi . Astfel, spermatocitul primar dă naștere la două celule, spermatocitele secundare, iar cele două spermatocite secundare prin subdiviziunea lor produc patru spermatozoizi și patru celule haploide.
Spermatozoizii sunt mature de sex masculin gameți în multe organisme sexual de reproducere. Astfel, spermatogeneza este versiunea masculină a gametogenezei , din care echivalentul feminin este oogeneza . La mamifere apare în tubulii seminiferi ai testiculelor masculine în mod treptat. Spermatogeneza este foarte dependentă de condițiile optime pentru ca procesul să se desfășoare corect și este esențială pentru reproducerea sexuală . Metilarea ADN și modificarea histonelor au fost implicate în reglarea acestui proces. Începe la pubertate și, de obicei, continuă neîntrerupt până la moarte, deși se poate distinge o ușoară scădere a cantității de spermă produsă odată cu creșterea vârstei (vezi Infertilitatea masculină ).
Spermatogeneza începe în partea de jos a tuburilor seminifere și, progresiv, celulele merg mai adânc în tuburi și se deplasează de-a lungul acestuia până când spermatozoizii maturi ajung în lumen, unde sunt depuși spermatozoizii maturi. Împărțirea are loc asincron; dacă tubul este tăiat transversal, s-ar putea observa diferite stări de maturare. Un grup de celule cu stări de maturare diferite care sunt generate în același timp se numește undă spermatogenă.
Scop
Spermatogeneza produce gamete masculi maturi, denumiți în mod obișnuit spermatozoizi, dar mai specific cunoscuți ca spermatozoizi , care sunt capabili să fertilizeze gametul feminin omolog, ovocitul , în timpul concepției pentru a produce un individ unicelular cunoscut sub numele de zigot . Aceasta este piatra de temelie a reproducerii sexuale și implică cei doi gameti care contribuie ambii la jumătate din setul normal de cromozomi ( haploid ) pentru a rezulta un zigot cromozomal normal ( diploid ).
Pentru a păstra numărul cromozomilor din descendenți - care diferă între specii - unul din fiecare gamet trebuie să aibă jumătate din numărul obișnuit de cromozomi prezenți în alte celule ale corpului. În caz contrar, descendenții vor avea de două ori numărul normal de cromozomi și pot rezulta anomalii grave. La om, anomaliile cromozomiale care rezultă din spermatogeneza incorectă duc la defecte congenitale și malformații congenitale anormale ( sindrom Down , sindrom Klinefelter ) și, în majoritatea cazurilor, avort spontan al fătului în curs de dezvoltare.
Localizarea la oameni
Spermatogeneza are loc în cadrul mai multor structuri ale sistemului reproductiv masculin . Etapele inițiale apar în interiorul testiculelor și progresează către epididim, unde gametii în curs de dezvoltare se maturizează și sunt depozitați până la ejaculare . De tubulilor seminiferi ale testiculelor sunt punctul de plecare al procesului, unde spermatogonial celulele stem adiacente interior divide tubilor perete într - o direcție care pornește de la pereți și proceduri în partea interioară sau centripetă lumen -sa spermatozoizilor produse imature. Maturarea are loc în epididim. Localizarea [Testiculelor / Scrotului] este deosebit de importantă deoarece procesul de spermatogeneză necesită o temperatură mai scăzută pentru a produce spermă viabilă, în mod specific cu 1 ° -8 ° C mai mică decât temperatura normală a corpului de 37 ° C (98,6 ° F). Din punct de vedere clinic, mici fluctuații de temperatură, cum ar fi de la o curea de sprijin atletic, nu cauzează afectarea viabilității sau numărului spermei.
Durată
Pentru oameni, întregul proces de spermatogeneză este estimat în mod diferit ca durând 74 de zile (conform biopsiilor marcate cu tritiu) și aproximativ 120 de zile (conform măsurătorilor ceasului ADN). Inclusiv transportul pe sistemul ductal, durează 3 luni. Testiculele produc zilnic 200 până la 300 de milioane de spermatozoizi. Cu toate acestea, doar aproximativ jumătate sau 100 de milioane dintre acestea devin spermatozoizi viabili.
Etape
Întregul proces de spermatogeneză poate fi împărțit în mai multe etape distincte, fiecare corespunzând unui anumit tip de celulă la om. În tabelul următor, ploidia, numărul de copii și numărul cromozomilor / cromatidelor sunt pentru o celulă, în general înainte de sinteza și divizarea ADN-ului (în G1, dacă este cazul). Spermatocitul primar este arestat după sinteza ADN și înainte de divizare.
| Tipul celulei | ploidie / cromozomi la om | Numărul copiei ADN / cromatide la om | Proces introdus de celulă |
| spermatogoniu (tipuri Ad, Ap și B) | diploid (2N) / 46 | 2C / 46 | spermatocitogeneză ( mitoză ) |
| spermatocit primar | diploid (2N) / 46 | 4C / 2x46 | spermatidogeneza (meioza I) |
| două spermatocite secundare | haploide (N) / 23 | 2C / 2x23 | spermatidogeneza (meioza II) |
| patru spermatide | haploide (N) / 23 | C / 23 | spermiogeneza |
| patru spermatozoizi funcționali | haploide (N) / 23 | C / 23 | spermierea |
Spermatocitogeneza
Spermatocitogeneza este forma masculină a gametocitogenezei și are ca rezultat formarea de spermatocite care posedă jumătate din complementul normal al materialului genetic. În spermatocitogeneză, un spermatogoniu diploid , care se află în compartimentul bazal al tubilor seminiferi, se împarte mitotic, producând două celule intermediare diploide numite spermatocite primare . Fiecare spermatocit primar se mută apoi în compartimentul adluminal al tubulilor seminiferi și își duplică ADN-ul și ulterior suferă meioza I pentru a produce două spermatocite secundare haploide , care mai târziu se vor împărți încă o dată în spermatide haploide . Această diviziune implică surse de variație genetică, cum ar fi includerea aleatorie a cromozomilor parentali și încrucișarea cromozomială care crește variabilitatea genetică a gametului. Deteriorarea ADN - ului mașinilor de răspuns (DDR) joacă un rol important în spermatogenezei. Proteina FMRP se leagă de cromozomii meiotici și reglează dinamica utilajului DDR în timpul spermatogenezei. FMRP pare a fi necesar pentru repararea deteriorării ADN-ului .
Fiecare diviziune celulară de la un spermatogoniu la un spermatid este incompletă; celulele rămân conectate între ele prin punți de citoplasmă pentru a permite dezvoltarea sincronă. Nu toate spermatogonia se divid pentru a produce spermatocite; în caz contrar, furnizarea de spermatogonie s-ar epuiza. În schimb, celulele stem spermatogoniale se împart mitotic pentru a produce copii ale lor, asigurând o alimentare constantă de spermatogonie pentru a alimenta spermatogeneza.
Spermatidogeneza
Spermatidogeneza este crearea de spermatide din spermatocite secundare. Spermatocitele secundare produse mai devreme intră rapid în meioza II și se divid pentru a produce spermatide haploide. Concizia acestei etape înseamnă că spermatocitele secundare sunt rareori observate în studiile histologice .
Spermiogeneza
În timpul spermiogenezei, spermatidele încep să formeze o coadă prin creșterea microtubulilor pe unul dintre centrioli, care se transformă în corp bazal. Acești microtubuli formează un axonem . Mai târziu, centriolul este modificat în procesul de reducere a centrosomului . Partea anterioară a cozii (numită piesă mijlocie) se îngroașă deoarece mitocondriile sunt dispuse în jurul axonemului pentru a asigura furnizarea de energie. De asemenea, ADN-ul spermatid suferă ambalare, devenind foarte condensat. ADN-ul este ambalat mai întâi cu proteine nucleare de bază specifice, care sunt ulterior înlocuite cu protamine în timpul alungirii spermatidei. Cromatina strânsă rezultată este inactivă transcripțional. Aparatul Golgi înconjoară nucleul acum condensat, devenind acrosom .
Maturarea are loc apoi sub influența testosteronului, care elimină citoplasma și organele inutile rămase . Citoplasma în exces, cunoscută sub numele de corpuri reziduale , este fagocitată de celulele Sertoli din jur în testicule . Spermatozoizii rezultați sunt acum maturi, dar nu au motilitate. Spermatozoizii maturi sunt eliberați din celulele protectoare Sertoli în lumenul tubului seminifer într-un proces numit spermare .
Spermatozoizii nemotivi sunt transportați la epididim în lichid testicular secretat de celulele Sertoli cu ajutorul contracției peristaltice . În timp ce în epididim, spermatozoizii câștigă motilitate și devin capabili de fertilizare. Cu toate acestea, transportul spermatozoizilor maturi prin restul sistemului reproductiv masculin se realizează prin contracție musculară mai degrabă decât prin motilitatea recent dobândită a spermatozoizilor.
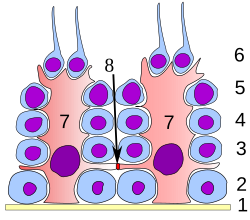
Rolul celulelor Sertoli
În toate etapele diferențierii, celulele spermatogene sunt în contact strâns cu celulele Sertoli despre care se crede că oferă suport structural și metabolic spermatozoizilor în curs de dezvoltare. O singură celulă Sertoli se extinde de la membrana bazală la lumenul tubului seminifer, deși procesele citoplasmatice sunt dificil de distins la nivel microscopic ușor.
Celulele Sertoli îndeplinesc o serie de funcții în timpul spermatogenezei, susțin gametii în curs de dezvoltare în următoarele moduri:
- Mențineți mediul necesar dezvoltării și maturizării, prin bariera sângelui-testicul
- Secretați substanțe care inițiază meioza
- Secretați lichidul testicular de susținere
- Proteină secretă de legare a androgenilor (ABP), care concentrează testosteronul în imediata apropiere a gametilor în curs de dezvoltare
- Testosteronul este necesar în cantități foarte mari pentru întreținerea tractului reproductiv, iar ABP permite un nivel mult mai ridicat de fertilitate
- Secreta hormoni care afectează controlul spermatogenezei glandei hipofizare, în special hormonul polipeptidic, inhibina
- Citoplasma reziduală fagocitată rămasă din spermiogeneză
- Secreția hormonului anti-Müllerian determină deteriorarea canalului Müllerian
- Protejați spermatidele de sistemul imunitar al bărbatului, prin bariera sângelui-testicul
- Contribuie la nișa de celule stem spermatogoniale
Cele molecule de adeziune intercelulară ICAM-1 și ICAM-1 solubil au efecte antagoniste asupra joncțiunilor strânse care formează bariera hemato-testicul. Moleculele ICAM-2 reglează aderența spermatidelor pe partea apicală a barierei (spre lumen ).
Factori care influențează
Procesul de spermatogeneză este extrem de sensibil la fluctuațiile din mediu, în special hormoni și temperatură. Testosteronul este necesar în concentrații locale mari pentru a menține procesul, care se realizează prin legarea testosteronului de proteina de legare a androgenilor prezenți în tubulii seminiferi. Testosteronul este produs de celulele interstițiale, cunoscute și sub denumirea de celule Leydig , care locuiesc adiacente tubulilor seminiferi.
Epiteliul seminifer este sensibil la temperaturi ridicate la om și la alte specii și va fi afectat negativ de temperaturi la fel de ridicate ca temperatura normală a corpului. În consecință, testiculele sunt situate în afara corpului într-un sac de piele numit scrot . Temperatura optimă este menținută la 2 ° C ( om ) (8 ° C șoarece ) sub temperatura corpului. Acest lucru se realizează prin reglarea fluxului sanguin și poziționarea către și departe de căldura corpului de către mușchiul cremasteric și mușchiul dartos neted din scrot.
Un mecanism important este schimbul termic între fluxurile de sânge arterial și venos testicular. Aranjamentele anatomice specializate constau din două zone de înfășurare de-a lungul arterei spermatice interne. Acest aranjament anatomic prelungește timpul de contact și schimbul termic dintre fluxul sanguin testicular arterial și venos și poate explica, în parte, gradientul de temperatură dintre sângele arterial aortic și testicular raportat la câini și berbeci. Mai mult, reducerea presiunii pulsului, care apare în treimea proximală a lungimii înfășurate a arterei spermatice interne. Mai mult, activitatea recombinazei spermatogene scade și se presupune că acesta este un factor important al degenerării testiculelor.
Deficiențele alimentare (cum ar fi vitaminele B, E și A), steroizii anabolizanți , metalele (cadmiu și plumb), expunerea la raze X, dioxina , alcoolul și bolile infecțioase vor afecta, de asemenea, rata spermatogenezei. În plus, linia germinală masculină este susceptibilă de deteriorarea ADN-ului cauzată de stresul oxidativ, iar această afectare are probabil un impact semnificativ asupra fertilizării și a sarcinii. Expunerea la pesticide afectează și spermatogeneza.
Control hormonal
Controlul hormonal al spermatogenezei variază în funcție de specie. La om mecanismul nu este complet înțeles; totuși se știe că inițierea spermatogenezei are loc la pubertate datorită interacțiunii dintre hipotalamus , glanda pituitară și celulele Leydig . Dacă glanda pituitară este îndepărtată, spermatogeneza poate fi încă inițiată de hormonul foliculostimulant (FSH) și testosteron . Spre deosebire de FSH, hormonul luteinizant (LH) pare să aibă un rol redus în spermatogeneză în afara producției de testosteron gonadal.
FSH stimulează atât producția de proteine de legare a androgenilor (ABP) de către celulele Sertoli , cât și formarea barierei hemato-testiculare . ABP este esențial pentru concentrarea testosteronului la niveluri suficient de ridicate pentru a iniția și menține spermatogeneza. Nivelurile de testosteron intratesticular sunt de 20-100 sau 50-200 de ori mai mari decât concentrația din sânge, deși există variații de la 5 la 10 ori în rândul bărbaților sănătoși. FSH poate iniția sechestrarea testosteronului în testicule, dar odată dezvoltat este necesar doar testosteron pentru a menține spermatogeneza. Cu toate acestea, creșterea nivelurilor de FSH va crește producția de spermatozoizii prin prevenirea apoptozei de tip A spermatogonia . Hormonul inhibin acționează pentru scăderea nivelului de FSH. Studiile efectuate pe modele de rozătoare sugerează că gonadotropinele (atât LH cât și FSH) susțin procesul spermatogenezei prin suprimarea semnalelor proapoptotice și, prin urmare, promovează supraviețuirea celulelor spermatogene.
Celulele Sertoli mediatizează ele însele părți ale spermatogenezei prin producerea de hormoni. Sunt capabili să producă hormonii estradiol și inhibină. Celulele Leydig sunt, de asemenea, capabile să producă estradiol în plus față de principalul lor produs testosteron. S-a constatat că estrogenul este esențial pentru spermatogeneză la animale. Cu toate acestea, sa constatat că un bărbat cu sindrom de insensibilitate la estrogen (un ERα defect ) produce spermatozoizi cu un număr normal de spermatozoizi , deși viabilitate anormală a spermei ; dacă a fost steril sau nu este neclar. Nivelurile de estrogen care sunt prea mari pot fi dăunătoare spermatogenezei datorită suprimării secreției de gonadotropină și prin extensie producția intratesticulară de testosteron. Prolactina pare de asemenea importantă pentru spermatogeneză.
Vezi si
Referințe
Lecturi suplimentare
- Okano, Tsukasa; Ishiniwa, Hiroko; Onuma, Manabu; Shindo, Junji; Yokohata, Yasushi; Tamaoki, Masanori (23 martie 2016). "Efectele radiațiilor de mediu asupra testiculelor și spermatogenezei la șoareci japonezi de câmp sălbatici mari (Apodemus speciosus) de la Fukushima" . Rapoarte științifice . 6 (1): 23601. Cod Bib : 2016NatSR ... 623601O . doi : 10.1038 / srep23601 . PMC 4804236 . PMID 27005329 .
- Johnson, L .; Blanchard, TL; Varner, DD; Scrutchfield, WL (noiembrie 1997). „Factori care afectează spermatogeneza la armăsar”. Teriogenologie . 48 (7): 1199–1216. doi : 10.1016 / s0093-691x (97) 00353-1 . PMID 16728209 .
- Bardin, CW (1991). „Axa hipofizo-testiculară”. În Yen, SSC; Jaffee, RB (eds.). Endocrinologia reproducerii (ediția a III-a). Philadelphia: WB Saunders. ISBN 0721632068.
- Chambers, Christopher V .; Shafer, Mary-Ann; Adger, Hoover; Ohm-Smith, Marilyn; Millstein, Susan G .; Irwin, Charles E .; Schachter, Julius; Sweet, Richard (februarie 1987). „Microflora uretrei la băieții adolescenți: relații cu activitatea sexuală și uretrita nongonococică”. Jurnalul de pediatrie . 110 (2): 314-321. doi : 10.1016 / s0022-3476 (87) 80180-4 . PMID 3100755 .
- Czyba, JC; Girod, C. (1980). „Dezvoltarea testiculului normal”. În Hafez, ESE (ed.). Testicul descendent și criptorhid . Haga: Martinus Nijhoff. ISBN 9024723337.
- Whitmore, Willet F .; Karsh, Lawrence; Gittes, Ruben F. (octombrie 1985). „Rolul epiteliului germinal și al spermatogenezei în supraviețuirea privilegiată a grefelor intratesticulare”. Jurnal de urologie . 134 (4): 782-786. doi : 10.1016 / s0022-5347 (17) 47438-6 . PMID 2863395 .