Izomeri de hidrogen - Spin isomers of hydrogen
Hidrogenul molecular apare în douăforme izomerice , una cu cele două rotiri nucleare ale protonuluialiniate paralel (ortohidrogen), cealaltă cu cele două rotiri ale protonului aliniate antiparalel (parahidrogen). Aceste două forme sunt adesea denumite izomeri de spin.
Parahidrogenul are o stare energetică mai mică decât ortohidrogenul. La temperatura camerei și echilibrul termic , excitația termică face ca hidrogenul să fie format din aproximativ 75% ortohidrogen și 25% parahidrogen. Când hidrogenul este lichidizat la temperatură scăzută, există o tranziție spontană lentă la un raport predominant para, energia eliberată având implicații pentru depozitare. Forma esențial pură de parahidrogen poate fi obținută la temperaturi foarte scăzute, dar nu este posibil să se obțină o probă care conține mai mult de 75% ortohidrogen prin încălzire.
Un amestec sau un amestec de 50:50 de orto și parahidrogen se poate face în laborator trecându-l peste un catalizator de oxid de fier (III) la temperatura de azot lichid (77 K) sau stocând hidrogen la 77 K timp de 2-3 ore în prezența cărbunelui activat. În absența unui catalizator, parahidrogenul în fază gazoasă durează zile pentru a se relaxa la hidrogenul normal la temperatura camerei, în timp ce durează ore pentru a face acest lucru în solvenți organici.
Spin - nucleare prevede H 2
Fiecare moleculă de hidrogen ( H
2) este format din doi atomi de hidrogen legați printr-o legătură covalentă . Dacă neglijăm proporția mică de deuteriu și tritiu care poate fi prezentă, fiecare atom de hidrogen este format dintr-un proton și un electron . Fiecare proton are un moment magnetic asociat , care este asociat cu rotirea protonului de 1 ⁄ 2 . În H
2moleculă, rotirile celor doi nuclei de hidrogen (protoni) se cuplează pentru a forma o stare tripletă cunoscută sub numele de ortohidrogen și o stare singletă cunoscută sub numele de parahidrogen .
Starea tripletă ortohidrogenă are centrifugare nucleară totală I = 1, astfel încât componenta de-a lungul unei axe definite poate avea cele trei valori M I = 1, 0 sau -1. Funcțiile de undă nucleare corespunzătoare sunt , și . Aceasta folosește notația standard bra-ket ; simbolul ↑ reprezintă funcția de undă spin-up și simbolul ↓ funcția de undă spin-down pentru un nucleu, deci ↑ ↓ înseamnă că primul nucleu este în sus și al doilea în jos. Fiecare nivel de energie ortohidrogen are apoi o degenerare de spin (nucleară) de trei, ceea ce înseamnă că corespunde cu trei stări ale aceleiași energii (în absența unui câmp magnetic). Starea parahidrogen singlet are numere cuantice de spin nuclear I = 0 și M I = 0, cu funcție de undă . Deoarece există o singură posibilitate, fiecare nivel parahidrogen are o degenerare de spin de una și se spune că este nedegenerat.
Niveluri de energie de rotație permise
Deoarece protonii au spin 1 ⁄ 2 , ei sunt fermioni și antisimetria permutațională a totalului H
2funcția de undă impune restricții asupra posibilelor stări de rotație ale celor două forme de H
2. Ortohidrogenul, cu funcții simetrice de centrifugare nucleară, poate avea doar funcții de undă de rotație care sunt antisimetrice în ceea ce privește permutarea celor doi protoni, corespunzătoare valorilor impare ale numărului cuantic de rotație J ; invers, parahidrogen cu o funcție de spin nuclear antisimetric, poate avea doar wavefunctions de rotație , care sunt simetrice în raport cu permutare a doi protoni, care corespund chiar J .
Forma para al cărui nivel cel mai mic este J = 0 este mai stabilă cu 1,455 kJ / mol decât forma orto al cărei nivel cel mai mic este J = 1. Raportul dintre numerele de molecule orto și para este de aproximativ 3: 1 la temperatura standard, unde multe rotații nivelurile de energie sunt populate, favorizând forma orto ca urmare a energiei termice. Cu toate acestea, la temperaturi scăzute, numai nivelul J = 0 este populat în mod apreciabil, astfel încât forma para domină la temperaturi scăzute (aproximativ 99,8% la 20 K). Căldura de vaporizare este de numai 0,904 kJ / mol. Ca urmare, hidrogenul orto-lichid care se echilibrează cu forma para eliberează suficientă energie pentru a provoca pierderi semnificative prin fierbere.
Proprietati termice
Aplicând aproximarea rigidă a rotorului , energiile și degenerările stărilor de rotație sunt date de:
- .
Funcția de partiție rotațională este scrisă în mod convențional ca:
- .
Cu toate acestea, atâta timp cât cei doi izomeri de spin nu sunt în echilibru, este mai util să scrieți funcții de partiție separate pentru fiecare:
Factorul de 3 în funcția de partiție pentru ortohidrogen explică degenerescența de spin asociată cu starea de spin de +1; când echilibrul între izomerii spin este posibil, atunci o funcție de partiție generală care încorporează această diferență de degenerare poate fi scrisă ca:
Energiile de rotație molară și capacitățile de căldură sunt derivate pentru oricare dintre aceste cazuri din:
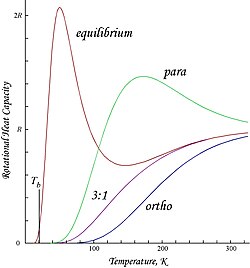
Graficele prezentate aici sunt energiile de rotație molare și capacitățile de căldură pentru orto și parahidrogen și raportul „normal” orto: para (3: 1) și amestecurile de echilibru:
Datorită restricției impuse de antisimetrie asupra posibilelor stări de rotație, ortohidrogenul are energie de rotație reziduală la temperatură scăzută în care aproape toate moleculele se află în starea J = 1 (moleculele în starea de triplet de rotire simetrică nu pot cădea în starea de rotație cea mai joasă și simetrică ) și posedă entropie de rotire nucleară din cauza tripletei degenerări a stării triplete. Energia reziduală este semnificativă, deoarece nivelurile de energie de rotație sunt relativ distanțate în H
2; decalajul dintre primele două niveluri atunci când este exprimat în unități de temperatură este de două ori temperatura de rotație caracteristică pentru H
2:
- .
Aceasta este intercepția T = 0 observată în energia molară a ortohidrogenului. Deoarece hidrogenul „normal” la temperatura camerei este un amestec orto: para 3: 1, energia sa de rotație reziduală molară la temperatură scăzută este (3/4) × 2 Rθ rot ≈ 1091 J / mol, care este ceva mai mare decât entalpia de vaporizarea hidrogenului normal, 904 J / mol la punctul de fierbere, T b ≈ 20.369 K. În special, punctele de fierbere ale parahidrogenului și ale hidrogenului normal (3: 1) sunt aproape egale; pentru parahidrogen ∆H vap ≈ 898 J / mol la T b ≈ 20.277 K și rezultă că aproape toată energia de rotație reziduală a ortohidrogenului este reținută în stare lichidă.
Cu toate acestea, ortohidrogenul este instabil termodinamic la temperaturi scăzute și se transformă spontan în parahidrogen. Acest proces nu are nici un mod de radiație de de-excitație naturală, deci este lent în absența unui catalizator care poate facilita interconversia stărilor de spin singlet și triplet. La temperatura camerei, hidrogenul conține 75% ortohidrogen, o proporție pe care procesul de lichefiere o păstrează dacă este efectuată în absența unui catalizator precum oxidul feric , cărbunele activ , azbestul platinizat, metalele pământurilor rare, compușii uraniului, oxidul crom sau unii compuși de nichel pentru a accelera conversia hidrogenului lichid în parahidrogen. Alternativ, se pot folosi echipamente frigorifice suplimentare pentru a absorbi încet căldura pe care fracția ortohidrogenă o va elibera (mai încet) pe măsură ce se transformă spontan în parahidrogen. Dacă ortohidrogenul nu este îndepărtat din hidrogenul lichidat rapid, fără un catalizator, căldura eliberată în timpul descompunerii sale poate fierbe până la 50% din lichidul inițial.
Istorie
Capacitatea neobișnuită de căldură a hidrogenului a fost descoperită în 1912 de Arnold Eucken . Cele două forme de hidrogen molecular au fost propuse pentru prima dată de Werner Heisenberg și Friedrich Hund în 1927. Ținând cont de acest cadru teoretic, parahidrogenul pur a fost sintetizat pentru prima dată de Paul Harteck și Karl Friedrich Bonhoeffer în 1929 la Institutul Kaiser Wilhelm de Chimie Fizică și Electrochimie . Când Heisenberg a primit premiul Nobel pentru fizică din 1932 pentru crearea mecanicii cuantice, această descoperire a „formelor alotrope de hidrogen” a fost evidențiată ca fiind cea mai notabilă aplicație a sa. Lucrări suplimentare privind proprietățile și reactivitatea chimică a parahidrogenului au fost efectuate în deceniul următor de Elly Agallidis și Georg-Maria Schwab .
Izolarea modernă a parahidrogenului pur a fost realizată folosind depunerea rapidă în vid a parahidrogenului solid gros de milimetri (p– H
2) probe care se remarcă prin calitățile optice excelente.
Utilizare în RMN și RMN
Atunci când un exces de parahidrogen este utilizat în timpul reacțiilor de hidrogenare (în loc de amestecul normal de ortohidrogen la parahidrogen de 3: 1), produsul rezultat prezintă semnale hiperpolarizate în spectrele RMN protonice , efect denumit PHIP (Parahydrogen Induced Polarization) sau, echivalent, PASADENA (Parahidrogenul și sinteza permit alinierea nucleară îmbunătățită dramatic; numit pentru prima recunoaștere a efectului de către Bowers și Weitekamp din Caltech ), fenomen care a fost folosit pentru a studia mecanismul reacțiilor de hidrogenare.
Amplificarea semnalului prin schimb reversibil (SABER) este o tehnică de hiperpolarizare a probelor fără modificarea lor chimică. Comparativ cu ortohidrogenul sau moleculele organice, o fracțiune mult mai mare a nucleilor de hidrogen din parahidrogen se aliniază cu un câmp magnetic aplicat. În SABRE, un centru metalic se leagă reversibil atât de molecula de testare, cât și de o moleculă de parahidrogen, facilitând molecula țintă pentru a prelua polarizarea parahidrogenului. Această tehnică poate fi îmbunătățită și utilizată pentru o gamă largă de molecule organice utilizând o moleculă intermediară cu „releu”, cum ar fi amoniacul. Amoniacul se leagă eficient de centrul metalic și preia polarizarea din parahidrogen. Amoniacul îi transferă apoi alte molecule care nu se leagă la fel de bine de catalizatorul metalic. Acest semnal RMN îmbunătățit permite analiza rapidă a unor cantități foarte mici de material și are un mare potențial pentru aplicații în imagistica prin rezonanță magnetică .
Deuteriu
Diatomic deuteriu ( D
2) are izomeri de spin nuclear precum hidrogenul diatomic, dar cu populații diferite ale celor două forme, deoarece nucleul deuteriu (deuteron) este un boson cu spin nuclear egal cu unul. Există șase funcții de undă de spin nuclear care sunt orto sau simetrice pentru schimbul celor două nuclee și trei care sunt para sau antisimetrice. Stările orto corespund nivelurilor de rotație pare cu funcții de rotație simetrice, astfel încât funcția de undă totală este simetrică așa cum este necesar pentru schimbul a doi bosoni, iar stările para corespund nivelurilor de rotație impare. Starea de bază ( J = 0) populată la temperatură scăzută este orto, iar la temperatura standard raportul orto: para este 2: 1.
Alte substanțe cu izomeri de spin
Alte molecule și grupe funcționale care conțin doi atomi de hidrogen, cum ar fi apa și metilen (CH 2 ), de asemenea , au orto- și para- forme ( de exemplu , orthowater și parawater), dar acest lucru este de mică importanță pentru proprietățile lor termice. Raportul lor orto: para diferă de cel al dihidrogenului. Formele de apă orto și para au fost recent izolate.
Oxigen molecular ( O
2) există, de asemenea, în trei stări triplete cu energie inferioară și într-o singură stare, ca oxigen triplet paramagnetic de bază și oxigen singlet diamagnetic puternic reactiv . Aceste stări apar din rotirile electronilor lor nepereche , nu din protoni sau nuclei.
Referințe
Lecturi suplimentare
- Aline Léon, Ed. 2008, Hydrogen Technology: Mobile and Portable Applications, pp. 93–101, New York, NY: Springer Science & Business, ISBN 3-540-69925-2 , vezi [1] , accesat la 10 mai 2015.
- Tihonov VI, Volkov AA (2002). "Separarea apei în izomerii ei orto și para" . Știință . 296 (5577): 2363. doi : 10.1126 / science.1069513 . PMID 12089435 . S2CID 26190863 .
- Mario E. Fajardo; Simon Tam (1997). Depunere rapidă de vapori de probe de parahidrogen solid, optic, gros și gros, pentru spectroscopie de izolare a matricei . Edwards AFB (Propulsion Directorate West): USAF Research Lab.CS1 maint: mai multe nume: lista autorilor ( link )
- Bowers, CR; Weitekamp, DP (1986). „Transformarea ordinii de simetrizare în magnetizarea cu spin nuclear prin reacție chimică și rezonanță magnetică nucleară” (PDF) . Fizic. Pr . Lett . 57 (21): 2645–2648. Cod Bib : 1986PhRvL..57.2645B . doi : 10.1103 / physrevlett.57.2645 . PMID 10033824 .
- A. Farkas (1935). Ortohidrogen, parahidrogen și hidrogen greu . Seria Cambridge de chimie fizică. Cambridge, Marea Britanie: CUP .
- Bonhoeffer KF , Harteck P (1929). „Para- și orto hidrogen”. Zeitschrift für Physikalische Chemie B . 4 (1-2): 113-141.
- Oxford Instruments, Data necunoscută, „Creșterea sensibilității spectroscopiei RMN utilizând parahidrogen”