Atrofia musculară a coloanei vertebrale - Spinal muscular atrophy
| Atrofia musculară a coloanei vertebrale | |
|---|---|
| Alte nume | Atrofie musculară autozomală recesivă proximală, 5q atrofie musculară spinală |
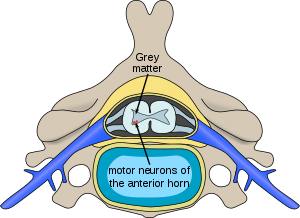 | |
| Localizarea neuronilor afectați de atrofia musculară a coloanei vertebrale în măduva spinării | |
| Specialitate | Neurologie |
| Simptome | Slăbiciune musculară progresivă |
| Complicații | Scolioză , contracturi articulare , pneumonie |
| Tipuri | Tastați de la 0 la 4 |
| Cauze | Mutație în SMN1 |
| Metoda de diagnosticare | Testarea genetică |
| Diagnostic diferentiat | Distrofia musculară congenitală , distrofia musculară Duchenne , sindromul Prader-Willi |
| Tratament | Îngrijire de susținere , medicamente |
| Medicament | Nusinersen , onasemnogene abeparvovec , Risdiplam |
| Prognoză | Variază după tip |
| Frecvență | 1 din 10.000 de persoane |
Atrofia musculară spinală ( SMA ) este o afecțiune neuromusculară rară care are ca rezultat pierderea neuronilor motori și pierderea progresivă a mușchilor . De obicei, este diagnosticat în copilărie sau în copilăria timpurie și, dacă nu este tratat, este cea mai frecventă cauză genetică a morții sugarului. Poate să apară și mai târziu în viață și apoi să aibă o evoluție mai ușoară a bolii. Caracteristica comună este slăbiciunea progresivă a mușchilor voluntari, mușchii brațului, picioarelor și respiratorii fiind afectați mai întâi. Problemele asociate pot include un control slab al capului, dificultăți la înghițire, scolioză și contracturi articulare .
Vârsta de debut și severitatea simptomelor formează baza clasificării tradiționale a atrofiei musculare spinale într-un număr de tipuri.
Atrofia musculară spinală se datorează unei anomalii ( mutații ) în gena SMN1 care codifică SMN , o proteină necesară pentru supraviețuirea neuronilor motori . Pierderea acestor neuroni din măduva spinării previne semnalizarea între creier și mușchii scheletici . O altă genă, SMN2 , este considerată o genă modificatoare a bolii, deoarece de obicei cu cât sunt mai multe copii SMN2 , cu atât evoluția bolii este mai ușoară. Diagnosticul SMA se bazează pe simptome și se confirmă prin teste genetice .
De obicei, mutația genei SMN1 este moștenită de la ambii părinți într-un mod autosomal recesiv , deși în aproximativ 2% din cazuri apare în timpul dezvoltării timpurii ( de novo ). Incidența atrofiei musculare a coloanei vertebrale la nivel mondial variază de la aproximativ 1 din 4.000 de nașteri la aproximativ 1 din 16.000 de nașteri, cu 1 din 7.000 și 1 din 10.000 citate în mod obișnuit pentru Europa și, respectiv, pentru SUA.
Rezultatele în cursul natural al bolii variază de la deces la câteva săptămâni după naștere în cele mai acute cazuri până la speranța de viață normală în formele SMA prelungite. Introducerea tratamentelor cauzale în 2016 a îmbunătățit semnificativ rezultatele. Medicamentele care vizează cauza genetică a bolii includ nusinersen , risdiplam și medicamentul pentru terapie genetică onasemnogene abeparvovec . Îngrijirea de susținere include terapie fizică , terapie ocupațională, suport respirator, suport nutrițional, intervenții ortopedice și suport pentru mobilitate .
Clasificare
5q SMA este o singură boală care se manifestă pe o gamă largă de gravitate, afectând sugarii prin adulți. Înainte ca genetica sa să fie înțeleasă, manifestările sale variate erau considerate a fi boli diferite - boala Werdnig-Hoffmann atunci când copiii mici erau afectați și boala Kugelberg-Welander pentru cazurile cu debut tardiv.
În 1990, s-a realizat că aceste boli separate formează un spectru al aceleiași tulburări. Atrofia musculară a coloanei vertebrale a fost apoi clasificată în 3-5 tipuri clinice bazate fie pe vârsta apariției simptomelor, fie pe funcția motorie maximă realizată. În prezent, consensul este că fenotipul atrofiei musculare spinale se întinde pe un continuu de simptome fără o delimitare clară a subtipurilor. Cu toate acestea, clasificarea tradițională, prezentată în tabelul de mai jos, este folosită și astăzi atât în cercetarea clinică, cât și uneori, în mod controversat, ca criteriu de acces la terapii.
| Tip | Eponim | Vârsta obișnuită de debut | Istorie naturală (fără tratament farmacologic) | OMIM |
|---|---|---|---|---|
| SMA 0 | Prenatal | Simptomele sunt observate la naștere și adesea apar în perioada prenatală ca mișcare fetală redusă. Copiii afectați au de obicei doar o singură copie a genei SMN2 și, de obicei, supraviețuiesc doar câteva săptămâni, chiar și cu suport respirator 24/7. Acest formular este foarte rar - reprezintă aprox. 2% din cazuri. | ||
|
SMA 1 (Infantil) |
Boala Werdnig – Hoffmann | 0-6 luni | Această formă este diagnosticată la aproximativ 50% dintre pacienți, la care boala se manifestă în primele câteva săptămâni sau luni de viață. SMA are apoi un debut rapid și neașteptat, cu diferite grupuri musculare care eșuează progresiv. Sugarii nu învață niciodată să stea nesupravegheați și majoritatea își pierd treptat cea mai mare parte a funcției musculare. Moartea este de obicei cauzată de eșecul mușchilor respiratori induși de pneumonie (frecvent, pneumonie prin aspirație ). Cu excepția cazului în care li se oferă asistență respiratorie și / sau tratament farmacologic timpuriu, bebelușii diagnosticați cu SMA tip 1 nu supraviețuiesc, în general, în ultimii doi ani. Cu suport respirator adecvat, cei cu fenotipuri mai ușoare de tip SMA 1, care reprezintă aproximativ 10% din cazurile de SMA 1, sunt cunoscute pentru a supraviețui până la adolescență și la maturitate, chiar și fără tratament farmacologic, deși necesită întotdeauna îngrijire non-stop. | 253300 |
|
SMA 2 (intermediar) |
Boala Dubowitz | 6–18 luni | Forma intermediară, diagnosticată la aproximativ 20% dintre pacienți, denotă persoanele care au reușit să mențină poziția șezând cel puțin un timp în viața lor, dar care nu au învățat niciodată să meargă nesuportate. Debutul slăbiciunii se observă de obicei la un timp cuprins între 6 și 18 luni de viață. Se știe că progresul variază foarte mult, unii oameni devin treptat mai slabi în timp, în timp ce alții printr-o întreținere atentă rămân relativ stabile. Mușchii corpului sunt slăbiți, iar sistemul respirator este o preocupare majoră, la fel ca și contracturile musculare și curbura coloanei vertebrale. Speranța de viață este redusă, chiar dacă majoritatea persoanelor cu SMA 2 trăiesc până la maturitate chiar și fără tratament. | 253550 |
|
SMA 3 (juvenil) |
Boala Kugelberg – Welander | > 12 luni | Forma juvenilă, diagnosticată la aproximativ 30% dintre pacienți, se manifestă după vârsta de 12 luni sau după ce copiii au învățat deja să facă cel puțin câțiva pași independenți. Boala progresează încet și majoritatea persoanelor cu SMA 3 își pierd capacitatea de mers pe jos cândva în viața lor, necesitând sprijin pentru mobilitate. Implicarea respiratorie este rară, iar speranța de viață este normală sau aproape normală. | 253400 |
|
SMA 4 (debut la adulți) |
Maturitate | Aceasta denotă forma cu debut la adulți, uneori clasificată și ca SMA cu debut tardiv de tip 3. Apare în cca. 5% dintre pacienți și se manifestă de obicei în deceniul al treilea sau al patrulea al vieții. Simptomele constau în slăbirea treptată a mușchilor picioarelor, ceea ce face adesea necesar ca pacientul să utilizeze mijloace de mers pe jos. Alte complicații sunt rare și speranța de viață nu este afectată. | 271150 |
Pentru comoditate, publicațiile axate pe îngrijire clasifică pacienții în „non-sitters”, „sitters” și „walkers” pe baza stării lor funcționale reale.
Dezvoltarea motorie și progresia bolii la persoanele cu SMA este de obicei evaluată utilizând scale funcționale validate - CHOP-INTEND (The Children's Hospital of Philadelphia Infant Test of Neuromuscular Disorders) sau HINE (Hammersmith Infant Neurological Examination) la sugari; și fie MFM (Motor Function Measure), fie una dintre mai multe variante ale HFMS (Hammersmith Functional Motor Scale) la pacienții mai în vârstă.
Eticheta omonimă Boala Werdnig – Hoffmann (uneori ortografiată greșit cu un singur n ) se referă la primele descrieri clinice ale SMA din copilărie de Johann Hoffmann și Guido Werdnig . Termenul omonim de boală Kugelberg – Welander este după Erik Klas Hendrik Kugelberg (1913–1983) și Lisa Welander (1909–2001) care au documentat prima dată forma cu debut tardiv și au deosebit-o de distrofia musculară. Foarte rar folosită boala Dubowitz (care nu trebuie confundată cu sindromul Dubowitz ) poartă numele lui Victor Dubowitz , un neurolog englez care a scris mai multe studii asupra fenotipului SMA intermediar.
semne si simptome
Simptomele variază în funcție de tipul SMA, de stadiul bolii, precum și de factorii individuali. Semnele și simptomele de mai jos sunt cele mai frecvente la tipul SMA sever 0 / I:
- Areflexie , în special la extremități
- În general slăbiciune musculară , tonusul muscular săraci , sau o lipsă de vlagă tendință de flop
- Dificultăți în atingerea etapelor de dezvoltare, dificultăți în șezut / în picioare / mers
- La copii mici: adoptarea unei poziții de picior-broască atunci când stați (șoldurile răpite și genunchii flecați)
- Pierderea forței mușchilor respiratori : tuse slabă , plâns slab (sugari), acumularea de secreții în plămâni sau gât, suferință respiratorie
- Tors în formă de clopot (cauzat de utilizarea doar a mușchilor abdominali pentru respirație) în tipul SMA sever
- Fasciculări (zvâcniri) ale limbii
- Dificultăți de supt sau de înghițire, hrană slabă
Cauze
Atrofia musculară a coloanei vertebrale este cauzată de o mutație genetică a genei SMN1 .
Cromozomul uman 5 conține două gene aproape identice la locația 5q13: o copie telomerică SMN1 și o copie centromerică SMN2 . La persoanele sănătoase, gena SMN1 codifică supraviețuirea proteinei neuronului motor (SMN) care, așa cum spune și numele său, joacă un rol crucial în supraviețuirea neuronilor motori . SMN2 Gena, pe de altă parte - din cauza unei variații într - o singură nucleotidă (840.C → T) - este supus splicing alternativ , la intersecția dintre intronului 6 la exonul 8, cu doar 10-20% din SMN2 transcripte care codifică un sistem complet supraviețuirea funcțională a proteinei neuronului motor (SMN-fl) și 80-90% din transcrieri rezultând un compus proteic trunchiat (SMNΔ7) care se degradează rapid în celulă.
La indivizii afectați de SMA, gena SMN1 este mutată în așa fel încât este incapabilă să codeze corect proteina SMN - fie din cauza unei ștergeri care apare la exonul 7, fie a altor mutații punctuale (care duc frecvent la conversia funcțională a SMN1 secvență în SMN2 ). Cu toate acestea, aproape toți oamenii au cel puțin o copie funcțională a genei SMN2 (majoritatea având 2-4 dintre ei) care încă codifică 10-20% din nivelul obișnuit al proteinei SMN, permițând unor neuroni să supraviețuiască. Cu toate acestea, pe termen lung, disponibilitatea redusă a proteinei SMN are ca rezultat moartea treptată a celulelor neuronilor motorii din cornul anterior al măduvei spinării și al creierului. Mușchii scheletici , care depind de toți neuronii motori pentru aportul neuronal, au acum o inervație scăzută (denumită și denervare ) și, prin urmare, au un aport scăzut din sistemul nervos central (SNC). Scăderea transmisiei impulsului prin neuronii motori duce la scăderea activității contractile a mușchiului denervat. În consecință, mușchii denervați suferă atrofie progresivă (deșeuri).
Mușchii extremităților inferioare sunt de obicei afectați mai întâi, urmați de mușchii extremităților superioare, ale coloanei vertebrale și ale gâtului și, în cazuri mai severe, mușchii pulmonari și masticativi. Mușchii proximali sunt întotdeauna afectați mai devreme și într-un grad mai mare decât mușchii distali .
Severitatea simptomelor SMA este în general legată de cât de bine pot rămâne genele SMN2 rămase pentru pierderea funcției SMN1 . Acest lucru depinde parțial de numărul de copii ale genei SMN2 prezente pe cromozom. În timp ce indivizii sănătoși poartă de obicei două copii ale genei SMN2 , persoanele cu SMA pot avea între 1 și 5 (sau mai multe) dintre ele; cu cât numărul de copii SMN2 este mai mare, cu atât severitatea bolii este mai mică. Astfel, majoritatea copiilor SMA tip I au una sau două copii SMN2 ; persoanele cu SMA II și III au de obicei cel puțin trei copii SMN2 ; iar persoanele cu SMA IV au în mod normal cel puțin patru dintre ele. Cu toate acestea, corelația dintre severitatea simptomelor și numărul de copii SMN2 nu este absolută și par să existe și alți factori care afectează fenotipul bolii.
Atrofia musculară spinală este moștenită într-un model autosomal recesiv , ceea ce înseamnă că gena defectă este localizată pe un autozom . Două copii ale genei defecte - una de la fiecare părinte - sunt necesare pentru a moșteni tulburarea: părinții pot fi purtători și nu sunt afectați personal. SMA pare să apară de novo (adică fără cauze ereditare) în aproximativ 2-4% din cazuri.
Atrofia musculară a coloanei vertebrale afectează indivizii din toate grupurile etnice, spre deosebire de alte tulburări autosomale recesive bine cunoscute, cum ar fi boala cu celule secera și fibroza chistică , care au diferențe semnificative în rata de apariție între grupurile etnice. Prevalența generală a SMA, de toate tipurile și între toate grupurile etnice, este în intervalul 1 la 10.000 de indivizi; frecvența genei este de aproximativ 1: 100, prin urmare, aproximativ una din 50 de persoane sunt purtători. Nu există consecințe cunoscute asupra sănătății a fi transportator. O persoană poate învăța statutul de purtător numai dacă copilul este afectat de SMA sau de a avea secvențiată gena SMN1 .
Frații afectați au de obicei o formă foarte similară de SMA. Cu toate acestea, există apariții ale diferitelor tipuri de SMA la frați - deși rare, aceste cazuri s-ar putea datora unor ștergeri de novo suplimentare ale genei SMN , care nu implică gena NAIP sau diferențelor în numerele de copii SMN2 .
Diagnostic
SMA este diagnosticat folosind teste genetice care detectează deleția homozigotă a genei SMN1 în peste 95% din cazuri și o mutație compusă SMN1 la restul pacienților. Testarea genetică se efectuează de obicei folosind o probă de sânge, iar MLPA este una dintre tehnicile de testare genetică utilizate mai frecvent, deoarece permite și stabilirea numărului de copii ale genei SMN2 , care are importanță clinică.
Simptomatic, SMA poate fi diagnosticat cu un anumit grad de certitudine numai la copiii cu forma acută care manifestă o boală progresivă cu respirație paradoxală , tonus muscular bilateral scăzut și reflexe tendinoase absente.
Diagnostic precoce
Diagnosticul precoce al SMA, în stadiul asimptomatic al bolii, permite
Testarea preimplantării
Diagnosticul genetic preimplantare poate fi folosit pentru a depista embrionii afectați de SMA în timpul fertilizării in vitro .
Testarea prenatală
Testarea prenatală pentru SMA este posibilă prin eșantionarea villusului corionic , analiza ADN-ului fetal fără celule și alte metode.
Screening pentru nou-născuți
Depistarea de rutină a nou-născuților pentru SMA devine din ce în ce mai obișnuită în țările dezvoltate, având în vedere disponibilitatea tratamentelor cauzale care sunt cele mai eficiente în stadiul asimptomatic al bolii. În 2018, screening-ul nou-născuților pentru SMA a fost adăugat pe lista SUA a testelor recomandate de screening pentru nou-născuți și, din aprilie 2020, a fost adoptat în 39 de state din SUA. Începând cu mai 2021, screening-ul SMA pentru nou-născuți a fost implementat în Taiwan și este în curs de implementare în Australia, Belgia, Canada, Franța, Germania, Olanda, Polonia, Serbia și Slovenia. În plus, se desfășoară proiecte pilot în Australia, China, Italia și Japonia.
Testarea purtătorului
Cei cu riscul de a fi purtători de ștergere SMN1 și, prin urmare, cu riscul de a avea descendenți afectați de SMA, pot fi supuși analizei purtătorului utilizând o probă de sânge sau salivă. Colegiul American de Obstetrica si Ginecologie recomanda tuturor oamenilor de gândire de a deveni gravide testate pentru a vedea dacă acestea sunt un purtător. Frecvența purtătoare a SMA este comparabilă cu alte tulburări precum talasemia și într-o cohortă din nordul Indiei sa constatat că este 1 din 38. Cu toate acestea, testarea genetică nu va putea identifica toți indivizii cu risc, deoarece aproximativ 2% din cazuri sunt cauzate de mutațiile de novo și 5% din populațiile normale au două copii ale SMN1 pe același cromozom, ceea ce face posibil să fie purtător având un cromozom cu două copii și un al doilea cromozom cu zero copii. Această situație va duce la un rezultat fals negativ , deoarece statutul de purtător nu va fi detectat corect printr-un test genetic tradițional.
Management
Gestionarea SMA variază în funcție de severitate și tip. În cele mai severe forme (tipurile 0/1), indivizii prezintă cea mai mare slăbiciune musculară care necesită intervenție promptă. În timp ce forma cea mai puțin severă (tipul 4 / debutul adulților), este posibil ca indivizii să nu solicite anumite aspecte ale îngrijirii decât mai târziu (decenii) în viață. În timp ce tipurile de SMA și indivizii din fiecare tip pot diferi, prin urmare, aspectele specifice ale îngrijirii individului pot diferi.
Medicament
Nusinersen (comercializat ca Spinraza) este utilizat pentru a trata atrofia musculară a coloanei vertebrale. Este un nucleotid antisens care modifică îmbinarea alternativă a genei SMN2 . Se administrează direct sistemului nervos central folosind o injecție intratecală . Nusinersen prelungește supraviețuirea și îmbunătățește funcția motorie la sugarii cu SMA. A fost aprobat pentru utilizare în SUA în 2016 și pentru utilizare în UE în 2017.
Onasemnogene abeparvovec (comercializat sub numele de Zolgensma) este un tratament de terapie genetică care folosește virusul auto-complementar adeno-asociat tip 9 (scAAV-9) ca vector pentru a livra transgenul SMN1 . Terapia a fost aprobată pentru prima dată în SUA în mai 2019 ca formulare intravenoasă pentru copii cu vârsta sub 24 de luni. A urmat aprobarea în Uniunea Europeană, Japonia și alte țări, deși adesea cu domenii de aprobare diferite.
Risdiplam (comercializat ca Evrysdi) este un medicament administrat pe cale orală sub formă lichidă. Este un derivat de piridazină care funcționează prin creșterea cantității de proteină funcțională a neuronului motor supraviețuitor produsă de gena SMN2 prin modificarea modelului său de îmbinare . Risdiplam a fost aprobat pentru prima dată pentru uz medical în Statele Unite în august 2020 și de atunci a fost aprobat în peste 30 de țări.
Respiraţie
Sistemul respirator este cel mai frecvent sistem afectat, iar complicațiile sunt principala cauză de deces la tipurile SMA 0/1 și 2. SMA tip 3 poate avea probleme respiratorii similare, dar este mai rar. Complicațiile care apar din cauza slăbirii mușchilor intercostali din cauza lipsei de stimulare a nervului. Diafragma este mai puțin afectată decât mușchii intercostali. Odată slăbiți, mușchii nu recuperează niciodată pe deplin aceeași capacitate funcțională pentru a ajuta la respirație și tuse, precum și la alte funcții. Prin urmare, respirația este mai dificilă și prezintă riscul de a nu obține suficient oxigen / respirație superficială și a clearance-ului insuficient al secrețiilor căilor respiratorii. Aceste probleme apar mai frecvent în timpul somnului, când mușchii sunt mai relaxați. Înghițirea mușchilor din faringe poate fi afectată, ceea ce duce la aspirație cuplată cu un mecanism slab de tuse crește probabilitatea de infecție / pneumonie . Mobilizarea și curățarea secrețiilor implică fizioterapie toracică manuală sau mecanică cu drenaj postural și dispozitiv manual sau mecanic de asistare a tusei. Pentru a ajuta la respirație, ventilația neinvazivă ( BiPAP ) este frecvent utilizată și traheostomia poate fi uneori efectuată în cazuri mai severe; ambele metode de ventilație prelungesc supraviețuirea într-un grad comparabil, deși traheostomia împiedică dezvoltarea vorbirii.
Nutriție
Cu cât tipul de SMA este mai sever, cu atât este mai probabil să existe probleme de sănătate legate de nutriție. Problemele de sănătate pot include dificultăți în hrănire, deschiderea maxilarului, mestecarea și înghițirea. Persoanele cu astfel de dificultăți pot avea un risc crescut de supra-alimentație sau subnutriție, eșecul de a prospera și aspirație. Alte probleme nutriționale, în special la persoanele care nu sunt ambulatorii (tipuri mai severe de SMA), includ alimentele care nu trec suficient prin stomac, reflux gastric, constipație, vărsături și balonare. Acolo, ar putea fi necesar la SMA tip I și la persoanele cu tip II mai sever să aibă un tub de alimentare sau gastrostomie . In plus, anomalii metabolice rezultate din SMA impiedica β-oxidare a acizilor grași în mușchi și poate duce la acidemia organice și daune musculare ca urmare, mai ales atunci când repaus alimentar. Se sugerează ca persoanele cu SMA, în special cele cu forme mai severe ale bolii, să reducă aportul de grăsimi și să evite postul prelungit (adică să mănânce mai frecvent decât persoanele sănătoase), precum și să aleagă alimente mai moi pentru a evita aspirația. În timpul unei boli acute, în special la copii, problemele nutriționale pot prezenta mai întâi sau pot exacerba o problemă existentă (exemplu: aspirație), precum și pot provoca alte probleme de sănătate, cum ar fi electrolit și tulburări ale zahărului din sânge.
Ortopedie
Problemele scheletice asociate cu mușchii slabi în SMA includ articulații strânse cu o mișcare limitată, luxații de șold, deformare a coloanei vertebrale, osteopenie, un risc crescut de fracturi și durere. Mușchii slabi care stabilizează în mod normal articulațiile, cum ar fi coloana vertebrală, duc la dezvoltarea cifozei și / sau a scoliozei și a contracturii articulare. Fuziunea coloanei vertebrale este uneori efectuată la persoanele cu SMA I / II odată ce ajung la vârsta de 8-10 ani pentru a ameliora presiunea unei coloane deformate pe plămâni. În plus, persoanele imobile, postura și poziția pe dispozitivele de mobilitate, precum și gama de exerciții de mișcare și întărirea oaselor pot fi importante pentru a preveni complicațiile. Persoanele cu SMA ar putea beneficia, de asemenea, foarte mult de diferite forme de fizioterapie , terapie ocupațională și kinetoterapie.
Dispozitivele ortotice pot fi utilizate pentru a susține corpul și pentru a ajuta mersul pe jos. De exemplu, orteze precum AFO (orteze ale gleznei) sunt utilizate pentru stabilizarea piciorului și pentru a ajuta mersul, TLSO (orteze sacrale lombare toracice) sunt utilizate pentru stabilizarea trunchiului. Tehnologiile de asistență pot ajuta la gestionarea mișcării și a activității zilnice și pot crește foarte mult calitatea vieții.
Alte
Deși inima nu este o problemă de rutină, a fost sugerată o legătură între SMA și anumite afecțiuni cardiace.
Copiii cu SMA nu diferă de populația generală în ceea ce privește comportamentul lor; dezvoltarea lor cognitivă poate fi ușor mai rapidă, iar anumite aspecte ale inteligenței lor sunt peste medie. În ciuda dizabilității lor, persoanele afectate de SMA raportează un grad ridicat de satisfacție din viață.
Îngrijirea paliativă în SMA a fost standardizată în Declarația de consens pentru standardul de îngrijire în atrofia musculară spinală, care a fost recomandată pentru adoptarea standard la nivel mondial.
Prognoză
În lipsa tratamentului farmacologic, persoanele cu SMA tind să se deterioreze în timp. Recent, supraviețuirea a crescut la pacienții cu SMA severe, cu suport respirator și nutrițional de susținere agresiv și proactiv.
Dacă nu sunt tratați, majoritatea copiilor diagnosticați cu SMA tip 0 și 1 nu ating vârsta de 4 ani, problemele respiratorii recurente fiind principala cauză a decesului. Cu o îngrijire adecvată, cazurile SMA mai ușoare de tip I (care reprezintă aproximativ 10% din toate cazurile SMA1) trăiesc la vârsta adultă. Supraviețuirea pe termen lung în SMA de tip I nu este suficient evidențiată; cu toate acestea, începând cu 2007 progresele în sprijinul respirator par să fi scăzut mortalitatea.
În SMA netratate de tip II, evoluția bolii este mai lentă, iar speranța de viață este mai mică decât populația sănătoasă. Moartea înainte de vârsta de 20 de ani este frecventă, deși mulți oameni cu SMA trăiesc pentru a deveni părinți și bunici. SMA de tip III are speranță de viață normală sau aproape normală dacă sunt respectate standardele de îngrijire. SMA de tip IV, cu debut la adulți, înseamnă de obicei doar afectarea mobilității și nu afectează speranța de viață.
Direcții de cercetare
De când a fost identificată cauza genetică subiacentă a SMA în 1995, au fost propuse și investigate mai multe abordări terapeutice care se concentrează în primul rând pe creșterea disponibilității proteinei SMN în neuronii motori. Principalele direcții de cercetare au fost după cum urmează:
Înlocuirea genei SMN1
Terapia genică în SMA urmărește restabilirea funcției genei SMN1 prin inserarea unei secvențe de nucleotide special create (o transgenă SMN1 ) în nucleul celulei utilizând un vector viral . Această abordare a fost exploatată de prima terapie genetică aprobată pentru tratamentul SMA, bazat pe scAAV- 9 onasemnogene abeparvovec.
Modulație alternativă de îmbinare SMN2
Această abordare urmărește modificarea îmbinării alternative a genei SMN2 pentru a o forța să codifice un procent mai mare de proteină SMN de lungime completă. Uneori se mai numește și conversie genică, deoarece încearcă să transforme funcțional gena SMN2 în gena SMN1 . Este mecanismul terapeutic al medicamentelor aprobate nusinersen și risdiplam.
Branaplam este un alt modulator de îmbinare SMN2 care a atins stadiul clinic de dezvoltare.
Din punct de vedere istoric, această direcție de cercetare a investigat și alte molecule. RG3039, cunoscut și sub numele de Quinazoline495, a fost un derivat propriu de chinazolină dezvoltat de Repligen și licențiat la Pfizer în martie 2014, care a fost întrerupt la scurt timp după ce a finalizat doar testele de fază I. PTK-SMA1 a fost un modulator brevetat de splicing cu molecule mici din grupul de tetracicline dezvoltat de Paratek Pharmaceuticals și pe cale să intre în dezvoltare clinică în 2010, care totuși nu s-a întâmplat niciodată. RG7800, dezvoltat de Hoffmann-La Roche, a fost o moleculă asemănătoare cu risdiplam care a fost supusă testării de fază I, dar a fost întreruptă din cauza toxicității pe animale. Conductele timpurii au inclus, de asemenea, ortovanadatul de sodiu și aclarubicina .
Oligonucleotidele antisens de tip morfolino , cu aceeași țintă celulară ca și nusinersen, rămân un subiect de cercetare în tratarea SMA și a altor boli cu o singură genă, inclusiv la University College London și la University of Oxford .
Activarea genei SMN2
Această abordare vizează creșterea expresiei (activității) genei SMN2 , crescând astfel cantitatea de proteină SMN de lungime completă disponibilă.
- Salbutamolul oral (albuterol), un medicament popular pentru astm , a arătat potențial terapeutic în SMA atât in vitro, cât și în trei studii clinice la scară mică, care au implicat pacienți cu tipuri 2 și 3 de SMA, pe lângă faptul că oferă beneficii respiratorii.
Câțiva compuși au arătat inițial promisiuni, dar nu au reușit să demonstreze eficacitatea în studiile clinice. Butirații ( butiratul de sodiu și fenilbutiratul de sodiu ) au avut o promisiune în studiile in vitro , dar un studiu clinic la persoanele simptomatice nu a confirmat eficacitatea acestora. Un alt studiu clinic la sugari pre-simptomatici de tip 1-2 a fost finalizat în 2015, dar nu au fost publicate rezultate.
- Acidul valproic (VPA) a fost utilizat în SMA pe bază experimentală în anii 1990 și 2000, deoarece cercetările in vitro au sugerat eficacitatea sa moderată. Cu toate acestea, nu a demonstrat nici o eficacitate în concentrații realizabile atunci când a fost supus unui studiu clinic amplu. De asemenea, s-a propus că poate fi eficient la un subgrup de persoane cu SMA, dar acțiunea sa poate fi suprimată de translocaza acizilor grași la alții. Alții susțin că poate agrava simptomele SMA. În prezent, nu este utilizat din cauza riscului de efecte secundare severe legate de utilizarea pe termen lung. O meta-analiză din 2019 a sugerat că VPA poate oferi beneficii, chiar și fără a îmbunătăți scorul funcțional.
- Hidroxicarbamida (hidroxiureea) s-a dovedit eficientă la modelele de șoarece și ulterior cercetată comercial de Novo Nordisk , Danemarca, dar nu a demonstrat niciun efect asupra persoanelor cu SMA în studiile clinice ulterioare.
Compușii care au crescut activitatea SMN2 in vitro, dar nu au ajuns la stadiul clinic includ hormonul de creștere , diferiți inhibitori ai histonei deacetilazei , benzamida M344, acizi hidroxamici (CBHA, SBHA, entinostat , panobinostat , trichostatin A , vorinostat ), prolactină , precum și naturale compuși polifenolici precum resveratrolul și curcumina . Celecoxib , un activator al căii p38 , este uneori utilizat în afara etichetei de către persoanele cu SMA pe baza unui singur studiu pe animale, dar o astfel de utilizare nu este susținută de cercetări în stadiu clinic.
Stabilizare SMN
Stabilizarea SMN vizează stabilizarea proteinei SMNΔ7, proteina defectă de scurtă durată codificată de gena SMN2 , astfel încât să poată susține celulele neuronale.
Nici un compus nu a fost adus în stadiul clinic. Aminoglicozidele au arătat capacitatea de a crește disponibilitatea proteinei SMN în două studii. Indoprofenul a oferit unele promisiuni in vitro .
Neuroprotecție
Medicamentele neuroprotectoare urmăresc să permită supraviețuirea neuronilor motori chiar și cu niveluri scăzute de proteine SMN.
- Olesoxima a fost un compus neuroprotector propriu dezvoltat de compania franceză Trophos , achiziționat ulterior de Hoffmann-La Roche , care a arătat efect stabilizator într-un studiu clinic de fază II care a implicat persoane cu SMA tipurile 2 și 3. Dezvoltarea sa a fost întreruptă în 2018, având în vedere concurență cu nusinersen și date mai slabe decât se așteptau provenind dintr-un proces de extensie deschis.
Dintre compușii studiați clinic care nu au demonstrat eficacitate, hormonul care eliberează tirotropina (TRH) a avut o promisiune într-un studiu clinic necontrolat deschis , dar nu s-a dovedit eficient într-un studiu dublu-orb controlat cu placebo . Riluzolul , un medicament care are beneficii clinice ușoare în scleroza laterală amiotrofică , a fost propus a fi testat în mod similar în SMA; cu toate acestea, un studiu 2008-2010 pe tipurile 2 și 3 de SMA a fost oprit din timp din cauza lipsei de rezultate satisfăcătoare. Alți compuși care au avut un anumit efect neuroprotector în cercetările in vitro, dar nu au trecut niciodată la studii in vivo includ antibiotice β-lactamice (de exemplu, ceftriaxonă ) și folistatină .
Restaurarea musculară
Această abordare își propune să contracareze efectul SMA prin vizarea țesutului muscular în locul neuronilor.
- Reldesemtiv (CK-2127107, CK-107) este un activator al troponinei scheletice dezvoltat de Cytokinetics în cooperare cu Astellas . Medicamentul vizează creșterea reactivității musculare, în ciuda semnalizării neuronale reduse. Molecula a arătat un anumit succes în studiul clinic de fază II la adolescenți și adulți cu SMA tipuri 2, 3 și 4.
- Apitegromab (SRK-015) este anticorp monoclonal care acționează pentru a bloca activarea proteinei musculare scheletice miostatină , promovând astfel creșterea țesutului muscular. Începând cu 2021, molecula a arătat succes ca tratament experimental suplimentar la pacienții pediatrici și adulți tratați cu nusinersen.
Celule stem
În timp ce celulele stem nu fac niciodată parte dintr-o terapie recunoscută pentru SMA, o serie de companii private, situate de obicei în țări cu supraveghere regulatorie laxă, profită de hype media și introduc pe piață injecțiile cu celule stem ca „leac” pentru o gamă largă de tulburări , inclusiv SMA. Consensul medical este că astfel de proceduri nu oferă niciun beneficiu clinic în timp ce prezintă un risc semnificativ, de aceea persoanele cu SMA sunt sfătuiți împotriva lor. În 2013-2014, un număr mic de copii SMA1 din Italia au primit injecții cu celule stem mandatate de instanță în urma înșelătoriei Stamina , dar tratamentul a fost raportat fără efect
Registrele
Persoanele cu SMA din Uniunea Europeană pot participa la cercetări clinice prin introducerea detaliilor lor în registrele gestionate de TREAT-NMD .
Vezi si
Referințe
Lecturi suplimentare
- Parano E, Pavone L, Falsaperla R, Trifiletti R, Wang C (august 1996). „Baza moleculară a eterogenității fenotipice la frații cu atrofie musculară spinală”. Analele Neurologiei . 40 (2): 247-51. doi : 10.1002 / ana.410400219 . PMID 8773609 . S2CID 42514712 .
- Wang CH, Finkel RS, Bertini ES, Schroth M, Simonds A, Wong B, Aloysius A, Morrison L, Main M, Crawford TO, Trela A (august 2007). "Declarație de consens pentru standardul de îngrijire în atrofia musculară a coloanei vertebrale". Journal of Child Neurology . 22 (8): 1027–49. doi : 10.1177 / 0883073807305788 . PMID 17761659 . S2CID 6478040 .
linkuri externe
| Clasificare | |
|---|---|
| Resurse externe |


