Staphylococcus aureus -Staphylococcus aureus
| Staphylococcus aureus | |
|---|---|
|
|
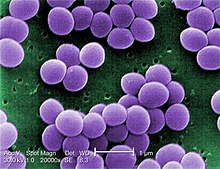
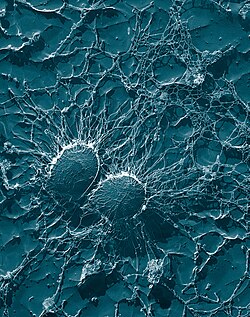
| Micrografie electronică de scanare a S. aureus ; culoare falsă adăugată | |
|
Clasificare științifică |
|
| Domeniu: | Bacterii |
| Phylum: | Firmicute |
| Clasă: | Bacili |
| Ordin: | Bacillales |
| Familie: | Stafilococacee |
| Gen: | Stafilococ |
| Specii: |
S. aureus
|
| Numele binomului | |
|
Staphylococcus aureus
1884. Rosenbach
|
|
| Staphylococcus aureus | |
|---|---|
| Alte nume | Staph aureus , S. aureus |
| Specialitate | Boală infecțioasă |
| Tipuri | Staphylococcus Aureus susceptibil la meticilină, Staphylococcus aureus rezistent la meticilină |
| Cauze | Staphylococcus aureus bacterii |
| Diagnostic diferentiat | alte infecții bacteriene, virale și fungice, |
| Prevenirea | spălarea mâinilor, curățarea suprafețelor |
| Medicament | Antibiotice |
| Frecvență | 20% până la 30% din populația umană deseori fără simptome |
Staphylococcus aureus este un gram-pozitiv în formă rotundă bacterie , un membru al Firmicutes , și este un membru obișnuit al microbiotei a corpului, frecvent in tractul respirator superior și pe piele . Este adesea pozitiv pentru reducerea catalazei și a nitraților și este un anaerob facultativ care poate crește fără a fi nevoie de oxigen. Deși S. aureus acționează de obicei ca un comensal al microbiotei umane, acesta poate deveni și un agent patogen oportunist , fiind o cauză frecventă a infecțiilor cutanate, inclusiv abcese , infecții respiratorii, cum ar fi sinuzită și intoxicații alimentare . Tulpinile patogene promovează adesea infecțiile prin producerea de factori de virulență, cum ar fi toxine proteice puterniceși expresia unei proteine de suprafață celulară care leagă și inactivează anticorpii . Aparițiatulpinilor de S. aureus rezistente la antibiotice, cum ar fi S. aureus rezistente la meticilină (MRSA), reprezintă o problemă mondială în medicina clinică . În ciuda multor cercetări și dezvoltări , nua fost aprobatniciun vaccin pentru S. aureus .
Se estimează că 20% până la 30% din populația umană sunt purtători pe termen lung de S. aureus, care pot fi găsiți ca parte a florei normale a pielii , în nări și ca locuitor normal al tractului reproductiv inferior al femeilor. S. aureus poate provoca o serie de boli, de la infecții minore ale pielii, cum ar fi coșuri , impetigo , furuncule , celulită , foliculită , carbuncule , sindromul pielii opărite și abcese , la boli care pun viața în pericol, cum ar fi pneumonia , meningita , osteomielita , endocardita , sindrom de șoc toxic , bacteriemie și sepsis . Este încă una dintre cele mai frecvente cinci cauze ale infecțiilor dobândite în spital și este adesea cauza infecțiilor plăgii după intervenția chirurgicală . În fiecare an, aproximativ 500.000 de pacienți din spitalele din Statele Unite contractă o infecție stafilococică, în principal de S. aureus . Până la 50.000 de decese în fiecare an în SUA sunt legate de infecțiile cu S. aureus .
Istorie
Descoperire
În 1881, Alexander Ogston , chirurg scoțian, a descoperit că Staphylococcus poate provoca infecții ale plăgii după ce a observat grupuri de bacterii în puroi dintr-un abces chirurgical în timpul unei proceduri pe care a efectuat-o. El l-a numit Staphylococcus după aspectul său grupat, evident la microscop. Apoi, în 1884, omul de știință german Friedrich Julius Rosenbach a identificat Staphylococcus aureus , discriminând și separându-l de Staphylococcus albus , o bacterie înrudită. La începutul anilor 1930, medicii au început să folosească un test mai raționalizat pentru a detecta prezența unei infecții cu S. aureus prin testarea coagulazei , care permite detectarea unei enzime produse de bacterie. Înainte de anii 1940, infecțiile cu S. aureus erau fatale la majoritatea pacienților. Cu toate acestea, medicii au descoperit că utilizarea penicilinei ar putea vindeca infecțiile cu S. aureus . Din păcate, până la sfârșitul anilor 1940, rezistența la penicilină a devenit răspândită în rândul acestei populații de bacterii și au început să apară focare ale tulpinii rezistente.
Evoluţie
Staphylococcus aureus poate fi clasificat în zece descendențe umane dominante. Există, de asemenea, numeroase linii minore, dar acestea nu sunt văzute atât de des în populație. Genomurile bacteriilor din aceeași descendență sunt în mare parte conservate, cu excepția elementelor genetice mobile . Elementele genetice mobile care sunt comune în S. aureus includ bacteriofagii, insulele de patogenitate , plasmidele , transpozonii și cromozomii casetei stafilococici. Aceste elemente au permis S. aureus să evolueze continuu și să câștige noi trăsături. Există o mare variație genetică în cadrul speciei S. aureus . Un studiu realizat de Fitzgerald și colab. (2001) au relevat că aproximativ 22% din genomul S. aureus este necodificator și, prin urmare, poate diferi de la o bacterie la alta. Un exemplu al acestei diferențe este văzut în virulența speciei. Doar câteva tulpini de S. aureus sunt asociate cu infecții la om. Acest lucru demonstrează că există o gamă largă de abilități infecțioase în cadrul speciei.
S-a propus că un motiv posibil pentru o mare eterogenitate în cadrul speciei s-ar putea datora dependenței sale de infecții eterogene. Acest lucru se întâmplă atunci când mai multe tipuri diferite de S. aureus provoacă o infecție în cadrul unei gazde. Diferitele tulpini pot secreta enzime diferite sau pot aduce rezistențe antibiotice diferite grupului, crescând capacitatea sa patogenă. Astfel, este nevoie de un număr mare de mutații și achiziții de elemente genetice mobile.
Un alt proces evolutiv notabil în cadrul speciei S. aureus este co-evoluția sa cu gazdele sale umane. De-a lungul timpului, această relație parazitară a dus la capacitatea bacteriei de a fi transportată în nazofaringele oamenilor fără a provoca simptome sau infecții. Acest lucru îi permite să fie transmis în întreaga populație umană, sporindu-și aptitudinea ca specie. Cu toate acestea, doar aproximativ 50% din populația umană este purtătoare de S. aureus , cu 20% ca purtători continui și 30% ca intermitenți. Acest lucru îi face pe oamenii de știință să creadă că există mulți factori care determină dacă S. aureus este transportat asimptomatic la oameni, inclusiv factori care sunt specifici unei persoane individuale. Conform unui studiu realizat în 1995 de Hofman și colab., Acești factori pot include vârsta, sexul, diabetul și fumatul. De asemenea, au determinat unele variații genetice la oameni care duc la o capacitate crescută de colonizare a S. aureus , în special un polimorfism în gena receptorului glucocorticoid care are ca rezultat o producție mai mare de corticosteroizi . În concluzie, există dovezi că orice tulpină a acestei bacterii poate deveni invazivă, deoarece aceasta este foarte dependentă de factorii umani.
Deși S. aureus are rate reproductive și micro-evolutive rapide, există multiple bariere care împiedică evoluția cu specia. O astfel de barieră este AGR, care este un regulator global al genei accesorii în cadrul bacteriilor. Acest regulator a fost legat de nivelul de virulență al bacteriilor. S-a constatat că pierderea mutațiilor funcționale în cadrul acestei gene crește capacitatea de sănătate a bacteriei care o conține. Astfel, S. aureus trebuie să facă un compromis pentru a-și spori succesul ca specie, schimbând virulența redusă pentru o rezistență crescută la medicamente. Un alt obstacol în calea evoluției este sistemul Sau1 Type I restriction modification (RM). Acest sistem există pentru a proteja bacteria de ADN-ul străin, digerându-l. Schimbul de ADN între aceeași filiație nu este blocat, deoarece acestea au aceleași enzime, iar sistemul RM nu recunoaște noul ADN ca fiind străin, dar transferul între filiații este blocat.
Microbiologie
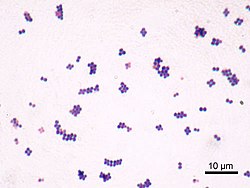
S. aureus ( / ˌ s t æ f ɪ l ə k ɒ k ə s ɔːr i ə s , - l oʊ - / , greacă σταφυλόκοκκος, "boabe de struguri-ciorchine", latin aureus , " de aur") este un bacterie facultativă aerobă , coccică (rotundă) Gram-pozitivă , cunoscută și sub numele de „stafilococ de aur” și „stafiră de aur”. S. aureus este nemotil și nu formează spori . În literatura medicală, bacteria este adesea denumită S. aureus , Staph aureus sau Staph a. . S. aureus apare ca stafilococi (ciorchini asemănători strugurilor) atunci când este privit la microscop și are colonii mari, rotunde, galben-aurii, adesea cu hemoliză , atunci când sunt cultivate pe plăci de agar din sânge . S. aureus se reproduce asexual prin fisiune binară . Separarea completă a celulelor fiice este mediată de S. aureus autolysin , iar în absența sau inhibarea țintită a acesteia, celulele fiice rămân atașate una de alta și apar ca grupuri.
S. aureus este catalază pozitivă (ceea ce înseamnă că poate produce enzima catalază). Catalaza convertește peroxidul de hidrogen ( H
2O
2) la apă și oxigen. Testele de activitate catalază sunt uneori folosite pentru a distinge stafilococii de enterococi și streptococi . Anterior, S. aureus a fost diferențiat de alți stafilococi prin testul coagulazei . Cu toate acestea, nu toate tulpinile de S. aureus sunt coagulaz-pozitive și identificarea incorectă a speciilor poate avea un impact asupra tratamentului și măsurilor de control.
Stafilococul este diferit de genul numit și relevant din punct de vedere medical Streptococcus .
Transformarea genetică naturală este un proces de reproducere care implică transferul ADN-ului de la o bacterie la alta prin mediul care intervine și integrarea secvenței donatorului în genomul receptorului prin recombinare omoloagă . S. aureus sa dovedit a fi capabil de transformare genetică naturală, dar numai la o frecvență scăzută în condițiile experimentale utilizate. Alte studii au sugerat că dezvoltarea competenței pentru transformarea genetică naturală poate fi substanțial mai mare în condiții adecvate, încă de descoperit.
Rolul în sănătate
La om, S. aureus poate fi prezent în tractul respirator superior, mucoasa intestinală și piele ca membru al microbiotei normale . Cu toate acestea, deoarece S. aureus poate provoca boli în anumite condiții de gazdă și mediu, este caracterizat ca un „patobiont”.
Rolul în boală

În timp ce S. aureus acționează de obicei ca o bacterie comensală , colonizând asimptomatic aproximativ 30% din populația umană, uneori poate provoca boli. În special, S. aureus este una dintre cele mai frecvente cauze de bacteremie și endocardită infecțioasă . În plus, poate provoca diverse infecții ale pielii și ale țesuturilor moi , în special atunci când barierele pielii sau ale mucoasei au fost încălcate.
Infecțiile cu S. aureus se pot răspândi prin contactul cu puroi dintr-o rană infectată, contactul piele-piele cu o persoană infectată și contactul cu obiecte utilizate de o persoană infectată, cum ar fi prosoape, cearșafuri, îmbrăcăminte sau echipament sportiv. Înlocuirea articulațiilor pune o persoană într-un risc deosebit de artrită septică , endocardită stafilococică (infecție a valvelor inimii) și pneumonie .
Măsurile preventive includ spălarea mâinilor deseori cu săpun și asigurarea faptului că faceți baie sau duș zilnic.
S. aureus este o cauză semnificativă a infecțiilor cronice cu biofilm pe implanturi medicale , iar represorul toxinelor face parte din calea infecției.
S. aureus poate rămâne latentă în corp ani de zile nedetectată. Odată ce simptomele încep să apară, gazda este contagioasă încă două săptămâni, iar boala generală durează câteva săptămâni. Dacă nu este tratată, boala poate fi însă mortală. Infecțiile cu penetrare profundă a S. aureus pot fi severe.
Infecții cutanate
Infecțiile cutanate sunt cea mai frecventă formă de infecție cu S. aureus . Acest lucru se poate manifesta în diferite moduri, inclusiv furuncule benigne mici , foliculită , impetigo , celulită și infecții mai severe, invazive ale țesuturilor moi.
S. aureus este extrem de răspândită la persoanele cu dermatită atopică , mai frecvent cunoscută sub numele de eczeme. Se găsește mai ales în locuri fertile, active, inclusiv la subsuori, păr și scalp. Coșurile mari care apar în aceste zone pot agrava infecția dacă sunt lacerate. Acest lucru poate duce la sindromul pielii opărite stafilococice , a cărui formă severă poate fi observată la nou-născuți .
Prezența S. aureus la persoanele cu dermatită atopică nu este o indicație pentru tratarea cu antibiotice orale, deoarece dovezile nu au arătat acest lucru pentru a aduce beneficii pacientului. Cu toate acestea, s-a constatat că antibioticele topice combinate cu corticosteroizii îmbunătățesc starea. Colonizarea S. aureus determină inflamația dermatitei atopice; Se crede că S. aureus exploatează defecte ale barierei cutanate a persoanelor cu dermatită atopică, declanșând expresia citokinelor și, prin urmare, exacerbând simptomele.
Intoxicație alimentară
S. aureus este, de asemenea, responsabil pentru otrăvirea alimentară . Este capabil să genereze toxine care produc intoxicații alimentare în corpul uman. Perioada de incubație durează una până la șase ore, boala însăși durând de la 30 de minute la 3 zile. Măsurile preventive pe care le puteți lua pentru a preveni răspândirea bolii includ spălarea bine a mâinilor cu apă și săpun înainte de a pregăti mâncarea. Stați departe de orice aliment dacă sunteți bolnav și purtați mănuși dacă apar răni deschise la mâini sau la încheieturi în timp ce pregătiți mâncarea. Dacă depozitați alimentele mai mult de 2 ore, păstrați alimentele sub 40,4 sau peste 140 ° F (4,4 sau 60 ° C).
Infecții osoase și articulare
S. aureus este bacteria responsabilă în mod obișnuit de toate infecțiile majore ale oaselor și articulațiilor. Aceasta se manifestă sub una din cele trei forme: osteomielită , artrită septică și infecție dintr-o intervenție chirurgicală de înlocuire .
Bacteremia
S. aureus este principala cauză a infecțiilor din sânge în toată lumea industrializată. Infecția este, în general, asociată cu rupturi ale pielii sau membranelor mucoasei datorate intervențiilor chirurgicale, rănirii sau utilizării dispozitivelor intravasculare , cum ar fi catetere , aparate de hemodializă sau medicamente injectate. Odată ce bacteriile au pătruns în sânge, ele pot infecta diferite organe, provocând endocardită infecțioasă , artrită septică și osteomielită . Această boală este deosebit de răspândită și severă la cei foarte tineri și foarte bătrâni.
Fără tratament cu antibiotice, bacteriemia S. aureus are o rată de fatalitate de aproximativ 80%. Cu tratamentul cu antibiotice, ratele de fatalitate variază de la 15% la 50% în funcție de vârsta și starea de sănătate a pacientului, precum și de rezistența la antibiotice a tulpinii de S. aureus .
Infecții implantare medicale
S. aureus se găsește adesea în biofilme formate pe dispozitive medicale implantate în corp sau pe țesutul uman. Se găsește în mod obișnuit cu un alt agent patogen, Candida albicans , formând biofilme multispecii. Acesta din urmă este suspectat că ajută S. aureus să pătrundă în țesutul uman. O mortalitate mai mare este legată de biofilmele multispeciale.
Biofilmul S. aureus este cauza predominantă a infecțiilor ortopedice legate de implant, dar se găsește și pe implanturile cardiace, grefele vasculare , diferite catetere și implanturile chirurgicale cosmetice. După implantare, suprafața acestor dispozitive devine acoperită cu proteine gazdă, care oferă o suprafață bogată pentru atașarea bacteriană și formarea biofilmului. Odată ce dispozitivul este infectat, acesta trebuie eliminat complet, deoarece biofilmul S. aureus nu poate fi distrus de tratamentele cu antibiotice.
Terapia actuală pentru infecțiile mediate de biofilmul S. aureus implică îndepărtarea chirurgicală a dispozitivului infectat urmată de tratament cu antibiotice. Tratamentul antibiotic convențional singur nu este eficient în eradicarea acestor infecții. O alternativă la tratamentul cu antibiotice postchirurgicale este utilizarea de margele de sulfat de calciu dizolvabile încărcate cu antibiotice, care sunt implantate cu dispozitivul medical. Aceste margele pot elibera doze mari de antibiotice la locul dorit pentru a preveni infecția inițială.
Sunt studiate noi tratamente pentru biofilmul S. aureus care implică nano particule de argint, bacteriofagi și agenți antibiotici de origine vegetală. Acești agenți au prezentat efecte inhibitoare împotriva S. aureus încorporate în biofilme. S-a constatat că o clasă de enzime are capacitatea de degradare a matricei biofilmului, astfel poate fi utilizată ca agenți de dispersie a biofilmului în combinație cu antibiotice.
Infecții la animale
S. aureus poate supraviețui la câini, pisici și cai și poate provoca bumblefoot la pui. Unii cred că câinii lucrătorilor din domeniul sănătății ar trebui considerați o sursă semnificativă de S. aureus rezistent la antibiotice , în special în perioade de focar. Într-un studiu din 2008 realizat de Boost, O'Donoghue și James, s-a constatat că doar aproximativ 90% din S. aureus au colonizat la câinii de companie prezentate ca rezistente la cel puțin un antibiotic. Regiunea nazală a fost implicată ca cel mai important loc de transfer între câini și oameni.
S. aureus este unul dintre agenții cauzali ai mastitei la vacile de lapte . Capsula sa mare de polizaharidă protejează organismul de recunoașterea prin apărarea imună a vacii .
Factorii de virulență
Enzime
S. aureus produce diferite enzime cum ar fi coagulaza ( coagulazele legate și libere) care coagulează plasma și acoperă celula bacteriană, probabil pentru a preveni fagocitoza . Hialuronidaza (cunoscută și sub numele de factor de răspândire) descompune acidul hialuronic și ajută la răspândirea acestuia. Deoxiribonucleaza , care descompune ADN-ul, protejează S. aureus de uciderea intermediară a capcanelor extracelulare neutrofile . S. aureus produce, de asemenea, lipază pentru a digera lipidele, stafilokinază pentru a dizolva fibrina și a ajuta la răspândire și beta-lactamază pentru rezistența la medicamente.
Toxine
În funcție de tulpină, S. aureus este capabil să secrete mai multe exotoxine , care pot fi clasificate în trei grupe. Multe dintre aceste toxine sunt asociate cu boli specifice.
- Superantigene
- Antigenele cunoscute sub numele de superantigene pot induce sindromul șocului toxic (TSS). Acest grup cuprinde 25 de enterotoxine stafilococice (SE) care au fost identificate până în prezent și denumite alfabetic (SEA - SEZ), incluzând enterotoxina de tip B , precum și toxina sindromului de șoc toxic TSST-1 care cauzează TSS asociate cu utilizarea tamponului . Sindromul șocului toxic se caracterizează prin febră , erupție eritematoasă , tensiune arterială scăzută , șoc , insuficiență multiplă a organelor și peelingul pielii . Lipsa anticorpului împotriva TSST-1 joacă un rol în patogeneza TSS. Alte tulpini de S. aureus pot produce o enterotoxină care este agentul cauzal al unui tip de gastroenterită . Această formă de gastroenterită este autolimitată, caracterizată prin vărsături și diaree la 1-6 ore după ingestia toxinei, cu recuperare în 8 până la 24 de ore. Simptomele includ greață, vărsături, diaree și dureri abdominale majore.
- Toxine exfoliative
- Toxinele exfoliative sunt exotoxine implicate în boala sindromului pielii opărite stafilococice (SSSS), care apare cel mai frecvent la sugari și copii mici. De asemenea, poate apărea ca epidemie în creșele spitalului. Activitatea de protează a toxinelor exfoliative determină descuamarea pielii observată cu SSSS.
- Alte toxine
- Toxinele stafilococice care acționează asupra membranelor celulare includ toxina alfa , toxina beta , toxina delta și mai multe toxine bicomponente. Tulpinile de S. aureus pot găzdui fagi , cum ar fi profagul Φ-PVL care produce leucocidina Panton-Valentine (PVL), pentru a crește virulența . Toxina bicomponentă PVL este asociată cu pneumonie necrozantă severă la copii. Genele care codifică componentele PVL sunt codificate pe un bacteriofag găsit în tulpinile MRSA asociate comunității.
ARN mic
Lista ARN-urilor mici implicate în controlul virulenței bacteriene în S. aureus este în creștere. Acest lucru poate fi facilitat de factori precum formarea crescută a biofilmului în prezența unor niveluri crescute de astfel de ARN-uri mici. De exemplu, RNAIII , SprD , SprC, RsaE , SprA1, SSR42, ArtR, SprX și Teg49 .
Strategii pentru reglarea post-transcripțională după regiunea 3'tradusă
Multe ARNm din S. aureus poartă trei regiuni primare netraduse (3'UTR) mai lungi de 100 de nucleotide , care pot avea o funcție de reglare.
O investigație ulterioară a ARNm i caR (ARNm care codifică represorul principalului compus expolizaharidic al matricei biofilmului bacteriilor) a demonstrat că legarea 3'UTR la 5 'UTR poate interfera cu complexul de inițiere a traducerii și poate genera un substrat dublu catenar pentru RNază III . Interacțiunea este între motivul UCCCCUG din 3'UTR și regiunea Shine-Dalagarno din 5'UTR. Ștergerea motivului a dus la acumularea represorului IcaR și inhibarea dezvoltării biofilmului. Formarea biofilmului este principala cauză a infecțiilor cu implant Staphylococcus .
Biofilm
Biofilmele sunt grupuri de microorganisme, cum ar fi bacteriile, care se atașează între ele și cresc pe suprafețe umede. S. aureus biofilm este încorporat într - un strat glycocalyx slime și poate consta din acizi teicoic, proteine gazda, ADN extracelular (Edna) și antigenul intercelulară polizaharid (PIA). Nu toate biofilmele S. aureus conțin PIA. Biofilmele S. aureus sunt importante în patogeneza bolii, deoarece pot contribui la rezistența la antibiotice și evaziunea sistemului imunitar. Biofilmul S. aureus are o rezistență ridicată la tratamentele cu antibiotice și răspuns imun al gazdei. O ipoteză pentru a explica acest lucru este că matricea biofilmului protejează celulele încorporate acționând ca o barieră pentru a preveni pătrunderea antibioticelor. Cu toate acestea, matricea biofilmului este compusă din mai multe canale de apă, astfel încât această ipoteză devine din ce în ce mai puțin probabilă, dar o matrice biofilm conține, probabil, enzime care degradează antibiotice, cum ar fi β-lactamazele, care pot preveni pătrunderea antibioticelor. O altă ipoteză este că condițiile din matricea biofilmului favorizează formarea celulelor persistente , care sunt celule bacteriene inactive, rezistente la antibiotice. Biofilmele S. aureus au, de asemenea, o rezistență ridicată la răspunsul imun al gazdei. Deși mecanismul exact de rezistență este necunoscut, biofilmele S. aureus au crescut în creștere sub prezența citokinelor produse de răspunsul imun al gazdei. Anticorpii gazdă sunt mai puțin eficienți pentru biofilmul S. aureus datorită distribuției eterogene a antigenului , unde un antigen poate fi prezent în unele zone ale biofilmului, dar complet absent din alte zone.
Studiile privind dezvoltarea biofilmului s-au dovedit a fi legate de modificările exprimării genelor. Există gene specifice care s-au dovedit a fi cruciale în diferitele etape de creștere a biofilmului. Două dintre aceste gene includ rocD și gudB, care codifică transaminaza enzimei ornitină-oxo-acidă și glutamatul dehidrogenază, care sunt importante pentru metabolismul aminoacizilor. Studiile au arătat că dezvoltarea biofilmului se bazează pe aminoacizi glutamină și glutamat pentru funcții metabolice adecvate.
Alte strategii imunoevazive
- Proteina A
Proteina A este ancorată la punțile pentaglicinei stafilococice peptidoglican (lanțuri de cinci reziduuri de glicină ) de transpeptidaza sortază A. Proteina A, o proteină care leagă IgG , se leagă de regiunea Fc a unui anticorp . De fapt, studiile care implică mutația genelor care codifică proteina A au dus la scăderea virulenței S. aureus măsurată prin supraviețuirea în sânge, ceea ce a condus la speculații că virulența contribuită la proteina A necesită legarea regiunilor Fc ale anticorpului.
Proteina A în diferite forme recombinante a fost utilizată de zeci de ani pentru a lega și purifica o gamă largă de anticorpi prin cromatografie de imunoaffinitate . Transpeptidazele, cum ar fi sortazele responsabile de ancorarea factorilor precum proteina A la peptidoglicanul stafilococic, sunt studiate în speranța dezvoltării de noi antibiotice pentru a viza infecțiile cu SARM.
- Pigmenți stafilococici
Unele tulpini de S. aureus sunt capabile să producă stafiloxantină - un pigment carotenoid de culoare aurie . Acest pigment acționează ca un factor de virulență , în primul rând fiind un antioxidant bacterian care ajută microbul să se sustragă de speciile reactive de oxigen pe care sistemul imunitar gazdă le folosește pentru a ucide agenții patogeni.
Tulpinile mutante de S. aureus modificate pentru a lipsi de stafiloxantină sunt mai puțin susceptibile de a supraviețui incubației cu o substanță chimică oxidantă, cum ar fi peroxidul de hidrogen , decât tulpinile pigmentate. Coloniile mutante sunt ucise rapid atunci când sunt expuse la neutrofile umane , în timp ce multe dintre coloniile pigmentate supraviețuiesc. La șoareci, tulpinile pigmentate cauzează abcese persistente atunci când sunt inoculate în răni, în timp ce rănile infectate cu tulpinile nepigmentate se vindecă rapid.
Aceste teste sugerează că tulpinile Staphylococcus utilizează stafiloxantina ca apărare împotriva sistemului imunitar normal al omului. Medicamentele concepute pentru a inhiba producția de stafiloxantină pot slăbi bacteria și își pot reînnoi susceptibilitatea la antibiotice. De fapt, datorită similitudinilor dintre căile de biosinteză a stafiloxantinei și colesterolului uman , sa demonstrat că un medicament dezvoltat în contextul terapiei de scădere a colesterolului blochează pigmentarea S. aureus și progresia bolii într-un model de infecție la șoarece .
Diagnosticul clasic
În funcție de tipul de infecție prezent, se obține în mod corespunzător un specimen adecvat și se trimite la laborator pentru identificare definitivă utilizând teste biochimice sau bazate pe enzime. O pată de Gram este efectuată mai întâi pentru a ghida calea, care ar trebui să prezinte bacterii Gram-pozitive tipice , coci, în grupuri. În al doilea rând, izolatul se cultivă pe agar de sare de manitol , care este un mediu selectiv cu NaCl 7,5% care permite creșterea S. aureus , producând colonii de culoare galbenă ca urmare a fermentării manitolului și a scăderii ulterioare a pH-ului mediului .
Mai mult, pentru diferențierea la nivel de specie, catalază (pozitivă pentru toate speciile de stafilococi ), coagulază ( formarea cheagurilor de fibrină , pozitivă pentru S. aureus ), ADNseza (zona de degajare pe agar DNază), lipază (o culoare galbenă și miros de miros rânced) ) și testele de fosfatază (o culoare roz) sunt toate efectuate. Pentru otrăvirea alimentară cu stafilococi, se poate efectua tiparea fagilor pentru a determina dacă stafilococii recuperați din alimente au fost sursa infecției.
Diagnosticarea rapidă și tastarea
Activitățile și alimentele recente pe care un pacient le-a consumat recent vor fi solicitate de un medic și se va efectua o examinare fizică pentru a examina orice simptome. Cu simptome mai severe, testele de sânge și cultura scaunelor pot fi în ordine. Laboratoarele de microbiologie de diagnostic și laboratoarele de referință sunt cheia pentru identificarea focarelor și a noilor tulpini de S. aureus . Progresele genetice recente au permis tehnici rapide și fiabile pentru identificarea și caracterizarea izolatelor clinice de S. aureus în timp real. Aceste instrumente susțin strategiile de control al infecțiilor pentru a limita răspândirea bacteriană și pentru a asigura utilizarea adecvată a antibioticelor. PCR cantitativă este utilizată din ce în ce mai mult pentru a identifica focarele de infecție.
Atunci când se observă evoluția S. aureus și capacitatea sa de a se adapta la fiecare antibiotic modificat, sunt utilizate două metode de bază cunoscute sub denumirea de „pe bază de bandă” sau „pe bază de secvență”. Ținând cont de aceste două metode, alte metode, cum ar fi tastarea secvenței multilocus (MLST), electroforeza pe gel cu câmp pulsat (PFGE), tastarea bacteriofagelor , tastarea locusului spa și tastarea SCCmec sunt adesea efectuate mai mult decât altele. Cu aceste metode, se poate determina unde au apărut tulpinile de MRSA și, de asemenea, unde se află în prezent.
Cu MLST, această tehnică de tastare folosește fragmente din mai multe gene de menaj cunoscute sub numele de aroE, glpF, gmk, pta, tip și yqiL . Aceste secvențe sunt apoi atribuite unui număr care dă unui șir de mai multe numere care servesc drept profil alelic. Deși aceasta este o metodă obișnuită, o limitare a acestei metode este menținerea microarray-ului care detectează profilurile nou alelice, făcându-l un experiment costisitor și consumator de timp.
Cu PFGE, o metodă care este încă foarte utilizată, datând de la primul său succes în anii 1980, rămâne capabilă să ajute la diferențierea izolatelor MRSA. Pentru a realiza acest lucru, tehnica folosește electroforeza pe mai multe geluri, împreună cu un gradient de tensiune pentru a afișa rezoluții clare ale moleculelor. Fragmentele S. aureus fac apoi tranziția în jos, producând modele specifice de bandă care sunt comparate ulterior cu alte izolate în speranța identificării tulpinilor înrudite. Limitările metodei includ dificultăți practice cu modele uniforme de bandă și sensibilitatea PFGE în ansamblu.
Tastarea locusului spa este, de asemenea, considerată o tehnică populară care utilizează o singură zonă locus într-o regiune polimorfă a S. aureus pentru a distinge orice formă de mutații. Deși această tehnică este adesea ieftină și consumă mai puțin timp, șansa de a pierde puterea discriminatorie făcând dificilă diferențierea dintre complexele clonale MLST exemplifică o limitare crucială.
Tratament
Pentru tulpinile sensibile, tratamentul de alegere pentru infecția cu S. aureus este penicilina . Un antibiotic derivat din unele specii fungice Penicillium , penicilina inhibă formarea de legături încrucișate peptidoglican care asigură rigiditatea și rezistența într-un perete celular bacterian . Inelul β-lactamic cu patru membri al penicilinei este legat de enzima DD-transpeptidază , o enzimă care, atunci când este funcțională, leagă lanțurile de peptidoglican care formează pereții celulari bacterieni. Legarea β-lactamei de DD-transpeptidaza inhibă funcționalitatea enzimei și nu mai poate cataliza formarea legăturilor încrucișate. Ca rezultat, formarea și degradarea peretelui celular sunt dezechilibrate, rezultând astfel moartea celulară. Cu toate acestea, în majoritatea țărilor, rezistența la penicilină este extrem de frecventă (> 90%), iar terapia de primă linie este cel mai frecvent un antibiotic β-lactamic rezistent la penicilinază (de exemplu, oxacilină sau flucloxacilină , ambele având același mecanism de acțiune ca penicilină) sau vancomicină, în funcție de tiparele de rezistență locale. Terapia combinată cu gentamicină poate fi utilizată pentru tratarea infecțiilor grave, cum ar fi endocardita , dar utilizarea sa este controversată din cauza riscului ridicat de afectare a rinichilor. Durata tratamentului depinde de locul infecției și de severitate. Rifampicina adjuvantă a fost utilizată în mod istoric în gestionarea bacteriemiei S aureus , dar dovezile studiilor controlate randomizate au arătat că acest lucru nu prezintă niciun beneficiu general față de terapia standard cu antibiotice.
Rezistența la antibiotice în S. aureus a fost neobișnuită când penicilina a fost introdusă pentru prima dată în 1943. Într-adevăr, placa Petri originală pe care Alexander Fleming de la Imperial College din Londra a observat activitatea antibacteriană a ciupercii Penicillium crește o cultură de S. aureus . Până în 1950, 40% din izolatele de S. aureus din spital erau rezistente la penicilină; până în 1960, aceasta a crescut la 80%.
Meticilino-rezistent Staphylococcus aureus (MRSA, adesea pronuntat / m ɜːr s ə / sau / ɛ m ɑːr ɛ s eɪ / ), este una dintre o serie de tulpini de mult temute S. aureus care au devenit rezistente la majoritatea β-lactamic antibiotice. Din acest motiv, vancomicina , un antibiotic glicopeptidic , este frecvent utilizată pentru combaterea MRSA. Vancomicina inhibă sinteza peptidoglicanului, dar spre deosebire de antibioticele β-lactamice, antibioticele glicopeptidice vizează și se leagă de aminoacizii din peretele celular, împiedicând formarea legăturilor încrucișate ale peptidoglicanului. Tulpinile MRSA se găsesc cel mai adesea asociate cu instituții precum spitalele, dar devin din ce în ce mai răspândite în infecțiile dobândite în comunitate.
Infecțiile minore ale pielii pot fi tratate cu unguent triplu cu antibiotice . Un agent local care este prescris este Mupirocin, un inhibitor al sintezei proteinelor care este produs în mod natural de Pseudomonas fluorescens și care a avut succes pentru tratamentul transportului nazal S. aureus.
Rezistență la antibiotic
Rezistența stafilococică la penicilină este mediată de producerea penicilinazei (o formă de beta-lactamază ): o enzimă care clivează inelul β-lactamic al moleculei de penicilină, făcând antibioticul ineficient. Antibioticele β-lactamice rezistente la penicilinază, cum ar fi meticilina , nafcilina , oxacilina , cloxacilina , dicloxacilina și flucloxacilina sunt capabile să reziste degradării de către penicilinaza stafilococică.
Rezistența la meticilină este mediată prin intermediul operonului mec , parte a meciului cromozomului casetei stafilococice ( mec SCC ). SCCmec este o familie de elemente genetice mobile, care este o forță motrice majoră a evoluției S. aureus . Rezistența este conferită de gena mecA , care codifică o proteină modificată de legare a penicilinei (PBP2a sau PBP2 ') care are o afinitate mai mică pentru legarea β-lactamelor (peniciline, cefalosporine și carbapeneme ). Acest lucru permite rezistența la toate antibioticele β-lactamice și elimină utilizarea lor clinică în timpul infecțiilor cu MRSA. Studiile au explicat că acest element genetic mobil a fost dobândit de diferite linii în evenimente de transfer de gene separate, indicând că nu există un strămoș comun al tulpinilor MRSA diferite. Interesant este că un studiu sugerează că MRSA sacrifică virulența, de exemplu, producția de toxine și invazivitatea, pentru supraviețuirea și crearea biofilmelor
Antibioticele aminoglicozidice , cum ar fi kanamicina , gentamicina , streptomicina , au fost odată eficiente împotriva infecțiilor stafilococice până când tulpinile au evoluat mecanisme pentru a inhiba acțiunea aminoglicozidelor, care are loc prin interacțiuni cu amină protonată și / sau hidroxil cu ARN ribozomal al subunității ribosomale bacteriene 30S . Trei mecanisme principale ale mecanismelor de rezistență la aminoglicozide sunt în prezent acceptate pe scară largă: enzime modificatoare ale aminoglicozidelor, mutații ribozomale și efluxul activ al medicamentului din bacterii.
Enzimele modificatoare de aminoglicozide inactivează aminoglicozida prin atașarea covalentă fie a unui fragment fosfat , nucleotid sau acetil, fie la amină, fie la grupul funcțional cheie de alcool (sau ambele grupuri) ale antibioticului. Aceasta schimbă sarcina sau împiedică steric antibioticul, scăzând afinitatea sa de legare ribozomală. În S. aureus , enzima modificatoare a aminoglicozidelor cel mai bine caracterizată este aminoglicozida adenililtransferază 4 'IA ( ANT (4') IA ). Această enzimă a fost rezolvată prin cristalografie cu raze X . Enzima este capabilă să atașeze o porțiune adenil la gruparea 4 'hidroxil a multor aminoglicozide, inclusiv kamamicină și gentamicină.
Rezistența la glicopeptide este mediată prin achiziționarea genei vanA , care provine din transpozonul Tn1546 găsit într-o plasmidă din enterococi și codifică o enzimă care produce un peptidoglican alternativ de care vancomicina nu se va lega.
Astăzi, S. aureus a devenit rezistent la multe antibiotice utilizate în mod obișnuit. În Marea Britanie, doar 2% din toate izolatele de S. aureus sunt sensibile la penicilină, cu o imagine similară în restul lumii. Penicilinele rezistente la β-lactamază (meticilină, oxacilină, cloxacilină și flucloxacilină) au fost dezvoltate pentru a trata S. aureus rezistent la penicilină și sunt încă utilizate ca tratament de primă linie. Meticilina a fost primul antibiotic din această clasă care a fost utilizat (a fost introdus în 1959), dar, doar doi ani mai târziu, primul caz de Staphylococcus aureus rezistent la meticilină (MRSA) a fost raportat în Anglia.
În ciuda acestui fapt, MRSA a rămas, în general, o constatare neobișnuită, chiar și în spitale, până în anii 1990, când prevalența MRSA în spitale a explodat și este acum endemică .
Infecțiile cu MRSA atât în spital, cât și în comunitate sunt tratate în mod obișnuit cu antibiotice non-β-lactamice, cum ar fi clindamicina (o lincozamină) și co-trimoxazolul (cunoscut și sub denumirea de trimetoprim / sulfametoxazol ). Rezistența la aceste antibiotice a dus, de asemenea, la utilizarea de antibiotice noi, cu spectru larg, anti-Gram-pozitive, cum ar fi linezolidul , datorită disponibilității sale ca medicament oral. Tratamentul de primă linie pentru infecțiile invazive grave datorate MRSA este în prezent antibiotice glicopeptidice (vancomicină și teicoplanină ). Apar o serie de probleme cu aceste antibiotice, cum ar fi necesitatea administrării intravenoase (nu este disponibil un preparat oral), toxicitatea și necesitatea de a monitoriza în mod regulat nivelurile de medicamente prin teste de sânge. De asemenea, antibioticele glicopeptidice nu pătrund foarte bine în țesuturile infectate (aceasta este o preocupare specială cu infecțiile creierului, meningelor și în endocardită ). Glicopeptidele nu trebuie utilizate pentru a trata S. aureus sensibil la meticilină (MSSA), deoarece rezultatele sunt inferioare.
Datorită nivelului ridicat de rezistență la peniciline și datorită potențialului pentru MRSA de a dezvolta rezistență la vancomicină, Centrele SUA pentru Controlul și Prevenirea Bolilor au publicat linii directoare pentru utilizarea adecvată a vancomicinei. În situațiile în care se știe că incidența infecțiilor cu SARM este mare, medicul curant poate alege să utilizeze un antibiotic glicopeptidic până când se cunoaște identitatea organismului infectant. După ce se confirmă că infecția se datorează unei tulpini de S. aureus susceptibile la meticilină , tratamentul poate fi schimbat în flucloxacilină sau chiar penicilină, după caz.
S. aureus rezistent la vancomicină (VRSA) este o tulpină de S. aureus care a devenit rezistentă la glicopeptide. Primul caz de vancomicină intermediară S. aureus (VISA) a fost raportat în Japonia în 1996; dar primul caz de S. aureus cu adevărat rezistent la antibiotice glicopeptidice a fost raportat abia în 2002. Trei cazuri de infecție cu VRSA fuseseră raportate în Statele Unite începând cu 2005. Cel puțin parțial rezistența antimicrobiană în S. aureus poate fi explicată prin capacitatea sa de adaptare. Căile de transducție a semnalului cu două componente multiple ajută S. aureus să exprime gene care sunt necesare pentru a supraviețui sub stres antimicrobian.
Transport
Aproximativ 33% din populația SUA este purtătoare de S. aureus și aproximativ 2% poartă MRSA . Chiar și furnizorii de servicii medicale pot fi coloniști MRSA
Transportul S. aureus este o sursă importantă de infecție dobândită de spital (numită și nosocomială) și de SARM dobândit în comunitate. Deși S. aureus poate fi prezent pe pielea gazdei, o mare parte din transportul său este prin narile anterioare ale căilor nazale și poate fi prezentă și în urechi. Capacitatea pasajelor nazale de a adăposti S. aureus rezultă dintr-o combinație de imunitate slabă sau defectă a gazdei și capacitatea bacteriei de a se sustrage imunității înnăscute a gazdei. Transportul nazal este, de asemenea, implicat în apariția infecțiilor cu stafilococ.
Controlul infecției
Răspândirea S. aureus (inclusiv MRSA) se face, în general, prin contact de la om la om, deși recent unii medici veterinari au descoperit că infecția poate fi răspândită prin animale de companie, contaminarea mediului considerând că joacă un rol relativ mai puțin important. Accentul pus pe tehnicile de bază de spălare a mâinilor este, prin urmare, eficient în prevenirea transmiterii acestuia. Utilizarea de șorțuri și mănuși de unică folosință de către personal reduce contactul piele cu piele, reducând în continuare riscul de transmitere .
Recent, o multitudine de cazuri de S. aureus au fost raportate în spitale din toată America. Transmiterea agentului patogen este facilitată în medii în care igiena lucrătorilor din domeniul sănătății este insuficientă. S. aureus este o bacterie incredibil de rezistentă, așa cum sa arătat într-un studiu în care a supraviețuit pe poliester puțin sub trei luni; poliesterul este principalul material utilizat în perdelele de confidențialitate ale spitalelor.
Bacteriile sunt transportate pe mâinile lucrătorilor din domeniul sănătății, care le pot prelua de la un pacient aparent sănătos care poartă o tulpină benignă sau comensală de S. aureus și apoi o transmite următorului pacient care este tratat. Introducerea bacteriilor în fluxul sanguin poate duce la diverse complicații, inclusiv endocardită, meningită și, dacă este răspândită, sepsis .
Etanolul s- a dovedit a fi un dezinfectant local eficient împotriva MRSA. Amoniul cuaternar poate fi utilizat împreună cu etanolul pentru a crește durata acțiunii de igienizare. Prevenirea infecțiilor nosocomiale implică curățarea de rutină și terminală . Vapori de alcool neinflamabili în CO
2 Sistemele NAV-CO2 au un avantaj, deoarece nu atacă metalele sau materialele plastice utilizate în mediile medicale și nu contribuie la rezistența antibacteriană.
Un mijloc important și nerecunoscut anterior de colonizare și transmitere a MRSA asociate comunității este în timpul contactului sexual.
S. aureus este ucis într-un minut la 78 ° C și în zece minute la 64 ° C, dar este rezistent la îngheț .
Anumite tulpini de S. aureus au fost descrise ca fiind rezistente la dezinfecția cu clor
Utilizarea unguentului cu mupirocină poate reduce rata infecțiilor datorate transportului nazal al S. aureus. Există dovezi limitate că decontaminarea nazală a S. aureus utilizând antibiotice sau antiseptice poate reduce rata infecțiilor la nivelul locului chirurgical.
| Bacteria comună de top din fiecare industrie | |
|---|---|
| Industria de catering | Vibrio parahaemolyticus , S. aureus , Bacillus cereus |
| Industria medicală | Escherichia coli , S. aureus , Pseudomonas aeruginosa |
Cercetare
Începând cu 2021, nu există niciun vaccin aprobat împotriva S. aureus . Au fost efectuate studii clinice timpurii pentru mai multe vaccinuri candidate, cum ar fi Nabi StaphVax și PentaStaph, Intercell's / Merck's V710, VRi's SA75 și altele.
În timp ce unii dintre acești candidați au prezentat răspunsuri imune, alții au agravat o infecție cu S. aureus . Până în prezent, niciunul dintre acești candidați nu oferă protecție împotriva unei infecții cu S. aureus . Dezvoltarea StaphVax a lui Nabi a fost oprită în 2005 după ce studiile de fază III au eșuat. Prima variantă de vaccin V710 a lui Intercell a fost întreruptă în timpul fazei II / III după ce au fost observate mortalitate și morbiditate mai mari la pacienții care au dezvoltat infecție cu S. aureus .
PentaStaph, candidatul pentru vaccinurile S. aureus îmbunătățite de la Nabi, a fost vândut în 2011 către GlaxoSmithKline Biologicals SA Starea actuală a PentaStaph nu este clară. Un document al OMS indică faptul că PentaStaph a eșuat în faza de testare de fază III.
În 2010, GlaxoSmithKline a început un studiu orb de fază 1 pentru a-și evalua vaccinul GSK2392103A. Începând din 2016, acest vaccin nu mai este în curs de dezvoltare activă.
Vaccinul cu patru antigeni S. aureus Pfizer SA4Ag a primit desemnarea rapidă de către Food and Drug Administration din SUA în februarie 2014. În 2015, Pfizer a început un studiu de fază 2b privind vaccinul SA4Ag. Rezultatele fazei 1 publicate în februarie 2017 au arătat o imunogenitate foarte robustă și sigură a SA4Ag. Vaccinul a fost supus unui studiu clinic până în iunie 2019, cu rezultate publicate în septembrie 2020, care nu au demonstrat o reducere semnificativă a infecției postoperatorii a fluxului sanguin după operație.
În 2015, Novartis Vaccines and Diagnostics, o fostă divizie a Novartis și care acum face parte din GlaxoSmithKline, a publicat rezultate preclinice promițătoare ale vaccinului lor cu patru componente Staphylococcus aureus , 4C-staph.
În 2020, s-a constatat că uleiul esențial, extras prin hidrodistilare din frunzele de Myrciaria pilosa, are potențial ca medicament antimicrobian pentru a controla infecția prin tulpini multirezistente de stafilococ auriu.
Tulpini standard
Un număr de tulpini standard de S. aureus (numite „culturi de tip”) sunt utilizate în cercetare și în teste de laborator.
| Nume | NCTC | ATCC | Anul depunerii | cometariu |
|---|---|---|---|---|
| Oxford H | 6571 | 9144 | 1943 | Tulpină standard utilizată pentru testarea potenței penicilinei și prin care a fost inițial definită unitatea de penicilină. |
| Rosenbach | 12973 | 29213 | 1884 | Tulpină standard pentru testarea rezistenței antimicrobiene EUCAST. |
Referințe
Lecturi suplimentare
- Loskill P, Pereira PM, Jung P, Bischoff M, Herrmann M, Pinho MG, Jacobs K (septembrie 2014). „Reducerea reticulării peptidoglicanului determină o scădere a rigidității învelișului celular Staphylococcus aureus” . Jurnal biofizic . 107 (5): 1082–1089. Bibcode : 2014BpJ ... 107.1082L . doi : 10.1016 / j.bpj.2014.07.029 . PMC 4156677 . PMID 25185544 .
- Benson MA, Ohneck EA, Ryan C, Alonzo F, Smith H, Narechania A, Kolokotronis SO, Satola SW, Uhlemann AC, Sebra R, Deikus G, Shopsin B, Planet PJ, Torres VJ (august 2014). "Evoluția hipervirulenței de către o clonă MRSA prin achiziționarea unui element transpozabil" . Microbiologie moleculară . 93 (4): 664-81. doi : 10.1111 / mmi.12682 . PMC 4127135 . PMID 24962815 .
linkuri externe
| Clasificare |
|---|
- StopMRSANow.org - Discută despre modul de prevenire a răspândirii MRSA
- TheMRSA.com - Înțelegeți ce înseamnă infecția cu MRSA.
- „ Staphylococcus aureus ” . Browser NCBI Taxonomy . 1280.
- Packham C (16 martie 2015). „Test in vivo de succes al vaccinului descoperit împotriva Staphylococcus aureus” . Medical Press . Arhivat din original la 19 septembrie 2012 . Adus la 18 martie 2015 .
- Tip tulpină de Staphylococcus aureus la Bac Dive - Metadatabase de diversitate bacteriană