Acid tartaric - Tartaric acid

|
|
|
|
| Numele | |
|---|---|
|
Numele IUPAC preferat
Acid 2,3-dihidroxibutanedioic |
|
| Alte nume
Acid tartric Acid
2,3-dihidroxisuccinic Acid trearic Acid racemic Acid uvic Acid paratartaric Winestone |
|
| Identificatori | |
|
Model 3D ( JSmol )
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard |
100.121.903 |
| Numărul E | E334 (antioxidanți, ...) |
| KEGG | |
| Plasă | tartric + acid |
|
PubChem CID
|
|
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Proprietăți | |
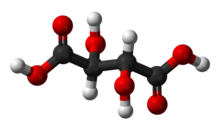
| C 4 H 6 O 6 (Formula de bază) HO 2 CCH (OH) CH (OH) CO 2 H (Formula structurală) |
|
| Masă molară | 150,087 g / mol |
| Aspect | pudră albă |
| Densitate | 1,79 g / ml (H 2 O) |
| Punct de topire | 171 la 174 ° C (340 la 345 ° F; 444 la 447 K) ( L sau D- tartric; pur) 206 ° C ( DL , racemic) 165-166 ° C ( mezo- anhidru) 146-148 ° C ( mezo- hidrat) |
| Aciditate (p K a ) | L (+) 25 ° C: pK a1 = 2,89, pK a2 = 4,40 meso 25 ° C: pK a1 = 3,22, pK a2 = 4,85
|
| Conjugați baza | Bitartrate |
| −67,5 · 10 −6 cm 3 / mol | |
| Pericole | |
|
Clasificare UE (DSD) (învechită)
|
Iritant ( Xi ) |
| Fraze R (învechite) | R36 |
| Compuși înrudiți | |
|
Alți cationi
|
Tartrat monosodic Tartrat disodic Tartrat monopotassic Tartrat dipotazic |
|
Related Acizi carboxilici
|
Acid butiric Acid succinic Acid dimercaptosuccinic Acid malic Acid maleic Acid fumaric |
|
Compuși înrudiți
|
2,3- Butandiol Acid cichoric |
|
|
|
| Referințe infobox | |
Acidul tartric este un acid organic alb, cristalin , care apare în mod natural în multe fructe, mai ales în struguri , dar și în banane , tamarinde și citrice . Sarea sa , bitartratul de potasiu , cunoscut în mod obișnuit sub numele de cremă de tartru , se dezvoltă în mod natural în procesul de fermentare . Se amestecă în mod obișnuit cu bicarbonat de sodiu și se vinde sub formă de pulbere de copt folosită ca agent de dospire în prepararea alimentelor. Acidul în sine este adăugat la alimente ca un antioxidant E334 și pentru a conferi gustul său acru distinctiv.
Acidul tartric este un acid alfa-hidroxi- carboxilic , are caracteristicile acidului diprotic și aldaric și este un derivat dihidroxilic al acidului succinic .
Istorie
Acidul tartric este cunoscut de vinificatori de secole. Cu toate acestea, procesul chimic pentru extracție a fost dezvoltat în 1769 de chimistul suedez Carl Wilhelm Scheele .
Acidul tartric a jucat un rol important în descoperirea chiralității chimice . Această proprietate a acidului tartric a fost observată pentru prima dată în 1832 de Jean Baptiste Biot , care a observat capacitatea sa de a roti lumina polarizată . Louis Pasteur a continuat această cercetare în 1847 investigând formele cristalelor de tartrat de sodiu amoniu, pe care le-a găsit ca fiind chirale. Prin sortarea manuală a cristalelor de diferite forme, Pasteur a fost primul care a produs o probă pură de acid levotartaric.
Stereochimie
Acidul tartric natural este chiral și este o materie primă utilă în sinteza chimică organică . Forma naturală a acidului este acidul dextrotartaric sau acidul L - (+) - tartric (denumire învechită de acid d- tartric). Deoarece este disponibil în mod natural, este puțin mai ieftin decât enantiomerul său și izomerul mezo . De dextrogirj și LEVO prefixe sunt termeni arhaice. Manualele moderne se referă la forma naturală ca (2 R , 3 R ) -acid tartric ( L - (+) - acid tartric) , și enantiomerul său ca (2 S , 3 S ) -acid tartric ( D - (-) - acid tartric) . Meso diastereomerul este (2 R , 3 S ) -tartric (care este identic cu '(2 S , 3 R ) -tartric').
În timp ce cei doi stereoizomeri chirali rotesc lumina polarizată plană în direcții opuse, soluțiile de acid mezo-tartric nu rotesc lumina polarizată plan. Absența activității optice se datorează unui plan oglindă din moleculă [linie segmentată în imaginea de mai jos].
Acidul tartric din soluția Fehling se leagă de ionii de cupru (II), prevenind formarea sărurilor insolubile de hidroxid.
| DL- acid tartric (acid racemic ) (atunci când are un raport 1: 1) | acid mezotartaric | |
|---|---|---|
| acid dextrotartaric ( acid L - (+) - acid tartric) |
acid levotartaric ( acid D - (-) - tartric) |
|

|

|

|
| Denumirea comună | Acid tartaric | Acidul levotartaric | Acid dextrotartaric | Acid mezotartaric | Acid racemic |
|---|---|---|---|---|---|
| Sinonime | (2 S , 3 S ) -acid tartric ( S , S ) -acid tartric (-) - acid tartric l -acid tartric (învechit) acid levotartaric D -acid tartric D -acid terearic („izomer nenatural”) |
(2 R , 3 R ) -acid tartric ( R , R ) -acid tartric (+) - acid tartric Acid d- tartric (învechit) L- acid tartric L- acid teraric („izomer natural”) |
(2 R , 3 S ) -acid tartric acid mezo- tartric acid eritraric |
rac - (2 R , 3 S ) -acid tartric (2 RS , 3 SR ) -acid tartric (±) -acid tartric DL -acid tartric dl -acid tartric (caduc) acid paratartaric acid uvic |
|
| PubChem | CID 875 de la PubChem | CID 439655 de la Extract | CID 444305 de la Extract | CID 78956 din Extract | CID 5851 din PubChem |
| Numărul EINECS | |||||
| numar CAS | 526-83-0 | 147-71-7 | 87-69-4 | 147-73-9 | 133-37-9 |
Producție
L - (+) - acid tartric
L - (+) - izomerul acidului tartric acid tartric este produsă industrial în cele mai mari cantități. Se obține din drojdie , un produs secundar solid al fermentațiilor. Fostele produse secundare constau în cea mai mare parte din bitartrat de potasiu (KHC 4 H 4 O 6 ). Această sare de potasiu este transformată în tartrat de calciu (CaC 4 H 4 O 6 ) la tratamentul cu lapte de var (Ca (OH) 2 ):
- KO 2 CCH (OH) CH (OH) CO 2 H + Ca (OH) 2 → Ca (O 2 CCH (OH) CH (OH) CO 2 ) + KOH + H 2 O
În practică, se obțin randamente mai mari de tartrat de calciu prin adăugarea de clorură de calciu . Tartratul de calciu este apoi transformat în acid tartric prin tratarea sării cu acid sulfuric apos:
- Ca (O 2 CCH (OH) CH (OH) CO 2 ) + H 2 SO 4 → HO 2 CCH (OH) CH (OH) CO 2 H + CaSO 4
Acid tartric racemic
Acidul tartric racemic ( adică : un amestec de 50:50 de acid D - (-) - tartric și molecule de acid L - (+) - acid tartric, acid racemic ) poate fi preparat într-o reacție cu mai multe etape din acidul maleic . În prima etapă, acidul maleic este epoxidat de peroxid de hidrogen folosind tungstat de potasiu ca catalizator.
- HO 2 CC 2 H 2 CO 2 H + H 2 O 2 → OC 2 H 2 (CO 2 H) 2
În etapa următoare, epoxidul este hidrolizat.
- OC 2 H 2 (CO 2 H) 2 + H 2 O → (HOCH) 2 (CO 2 H) 2
mezo- acid tartric
mezo- acidul tartric se formează prin izomerizare termică. acidul dextro- tartric este încălzit în apă la 165 ° C timp de aproximativ 2 zile. acidul meso- tartric poate fi preparat și din acid dibromosuccinic folosind hidroxid de argint:
- HO 2 CCHBrCHBrCO 2 H + 2 AgOH → HO 2 CCH (OH) CH (OH) CO 2 H + 2 AgBr
acidul meso- tartric poate fi separat de acidul racemic rezidual prin cristalizare, racematul fiind mai puțin solubil.
Reactivitate
L - (+) - acid tartric, poate participa la mai multe reacții. După cum se arată schema de reacție de mai jos, acidul dihidroximaleic este produs la tratamentul acidului L - (+) - tartric cu peroxid de hidrogen în prezența unei sări feroase.
- HO 2 CCH (OH) CH (OH) CO 2 H + H 2 O 2 → HO 2 CC (OH) C (OH) CO 2 H + 2 H 2 O
Acidul dihidroximaleic poate fi apoi oxidat în acid tartronic cu acid azotic.
Derivate
Derivații importanți ai acidului tartric includ sărurile sale, crema de tartru ( bitartrat de potasiu ), sarea Rochelle (tartrat de sodiu de potasiu, un laxativ ușor ) și emeticul tartric (tartrat de potasiu de antimoniu). Tartratul de diizopropil este utilizat ca co-catalizator în sinteza asimetrică.
Acidul tartric este o toxină musculară , care acționează prin inhibarea producției de acid malic și, în doze mari, provoacă paralizie și moarte. Doza letală medie (LD 50 ) este de aproximativ 7,5 grame / kg pentru un om, 5,3 grame / kg pentru iepuri, și 4,4 grame / kg pentru șoareci. Având în vedere această cifră, ar fi nevoie de peste 500 g (18 oz) pentru a ucide o persoană care cântărește 70 kg (150 lb), deci poate fi inclusă în siguranță în multe alimente, în special dulciurile cu gust acru . Ca aditiv alimentar , acidul tartric este utilizat ca antioxidant cu numărul E E334 ; tartratii sunt alți aditivi care servesc ca antioxidanți sau emulgatori .
Când se adaugă cremă de tartru în apă, rezultă o suspensie care servește la curățarea foarte bună a monedelor de cupru , deoarece soluția de tartrat poate dizolva stratul de oxid de cupru (II) prezent pe suprafața monedei. Complexul de cupru (II) -tartrat rezultat este ușor solubil în apă.
Acid tartric în vin
Acidul tartric poate fi cel mai imediat recunoscut de consumatorii de vin ca sursă de "diamante de vin", micile cristale de bitartrat de potasiu care uneori se formează spontan pe plută sau pe fundul sticlei. Aceste „tartrate” sunt inofensive, deși uneori sunt confundate cu sticla spartă și sunt prevenite în multe vinuri prin stabilizarea la rece (ceea ce nu este întotdeauna preferat, deoarece poate schimba profilul vinului). Tartratii rămași în interiorul butoaielor îmbătrânite au fost la un moment dat o sursă industrială majoră de bitartrat de potasiu.
Acidul tartric joacă un rol important din punct de vedere chimic, scăzând pH-ul fermentării „mustului” la un nivel în care multe bacterii deteriorate nedorite nu pot trăi și acționând ca conservant după fermentare . În gură, acidul tartric oferă o parte din aciditatea din vin, deși acizii citric și malic joacă, de asemenea, un rol.
Acid tartric în citrice
Rezultatele unui studiu au arătat că în citrice, fructele produse în agricultura ecologică conțin niveluri mai ridicate de acid tartric decât fructele produse în agricultura convențională.
În supraconductori
Acidul tartric pare să crească temperatura critică în anumiți supraconductori , prin creșterea presupusă a gradului de oxidare, în timp ce mecanismul acestui fenomen nu este încă cunoscut.
Aplicații
Acidul tartric și derivații săi au o mulțime de utilizări în domeniul farmaceutic. De exemplu, a fost utilizat la producerea sărurilor efervescente, în combinație cu acidul citric, pentru a îmbunătăți gustul medicamentelor orale. Derivatul antimonil de potasiu al acidului cunoscut sub numele de tartric emetic este inclus, în doze mici, în siropul de tuse ca expectorant .
Acidul tartric are, de asemenea, mai multe aplicații pentru uz industrial. S-a observat că acidul chelează ioni metalici precum calciu și magneziu. Prin urmare, acidul a servit în industria agricolă și a metalelor ca agent chelator pentru complexarea micronutrienților din îngrășământul solului și pentru curățarea suprafețelor metalice constând din aluminiu, cupru, fier și aliaje ale acestor metale.
Toxicitate la canini
În timp ce acidul tartric este bine tolerat de oameni și animale de laborator, dovezi recente sugerează că acidul tartric ar putea fi cauza insuficienței renale la câinii care consumă struguri sau stafide care conțin concentrații mari de acid tartric.



