Tiostrepton - Thiostrepton

|
|
| Numele | |
|---|---|
|
Numele IUPAC
N- [3 - [(3-amino-3-oxoprop-1-en-2-il) amino] -3-oxoprop-1-en-2-il] -2 - [(1R, 8S, 11Z, 18S , 25S, 26R, 53S, 59S) -37-butan-2-il-18 - [(2S, 3R) -2,3-dihidroxibutan-2-il] -11-etiliden-59-hidroxi-8 - [( 1R) -1-hidroxietil] -31 - [(1S) -1-hidroxietil] -26,40,46-trimetil-43-metiliden-6,9,16,23,28,38,41,44,47- nonaoxo-27-oxa-3,13,20,56-tetrathia-7,10,17,24,36,39,42,45,48,52,58,61,62,63,64-pentadecazanonacyclo [23,23. 9.329,35.12,5.112,15.119,22.154,57.01,53.032,60] tetrahexaconta-2 (64), 4,12 (63), 19 (62), 21,29 (61), 30,32 (60), 33 , 51,54,57-dodecaen-51-il] -1,3-tiazol-4-carboxamidă
|
|
| Alte nume
Alaninamidă, bramicină, tiactină
|
|
| Identificatori | |
|
Model 3D ( JSmol )
|
|
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard |
100.014.304 |
| Numărul CE | |
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Proprietăți | |
| C 72 H 85 N 19 O 18 S 5 | |
| Masă molară | 1664,83 g / mol |
| Aspect | Pulbere albă până la aproape albă |
| Punct de topire | 246 până la 256 ° C (475 până la 493 ° F; 519 până la 529 K) |
| Insolubil | |
| Solubilitate în alți solvenți | Solubil în CHCI 3 , CH 2 Cl 2 , dioxan, piridină, acid acetic glacial, DMF. Practic insolubil în alcoolii inferiori, solvenți organici nepolari, acizi sau baze apoase diluate. Poate fi dizolvat prin acid metanolic sau bază, dar cu descompunere. |
| Pericole | |
| Pictograme GHS |

|
| GHS Cuvânt de avertizare | Avertizare |
| H302 | |
| P264 , P270 , P301 + 312 , P330 , P501 | |
|
|
|
| Referințe infobox | |
Tiostreptonul este un antibiotic oligopeptidic ciclic natural din clasa tiopeptidelor , derivat din mai multe tulpini de streptomicete , cum ar fi Streptomyces azureus și Streptomyces laurentii . Tiostreptonul este un produs natural din clasa peptidei sintetizate ribozomal și post-translațional modificate (RiPP).
Istorie
Tiostreptonul a fost descoperit de Donovick și colab. care a descris proprietățile sale antibacteriene în 1955. Dorothy Crowfoot Hodgkin a rezolvat structura tiostreptonului în 1970. La începutul anului 1978, Bycroft și Gowland au propus biosinteza tiostreptonului, care era încă neclară până în 2009. Mai multe studii despre biosinteza tiopeptidelor au fost publicate contemporan în 2009 iar doi dintre ei (Liao și colab. și Kelly și colab. ) au inclus biosinteza similară a tiostreptonului: este sintetizat ribozomial din genele biosintetice ale tiostreptonului (gene tsr) și este necesară modificarea posttranslatională.
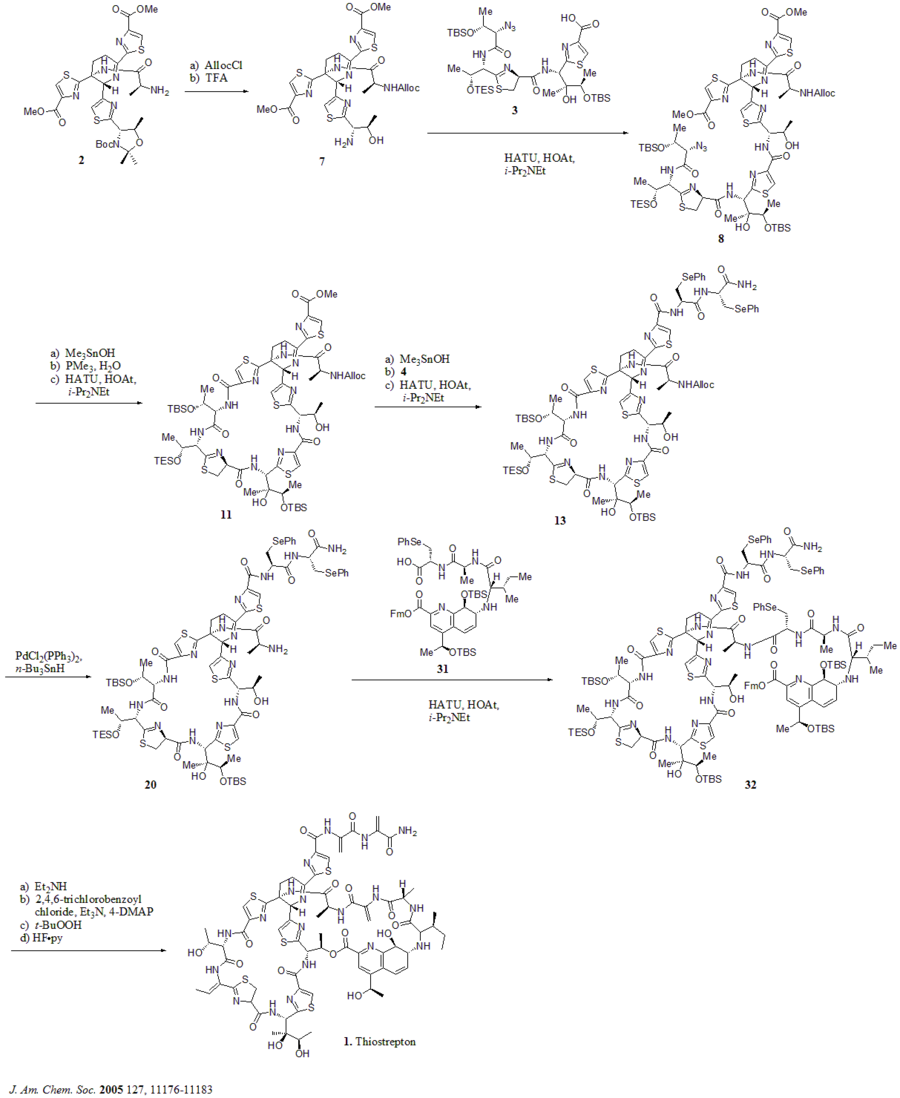
O sinteză totală a tiostreptonul a fost completat de KC Nicolaou , et al. în 2004.
Aplicații
Tiostreptonul a fost utilizat în medicina veterinară în mastita cauzată de organisme gram-negative și în tulburările dermatologice. Este utilizat în principal în unguente complexe care conțin neomicină , nistatină , tiostrepton și steroizi topici . De asemenea, este activ împotriva bacteriilor gram-pozitive. Este remarcabil faptul că unguentele de uz uman conțin neomicină , nistatină și steroizi topici , dar nu tiostrepton.
Tiostreptonul a fost raportat (în 2008) că prezintă activitate împotriva celulelor canceroase de sân prin vizarea factorului de transcripție a cutiei M1 ( FOXM1 ), tot în 2011. S-a demonstrat, de asemenea, că ocolește rezistența dobândită a cisplatinei în celulele cancerului de sân, în condiții de invitro.
Tiostreptonul este utilizat în biologia moleculară ca reactiv atât pentru selecția pozitivă, cât și pentru cea negativă a genelor implicate în metabolismul nucleotidic.
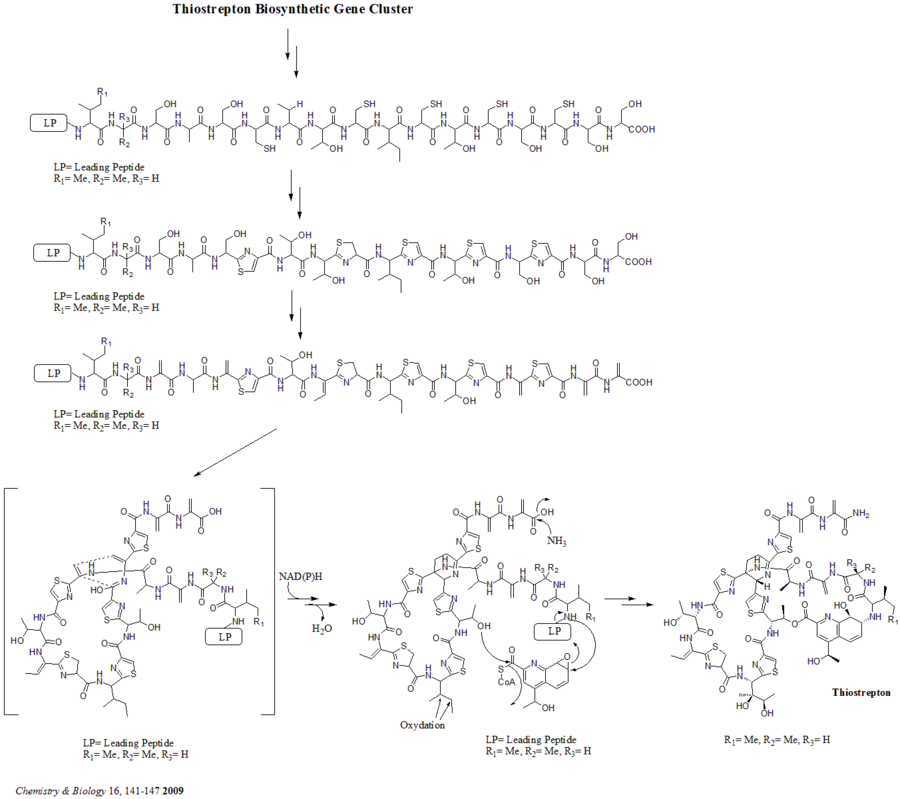
Biosinteza
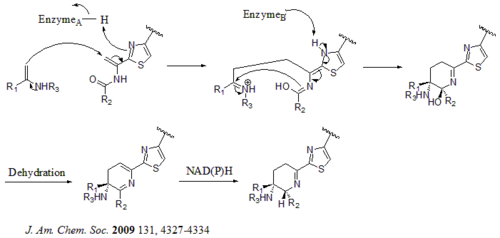
Există în total 21 de gene (tsrA ~ tsrU) în grupul de gene biosintetice. Precursorul tiostreptonului conține 58 de aminoacizi în lanțul peptidic, care include peptida lider 41-aa (LP) și peptida structurală 17-aa (IASASCTTCICTCSCSS). Odată ce precursorul este sintetizat, ciclodehidrataza tsrO și dehidrogenaza tsrM catalizează formarea tiazolului sau tiazolinei din fiecare reziduu de cisteină din lanțul peptidic. După formarea tiazolului / tiazolinei, dehidratazele tsrJ, K și S convertesc apoi toate reziduurile de serină în dehidroalanine. O ciclizare hetero Diels-Alder a dehidropiperidinei centrale (la S5, C13 și S14) a fost sugerată de Bycroft încă din 1978 și a fost utilizată în sinteza chimică a acestei structuri de bază de Nicolaou și colab. în 2005. Un mecanism alternativ de formare a dehidropiperidinei a fost, de asemenea, sugerat de Kelly și colab . în 2009. Cu toate acestea, pe baza dovezilor experimentale, se sugerează că tsrN și L sunt responsabili de ciclizarea hetero Diels-Alder. Se sugerează că fragmentul de acid chinaldic este sintetizat de cele nouă gene tsrFAEBDUPQI din triptofan și are ca rezultat închiderea macrociclului acidului chinaldic. În cele din urmă, tsrR servește ca candidat pentru oxidarea reziduului Ile pentru a da tiostrepton.
Mecanism alternativ pentru formarea miezului dehidropiperidinei
Sinteza totală
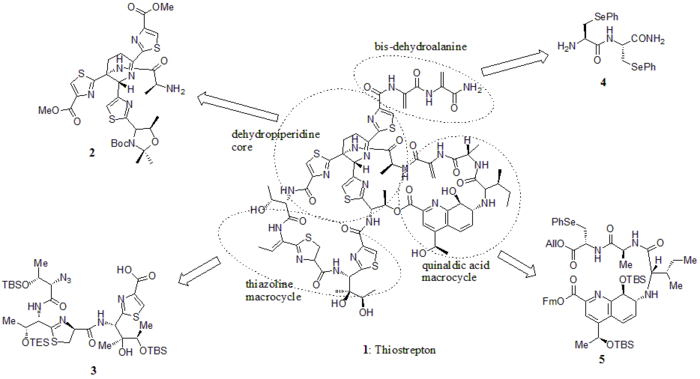
În 2005, Nicolaou și colab. a publicat sinteza totală a tiostreptonului. La început, au construit elementele cheie ale tiostreptonului (1): nucleul de dehdropiperidină (2), macrociclul tiazolinei (3), coada bis-dehidroalaninei (4) și macrociclul acidului chinaldic (5). Apoi au asamblat blocurile de construcție secvențial așa cum se arată în schema sintetică (numerele compuse sunt din referință).