trans- Cicloocten - trans-Cyclooctene
|
|
| Numele | |
|---|---|
|
Numele IUPAC preferat
( E ) -Cicloocten |
|
| Alte nume
trans -Cicloocten
|
|
| Identificatori | |
|
Model 3D ( JSmol )
|
|
| ChEBI | |
| ChemSpider | |
| Numărul CE | |
|
PubChem CID
|
|
|
|
|
|
| Proprietăți | |
| C 8 H 14 | |
| Masă molară | 110.200 g · mol −1 |
| Aspect | lichid incolor |
| Densitate | 0,848 g / ml |
| Punct de topire | −59 ° C (−74 ° F; 214 K) |
| Punct de fierbere | 143 ° C (1 atm); 68-72 ° C (100 torr) |
| Pericole | |
| Pictograme GHS |
 
|
| GHS Cuvânt de avertizare | Pericol |
| Referințe infobox | |
trans- Ciclooctenul este o hidrocarbură ciclică cu formula [- (CH 2 ) 6 CH = CH–], unde cele două legături simple C – C adiacente legăturii duble sunt pe laturile opuse ale planului acestuia din urmă. Este un lichid incolor cu miros neplăcut.
Ciclooctenul este notabil ca fiind cel mai mic cicloalchen care este ușor izolat ca trans - izomer . De cis izomerului este mult mai stabil; energiile de deformare inelară fiind de 16,7 și respectiv 7,4 kcal / mol.
 |
|
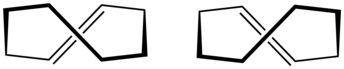
| cis -Cicloocten | trans -Cicloocten |
O dispunere plană a carbonilor inelari ar fi prea tensionată și, prin urmare, conformațiile stabile ale formei trans au un inel îndoit (neplan). Calculele indică faptul că cea mai stabilă conformație „coroană” are atomii de carbon alternativ deasupra și sub planul inelului. O conformație „cu jumătate de scaun”, cu o energie mai mare cu aproximativ 6 kcal / mol, are atomi de carbon 2,3,5,6 și 8 pe aceeași parte a planului de atomi de carbon 1,4 și 7.
Toate conformațiile trans- ciclooctenului sunt chirale (în mod specific, ceea ce unii numesc plan-chirale ) și enantiomerii pot fi separați. În teorie, conversia între enantiomeri se poate face, fără a rupe legături, prin răsucirea întregului grup –CH = CH–, rigid, cu 180 de grade. Cu toate acestea, aceasta implică trecerea unuia dintre hidrogenii săi prin inelul aglomerat.
Pregătirea
trans- Ciclooctenul a fost sintetizat mai întâi la scară pregătitoare de Arthur C. Cope cu o reacție de eliminare Hofmann a iodurii de N, N, N- trimetilciclooctilamoniu. Reacția dă un amestec de izomeri cis și trans , iar izomerul trans este captiv selectiv ca un complex cu azotat de argint .
Există alte metode în care izomerul trans este sintetizat din izomerul cis în mai multe etape sintetice. De exemplu, poate fi preparat cu un randament de aproape 100% prin conversia izomerului cis în 1,2-epoxiciclooctan („oxid ciclooctenic”) urmat de reacții cu difenilfosfură de litiu ( LiPPh
2) și cu iodură de metil CH
3Eu . (Proceduri similare pot da izomeri cis , trans ai 1,4-ciclooctadienei și 1,5-ciclooctadienei ).
În plus, există o metodă fotochimică pentru izomerizarea directă cis - trans . Deși acest echilibru favorizează puternic forma cis mai stabilă , reacția poate fi condusă spre forma trans prin prinderea cu ioni de argint.
Reacții
Datorită tensiunii interne mai mari pe legătura dublă, izomerul trans este mai reactiv decât izomerul cis și al hidrocarburilor tipice nesaturate. De exemplu, legătura sa dublă va adăuga rapid tetrazină și derivații săi. Compusul, de asemenea, se polimerizează ușor cu un inițiator pe bază de ruteniu .
