Istoria electrochimiei - History of electrochemistry
Electrochimia , o ramură a chimiei , a trecut prin mai multe schimbări pe parcursul evoluției sale de la principiile timpurii legate de magneți la începutul secolelor al XVI-lea și al XVII-lea, la teorii complexe care implică conductivitatea , sarcina electrică și metodele matematice. Termenul electrochimie a fost folosit pentru a descrie fenomenele electrice de la sfârșitul secolelor XIX și XX. În ultimele decenii, electrochimia a devenit o zonă a cercetărilor actuale, inclusiv cercetarea bateriilor și pilelor de combustibil , prevenirea coroziunii metalelor, utilizarea celulelor electrochimice pentru îndepărtarea substanțelor organice refractare și a contaminanților similari din electrocoagularea apelor uzate și îmbunătățirea tehnicilor de rafinare a substanțelor chimice cu electroliză și electroforeza .
Fundalul și începutul electrochimiei
Secolul al XVI-lea a marcat începutul înțelegerii științifice a electricității și magnetismului, care a culminat cu producția de energie electrică și revoluția industrială de la sfârșitul secolului al XIX-lea.
În anii 1550, omul de știință englez William Gilbert a petrecut 17 ani experimentând magnetismul și, într-o măsură mai mică, electricitatea. Pentru munca sa asupra magneților, Gilbert a devenit cunoscut sub numele de „Tatăl magnetismului”. Cartea sa De Magnete a devenit rapid lucrarea standard în întreaga Europă privind fenomenele electrice și magnetice și a făcut o distincție clară între magnetism și ceea ce se numea atunci „efectul chihlimbar” (electricitate statică).

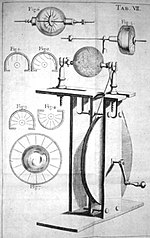
În 1663, fizicianul german Otto von Guericke a creat primul generator electrostatic, care a produs electricitate statică prin aplicarea fricțiunii. Generatorul era format dintr-o bilă mare de sulf în interiorul unui glob de sticlă, montat pe un arbore. Mingea a fost rotită cu ajutorul unei manivele și a fost produsă o scânteie electrică statică atunci când un tampon a fost frecat de minge în timp ce se rotea. Globul ar putea fi îndepărtat și folosit ca sursă electrică pentru experimentele cu electricitatea. Von Guericke și-a folosit generatorul pentru a arăta că aceleași acuzații se respingeau reciproc.
Secolul al XVIII-lea și nașterea electrochimiei
În 1709, Francis Hauksbee de la Societatea Regală din Londra a descoperit că, punând o cantitate mică de mercur în paharul generatorului lui Von Guericke și evacuând aerul din acesta, ar străluci ori de câte ori mingea construia o sarcină și mâna lui atingea glob. El a creat prima lampă cu descărcare de gaz .
Între 1729 și 1736, doi oameni de știință englezi, Stephen Gray și Jean Desaguliers , au efectuat o serie de experimente care au arătat că un plută sau un alt obiect aflat la o distanță de până la 245-275 m poate fi electrificat conectându-l printr-un tub de sticlă încărcat pe materiale precum fire metalice sau șnur de cânepă. Au descoperit că alte materiale, precum mătasea , nu ar transmite efectul.
Până la mijlocul secolului al XVIII-lea, chimistul francez Charles François de Cisternay Du Fay descoperise două forme de electricitate statică și care, la fel ca încărcăturile, se resping reciproc, în timp ce spre deosebire de sarcini se atrag. Du Fay a anunțat că electricitatea consta din două fluide: vitros (din latinesc pentru „sticlă”) sau electricitate pozitivă; și electricitate rășinoasă sau negativă. Aceasta a fost „teoria cu două fluide” a electricității, căreia i s-a opus „teoria cu un singur fluid” a lui Benjamin Franklin mai târziu în sec.
În 1745, Jean-Antoine Nollet a dezvoltat o teorie a atracției și respingerii electrice care presupunea existența unui flux continuu de materie electrică între corpurile încărcate. Teoria lui Nollet a câștigat la început o largă acceptare, dar a întâmpinat rezistență în 1752 cu traducerea Experimentelor și observațiilor despre electricitate a lui Franklin în franceză. Franklin și Nollet au dezbătut natura electricității, Franklin susținând acțiunea la distanță și două tipuri de electricitate opuse calitativ, iar Nollet susținea acțiunea mecanică și un singur tip de fluid electric. Argumentul lui Franklin a câștigat în cele din urmă și teoria lui Nollet a fost abandonată.
În 1748, Nollet a inventat unul dintre primii electrometri , electroscopul , care arăta sarcină electrică folosind atracția și repulsia electrostatică . Nollet este considerat a fi primul care a aplicat numele „ borcan Leyden ” primului dispozitiv de stocare a energiei electrice. Invenția lui Nollet a fost înlocuită de electrometrul lui Horace-Bénédict de Saussure în 1766.
În anii 1740, William Watson efectuase mai multe experimente pentru a determina viteza electricității. Credința generală de atunci era că electricitatea era mai rapidă decât sunetul, dar nu fusese conceput niciun test precis pentru a măsura viteza unui curent. Watson, în câmpurile de la nord de Londra, a întins o linie de sârmă susținută de bețișoare uscate și mătase, care mergea pe o lungime de 12 276 de picioare (3,7 km). Chiar și la această lungime, viteza electricității părea instantanee. Rezistența în fir a fost, de asemenea, observată, dar aparent nu a fost pe deplin înțeleasă, deoarece Watson a relatat că „am observat din nou că, deși compozițiile electrice erau foarte severe pentru cei care țineau firele, raportul Exploziei la conducătorul principal a fost mic, în comparația a ceea ce se aude când Circuitul este scurt. " Watson a decis în cele din urmă să nu își continue experimentele electrice, concentrându-se în schimb pe cariera sa medicală.
În anii 1750, pe măsură ce studiul electricității a devenit popular, au fost căutate modalități eficiente de producere a energiei electrice. Generatorul dezvoltat de Jesse Ramsden a fost printre primii generatori electrostatici inventați. Electricitatea produsă de astfel de generatoare a fost utilizată pentru a trata paralizia, spasmele musculare și pentru a controla ritmul cardiac. Alte utilizări medicale ale electricității includ umplerea corpului cu energie electrică, extragerea scânteilor din corp și aplicarea scânteilor de la generator pe corp.
Charles-Augustin de Coulomb a dezvoltat legea atracției electrostatice în 1781 ca rezultat al încercării sale de a investiga legea repulsiilor electrice, așa cum a afirmat Joseph Priestley în Anglia. În acest scop, el a inventat un aparat sensibil pentru a măsura forțele electrice implicate în legea lui Priestley. El a stabilit, de asemenea, legea pătrată inversă a polilor magnetici de atracție și repulsie, care a devenit baza teoriei matematice a forțelor magnetice dezvoltată de Siméon Denis Poisson . Coulomb a scris șapte lucrări importante despre electricitate și magnetism pe care le-a prezentat la Academia de Științe între 1785 și 1791, în care a raportat că a dezvoltat o teorie a atracției și repulsiei între corpurile încărcate și a continuat să caute conductori și dielectrici perfecți . El a sugerat că nu există un dielectric perfect, propunând că fiecare substanță are o limită, peste care va conduce electricitatea. SI Unitatea de sarcină se numește Coulomb în onoarea lui.
În 1789, Franz Aepinus a dezvoltat un dispozitiv cu proprietățile unui „condensator” (cunoscut acum sub numele de condensator .) Condensatorul Aepinus a fost primul condensator dezvoltat după borcanul Leyden și a fost folosit pentru a demonstra conducerea și inducția . Dispozitivul a fost construit astfel încât spațiul dintre două plăci să poată fi reglat, iar dielectricul de sticlă care separă cele două plăci să poată fi îndepărtat sau înlocuit cu alte materiale.
În ciuda câștigului în cunoașterea proprietăților electrice și a construirii de generatoare, abia la sfârșitul secolului al XVIII-lea medicul și anatomistul italian Luigi Galvani a marcat nașterea electrochimiei prin stabilirea unei punți între contracțiile musculare și electricitate cu eseu-ul său De Viribus din 1791 Electricitatis în Motu Musculari Commentarius (Comentariu la efectul electricității asupra mișcării musculare), unde a propus o „substanță nervo-electrică” în formele de viață.
În eseul său, Galvani a concluzionat că țesutul animal conținea o forță vitală înnăscută până acum necunoscută, pe care el a denumit-o „electricitate animală”, care a activat mușchiul atunci când este plasat între două sonde metalice. El credea că aceasta era dovada unei noi forme de electricitate, separată de forma „naturală” care este produsă de fulgere și de forma „artificială” care este produsă prin frecare (electricitate statică). El a considerat că creierul este cel mai important organ pentru secreția acestui „fluid electric” și că nervii au condus fluidul către mușchi. El credea că țesuturile acționau similar cu suprafețele exterioare și interioare ale borcanelor Leyden. Fluxul acestui fluid electric a oferit un stimul fibrelor musculare.

Colegii științifici ai lui Galvani au acceptat în general punctele sale de vedere, dar Alessandro Volta , profesorul remarcabil de fizică de la Universitatea din Pavia , nu a fost convins de analogia dintre mușchi și borcane Leyden. Hotărând că picioarele broaștelor folosite în experimentele lui Galvani au servit doar ca electroscop, el a susținut că contactul metalelor diferite este adevărata sursă de stimulare. El s-a referit la electricitatea astfel generată drept „electricitate metalică” și a decis că mușchiul, prin contractare atunci când este atins de metal, seamănă cu acțiunea unui electroscop. Mai mult, Volta a susținut că dacă două metale diferite în contact unul cu celălalt ar atinge un mușchi, ar avea loc și agitație și ar crește odată cu diferențierea metalelor. Galvani a respins acest lucru obținând acțiune musculară folosind două bucăți de metal similar. Numele Voltei a fost folosit ulterior pentru unitatea de potențial electric, voltul .
Creșterea electrochimiei ca ramură a chimiei
În 1800, chimiștii englezi William Nicholson și Johann Wilhelm Ritter au reușit să separe apa în hidrogen și oxigen prin electroliză . Curând după aceea, Ritter a descoperit procesul de galvanizare . De asemenea, el a observat că cantitatea de metal depusă și cantitatea de oxigen produsă în timpul unui proces electrolitic depind de distanța dintre electrozi . Până în 1801 Ritter observase curenți termoelectrici, care anticipau descoperirea termoelectricității de către Thomas Johann Seebeck .
În 1802, William Cruickshank a proiectat prima baterie electrică capabilă să producă în masă. La fel ca Volta, Cruickshank a aranjat plăci pătrate de cupru, pe care le-a lipit la capetele lor, împreună cu plăci de zinc de dimensiuni egale. Aceste plăci au fost plasate într-o cutie lungă dreptunghiulară din lemn, care a fost sigilată cu ciment. Șanțurile din interiorul cutiei țineau plăcile metalice în poziție. Cutia a fost apoi umplută cu un electrolit de saramură sau acid udat. Acest design inundat a avut avantajul de a nu se usca cu utilizarea și a furnizat mai multă energie decât aranjamentul Volta, care folosea hârtii înmuiate în saramură între plăci.
În căutarea unei producții mai bune de metale de platină , doi oameni de știință, William Hyde Wollaston și Smithson Tennant , au lucrat împreună pentru a proiecta o tehnică electrochimică eficientă pentru rafinarea sau purificarea platinei. Tennant a ajuns să descopere elementele iridiu și osmiu . Efortul lui Wollaston, la rândul său, l-a condus la descoperirea metalelor paladiu în 1803 și rodiu în 1804.
Wollaston a îmbunătățit bateria galvanică (numită după Galvani) în anii 1810. În bateria lui Wollaston, cutia de lemn a fost înlocuită cu un vas de faianță, iar o placă de cupru a fost îndoită în formă de U, cu o singură placă de zinc plasată în centrul cuprului îndoit. Placa de zinc a fost împiedicată să intre în contact cu cuprul cu dibluri (bucăți) de plută sau lemn. În proiectarea sa cu celulă unică, placa de cupru în formă de U a fost sudată de un mâner orizontal pentru ridicarea plăcilor de cupru și zinc din electrolit atunci când bateria nu era în uz.
În 1809, Samuel Thomas von Soemmering a dezvoltat primul telegraf . El a folosit un dispozitiv cu 26 de fire (1 fir pentru fiecare literă din alfabetul german ) care se termină într-un recipient cu acid. La stația de trimitere, o cheie, care completează un circuit cu o baterie, a fost conectată, după cum este necesar, la fiecare dintre firele de linie. Trecerea curentului a făcut ca acidul să se descompună chimic, iar mesajul a fost citit observând la care dintre terminale au apărut bulele de gaz. Așa a reușit să trimită mesaje, câte o scrisoare pe rând.
Lucrarea lui Humphry Davy cu electroliza a condus la concluzia că producția de electricitate în celule electrolitice simple a rezultat din reacțiile chimice dintre electrolit și metale și a avut loc între substanțe cu sarcină opusă. El a argumentat că interacțiunile curenților electrici cu substanțele chimice oferă cel mai probabil mijloace de descompunere a tuturor substanțelor la elementele lor de bază. Aceste opinii au fost explicate în 1806 în prelegerea sa Despre unele agenții chimice ale electricității , pentru care a primit Premiul Napoleon de la Institutul de Franță în 1807 (în ciuda faptului că Anglia și Franța erau în război la acea vreme). Această lucrare a condus direct la izolarea sodiului și potasiului din compușii lor obișnuiți și a metalelor alcalino-pământoase din ale lor în 1808.
Descoperirea de către Hans Christian Ørsted a efectului magnetic al curenților electrici în 1820 a fost imediat recunoscută ca un progres important, deși a lăsat altor lucrări suplimentare despre electromagnetism . André-Marie Ampère a repetat rapid experimentul lui Ørsted și le-a formulat matematic (care a devenit legea lui Ampère ). Ørsted a descoperit, de asemenea, că nu numai un ac magnetic este deviat de curentul electric, ci că firul electric sub tensiune este de asemenea deviat într-un câmp magnetic, punând astfel bazele pentru construirea unui motor electric. Descoperirea piperinei de Ørsted , una dintre componentele înțepătoare ale piperului, a fost o contribuție importantă la chimie, la fel ca și prepararea sa de aluminiu în 1825.
În anii 1820, Robert Hare a dezvoltat Deflagrator , o formă de baterie voltaică cu plăci mari folosite pentru producerea unei combustii rapide și puternice . O formă modificată a acestui aparat a fost folosită în 1823 în volatilizarea și topirea carbonului . Cu aceste baterii s-a făcut prima utilizare a electricității voltaice pentru sablarea sub apă în 1831.
În 1821, fizicianul eston- german, Thomas Johann Seebeck, a demonstrat potențialul electric în punctele de joncțiune a două metale diferite atunci când există o diferență de temperatură între articulații. El a unit un fir de cupru cu un fir de bismut pentru a forma o buclă sau un circuit. Două joncțiuni s-au format prin conectarea capetelor firelor între ele. Apoi a descoperit accidental că, dacă încălzea o joncțiune la o temperatură ridicată, iar cealaltă joncțiune rămânea la temperatura camerei, un câmp magnetic era observat în jurul circuitului.
El nu a recunoscut că a fost generat un curent electric atunci când s-a aplicat căldură la o joncțiune bi-metalică. El a folosit termenul „curenți termomagnetici” sau „termomagnetism” pentru a-și exprima descoperirea. În următorii doi ani, el a raportat observațiile sale continue Academiei de Științe din Prusia , unde a descris observația sa ca fiind „polarizarea magnetică a metalelor și minereurilor produsă de o diferență de temperatură”. Acest efect Seebeck a devenit baza termocuplului , care este considerat și astăzi cea mai precisă măsurare a temperaturii. Efectul invers Peltier a fost observat peste un deceniu mai târziu, când un curent a fost trecut printr-un circuit cu două metale diferite, rezultând o diferență de temperatură între metale.
În 1827 omul de știință german Georg Ohm și-a exprimat legea în celebra sa carte Die galvanische Kette, mathematisch bearbeitet (Circuitul galvanic investigat matematic) în care a dat teoria sa completă a electricității.
În 1829 Antoine-César Becquerel a dezvoltat celula „curent constant”, precursor al cunoscutei celule Daniell . Când această celulă acid-alcalină a fost monitorizată de un galvanometru , sa constatat că curentul este constant timp de o oră, prima instanță de „curent constant”. El a aplicat rezultatele studiului său de termoelectricitate la construcția unui termometru electric și a măsurat temperaturile din interiorul animalelor, ale solului la diferite adâncimi și ale atmosferei la diferite înălțimi. El a ajutat la validarea legilor lui Faraday și a efectuat ample investigații privind galvanizarea metalelor cu aplicații pentru finisarea metalelor și metalurgie . Tehnologia celulei solare datează din 1839 când Becquerel a observat că lumina strălucitoare a unui electrod scufundat într-o soluție conductivă ar crea un curent electric.
Michael Faraday a început, în 1832, ceea ce a promis că va fi o încercare destul de plictisitoare de a demonstra că toate electricitățile au exact aceleași proprietăți și au provocat exact aceleași efecte. Efectul cheie a fost descompunerea electrochimică. Electricitatea voltaică și electromagnetică nu a pus probleme, dar electricitatea statică a făcut-o. Pe măsură ce Faraday a aprofundat problema, a făcut două descoperiri uimitoare. În primul rând, forța electrică nu a acționat, așa cum se presupunea de mult, la distanță de molecule pentru a le determina să se disocieze. Trecerea energiei electrice printr-un mediu lichid conducător a determinat disocierea moleculelor, chiar și atunci când energia electrică s-a descărcat în aer și nu a trecut printr-un „pol” sau „centru de acțiune” într-o celulă voltaică. În al doilea rând, s-a constatat că valoarea descompunerii este legată direct de cantitatea de energie electrică care trece prin soluție.
Aceste descoperiri l-au condus pe Faraday la o nouă teorie a electrochimiei. Forța electrică, a susținut el, a aruncat moleculele unei soluții într-o stare de tensiune. Când forța a fost suficient de puternică pentru a distorsiona forțele care țineau moleculele împreună astfel încât să permită interacțiunea cu particulele învecinate, tensiunea a fost ameliorată prin migrarea particulelor de-a lungul liniilor de tensiune, diferitele părți ale atomilor migrând în direcții opuse. Cantitatea de energie electrică care a trecut, atunci, a fost în mod clar legată de afinitățile chimice ale substanțelor în soluție. Aceste experimente au condus direct la cele două legi ale electrochimiei lui Faraday care afirmă:
- Cantitatea de substanță depusă pe fiecare electrod al unei celule electrolitice este direct proporțională cu cantitatea de electricitate care trece prin celulă.
- Cantitățile de elemente diferite depuse de o anumită cantitate de electricitate sunt în raport cu greutățile lor echivalente chimice .
William Sturgeon a construit un motor electric în 1832 și a inventat comutatorul , un inel de perii cu păr metalic care permit armăturii rotitoare să mențină contactul cu curentul electric și a schimbat curentul alternativ într-un curent continuu pulsatoriu . De asemenea, a îmbunătățit bateria voltaică și a lucrat la teoria termoelectricității.
Hippolyte Pixii , un producător francez de instrumente, a construit prima dinamă în 1832 și ulterior a construit o dinamă de curent continuu folosind comutatorul. Acesta a fost primul generator mecanic practic de curent electric care a folosit concepte demonstrate de Faraday.
John Daniell a început experimentele în 1835, în încercarea de a îmbunătăți bateria voltaică cu problemele sale de a fi instabile și a unei surse slabe de curent electric. Experimentele sale au dus în curând la rezultate remarcabile. În 1836, el a inventat o celulă primară în care hidrogenul a fost eliminat în generarea energiei electrice. Daniell rezolvase problema polarizării . În laboratorul său învățase să aleagă zincul amalgamat de Sturgeon cu mercur. Versiunea sa a fost prima baterie din clasa cu două fluide și prima baterie care a produs o sursă constantă și fiabilă de curent electric pe o perioadă lungă de timp.
William Grove a produs prima celulă de combustibil în 1839. El și-a bazat experimentul pe faptul că trimiterea unui curent electric prin apă împarte apa în părțile sale componente de hidrogen și oxigen. Deci, Grove a încercat să inverseze reacția - combinând hidrogenul și oxigenul pentru a produce electricitate și apă. În cele din urmă, termenul de celulă de combustibil a fost inventat în 1889 de Ludwig Mond și Charles Langer , care au încercat să construiască primul dispozitiv practic folosind aerul și gazul industrial de cărbune . El a introdus, de asemenea, o baterie puternică la reuniunea anuală a Asociației Britanice pentru Avansarea Științei din 1839. Prima celulă a lui Grove a constat din zinc în acid sulfuric diluat și platină în acid azotic concentrat , separat de un vas poros. Celula a putut genera aproximativ 12 amperi de curent la aproximativ 1,8 volți. Această celulă avea aproape dublu tensiunea primei celule Daniell. Celula de acid azotic a lui Grove a fost bateria preferată a primului telegraf american (1840-1860), deoarece oferea o putere puternică de curent.
Pe măsură ce traficul telegrafic a crescut, s-a constatat că celula Grove a evacuat dioxid de azot gazos otrăvitor . Pe măsură ce telegrafele au devenit mai complexe, necesitatea unei tensiuni constante a devenit critică, iar dispozitivul Grove a fost limitat (pe măsură ce celula s-a descărcat, acidul azotic s-a epuizat și s-a redus tensiunea). În timpul războiului civil american , bateria lui Grove fusese înlocuită cu bateria Daniell. În 1841 Robert Bunsen a înlocuit scumpul electrod de platină folosit în bateria lui Grove cu un electrod de carbon. Acest lucru a condus la utilizarea pe scară largă a „bateriei Bunsen” în producția de iluminat cu arc și în galvanizare.
Wilhelm Weber a dezvoltat, în 1846, electrodinamometrul , în care un curent face ca o bobină suspendată într-o altă bobină să se întoarcă atunci când un curent este trecut prin ambele. În 1852, Weber a definit unitatea absolută de rezistență electrică (care a fost numită ohm după Georg Ohm). Numele lui Weber este acum folosit ca nume de unitate pentru a descrie fluxul magnetic , weber .
Fizicianul german Johann Hittorf a concluzionat că mișcarea ionilor a cauzat curent electric. În 1853 Hittorf a observat că unii ioni călătoreau mai repede decât alții. Această observație a condus la conceptul de număr de transport, rata la care anii ionici transportau curentul electric. Hittorf a măsurat modificările concentrației soluțiilor electrolizate, a calculat din acestea numărul de transport (capacități de transport relative) a multor ioni și, în 1869, a publicat concluziile sale care guvernează migrația ionilor.
În 1866, Georges Leclanché a brevetat un nou sistem de baterii, care a avut imediat succes. Celula originală a lui Leclanché a fost asamblată într-o oală poroasă. Electrodul pozitiv ( catodul ) consta din dioxid de mangan zdrobit cu puțin amestec de carbon. Polul negativ ( anodul ) era o tijă de zinc. Catodul a fost ambalat în oală și s-a introdus o tijă de carbon pentru a acționa ca un colector de curent. Anodul și vasul au fost apoi imersate într-o soluție de clorură de amoniu. Lichidul a acționat ca electrolitul, se scurge ușor prin vasul poros și intră în contact cu materialul catodic. Celula „umedă” a lui Leclanché a devenit precursorul primei baterii utilizate pe scară largă din lume, celula zinc-carbon.
Progresele secolului al XIX-lea și apariția societăților electrochimice
În 1869 Zénobe Gramme a conceput prima sa dinamă curentă continuă curată. Generatorul său a prezentat o armătură de inel înfășurată cu multe bobine individuale de sârmă.
Svante August Arrhenius și-a publicat teza în 1884, Recherches sur la conductibilité galvanique des électrolytes (Investigații privind conductivitatea galvanică a electroliților). Din rezultatele experimentelor sale, autorul a concluzionat că electroliții, atunci când sunt dizolvați în apă, se împart în diferite grade sau se disociază în ioni pozitivi și negativi. Gradul în care a avut loc această disociere a depins mai ales de natura substanței și de concentrația acesteia în soluție, fiind mai dezvoltată cu atât diluția este mai mare. Ionii trebuiau să fie purtătorii nu numai a curentului electric, ca și în electroliză, ci și a activității chimice. Relația dintre numărul real de ioni și numărul lor la diluare mare (când toate moleculele au fost disociate) a dat o cantitate de interes special („constantă de activitate”).
Cursa pentru producția comercială viabilă de aluminiu a fost câștigată în 1886 de Paul Héroult și Charles M. Hall . Problema pe care mulți cercetători au avut-o cu extragerea aluminiului a fost aceea că electroliza unei sări de aluminiu dizolvate în apă produce hidroxid de aluminiu . Atât Hall, cât și Héroult au evitat această problemă prin dizolvarea oxidului de aluminiu într-un nou solvent - criolit condensat ( Na 3 Al F 6 ).
Wilhelm Ostwald , laureat al Premiului Nobel din 1909 , și-a început activitatea experimentală în 1875, cu o investigație asupra legii acțiunii în masă a apei în raport cu problemele de afinitate chimică, cu accent special pe electrochimie și dinamica chimică . În 1894 a dat prima definiție modernă a unui catalizator și și-a îndreptat atenția asupra reacțiilor catalitice. Ostwald este cunoscut în special pentru contribuțiile sale la domeniul electrochimiei, inclusiv studii importante privind conductivitatea electrică și disocierea electrolitică a acizilor organici.
Hermann Nernst a dezvoltat teoria forței electromotoare a celulei voltaice în 1888. El a dezvoltat metode de măsurare a constantelor dielectrice și a fost primul care a arătat că solvenții cu constante dielectrice ridicate promovează ionizarea substanțelor. Studiile timpurii ale lui Nernst în electrochimie au fost inspirate din teoria disocierii lui Arrhenius, care a recunoscut mai întâi importanța ionilor în soluție. În 1889, Nernst a elucidat teoria celulelor galvanice prin asumarea unei „presiuni electrolitice de dizolvare”, care forțează ionii din electrozi în soluție și care era opusă presiunii osmotice a ionilor dizolvați. El a aplicat principiile termodinamicii reacțiilor chimice care au loc într-o baterie. În același an, el a arătat cum pot fi utilizate caracteristicile curentului produs pentru a calcula schimbarea energiei libere în reacția chimică care produce curentul. El a construit o ecuație, cunoscută sub numele de ecuația Nernst , care descrie relația tensiunii unei celule a bateriei cu proprietățile acesteia.
În 1898, Fritz Haber și-a publicat manualul, Electrochimie: Grundriss der technischen Elektrochemie auf teorischer Grundlage (Bazele teoretice ale electrochimiei tehnice), care se baza pe prelegerile pe care le-a susținut la Karlsruhe . În prefața cărții sale și-a exprimat intenția de a lega cercetarea chimică de procesele industriale și în același an a raportat rezultatele muncii sale privind oxidarea și reducerea electrolitică, în care a arătat că pot rezulta produse de reducere definite dacă tensiunea la catodul se menține constant. În 1898 a explicat reducerea nitrobenzenului în etape la catod și acesta a devenit modelul pentru alte procese de reducere similare.
În 1909, Robert Andrews Millikan a început o serie de experimente pentru a determina sarcina electrică purtată de un singur electron. El a început prin măsurarea cursului picăturilor de apă încărcate într-un câmp electric. Rezultatele au sugerat că sarcina pe picături este un multiplu al sarcinii electrice elementare, dar experimentul nu a fost suficient de precis pentru a fi convingător. El a obținut rezultate mai precise în 1910 cu celebrul său experiment cu picături de ulei în care a înlocuit apa (care tindea să se evapore prea repede) cu ulei.
Jaroslav Heyrovský , laureat al Premiului Nobel, a eliminat cântărirea obositoare necesară de tehnicile analitice anterioare, care au folosit precipitarea diferențială a mercurului măsurând timpul de scădere. În metoda anterioară, s-a aplicat o tensiune la un electrod de mercur care scade și un electrod de referință a fost scufundat într-o soluție de testare. După ce au fost colectate 50 de picături de mercur, acestea au fost uscate și cântărite. Tensiunea aplicată a fost variată și experimentul repetat. Greutatea măsurată a fost reprezentată grafic față de tensiunea aplicată pentru a obține curba. În 1921, Heyrovský a avut ideea de a măsura curentul care curge prin celulă în loc să studieze doar timpul de cădere.
La 10 februarie 1922, s-a născut „ polarograful ”, deoarece Heyrovský a înregistrat curba curent-tensiune pentru o soluție de 1 mol / L NaOH . Heyrovský a interpretat corect creșterea actuală între -1,9 și -2,0 V ca fiind datorată depunerii ionilor Na + , formând un amalgam. La scurt timp după aceea, împreună cu colegul său japonez Masuzo Shikata , a construit primul instrument pentru înregistrarea automată a curbelor polarografice, care a devenit faimos în lume ca polarograf.
În 1923, Johannes Nicolaus Brønsted și Thomas Martin Lowry au publicat în esență aceeași teorie despre modul în care acizii și bazele se comportă folosind baza electrochimică.
Societatea Internațională de Electrochimie (ISE) a fost fondată în 1949, iar câțiva ani mai târziu , primul sofisticat electroforetică aparat a fost dezvoltat în 1937 de către Arne Tiselius , care a primit premiul Nobel 1948 pentru activitatea sa in proteine electroforeză . El a dezvoltat „limita în mișcare”, care mai târziu va deveni cunoscută sub numele de electroforeză de zonă și a folosit-o pentru a separa proteinele serice în soluție. Electroforeza s-a dezvoltat pe scară largă în anii 1940 și 1950 când tehnica a fost aplicată pe molecule variind de la cele mai mari proteine la aminoacizi și chiar la ioni anorganici.
În anii 1960 și 1970, electrochimia cuantică a fost dezvoltată de Revaz Dogonadze și elevii săi.
Vezi si
Referințe
- „Utilizarea electricității descrisă de medic în medicină” . Electricitatea lui T.Gale sau foc eteric, considerat, 1802 . Adus la 10 martie 2008 .
- Corrosion-Doctors.org
- O referință clasică și cunoscută - dar datată - cu privire la istoria electrochimiei este în 1909 Nobelul pentru chimie, Wilhelm Ostwald: Elektrochemie: Ihre Geschichte und Lehre, Wilhelm Ostwald, Veit, Leipzig, 1896. ( https://archive.org/details / elektrochemieih00ostwgoog ). O versiune în limba engleză este disponibilă ca „Electrochimie: istorie și teorie” (2 volume), tradusă de NP Date. A fost publicat pentru Smithsonian Institution și National Science Foundation, Washington, DC, de către Amerind Publ. Co., New Delhi, 1980.