Hexacloroplatinat de potasiu - Potassium hexachloroplatinate
|
|

|
|
| Identificatori | |
|---|---|
|
Model 3D ( JSmol )
|
|
| ECHA InfoCard |
100.037.239 |
|
PubChem CID
|
|
| Numărul RTECS | |
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
| Proprietăți | |
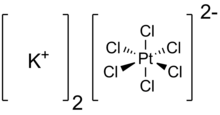
| K 2 PTCL 6 | |
| Masă molară | 485,99 g / mol |
| Aspect | solid portocaliu până la galben |
| Densitate | 3,344 g / cm 3 |
| Punct de topire | 250 ° C (482 ° F; 523 K) (se descompune) |
| 0,89 g / 100 ml H 2 O (la 25 ° C) | |
|
Produs de solubilitate ( K sp )
|
7,48 × 10 −6 |
| Pericole | |
| Fișa cu date de securitate | MSDS Oxford |
|
Clasificare UE (DSD) (învechită)
|
Toxic (T) |
| Punct de aprindere | 250 ° C (482 ° F; 523 K) |
| Compuși înrudiți | |
|
Alți anioni
|
Tetracloroplatinat de potasiu |
|
|
|
| Referințe infobox | |
Hexacloroplatinat de potasiu este compus anorganic cu formula K 2 PTCL 6 . Este un solid galben care este un exemplu de sare de potasiu relativ insolubilă. Sarea prezintă dianionul hexacloroplatinat (IV), care are o geometrie de coordonare octaedrică .
Precipitarea acestui compus din soluții de acid hexacloroplatinic a fost folosită anterior pentru determinarea potasiului prin analiză gravimetrică . De asemenea, este util ca intermediar în recuperarea platinei din deșeuri.
Reacții
Folosind reacții de metateză a sării , hexacloroplatinatul de potasiu este transformat într-o varietate de amoniu cuaternar și săruri lipofile conexe. Acestea includ sare de tetrabutilamoniu (NBu 4 ) 2 PtCl 6 , cunoscut sub numele de catalizator Lukevics .
Reducerea hexacloroplatinatului de potasiu cu diclorhidrat de hidrazină dă sarea tetracloroplatinată corespunzătoare .
Referințe
- ^ Grinberg, AA; Sibirskaya, VV (1967). "Solubilitatea complexelor de hexamină și hexahalo platină (IV)". Zhurnal Neorganicheskoi Khimii . 12 : 2069–2071.
- ^ John Rumble (18 iunie 2018). Manual CRC de chimie și fizică (ed. 99). CRC Press. pp. 5–189. ISBN 1138561630.
- ^ GF Smith; JL Gring (1933). "Separarea și determinarea metalelor alcaline folosind acid percloric. V. acid percloric și acid cloroplatinic în determinarea cantităților mici de potasiu în prezența unor cantități mari de sodiu". J. Am. Chem. Soc. 55 (10): 3957–3961. doi : 10.1021 / ja01337a007 .
- ^ George B. Kauffman, Larry A. Teter "Recuperarea platinei din reziduurile de laborator" Sinteze anorganice, 1963, volumul 7, pp. 232-236. doi : 10.1002 / 9780470132388.ch61
- ^ Iovel, IG; Goldberg, YS; Shymanska, MV; Lukevics, E. (1987). „Hexacloroplatinate cuaternare de oniu: noi catalizatori de hidrosililare”. Organometalici . 6 (7): 1410-1413. doi : 10.1021 / om00150a007 .CS1 maint: folosește parametrul autorilor ( link )
- ^ George B. Kauffman, Dwaine A. Cowan (1963). „Cis - și trans-diclorodiamminăplatinum (II)”. cis- și trans-diclorodiammină platină (II) . Sinteze anorganice. 7 . pp. 239–245. doi : 10.1002 / 9780470132388.ch63 . ISBN 9780470132388.CS1 maint: folosește parametrul autorilor ( link )
- ^ Keller, RN; Moeller, T. (1963). „Tetracloroplatinat de potasiu (II)”. Inorg. Sintetizator. 7 : 247–250. doi : 10.1002 / 9780470132333.ch79 .
