Mutație BRCA - BRCA mutation
| Mutație BRCA | |
|---|---|
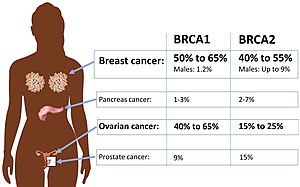 | |
| Risc absolut de cancer în mutația BRCA1 sau BRCA2 . | |
| Specialitate | Genetica medicală |
O mutație BRCA este o mutație în oricare dintre genele BRCA1 și BRCA2 , care sunt gene supresoare tumorale. Au fost identificate sute de diferite tipuri de mutații în aceste gene, dintre care unele au fost determinate ca fiind dăunătoare, în timp ce altele nu au un impact dovedit. Mutațiile nocive ale acestor gene pot produce un sindrom ereditar de cancer mamar-ovarian la persoanele afectate. Doar 5-10% din cazurile de cancer mamar la femei sunt atribuite mutațiilor BRCA1 și BRCA2 (mutațiile BRCA1 fiind puțin mai frecvente decât mutațiile BRCA2 ), dar impactul asupra femeilor cu mutația genică este mai profund. Femeile cu mutații dăunătoare ale fie BRCA1 sau BRCA2 au un risc de cancer de san , care este de aproximativ cinci ori mai mare decât riscul normal, și un risc de cancer ovarian , care este de aproximativ zece la treizeci de ori normale. Riscul de cancer mamar și ovarian este mai mare la femeile cu mutație BRCA1 cu risc crescut decât la mutația BRCA2 . A avea o mutație cu risc ridicat nu garantează că femeia va dezvolta orice tip de cancer sau nu implică faptul că orice cancer care apare a fost de fapt cauzat de mutație, mai degrabă decât un alt factor.
Mutațiile cu risc ridicat, care dezactivează un proces important de reparare a ADN-ului fără erori ( reparații direcționate către omologie ), cresc semnificativ riscul persoanei de a dezvolta cancer de sân , cancer ovarian și alte tipuri de cancer. De ce BRCA1 si BRCA2 mutatii conduce preferențial la cazurile de cancer de san si de ovar nu este cunoscut, dar lipsa de BRCA1 funcția pare să conducă la non-funcționale X-inactivare cromozom . Nu toate mutațiile sunt cu risc ridicat; unele par a fi variații inofensive. Riscul de cancer asociat cu orice mutație dată variază semnificativ și depinde de tipul exact și localizarea mutației și posibil de alți factori individuali.
Mutațiile pot fi moștenite de la oricare dintre părinți și pot fi transmise atât fiilor, cât și fiicelor. Fiecare copil al unui purtător genetic , indiferent de sex, are 50% șanse să moștenească gena mutantă de la părintele care poartă mutația. Ca urmare, jumătate dintre persoanele cu mutații genice BRCA sunt de sex masculin, care ar transmite apoi mutația la 50% din descendenții lor, bărbați sau femei. Riscul de cancer de sân legat de BRCA la bărbații cu mutație este mai mare decât la alți bărbați, dar este încă scăzut. Cu toate acestea, mutațiile BRCA pot crește riscul altor tipuri de cancer, cum ar fi cancerul de colon , cancerul pancreatic și cancerul de prostată .
Metodele pentru a diagnostica probabilitatea ca un pacient cu mutații în BRCA1 și BRCA2 să aibă cancer au fost acoperite de brevete deținute sau controlate de Myriad Genetics . Modelul de afaceri al Myriad de a oferi exclusiv testul de diagnostic a condus la creșterea Myriad de la a fi o startup în 1994 la a fi o companie cotată la bursă, cu 1200 de angajați și aproximativ 500 milioane USD în venituri anuale în 2012; a dus, de asemenea, la controverse privind prețurile ridicate și incapacitatea de a obține opiniile secundare de la alte laboratoare de diagnostic, ceea ce a dus la rândul său la procesul de referință al Asociației pentru Patologie Moleculară v. Myriad Genetics .
Efectele sanatatii
Femeile cu mutații dăunătoare fie BRCA1 sau BRCA2 gene au un risc ridicat de a dezvolta de san si / sau cancer ovarian . Deoarece diferite studii analizează populații diferite și deoarece diferite tipuri de mutații au riscuri oarecum diferite, riscul este cel mai bine exprimat ca un interval, mai degrabă decât un singur număr.
Aproximativ 50% până la 65% dintre femeile născute cu mutație dăunătoare în BRCA1 vor dezvolta cancer mamar până la vârsta de 70 de ani și 35% până la 46% vor dezvolta cancer ovarian până la vârsta de 70 de ani. Aproximativ 40% până la 57% dintre femeile cu mutație dăunătoare în BRCA2 va dezvolta cancer mamar până la vârsta de 70 de ani, iar 13% până la 23% vor dezvolta cancer ovarian până la vârsta de 70 de ani.
Femeile cu un cancer de sân asociat cu o mutație BRCA au o probabilitate de până la 40% să dezvolte un nou cancer de sân primar în decurs de 10 ani de la diagnosticarea inițială, dacă nu au primit tratament cu tamoxifen sau au ooforectomie . Riscul de zece ani al femeii pentru cancerul ovarian este, de asemenea, crescut cu 6-12% în aceste condiții.
Statisticile pentru cancerul ovarian legat de BRCA cuprind de obicei nu numai cancerul ovarelor în sine, ci și cancerul peritoneal și cancerul foarte rar, dar oarecum mai ușor de detectat, al trompelor uterine . Femeile cu mutație BRCA au o rată de peste 100 de ori mai mare decât cea normală a cancerului de trompă uterină. Aceste trei tipuri de cancere pot fi dificil de distins în stadiile lor avansate.
Debutul cancerului
Cancerul de sân legat de BRCA apare la o vârstă mai timpurie decât cancerul de sân sporadic. S-a afirmat că cancerul de sân legat de BRCA este mai agresiv decât cancerul de sân normal, cu toate acestea, majoritatea studiilor efectuate pe populații specifice sugerează o diferență mică sau deloc în ratele de supraviețuire, în ciuda factorilor prognostici aparent mai răi.
- BRCA1 este asociat cu cancer de sân triple-negativ , care nu răspunde la tratamentele hormonale și nu poate fi tratat în mod util cu unele medicamente, cum ar fi trastuzumab . Cancerul de sân apare adesea cu aproximativ două decenii mai devreme decât în mod normal.
- BRCA2 este asociat în primul rând cu cancerul de sân post-menopauză, deși riscul de cancer de sân pre-menopauză este semnificativ. De obicei, este foarte receptiv la tratamentele hormonale.
Cancerul ovarian și al trompei Fallopian legat de BRCA este mai tratabil decât media, deoarece este neobișnuit de susceptibil la chimioterapie pe bază de platină, cum ar fi cisplatina . Cancerul ovarian legat de BRCA1 apare la vârste mai mici, dar riscul pentru femeile cu BRCA2 crește semnificativ la sau imediat după menopauză.
Impactul supraviețuirii
72/100 | |
46/100 | |
|
11/100
72% dintre femeile cu mutație BRCA1 și 46% dintre femeile cu mutație BRCA2 (și fără screening sau intervenții medicale) care mor înainte de vârsta de 70 de ani vor muri de cancer mamar sau ovarian. 11% dintre femeile din SUA care mor înainte de vârsta de 70 de ani vor muri de cancer mamar sau ovarian.
|
| grup | Procent care a supraviețuit până la vârsta de 70 de ani |
|---|---|
| Mutație BRCA1 |
59
|
| Mutație BRCA2 |
71
|
| Femeie tipică |
84
|
O femeie în vârstă de 25 de ani, fără nicio mutație în genele sale BRCA, are o probabilitate de 84% să atingă cel puțin vârsta de 70 de ani. Din cei care nu supraviețuiesc, 11% mor fie din cauza cancerului mamar, fie a celui ovarian și 89% din alte cauze.
Comparativ cu aceasta, o femeie cu mutație BRCA1 cu risc crescut , dacă ar avea screening pentru cancerul de sân, dar nu ar avea intervenție medicală sau chirurgicală profilactică, ar avea doar 59% șanse să atingă vârsta de 70 de ani, cu douăzeci și cinci de puncte procentuale mai mică decât în mod normal. Dintre femeile care nu au supraviețuit, 26% ar muri de cancer mamar, 46% cancer ovarian și 28% alte cauze.
Femeile cu mutații BRCA2 cu risc ridicat , cu screening, dar fără intervenție medicală sau chirurgicală profilactică, ar avea doar 71% șanse să atingă vârsta de 70 de ani, cu 13 puncte procentuale mai mici decât în mod normal. Dintre cei care nu au supraviețuit, 21% ar muri de cancer mamar, 25% cancer ovarian și 54% alte cauze.
Probabilitatea de a supraviețui până la cel puțin 70 de ani poate fi îmbunătățită prin mai multe intervenții medicale, în special mastectomia profilactică și ooforectomia.
Cancer de san masculin
Bărbații cu mutație BRCA prezintă un risc relativ ridicat de a dezvolta cancer de sân, dar, deoarece incidența generală a cancerului de sân la bărbați este atât de mică, riscul absolut este egal sau mai mic decât riscul pentru femeile fără mutație BRCA . Aproximativ 1% până la 2% dintre bărbații cu mutație BRCA1 vor dezvolta cancer de sân până la vârsta de 70 de ani. Aproximativ 6% dintre bărbații cu mutație BRCA2 vor dezvolta cancer de sân până la vârsta de 70 de ani, ceea ce este aproximativ egal cu riscul pentru femeile fără mutație BRCA . Foarte puțini bărbați, cu sau fără o mutație predispozantă, dezvoltă cancer de sân înainte de vârsta de 50 de ani.
Aproximativ jumătate dintre bărbații care dezvoltă cancer de sân au o mutație într-o genă BRCA sau în una dintre celelalte gene asociate cu sindroame ereditare de cancer mamar-ovarian .
Cancerul de sân la bărbați poate fi tratat la fel de bine ca și cancerul de sân la femei, dar bărbații ignoră adesea semnele și simptomele cancerului, cum ar fi o zonă dureroasă sau o umflare neobișnuită, care poate fi mai mare decât un bob de orez , până când nu are a ajuns într-o etapă târzie.
Spre deosebire de ceilalți bărbați, bărbații cu mutație BRCA , în special o mutație BRCA2 , pot beneficia de examene profesionale și auto- mamare . Imagistica medicală nu este de obicei recomandată, dar deoarece purtătorii BRCA2 de sex masculin prezintă un risc de cancer mamar care este foarte asemănător cu populația generală feminină, programul anual de mamografie standard poate fi adaptat acestor bărbați cu risc ridicat.
Alte tipuri de cancer
Mutațiile au fost asociate cu un risc crescut de a dezvolta orice tip de cancer invaziv, inclusiv cancer de stomac , cancer pancreatic , cancer de prostată și cancer de colon . Purtătorii au riscurile normale de a dezvolta cancer (și alte boli) asociate cu vârsta crescută, fumatul, consumul de alcool, dieta slabă, lipsa exercițiilor fizice și alți factori de risc cunoscuți, plus riscul suplimentar din cauza mutațiilor genetice și o susceptibilitate crescută la deteriorare din radiații ionizante, inclusiv radiații naturale de fond .
Bărbații cu mutații BRCA nu pot face cancer ovarian, dar pot avea de două ori mai multe șanse ca cei care nu poartă să dezvolte cancer de prostată la o vârstă mai mică. Riscul este mai mic și contestat pentru transportatorii BRCA1 ; până la o treime din BRCA2 purtătorii mutației sunt de așteptat pentru a dezvolta cancer de prostata inainte de varsta de 65 de cancer de prostata in BRCA operatorii de transport mutatie tinde sa apara cu un deceniu mai devreme decât în mod normal, și tinde să fie mai agresiv decât în mod normal. Ca rezultat, screeningul anual al prostatei, inclusiv un examen rectal digital , este adecvat la vârsta de 40 de ani în rândul purtătorilor cunoscuți, mai degrabă decât la vârsta de 50 de ani.
Cancerul pancreasului tinde să apară în familii, chiar și în rândul familiilor BRCA . O mutație BRCA1 dublează sau triplează aproximativ riscul de a dezvolta cancer pancreatic pe viață; o mutație BRCA2 se triplează pentru a o quintupla. Între 4% și 7% dintre persoanele cu cancer pancreatic au o mutație BRCA . Cu toate acestea, deoarece cancerul pancreatic este relativ rar, persoanele cu mutație BRCA2 se confruntă probabil cu un risc absolut de aproximativ 5%. La fel ca cancerul ovarian, tinde să nu producă simptome în stadiile incipiente, tratabile. La fel ca cancerul de prostată, cancerul pancreatic asociat cu o mutație BRCA tinde să apară cu aproximativ un deceniu mai devreme decât cazurile non-ereditare. Screeningul asimptomatic este invaziv și poate fi recomandat numai purtătorilor de BRCA2 care au, de asemenea, un istoric familial de cancer pancreatic.
Melanomul este cel mai mortal cancer de piele, deși este ușor de vindecat în stadiile incipiente. Probabilitatea normală de a dezvolta melanom depinde de rasă, de numărul de alunițe pe care le are persoana, de antecedentele familiale, de vârstă, de sex și de cât de mult a fost expus persoana la radiații UV. Purtătorii de mutație BRCA2 au aproximativ dublu sau triplu riscul pe care l-ar avea în mod normal, inclusiv un risc mai mare decât cel mediu de melanom ocular .
Cancerul de colon este la fel de frecvent atât la bărbați, cât și la femei în lumea dezvoltată, pe cât cancerul de sân este printre femeile cu risc mediu, aproximativ 6% dintre oameni fiind diagnosticați cu acesta, de obicei cu vârsta peste 50 de ani. La fel ca cancerul de prostată sporadic, este o boală multifactorială și este afectată de vârstă, dietă și factori similari. Purtătorii de mutații BRCA prezintă un risc mai mare decât media de apariție a acestui cancer comun, dar riscul nu este la fel de mare ca în alte tipuri de cancer ereditar . Riscul ar putea fi de patru ori mai mare în unele familii BRCA1 și să dubleze riscul normal în rândul transportatorilor BRCA2 . La fel ca cancerul pancreatic, este posibil ca doar unele mutații BRCA sau unele familii BRCA să aibă un risc suplimentar; spre deosebire de alte tipuri de cancer cauzate de BRCA , acesta nu apare la o vârstă mai timpurie decât de obicei. De obicei, screening-ul cancerului de colon este recomandat purtătorilor de mutație BRCA .
Mutațiile din BRCA1 și BRCA2 sunt puternic implicate în unele tumori maligne hematologice . Mutațiile BRCA1 sunt asociate cu leucemie mielogenă acută și leucemie mielogenă cronică . Mutațiile BRCA2 se găsesc, de asemenea, în multe limfoame cu celule T și leucemii limfocitare cronice .
Copilă
Dilema de a avea sau nu copii poate fi o sursă de stres pentru femeile care află despre mutațiile lor BRCA în perioada fertilă.
Este probabil puțin sau deloc un efect al mutației genei BRCA asupra fertilității generale , deși femeile cu mutație BRCA pot avea mai multe șanse de a avea insuficiență ovariană primară . Purtătorii de mutație BRCA pot avea mai multe șanse să nască fete decât băieți, cu toate acestea această observație a fost atribuită prejudecății de constatare .
Dacă ambii părinți sunt purtători ai unei mutații BRCA , atunci diagnosticul genetic pre-implantare este uneori folosit pentru a preveni nașterea unui copil cu mutații BRCA . Moștenirea a două mutații BRCA1 (una de la fiecare părinte) nu a fost raportată niciodată și se crede că este un defect letal de naștere. Moștenirea unei mutații BRCA1 și a unei mutații BRCA2 a fost raportată ocazional; riscul copilului pentru orice tip de cancer dat este riscul mai mare al celor două gene (de exemplu, riscul de cancer ovarian de la BRCA1 și riscul de cancer pancreatic de la BRCA2 ). Moștenirea a două mutații BRCA2 produce anemie Fanconi .
Fiecare sarcină la femeile tipice genetic este asociată cu o reducere semnificativă a riscului mamei de a dezvolta cancer de sân după vârsta de 40 de ani. Cu cât femeia este mai tânără în momentul primei nașteri, cu atât primește mai multă protecție împotriva cancerului de sân. Alăptarea de mai mult de un an protejează împotriva cancerului de sân. Sarcina protejează și împotriva cancerului ovarian la femeile tipice genetic.
Deși unele studii au produs rezultate diferite, femeile cu mutații BRCA nu sunt în general de așteptat să primească aceste beneficii de protecție semnificative. Cercetările actuale sunt prea limitate și imprecise pentru a permite calcularea riscurilor specifice. Cu toate acestea, au fost identificate următoarele tendințe generale:
- Pentru femeile cu mutație BRCA1 , vârsta femeii la naștere nu are nicio asociere cu riscul de cancer mamar. Fecundarea nu oferă nicio protecție împotriva cancerului de sân, cu excepția cazului în care femeia are cinci sau mai multe sarcini pe termen lung, moment în care primește doar o protecție modestă. Similar femeilor tipice genetic, sarcina protejează împotriva cancerului ovarian la femeile BRCA1 . Alăptarea de mai mult de un an protejează semnificativ împotriva cancerului de sân. Acest efect poate fi de până la 19% pe an de alăptare, ceea ce este mult mai mare decât cel observat la femeile tipice genetic. Efectul, dacă este cazul, alăptării pe termen lung asupra cancerului ovarian nu este clar.
- Pentru femeile cu mutație BRCA2 , fiecare sarcină este asociată paradoxal cu o creștere semnificativă statistic a riscului de cancer mamar. Spre deosebire de femeile tipice genetic sau de femeile cu mutații BRCA1 , alăptarea nu are niciun efect asupra cancerului la femeile cu mutații BRCA2 . Datele limitate și contradictorii sugerează că, spre deosebire de alte femei, sarcina nu reduce semnificativ riscul de cancer ovarian la femeile cu mutație BRCA2 și ar putea să-l crească.
Genetica

Ambele gene BRCA sunt gene supresoare tumorale care produc proteine care sunt utilizate de celulă într-o cale enzimatică care face reparații foarte precise, perfect potrivite la moleculele de ADN care au pauze dublu catenare. Calea necesită proteine produse de alte câteva gene, inclusiv CHK2 , FANCD2 și ATM . Mutațiile nocive din oricare dintre aceste gene dezactivează gena sau proteina pe care o produce.
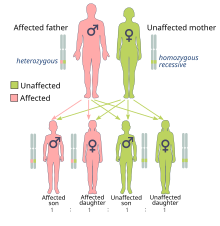
Riscul de cancer cauzat de mutațiile BRCA1 și BRCA2 sunt moștenite într-o manieră dominantă , deși, de obicei, o singură alelă mutantă este moștenită direct. Acest lucru se datorează faptului că este posibil ca persoanele cu mutație să dobândească oa doua mutație, ceea ce duce la expresia dominantă a cancerului. O genă BRCA mutantă poate fi moștenită de la oricare dintre părinți. Deoarece sunt moștenite de la părinți, acestea sunt clasificate ca mutații ereditare sau germinale mai degrabă decât mutații dobândite sau somatice . Cancerul cauzat de o genă mutantă moștenită de la părinții unei persoane este mai degrabă un cancer ereditar decât un cancer sporadic .
Deoarece oamenii au un genom diploid , fiecare celulă are două copii ale genei (una de la fiecare părinte biologic). De obicei, o singură copie conține o mutație dezactivată, moștenită, astfel încât persoana afectată este heterozigotă pentru mutație. Cu toate acestea, dacă copia funcțională este afectată, atunci celula este forțată să utilizeze mecanisme alternative de reparare a ADN-ului, care sunt mai predispuse la erori. Pierderea copiei funcționale se numește pierderea heterozigozității (LOH). Orice erori rezultate în repararea ADN pot duce la moartea celulelor sau la o transformare canceroasă a celulei.
Există multe variații ale genelor BRCA și nu toate modificările conferă aceleași riscuri. Unele variante sunt inofensive; se știe că altele sunt foarte dăunătoare. Unele polimorfisme nucleotidice unice pot conferi doar un risc mic sau pot conferi risc doar în prezența altor mutații sau în anumite circumstanțe. În alte cazuri, nu se știe dacă varianta este dăunătoare. Variantele sunt clasificate după cum urmează:
- Mutație dăunătoare : schimbarea se dovedește a provoca riscuri semnificative. Adesea, acestea sunt mutații de schimbare a cadrelor care împiedică celula să producă mai mult decât prima parte a proteinei necesare.
- Bănuit dăunător : Deși nimic nu este dovedit, variația este considerată a fi dăunătoare.
- Varianta de semnificație incertă (VUS): dacă schimbarea are vreun efect este incert. Acesta este un rezultat obișnuit al testului și majoritatea variantelor au început în această categorie. Pe măsură ce se dobândesc mai multe dovezi, acestea sunt reclasificate.
- Varianta, favorizează polimorfismul : Deși nimic nu este dovedit, variația este considerată a fi inofensivă.
- Polimorfism benign : Modificarea este clasificată ca inofensivă. Acestea pot fi raportate ca „fără mutație”.
Mutațiile dăunătoare au penetranță genetică ridicată, dar nu completă, ceea ce înseamnă că persoanele cu mutație prezintă un risc ridicat de a dezvolta boli ca urmare, dar că unii oameni nu vor dezvolta cancer în ciuda faptului că au o mutație dăunătoare.
Diagnostic
Consilierea genetică este recomandată femeilor a căror istorie de sănătate personală sau familială sugerează o probabilitate mai mare decât media de mutație. Scopul consilierii genetice este de a educa persoana cu privire la probabilitatea unui rezultat pozitiv, riscurile și beneficiile testării, limitările testelor, semnificația practică a rezultatelor și acțiunile de reducere a riscurilor care ar putea fi întreprinse dacă rezultatele sunt pozitive. De asemenea, sunt instruiți pentru a sprijini oamenii prin orice reacții emoționale și pentru a fi o persoană neutră care îl ajută pe client să ia propria decizie într-un model de consimțământ informat , fără a-l împinge pe client să facă ceea ce ar putea face consilierul. Deoarece cunoașterea unei mutații poate produce anxietate substanțială, unii oameni aleg să nu fie testați sau să amâne testarea până la o dată ulterioară.
Indicațiile relative pentru testarea unei mutații în BRCA1 sau BRCA2 pentru nou-diagnosticați sau membrii familiei includ un istoric familial printre rudele de gradul 1 (FDR), 2 (SDR) sau 3 (TDR), de obicei de pe aceeași parte a familiei, dar nu limitat :
- O mutație cunoscută (BRCA1 sau BRCA2) într-o genă de susceptibilitate la cancer în cadrul familiei
- Femeile afectate de orice cancer de sân diagnosticat cu vârsta sub 30 de ani
- Femeile afectate de cancer mamar triplu negativ (TNBC) ( receptor de estrogen negativ, receptor de progesteron negativ și HER2 / neu negativ) sub 50 de ani
- Două rude (FDR / SDR) diagnosticate cu vârsta sub 45 de ani
- Trei rude (FDR / SDR) diagnosticate cu vârsta medie de 50 sau mai puțin
- Patru rude la orice vârstă
- Cancer ovarian, fie cu o rudă diagnosticată suplimentară, fie cu o rudă cu cancer mamar masculin
- Un singur membru al familiei cu cancer mamar și ovarian
- Cancer de san masculin
- Cancer pancreatic cu sân sau cancer ovarian la aceeași persoană sau pe aceeași parte a familiei
- Ascendenți ascendenți evrei sau polonezi cu un membru al familiei FDR afectat de cancer de sân sau ovarian la orice vârstă
Testarea copiilor mici este considerată lipsită de etică din punct de vedere medical, deoarece rezultatele testelor nu ar schimba modul în care este îngrijită sănătatea copilului.
Procedura de testare
Sunt disponibile două tipuri de teste. Ambele folosesc în mod obișnuit o probă de sânge , deși testarea se poate face pe salivă. Testul cel mai rapid, cel mai simplu și cel mai mic cost folosește rezultatele pozitive ale testelor de la o rudă de sânge și verifică numai mutația unică despre care se știe că este prezentă în familie. Dacă nicio rudă nu a dezvăluit anterior rezultatele pozitive ale testului, atunci poate fi efectuat un test complet care verifică întreaga secvență atât a BRCA1, cât și a BRCA2 . În unele cazuri, din cauza efectului fondator , etnia evreiască poate fi utilizată pentru a restrânge testarea pentru a verifica rapid cele mai comune trei mutații observate la evreii askenazi .
Testarea este acoperită în mod obișnuit de asigurările de sănătate și de programele publice de asistență medicală pentru persoanele cu risc crescut de a avea o mutație și nu este acoperită pentru persoanele cu risc scăzut. Scopul limitării testării la persoanele cu risc ridicat este de a crește probabilitatea ca persoana să primească un rezultat semnificativ, acționabil din test, mai degrabă decât identificarea unei variante de semnificație necunoscută (VUS). În Canada, persoanele care își demonstrează statutul de risc crescut prin respectarea liniilor directoare specificate sunt direcționate inițial către un program specializat pentru cancerul ereditar și, dacă aleg să fie testate, costul testului este acoperit în totalitate. În SUA, în 2010, testarea la un singur loc a avut un cost de vânzare cu amănuntul între 400 și 500 USD, iar analiza completă a costat aproximativ 3.000 USD pe genă, iar costurile au fost acoperite în mod obișnuit de asigurările private de sănătate pentru persoanele considerate a fi cu risc ridicat.
Testul este comandat de un medic, de obicei un oncolog , iar rezultatele sunt întotdeauna returnate medicului, mai degrabă decât direct pacientului. Cât de repede sunt returnate rezultatele depinde de test (analiza pe un singur loc necesită mai puțin timp de laborator) și de infrastructura pusă la punct. În SUA, rezultatele testelor sunt de obicei returnate în decurs de una până la câteva săptămâni; în Canada, pacienții așteaptă de obicei opt până la zece luni pentru a obține rezultatele testelor.
Interpretarea testului
Un rezultat pozitiv al testului pentru o mutație dăunătoare cunoscută este dovada unei predispoziții, deși nu garantează că persoana va dezvolta orice tip de cancer. Un rezultat negativ al testului, dacă se știe că o mutație specifică este prezentă în familie, arată că persoana nu are o predispoziție BRCA pentru cancer, deși nu garantează că persoana nu va dezvolta un caz non-ereditar de cancer. În sine, un rezultat negativ al testului nu înseamnă că pacientul nu are predispoziție ereditară pentru cancerul de sân sau ovarian. Familia poate avea o altă predispoziție genetică pentru cancer, implicând o altă genă.
Prevenirea cancerului
O varietate de opțiuni de screening și intervenții sunt disponibile pentru a gestiona riscurile de cancer legate de BRCA . Screeningurile sunt ajustate la factorii de risc individuali și familiali.
Deoarece aceste metode de screening nu previn cancerul, ci doar încearcă să-l prindă devreme, se practică uneori numeroase metode de prevenire, cu rezultate diferite.
Screening
Un regim intensiv de screening al cancerului este recomandat, de obicei, pentru femeile cu mutații BRCA dăunătoare sau suspectate, pentru a detecta noi tipuri de cancer cât mai devreme posibil. O recomandare tipică include screeningul frecvent al cancerului de sân , precum și teste pentru depistarea cancerului ovarian.
Studiile de imagistică a sânului includ, de obicei, un RMN de sân (imagistică prin rezonanță magnetică) o dată pe an, începând cu vârste cuprinse între 20 și 30 de ani, în funcție de vârsta la care rudele au fost diagnosticate cu cancer de sân. Mamografiile sunt utilizate în mod obișnuit numai la vârste avansate, deoarece există motive să credem că purtătorii BRCA sunt mai susceptibili la inducerea cancerului de sân prin leziuni cu raze X decât populația generală.
Alternativele includ san ultrasonografie , CT , scanari PET , scintimammography , elastografia , termografia , lavaj ductal , si protocoale de screening experimentale, unele dintre care spera sa identifice biomarkerilor pentru cancerul de san (molecule care apar in sange atunci cand incepe cancerul de san).
Screeningul cancerului ovarian implică de obicei ultrasunografia regiunii pelvine, de obicei de două ori pe an. Femeile pot utiliza, de asemenea, un test de sânge pentru CA-125 și examene clinice pelvine . Testul de sânge are o sensibilitate și specificitate relativ slabe pentru cancerul ovarian.
Atât în screeningul mamar, cât și în cel ovarian, zonele de țesut care par suspecte sunt investigate fie cu mai multe imagistici, posibil folosind un alt tip de imagistică sau după o întârziere, fie cu biopsii ale zonelor suspecte.
Medicament
Pilulele contraceptive sunt asociate cu un risc substanțial mai scăzut de cancer ovarian la femeile cu mutații BRCA . O meta-analiză din 2013 a constatat că utilizarea contraceptivelor orale a fost asociată cu o reducere de 42% a riscului relativ de cancer ovarian, asocierea a fost similară pentru mutațiile BRCA1 și BRCA2. Utilizarea contraceptivelor orale nu a fost asociată în mod semnificativ cu riscul de cancer mamar, deși s-a observat o creștere mică a riscului care nu a atins semnificația statistică . O meta-analiză din 2011 a constatat că utilizarea OC a fost asociată cu o reducere relativă de 43% a riscului de cancer ovarian la femeile cu mutații BRCA , în timp ce datele privind riscul de cancer mamar la purtătorii de mutații BRCA cu utilizare a contraceptivelor orale au fost eterogene și rezultatele au fost inconsistente. .
S-a constatat că modulatorii selectivi ai receptorilor de estrogen , în special tamoxifenul , reduc riscul de cancer mamar la femeile cu mutații BRCA cărora nu le este îndepărtat sânul. Este eficient ca pentru prevenirea primară (prevenirea primului caz de cancer de sân) la femeile cu mutații BRCA2 , dar nu și mutații BRCA1 , și pentru prevenirea secundară (prevenirea unui al doilea cancer de sân independent) la ambele grupuri de femei. Administrarea de tamoxifen timp de cinci ani sa dovedit a reduce la jumătate riscul de cancer mamar la femeile care prezintă un risc ridicat de cancer mamar din orice motiv, dar potențial efecte adverse grave, cum ar fi cataracta , cheaguri de sânge și cancer endometrial , împreună cu probleme de calitate a vieții, cum ar fi bufeurile, duc la întreruperea utilizării de către unele femei și la unii medici, limitându-se utilizarea la femeile cu creșteri atipice la nivelul sânilor. Tamoxifenul este contraindicat femeilor care sunt cel mai probabil afectate de complicațiile frecvente. Raloxifenul (Evista), care prezintă un risc redus de efecte secundare, este utilizat ca alternativă, dar nu a fost studiat în mod specific în purtătorii de mutații BRCA . Utilizarea tamoxifenului poate fi combinată cu ooforectomia pentru o reducere și mai mare a riscului de cancer mamar, în special la femeile cu mutații BRCA2 .
Inhibitorii aromatazei sunt medicamente care previn producerea de estrogen în glandele suprarenale și țesutul adipos . Au mai puține efecte secundare decât modulatorii selectivi ai receptorilor de estrogen, cum ar fi tamoxifenul, dar nu funcționează la femeile aflate în premenopauză, deoarece nu împiedică ovarele să producă estrogen.
Interventie chirurgicala
Se știe că mai multe tipuri de intervenții chirurgicale preventive reduc substanțial riscul de cancer la femeile cu mutații BRCA cu risc ridicat . Intervențiile chirurgicale pot fi utilizate singure, în combinație între ele sau în combinație cu intervenții non-chirurgicale pentru a reduce riscul de cancer de sân și ovarian. Rețineți că operațiile precum mastectomia și oforectomia nu elimină complet șansa de cancer mamar; se pare că au apărut cazuri în ciuda acestor proceduri.
- Ligatura trompelor este cea mai puțin invazivă dintre aceste intervenții chirurgicale și pare să reducă riscul de cancer ovarian pentru purtătorii BRCA1 cu peste 60%. Salpingectomia este o altă opțiune mai invazivă decât ligatura trompelor și poate duce la reducerea suplimentară a riscului. Ambele pot fi efectuate oricând după finalizarea fertilității. Spre deosebire de alte intervenții chirurgicale profilactice, aceste două intervenții chirurgicale nu reduc riscul de cancer mamar.
- Mastectomia profilactică (preventivă) este asociată cu riscuri mici și o scădere mare a riscului de cancer mamar.
- Salpingo-ooforectomia profilactică (îndepărtarea ovarelor și a trompelor uterine) are ca rezultat o reducere foarte mare a riscului de cancer ovarian și o reducere mare a riscului de cancer mamar dacă se efectuează înainte de menopauză naturală. Cu toate acestea, vine și cu riscul de efecte adverse substanțiale dacă este efectuat la o vârstă fragedă.
- Histerectomia nu are efect direct asupra cancerelor legate de BRCA , dar le permite femeilor să utilizeze unele medicamente care reduc riscul de cancer de sân (cum ar fi tamoxifenul ) cu riscul de cancer uterin și să utilizeze mai puțini hormoni pentru a gestiona efectele adverse ale unei ooforectomii profilactice .
Dacă și când să efectuați operațiile preventive este o decizie personală complexă. Cunoștințele medicale actuale oferă câteva îndrumări despre riscuri și beneficii. Chiar și purtătorii aceleiași mutații sau din aceeași familie pot avea riscuri substanțial diferite pentru tipul și severitatea cancerului pe care sunt susceptibili să-l primească, precum și vârsta la care le pot suferi. Oamenii diferiți au, de asemenea, valori diferite. Aceștia pot alege să se concentreze pe prevenirea totală a cancerului, beneficiile psihologice, calitatea actuală a vieții sau supraviețuirea generală. Impactul posibil al viitoarelor evoluții medicale în tratament sau prognostic poate fi, de asemenea, de o oarecare importanță pentru femeile foarte tinere și pentru planificarea familială. Decizia este individualizată și se bazează de obicei pe mai mulți factori, cum ar fi apariția timpurie a cancerului asociat BRCA la rudele apropiate.
Efectul protector al chirurgiei profilactice este mai mare atunci când se face la vârste fragede; cu toate acestea, oforectomia are și efecte adverse care sunt cele mai mari atunci când se face cu mult înainte de menopauză naturală. Din acest motiv, oforectomia este recomandată mai ales după vârsta de 35 sau 40 de ani, presupunând că fertilitatea este completă. Riscul de cancer ovarian este scăzut înainte de această vârstă, iar efectele negative ale oforectomiei sunt mai puțin grave, deoarece femeia se apropie de menopauză naturală.
- Pentru purtătorii de mutații cu risc crescut BRCA1 , ooforectomia profilactică în jurul vârstei de 40 de ani reduce riscul de cancer ovarian și de sân și oferă un avantaj substanțial de supraviețuire pe termen lung. A avea această intervenție chirurgicală la o vârstă fragedă oferă puțin sau deloc un avantaj suplimentar de supraviețuire, dar crește efectele adverse ale intervenției chirurgicale. Comparativ cu nicio intervenție, efectuarea acestei intervenții chirurgicale în jurul vârstei de 40 de ani crește șansa femeii de a atinge vârsta de 70 de ani cu cincisprezece puncte procentuale, de la 59% la 74%. Adăugarea mastectomiei profilactice crește supraviețuirea așteptată cu încă câteva puncte procentuale.
- Pentru purtătorii de mutații BRCA2 cu risc crescut , oforectomia în jurul vârstei de 40 de ani are un efect mai mic. Operația crește șansa femeii de a atinge vârsta de 70 de ani cu doar cinci puncte procentuale, de la 75% la 80%. Atunci când se face doar mastectomie preventivă la vârsta de 40 de ani, îmbunătățirea este similară, șansa așteptată crescând de la 75% la 79%. Efectuarea ambelor intervenții chirurgicale împreună în jurul vârstei de 40 de ani este de așteptat să îmbunătățească șansele femeii de a atinge vârsta de 70 de la 75% la 82%
Pentru comparație, femeile din populația generală au șanse de 84% să trăiască până la vârsta de 70 de ani.
Cercetările au analizat efectele intervențiilor chirurgicale de reducere a riscului asupra bunăstării psihologice și sociale a femeilor cu mutație BRCA. Datorită dovezilor limitate, o meta-analiză din 2019 nu a reușit să tragă concluzii dacă intervențiile pot ajuta cu efectele psihologice ale intervenției chirurgicale la purtătorii BRCA de sex feminin. Sunt necesare mai multe cercetări pentru a concluziona cum să sprijine cel mai bine femeile care aleg o intervenție chirurgicală.
Mastectomia
La o femeie care nu a dezvoltat cancer de sân, îndepărtarea sânilor poate reduce riscul de a fi diagnosticată vreodată cu cancer de sân cu 90%, la un nivel care este aproximativ jumătate din riscul mediu al femeii.
Mastectomia bilaterală este îndepărtarea ambilor sâni de către un chirurg mamar . Mastectomia radicală modificată este utilizată numai la femei diagnosticate cu cancer de san invaziv. Tehnicile pentru mastectomii profilactice includ:
- Mastectomia simplă , recomandată femeilor care nu au reconstrucție mamară, lasă cea mai mică cantitate de țesut mamar din corp și, prin urmare, realizează cea mai mare reducere a riscului. Pe lângă utilizarea profilactică, este utilizat și de femeile cărora le-a fost diagnosticat cu stadii anterioare ale cancerului.
- Mastectomia care economisește pielea îndepărtează țesutul sânului, mamelonului și areolei, dar lasă pielea „în exces” la locul său pentru reconstrucție. Are țesut cicatricial mai puțin vizibil decât o simplă mastectomie.
- Mastectomia care economisește mamelonul îndepărtează țesutul mamar, dar lasă mamelonul și areola intacte pentru un aspect mai natural.
- Mastectomia subcutanată elimină țesutul mamar, dar lasă mamelonul și areola intacte. Cicatricile sunt ascunse în pliul inframamar de sub sân.
- Mastectomia care economisește areola îndepărtează țesutul mamar și mamelonul, dar nu areola.
- Mastectomia care economisește nervii este un efort de a menține nervii care oferă senzație pielii peste sâni. Sânii care au suferit oricare dintre aceste intervenții chirurgicale au mult mai puțină senzație tactilă decât sânii naturali. Tehnicile de economisire a nervilor sunt un efort de a păstra o senzație la nivelul sânilor, cu succes limitat și adesea doar parțial.
Ce tehnică este utilizată este determinată de existența oricărui cancer și de starea generală de sănătate, precum și de dorința femeii, dacă există, pentru o intervenție chirurgicală de reconstrucție a sânilor în scopuri estetice. Femeile care aleg un aspect cu piept plat sau folosesc proteze mamare externe aleg de obicei mastectomia simplă, cu o reducere mai mare a riscului.
Reconstrucția sânilor este de obicei realizată de un chirurg plastic și poate fi inițiată ca parte a aceleiași intervenții chirurgicale de mai multe ore care îndepărtează sânii. Au fost utilizate mai multe tehnici de reconstrucție, cu diferite locații și cantități de cicatrici. Unele tehnici folosesc țesuturi din altă parte a corpului, cum ar fi țesutul adipos din abdomenul inferior sau ocazional mușchii din alte părți ale trunchiului. Alții folosesc implanturi mamare , posibil precedate de expansori tisulari, pentru a oferi volum. Unele tehnici de reconstrucție necesită intervenții chirurgicale multiple. Ulterior, unor femei li s-au adăugat tatuaje pentru a simula areolele mamare sau au pielea remodelată pentru a forma un mamelon.
Salpingo-ooforectomia
Ooforectomia (îndepărtarea chirurgicală a ovarelor) și salpingectomia (îndepărtarea chirurgicală a trompelor uterine) sunt foarte recomandate femeilor cu mutații BRCA . Salpingo-ooforectomia este cea mai eficientă metodă de prevenire a cancerului ovarian și a trompei Fallopian la femeile cu mutație BRCA . Cu toate acestea, rămâne un risc mic de cancer peritoneal primar , cel puțin la femeile cu mutații BRCA1 , deoarece mucoasa peritoneală este același tip de celule ca și părțile ovarului. Se estimează că acest risc va produce aproximativ cinci cazuri de cancer peritoneal la 100 de femei cu mutații BRCA1 dăunătoare în cei 20 de ani după operație.
Cancerul ovarian legat de BRCA2 tinde să se prezinte la femeile perimenopauzale sau la menopauză, astfel încât salpingo-ooforectomia este recomandată între 45 și 50 de ani. Dacă se face înainte de menopauză, atunci și femeile beneficiază de un risc redus de cancer de sân.
Operația se face adesea în asociere cu o histerectomie (îndepărtarea chirurgicală a uterului) și, uneori, o cervicectomie (îndepărtarea chirurgicală a colului uterin ), în special la femeile care doresc să ia tamoxifen , despre care se știe că provoacă cancer uterin sau care au uter. fibroame . Sunt disponibile mai multe stiluri de intervenție chirurgicală, inclusiv chirurgia laparoscopică (gaură de cheie). Deoarece aproximativ 5% dintre femeile cu o mutație BRCA au cancer ovarian nedetectat la momentul intervenției chirurgicale planificate, intervenția chirurgicală ar trebui tratată ca și cum ar fi o eliminare a unui cancer cunoscut.
Salpingo-ooforectomia o face pe femeie sterilă (incapabilă să aibă copii). Serviciile de infertilitate pot fi folosite pentru conservarea ouălor , dacă se dorește. Cu toate acestea, întrucât beneficiile intervenției chirurgicale sunt mai mari în apropierea menopauzei, majoritatea femeilor amână pur și simplu operația până când au născut deja cât de mulți copii doresc.
Operația induce, de asemenea, în mod artificial menopauză, care provoacă bufeuri , tulburări de somn, schimbări ale dispoziției, uscăciune vaginală, dificultăți sexuale, dificultăți de rechemare a cuvântului și alte semne și simptome medicale . Efectele secundare variază de la ușoare la severe; majoritatea pot fi tratate cel puțin parțial. Multe femei cu BRCA iau terapie de substituție hormonală pentru a reduce aceste efecte: combinații estrogen-progesteron pentru femeile care au uter și estrogen neopozant pentru femeile cărora uterul a fost îndepărtat. Estrogenul poate provoca cancer de sân, dar întrucât cantitatea de estrogen luată este mai mică decât cantitatea produsă de ovarele acum îndepărtate, riscul net este de obicei considerat acceptabil.
Unele surse presupun că ooforectomia înainte de vârsta de 50 de ani dublează riscul de boli cardiovasculare și crește riscul de fracturi de șold cauzate de osteoporoză la populația relevantă.
Alegeri non-medicale
Având în vedere riscurile ridicate și beneficiile reduse ale alegerilor privind stilul de viață la purtătorii de mutații BRCA , nicio alegere privind stilul de viață nu oferă o protecție suficientă.
Având primul copil la o vârstă mai mică, având mai mulți copii decât media și alăptând mai mult de un an, scade riscul de cancer mamar pentru o femeie cu risc mediu. Studiile despre acest efect în rândul purtătorilor de mutații BRCA au produs rezultate contradictorii, dar, în general, a avea copii se consideră că oferă puțină sau deloc protecție împotriva cancerului de sân la femeile cu mutații BRCA1 și crește paradoxal riscul de cancer de sân la femeile cu mutații BRCA2 .
Fiind activ fizic și menținând o greutate corporală sănătoasă previne cancerul de sân și alte tipuri de cancer în populația generală, precum și prevenirea bolilor de inimă și a altor afecțiuni medicale. Dintre femeile cu mutație BRCA , a fi active fizic și a avea o greutate corporală sănătoasă în adolescență nu are niciun efect asupra cancerului ovarian și întârzie, dar nu previne în totalitate, cancerul de sân după menopauză. În unele studii, doar exercițiile fizice semnificative și obositoare au produs vreun beneficiu. Obezitatea și creșterea în greutate ca adult sunt asociate cu diagnosticele de cancer mamar.
Studiile asupra anumitor alimente, diete sau suplimente alimentare au produs în general informații contradictorii sau, în cazul grăsimilor alimentare , consumului de soia și consumului de ceai verde , au fost efectuate doar la femeile cu risc mediu. Singura intervenție dietetică care este în general acceptată ca prevenire a cancerului de sân la purtătorii de mutații BRCA este minimizarea consumului de băuturi alcoolice . Consumul mai multor băuturi alcoolice pe zi este puternic asociat cu un risc mai mare de a dezvolta cancer de sân, iar purtătorii sunt de obicei încurajați să consume nu mai mult de o băutură alcoolică pe zi și nu mai mult de patru în total într-o săptămână.
Într-un studiu realizat cu evreie Ashkenazi, s-a observat că purtătorii de mutație născuți înainte de 1940 au un risc mult mai mic de a fi diagnosticați cu cancer de sân până la vârsta de 50 de ani decât cei născuți după 1940; acest lucru a fost observat și la populația fără transportatori. Nu se cunosc motivele diferenței. Spre deosebire de populația generală, vârsta la menarhă și vârsta la menopauză nu are niciun efect asupra riscului de cancer mamar pentru purtătorii de mutații BRCA .
Avantaj evolutiv
Mai multe ipoteze propun că mutațiile BRCA ar putea avea avantaje evolutive, cum ar fi inteligența superioară. Ipoteza inteligenței Ashkenazi a fost propusă de Gregory Cochran și afirmă că un defect al genei BRCA1 ar putea dezlănțui creșterea neuronală.
Studiile au arătat că mutațiile BRCA1 nu sunt aleatorii, ci sub selecție adaptativă, indicând faptul că, deși mutațiile BRCA1 sunt legate de cancerul de sân, mutațiile au probabil un efect benefic și.
Brevete
O cerere de brevet pentru gena izolată BRCA1 și mutațiile care promovează cancerul cancerului discutate mai sus, precum și metodele de diagnosticare a probabilității de apariție a cancerului de sân, a fost depusă de Universitatea din Utah, Institutul Național de Științe ale Sănătății Mediului (NIEHS) și Myriad Genetics în 1994; în anul următor, Myriad, în colaborare cu anchetatorii de la Endo Recherche, Inc., HSC Research & Development Limited Partnership și Universitatea din Pennsylvania, a izolat și secvențiat gena BRCA2 și a identificat mutații cheie, iar primul brevet BRCA2 a fost depus în SUA de către Myriad și alte instituții în 1995. Myriad este titularul exclusiv al acestor brevete și le-a pus în aplicare în SUA împotriva laboratoarelor de diagnostic clinic. Acest model de afaceri a dus la creșterea Myriad ca o startup în 1994, devenind o companie cotată la bursă, cu 1200 de angajați și venituri anuale de aproximativ 500 milioane USD în 2012; a dus, de asemenea, la controverse privind prețurile ridicate și incapacitatea de a obține opiniile secundare de la alte laboratoare de diagnosticare, care, la rândul lor, au dus la procesul de referință al Asociației pentru Patologie Moleculară v. Myriad Genetics . Brevetele încep să expire în 2014.
Potrivit unui articol publicat în revista, Medicină genetică, în 2010, „Povestea brevetelor în afara Statelor Unite este mai complicată .... De exemplu, brevetele au fost obținute, dar brevetele sunt ignorate de sistemele de sănătate provinciale din Canada. În Australia și Marea Britanie, deținătorul licenței Myriad a permis utilizarea de către sistemele de sănătate, dar a anunțat o schimbare de planuri în august 2008. ... O singură mutație a fost brevetată în singurul brevet Myriad la nivel european, deși unele brevete rămân în curs de examinare a unui procedură de opoziție. De fapt, Statele Unite sunt singura jurisdicție în care poziția puternică a brevetului Myriad a conferit statutul de furnizor unic. " Peter Meldrum, CEO al Myriad Genetics, a recunoscut că Myriad are „alte avantaje competitive care pot face inutilă o astfel de aplicare [a brevetelor] în Europa”.
Deciziile legale referitoare la brevetele BRCA1 și BRCA2 vor afecta în general testarea genetică. În iunie 2013, în Association for Molecular Pathology v. Myriad Genetics (Nr. 12-398), Curtea Supremă a SUA a decis în unanimitate că „Un segment de ADN natural este un produs al naturii și nu este eligibil pentru brevet doar pentru că a fost izolat , „invalidând brevetele Myriad asupra genelor BRCA1 și BRCA2. Cu toate acestea, Curtea a susținut, de asemenea, că manipularea unei gene pentru a crea ceva care nu se găsește în natură ar putea fi în continuare eligibilă pentru protecția brevetului.
Vezi si
Referințe
linkuri externe
- BOADICEA , un instrument de estimare a riscului pentru cancerul de sân și ovarian familial
- BRCA1 și BRCA2 la Lab Tests Online
- BRCA Exchange , bază de date mare de variante BRCA1 și BRCA2 cu clasificări de patogenitate.
