Cancer ovarian - Ovarian cancer
| Cancer ovarian | |
|---|---|
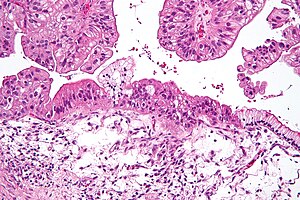 | |
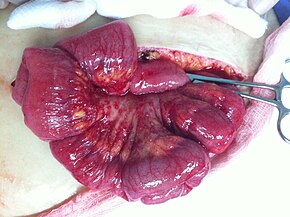
| Micrografia unui carcinom ovarian mucinos colorat de H&E . | |
| Specialitate | Oncologie , ginecologie |
| Simptome |
Mai devreme : vag Mai târziu : balonare, dureri pelvine , constipație , umflături abdominale, pierderea poftei de mâncare |
| Debut obișnuit | Vârsta obișnuită a diagnosticului 63 de ani |
| Tipuri | Carcinom ovarian, tumora cu celule germinale , sexul tumorii stromale din cordonul ombilical |
| Factori de risc | Niciodată să nu aveți copii , terapie hormonală după menopauză , medicamente pentru fertilitate , obezitate , genetică |
| Metoda de diagnosticare | Biopsie tisulară |
| Tratament | Chirurgie, radioterapie , chimioterapie |
| Prognoză | Rata de supraviețuire pe cinci ani c. 49% (SUA) |
| Frecvență | 1,2 milioane (2015) |
| Decese | 161.100 (2015) |
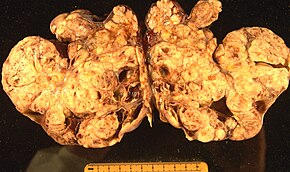
Cancerul ovarian este un cancer care se formează în sau pe un ovar . Rezultă în celule anormale care au capacitatea de a invada sau de a se răspândi în alte părți ale corpului. Când începe acest proces, este posibil să nu existe sau doar simptome vagi. Simptomele devin mai vizibile pe măsură ce cancerul progresează. Aceste simptome pot include balonare, dureri pelvine , umflături abdominale , constipație și pierderea poftei de mâncare , printre altele. Zonele comune în care se poate răspândi cancerul includ mucoasa abdomenului , a ganglionilor limfatici , a plămânilor și a ficatului .
Riscul de cancer ovarian crește la femeile care au ovulat mai mult de-a lungul vieții. Aceasta include cei care nu au avut niciodată copii , cei care încep ovulația la o vârstă mai mică și cei care ajung la menopauză la o vârstă mai înaintată. Alți factori de risc includ terapia hormonală după menopauză , medicamente pentru fertilitate și obezitate . Factorii care scad riscul includ controlul nașterii hormonale , ligaturile trompelor și alăptarea . Aproximativ 10% din cazuri sunt legate de riscul genetic moștenit; femeile cu mutații ale genelor BRCA1 sau BRCA2 au aproximativ 50% șanse de a dezvolta boala. Carcinomul ovarian este cel mai frecvent tip de cancer ovarian, cuprinzând peste 95% din cazuri. Există cinci subtipuri principale de carcinom ovarian, dintre care carcinomul seros de înaltă calitate (HGSC) este cel mai frecvent. Se crede că aceste tumori ovariene încep în celulele care acoperă ovarele, deși unele se pot forma la trompele uterine . Tipurile mai puțin frecvente de cancer ovarian includ tumorile cu celule germinale și tumorile stromale ale cordonului sexual . Diagnosticul de cancer ovarian este confirmat printr-o biopsie de țesut, de obicei îndepărtată în timpul intervenției chirurgicale.
Screeningul nu este recomandat la femeile cu risc mediu, deoarece dovezile nu susțin o reducere a decesului și rata ridicată a testelor fals pozitive poate duce la intervenții chirurgicale inutile, care este însoțită de propriile riscuri. Cei cu risc foarte mare pot avea ovarele îndepărtate ca măsură preventivă. Dacă este prins și tratat într-un stadiu incipient, cancerul ovarian este adesea vindecabil. Tratamentul include de obicei o combinație de intervenții chirurgicale, radioterapie și chimioterapie . Rezultatele depind de amploarea bolii, de subtipul de cancer prezent și de alte afecțiuni medicale. Rata globală de supraviețuire pe cinci ani în Statele Unite este de 49%. Rezultatele sunt mai grave în lumea în curs de dezvoltare.
În 2012, au apărut cazuri noi la aproximativ 239.000 de femei. În 2015 a fost prezent la 1,2 milioane de femei și a dus la 161.100 de decese în întreaga lume. Printre femei este cel de-al șaptelea cel mai frecvent cancer și a opta cea mai frecventă cauză de deces cauzată de cancer. Vârsta tipică a diagnosticului este de 63 de ani. Decesul cauzat de cancerul ovarian este mai frecvent în America de Nord și Europa decât în Africa și Asia.
semne si simptome
Simptome timpurii
Semnele și simptomele timpurii ale cancerului ovarian pot fi absente sau subtile. În majoritatea cazurilor, simptomele există timp de câteva luni înainte de a fi recunoscute și diagnosticate . Simptomele pot fi diagnosticate greșit ca sindrom de colon iritabil . Etapele incipiente ale cancerului ovarian tind să fie nedureroase. Simptomele pot varia în funcție de subtip. Tumorile limită ovariene , cunoscute și sub denumirea de tumori ovariene cu potențial malign scăzut (LMP), nu determină o creștere a nivelului de CA125 și nu sunt identificabile cu o ecografie. Simptomele tipice ale unei tumori LMP pot include distensie abdominală sau dureri pelvine. Masele deosebit de mari tind să fie benigne sau limită.
Cele mai tipice simptome ale cancerului ovarian includ balonare , dureri abdominale sau pelvine sau disconfort, dureri de spate, menstruație neregulată sau sângerări vaginale postmenopauzale, dureri sau sângerări după sau în timpul actului sexual , pierderea poftei de mâncare , oboseală , diaree , indigestie , arsuri la stomac , constipație , greață , senzație de plin și posibil simptome urinare (inclusiv urinare frecventă și urinare urgentă ).
Simptome ulterioare
Masa în creștere poate provoca durere dacă se dezvoltă torsiunea ovariană . Simptomele pot fi cauzate de apăsarea în masă a celorlalte organe abdominopelvice sau de metastaze. Dacă aceste simptome încep să apară mai des sau mai sever decât de obicei, mai ales după ce nu există antecedente semnificative de astfel de simptome, se ia în considerare cancerul ovarian. Metastazele pot provoca un nodul al surorii Mary Joseph . Rareori, teratoamele pot provoca sindromul teratoamei în creștere sau gliomatoza peritoneală . Unii se confruntă cu menometroragie și sângerări vaginale anormale după menopauză în majoritatea cazurilor. Alte simptome comune includ hirsutismul , durerea abdominală, virilizarea și o masă anexă .
Copii
La adolescenți sau copii cu tumori ovariene, simptomele pot include dureri abdominale severe, iritații ale peritoneului sau sângerări . Simptomele tumorilor cordonului stromal sexual produc hormoni care pot afecta dezvoltarea caracteristicilor sexuale secundare . Tumorile sexuale-stromale la copiii prepubertali se pot manifesta prin pubertate timpurie ; durerile abdominale și distensia sunt, de asemenea, frecvente. Adolescenții cu tumori ale cordonului sexual stromal pot prezenta amenoree . Pe măsură ce cancerul devine mai avansat, poate provoca o acumulare de lichid în abdomen. Dacă malignitatea nu a fost diagnosticată până când provoacă ascită, aceasta este de obicei diagnosticată la scurt timp după aceea. Cancerele avansate pot provoca, de asemenea, mase abdominale, mase de ganglioni limfatici sau revărsat pleural .
Factori de risc
Cancerul ovarian este legat de timpul petrecut în ovulație. Astfel, faptul de a nu avea copii este un factor de risc pentru cancerul ovarian, probabil deoarece ovulația este suprimată prin sarcină. În timpul ovulației, celulele sunt stimulate constant să se împartă în timp ce ciclurile ovulatorii continuă. Prin urmare, persoanele care nu au născut copii prezintă un risc de două ori mai mare decât cel al cancerului ovarian. O perioadă mai lungă de ovulație cauzată de prima menstruație timpurie și de menopauză târzie este, de asemenea, un factor de risc. Atât obezitatea, cât și terapia de substituție hormonală cresc, de asemenea, riscul.
Riscul de a dezvolta cancer ovarian este mai mic pentru femeile care au mai puține cicluri menstruale, nu au cicluri menstruale, alăptează , iau contraceptive orale, au sarcini multiple și au o sarcină la o vârstă fragedă. Riscul de a dezvolta cancer ovarian este redus la femeile care au avut ligatură tubară (cunoscută în mod colocvial ca având „tuburile legate”), ambele ovare îndepărtate sau histerectomia (o operație în care uterul și, uneori, colul uterin sunt îndepărtate). Vârsta este, de asemenea, un factor de risc.
Hormoni
Utilizarea medicamentelor pentru fertilitate poate contribui la formarea tumorilor la limita ovariană , dar legătura dintre cele două este contestată și este dificil de studiat. Medicamentele pentru fertilitate pot fi asociate cu un risc mai mare de apariție a tumorilor limită. Cei care au fost tratați pentru infertilitate, dar rămân nulipari, prezintă un risc mai mare de cancer ovarian epitelial; cu toate acestea, cei care sunt tratați cu succes pentru infertilitate și ulterior dau naștere nu prezintă un risc mai mare. Acest lucru se poate datora scurgerii de celule precanceroase în timpul sarcinii, dar cauza rămâne neclară. În schimb, factorul de risc poate fi infertilitatea în sine, nu tratamentul.
Condițiile hormonale, cum ar fi sindromul ovarului polichistic și endometrioza, sunt asociate cu cancerul ovarian, dar legătura nu este complet confirmată. Terapia de substituție hormonală postmenopauză (TRS) cu estrogen crește probabil riscul de cancer ovarian. Asocierea nu a fost confirmată într-un studiu la scară largă, dar studii notabile, inclusiv Studiul Milioane de Femei, au susținut această legătură. HRT postmenopauză cu estrogen și progesteron combinat poate crește riscul contemporan dacă este utilizat timp de peste 5 ani, dar acest risc revine la normal după încetarea tratamentului. HRT estrogen cu sau fără progestative crește riscul apariției tumorilor endometrioide și seroase, dar scade riscul apariției tumorilor mucinoase. Dozele mai mari de estrogen cresc acest risc. Endometrioza este un alt factor de risc pentru cancerul ovarian, la fel ca durerea la menstruație. Endometrioza este asociată cu subtipuri de celule limpezi și endometrioide, tumori seroase de grad scăzut, tumori de stadiul I și II, tumori de gradul 1 și mortalitate mai mică.
Înainte de menopauză, obezitatea poate crește riscul de cancer ovarian al unei persoane, dar acest risc nu este prezent după menopauză. Acest risc este relevant și la cei care sunt amândoi obezi și nu au folosit niciodată THS. O asociere similară cu cancerul ovarian apare la persoanele mai înalte.
Genetica
Un istoric familial de cancer ovarian este un factor de risc pentru cancerul ovarian. Persoanele cu cancer de colon ereditar nepolipozic (sindromul Lynch) și cele cu anomalii genetice BRCA-1 și BRCA-2 prezintă un risc crescut.
Factorul major de risc genetic pentru cancerul ovarian este o mutație a genelor BRCA1 sau BRCA2 sau a genelor de reparare a nepotrivirii ADN-ului , care este prezentă în 10% din cazurile de cancer ovarian. O singură alelă trebuie mutată pentru a pune o persoană la risc ridicat. Gena poate fi moștenită fie prin linia maternă, fie paternă, dar are penetranță variabilă . Deși mutațiile acestor gene sunt de obicei asociate cu un risc crescut de cancer de sân, ele prezintă, de asemenea, un risc substanțial pe tot parcursul vieții de cancer ovarian, un risc care atinge vârfurile în anii 40 și 50 de ani. Cel mai mic risc citat este de 30% și cel mai mare 60%. Mutațiile din BRCA1 prezintă un risc pe tot parcursul vieții de a dezvolta cancer ovarian de 15–45%. Mutațiile din BRCA2 sunt mai puțin riscante decât cele cu BRCA1 , cu un risc pe viață de 10% (cel mai mic risc citat) până la 40% (cel mai mare risc citat). În medie, cancerele asociate BRCA se dezvoltă cu 15 ani înainte de omologii lor sporadici, deoarece persoanele care moștenesc mutațiile pe o copie a genei lor au nevoie doar de o mutație pentru a începe procesul de carcinogeneză, în timp ce persoanele cu două gene normale ar trebui să dobândească două mutații.
În Statele Unite, cinci din 100 de femei cu o rudă de gradul I cu cancer ovarian vor suferi în cele din urmă de cancer ovarian ele însele, plasându-le pe cele cu membri ai familiei afectate la triplul risc al femeilor cu membri ai familiei neafectați. Șapte din 100 de femei cu două sau mai multe rude cu cancer ovarian vor suferi în cele din urmă cancer ovarian. În general, 5-10% din cazurile de cancer ovarian au o cauză genetică. Mutațiile BRCA sunt asociate cu cancer ovarian epitelial seros nonmucinos de înaltă calitate.
Un istoric familial puternic de cancer endometrial , cancer de colon sau alte tipuri de cancer gastro-intestinal poate indica prezența unui sindrom cunoscut sub numele de cancer colorectal ereditar nepolipozic (cunoscut și sub numele de sindrom Lynch), care conferă un risc mai mare de a dezvolta mai multe tipuri de cancer, inclusiv ovarianul. cancer. Sindromul Lynch este cauzat de mutații ale genelor de reparare a nepotrivirii, inclusiv MSH2 , MLH1 , MLH6 , PMS1 și PMS2 . Riscul de cancer ovarian pentru o persoană cu sindrom Lynch este între 10 și 12%. Oamenii de origine islandeză , descendență evreiască europeană / descendență evreiască Ashkenazi și descendență maghiară prezintă un risc mai mare de cancer ovarian epitelial. Gena receptorului de estrogen beta ( ESR2 ) pare a fi o cheie a patogenezei și a răspunsului la terapie. Alte gene care au fost asociate cu cancerul ovarian sunt BRIP1 , MSH6 , RAD51C și RAD51D . CDH1 , CHEK2 , PALB2 și RAD50 au fost, de asemenea, asociate cu cancerul ovarian.
Câteva tulburări genetice rare sunt asociate cu subtipuri specifice de cancer ovarian. Sindromul Peutz – Jeghers , o afecțiune genetică rară, predispune, de asemenea, oamenii la tumoarea cordonului sexual cu tubuli inelari . Boala Ollier și sindromul Maffucci sunt asociate cu tumorile cu celule granuloase la copii și pot fi asociate și cu tumorile Sertoli-Leydig. Fibromele benigne sunt asociate cu sindromul de carcinom bazocelular nevoid .
Factori de mediu
Națiunile industrializate, cu excepția Japoniei, au rate ridicate de cancer ovarian epitelial, care se poate datora dietei în aceste țări. Caucazienii prezintă un risc cu 30-40% mai mare de cancer ovarian în comparație cu persoanele de culoare și hispanici , probabil din cauza factorilor socioeconomici; femeile albe tind să aibă mai puțini copii și rate diferite de intervenții chirurgicale ginecologice care afectează riscul de cancer ovarian.
Studiile de cohortă au găsit o corelație între consumul de lactate și cancerul ovarian, dar studiile caz-control nu arată această corelație. Există dovezi mixte cu privire la efectul cărnii roșii și a cărnii procesate în cancerul ovarian.
Dovezi provizorii sugerează că talcul , pesticidele și erbicidele cresc riscul de cancer ovarian. Societatea Americană pentru Cancer remarcă faptul că, până în prezent, niciun studiu nu a reușit să asocieze cu exactitate vreo substanță chimică din mediul înconjurător sau din dieta umană, direct de mutațiile care cauzează cancer ovarian.
Alte
Consumul de alcool nu pare a fi legat de cancerul ovarian. Alți factori care au fost investigați, cum ar fi fumatul , nivelurile scăzute de vitamina D în sânge, prezența chisturilor ovariene de incluziune și infecția cu virusul papilomului uman (cauza unor cazuri de cancer de col uterin ), au fost respinse ca factori de risc pentru cancer ovarian. Carcinogenitatea talcului perineal este controversată, deoarece poate acționa ca un iritant dacă se deplasează prin tractul reproductiv către ovare. Studiile caz-control au arătat că utilizarea talcului perineal crește riscul de cancer ovarian, dar utilizarea talcului mai des nu creează un risc mai mare. Utilizarea talcului în altă parte a corpului nu are legătură cu cancerul ovarian. Așezarea regulată pe perioade prelungite este asociată cu o mortalitate mai mare din cauza cancerului ovarian epitelial. Riscul nu este negat prin exerciții fizice regulate, deși este redus.
Vârsta crescută (până în anii 70) este un factor de risc pentru cancerul ovarian epitelial, deoarece se pot acumula mai multe mutații în celule și, în cele din urmă, pot provoca cancer. Cei peste 80 de ani prezintă un risc ușor mai mic.
Fumatul de tutun este asociat cu un risc mai mare de cancer ovarian mucinos ; după renunțarea la fumat , riscul revine în cele din urmă la normal. O dietă bogată în grăsimi animale poate fi asociată cu cancerul ovarian, dar legătura este neclară. Dieta pare să joace un rol foarte mic, dacă este cazul, în riscul de cancer ovarian. Niveluri mai ridicate de proteine C-reactive sunt asociate cu un risc mai mare de a dezvolta cancer ovarian.
Factori de protecție
Suprimarea ovulației, care altfel ar provoca daune epiteliului ovarian și, în consecință, inflamației , este în general de protecție. Acest efect poate fi obținut prin a avea copii , a lua contraceptive orale combinate și a alăpta , care sunt factori de protecție. O perioadă mai lungă de alăptare se corelează cu o scădere mai mare a riscului de cancer ovarian. Fiecare naștere scade mai mult riscul de cancer ovarian și acest efect se observă cu până la cinci nașteri. Contraceptivele orale combinate reduc riscul de cancer ovarian cu până la 50%, iar efectul protector al contraceptivelor orale combinate poate dura 25-30 de ani după întreruperea lor. Utilizarea regulată a aspirinei sau a acetaminofenului (paracetamol) poate fi asociată cu un risc mai mic de cancer ovarian; alte AINS nu par să aibă un efect protector similar.
Ligatura trompelor este protectoare, deoarece agenții cancerigeni nu pot ajunge în ovar și fimbrii prin vagin, uter și trompele uterine. Ligatura trompelor este de asemenea protectoare la femeile cu mutație BRCA1, dar nu și mutația BRCA2. Histerectomia reduce riscul, iar îndepărtarea atât a trompelor uterine cât și a ovarelor ( salpingo-ooforectomie bilaterală ) reduce dramatic riscul de a nu numai cancer ovarian, ci și cancer de sân. Acesta este încă un subiect de cercetare, deoarece legătura dintre histerectomie și riscul scăzut al cancerului ovarian este controversată. Motivele pentru care histerectomia poate fi protectoare nu au fost elucidate începând cu 2015.
O dietă care include cantități mari de caroten , fibre și vitamine cu cantități mici de grăsimi - în mod specific, o dietă cu legume fără amidon (de exemplu, broccoli și ceapă ) - poate fi protectoare, deși cercetările sunt încă în curs în acest domeniu. Consumul mai mare de cofeină și consumul a mai mult de două căni de ceai pe zi au fost asociate cu un risc mai mic de cancer ovarian. Fumatul de tutun este protector pentru tumorile sexuale-stromale.
Fiziopatologie
| Gene mutate | Tipul mutației | Subtip | Prevalență |
|---|---|---|---|
| AKT1 | amplificare | 3% | |
| AKT2 | amplificare / mutație | 6%, 20% | |
| ARID1A | mutație punctuală | celulă endometrioidă și clară | |
| BECN1 | ștergere | ||
| BRAF | mutație punctuală | slab seros | 0,5% |
| BRCA1 | mutație fără sens | seros de înaltă calitate | 5% |
| BRCA2 | mutație framehift | seros de înaltă calitate | 3% |
| CCND1 | amplificare | 4% | |
| CCND2 | reglare ascendentă | 15% | |
| CCNE1 | amplificare | 20% | |
| CDK12 | seros de înaltă calitate | ||
| CDKN2A | reglare descendentă (30%) și ștergere (2%) | 32% | |
| CTNNB1 | celula limpede | ||
| DICER1 | mutație greșită (somatică) | nepithelial | 29% |
| DYNLRB1 (km23) | mutaţie | 42% | |
| EGFR | amplificare / supraexprimare | 20% | |
| ERBB2 (Her2 / neu) | amplificare / supraexprimare | mucoase și seroase de grad scăzut | 30% |
| FMS | coexpresie cu CSF-1 | 50% | |
| FOXL2 | mutație punctuală (402 C la G) | celula granuloasă adultă | ~ 100% |
| JAG1 | amplificare | 2% | |
| JAG2 | amplificare | 3% | |
| KRAS | amplificare | mucoase și seroase de grad scăzut | 11% |
| MAML1 | amplificare și mutație punctuală | 2% | |
| MAML2 | amplificare și mutație punctuală | 4% | |
| MAML3 | amplificare | 2% | |
| MLH1 | 1% | ||
| NF1 | ștergere (8%) și mutație punctuală (4%) | seros de înaltă calitate | 12% |
| NOTCH3 | amplificare și mutație punctuală | 11% | |
| NRAS | slab seros | ||
| PIK3C3 (PI3K3) | amplificare / mutație | 12-20% | |
| PIK3CA | amplificare | celulă endometrioidă și clară | 18% |
| PPP2R1A | celulă endometrioidă și clară | ||
| PTEN | ștergere | celulă endometrioidă și clară | 7% |
| RB1 | ștergere (8%) și mutație punctuală (2%) | 10% | |
| TGF-β | mutație / supraexprimare | 12% | |
| TP53 | mutație / supraexprimare | seros de înaltă calitate | 20-50% |
| TβRI | mutaţie | 33% | |
| TβRII | mutaţie | 25% | |
| USP36 | supraexprimare |
Cancerul ovarian se formează atunci când apar erori în creșterea normală a celulelor ovariene . De obicei, atunci când celulele îmbătrânesc sau se deteriorează, ele mor , iar celulele noi își iau locul. Cancerul începe atunci când celulele noi se formează inutil, iar celulele vechi sau deteriorate nu mor așa cum ar trebui. Acumularea de celule suplimentare formează adesea o masă de țesut numită tumoră ovariană sau creștere. Aceste celule canceroase anormale au multe anomalii genetice care le determină să crească excesiv. Când un ovar eliberează un ou , foliculul ovulului se deschide și devine corpul galben . Această structură trebuie reparată prin divizarea celulelor din ovar. Ovulația continuă pentru o lungă perioadă de timp înseamnă mai multă reparare a ovarului prin divizarea celulelor, care pot dobândi mutații în fiecare diviziune.
În general, cele mai frecvente mutații genetice în cancerul ovarian apar în NF1 , BRCA1, BRCA2 și CDK12 . Cancerele ovariene de tip I, care tind să fie mai puțin agresive, tind să aibă instabilitate microsatelitală în mai multe gene, inclusiv oncogene (mai ales BRAF și KRAS ) și supresoare tumorale (mai ales PTEN ). Cele mai frecvente mutații în cancerele de tip I sunt KRAS, BRAF, ERBB2, PTEN, PIK3CA și ARID1A. Cancerele de tip II, tipul mai agresiv, au diferite gene mutate, inclusiv p53 , BRCA1 și BRCA2 . Cancerele de grad scăzut tind să aibă mutații în KRAS, în timp ce cancerele de orice grad care se dezvoltă din tumorile cu potențial malign scăzut tind să aibă mutații în p53. Cancerele de tip I tind să se dezvolte din leziunile precursoare, în timp ce cancerele de tip II se pot dezvolta dintr-un carcinom tubular seros intraepitelial . Cancerele seroase care au mutații BRCA au, de asemenea, inevitabil mutații p53, indicând faptul că îndepărtarea ambelor gene funcționale este importantă pentru dezvoltarea cancerului.
În 50% din cazurile de cancer seros de înaltă calitate, repararea omologă a ADN-ului cu recombinare este disfuncțională, la fel ca și căile de semnalizare cu crestătură și FOXM1 . De asemenea, au aproape întotdeauna mutații p53. În afară de aceasta, mutațiile carcinomului seros de grad înalt sunt greu de caracterizat dincolo de gradul lor ridicat de instabilitate genomică . BRCA1 și BRCA2 sunt esențiale pentru repararea omologă a ADN-ului prin recombinare, iar mutațiile germinale din aceste gene se găsesc la aproximativ 15% dintre persoanele cu cancer ovarian. Cele mai frecvente mutații din BRCA1 și BRCA2 sunt mutațiile de schimbare a cadrelor care au apărut într-o mică populație fondatoare de evrei Ashkenazi.
Aproape 100% dintre carcinoamele mucinoase rare prezintă mutații în KRAS și amplificări ale ERBB2 (cunoscut și sub numele de Her2 / neu ). În general, 20% din cancerele ovariene au mutații în Her2 / neu .
Carcinoamele seroase se pot dezvolta din carcinomul intraepitelial tubar seros , mai degrabă decât să se dezvolte spontan din țesutul ovarian. Alte carcinoame se dezvoltă din chisturi de incluziune corticală , care sunt grupuri de celule ovariene epiteliale în interiorul stromei .
Diagnostic
Examinare
Diagnosticul cancerului ovarian începe cu un examen fizic (inclusiv un examen pelvian ), un test de sânge (pentru CA-125 și uneori alți markeri) și ultrasunete transvaginale . Uneori, un examen rectovaginal este folosit pentru a ajuta la planificarea unei intervenții chirurgicale. Diagnosticul trebuie confirmat cu o intervenție chirurgicală pentru inspectarea cavității abdominale , prelevarea de biopsii (probe de țesut pentru analize microscopice ) și căutarea celulelor canceroase în lichidul abdominal. Acest lucru ajută la determinarea dacă o masă ovariană este benignă sau malignă.
Stadiile incipiente ale cancerului ovarian (I / II) sunt dificil de diagnosticat, deoarece majoritatea simptomelor sunt nespecifice și, prin urmare, sunt puțin folositoare în diagnostic; ca rezultat, este rar diagnosticat până când nu se răspândește și avansează în stadii ulterioare (III / IV). În plus, simptomele cancerului ovarian pot apărea similare cu sindromul intestinului iritabil . La pacienții la care este posibilă sarcina, nivelul BHCG poate fi măsurat în timpul procesului de diagnostic. Alfa-fetoproteina serică , enolaza specifică neuronului și lactatul dehidrogenază pot fi măsurate la fetele tinere și adolescenții cu suspiciuni de tumori ovariene, deoarece pacienții mai tineri sunt mai predispuși să aibă tumori maligne ale celulelor germinale.
Un examen fizic, inclusiv un examen pelvian, și o ecografie pelviană (transvaginală sau altele) sunt ambele esențiale pentru diagnostic: examenul fizic poate dezvălui o circumferință abdominală crescută și / sau ascită (lichid în cavitatea abdominală), în timp ce examinarea pelviană poate dezvălui un ovar sau masă abdominală. O masă anexă este o constatare semnificativă care indică adesea cancerul ovarian, mai ales dacă este fix, nodular, neregulat, solid și / sau bilateral. 13–21% din masele anexe sunt cauzate de malignitate; cu toate acestea, există și alte cauze benigne ale maselor anexe, inclusiv chist folicular ovarian , leiomiom , endometrioză , sarcină ectopică , hidrosalpinx , abces tuboovarian , torsiune ovariană , chist dermoid , cistadenom (seros sau mucinos), abces diverticular sau apendiceal , tumoră în teacă nervoasă , rinichi pelvin , diverticul ureteral sau vezical , mezoteliom chistic benign al peritoneului , tuberculoză peritoneală sau chist paraovarian . Ovarele care pot fi resimțite sunt, de asemenea, un semn al cancerului ovarian la femeile aflate în postmenopauză. Alte părți ale unui examen fizic pentru suspectul de cancer ovarian pot include o examinare a sânilor și un examen rectal digital . Palparea ganglionilor limfatici supraclaviculari , axilari și inghinali poate dezvălui limfadenopatie , care poate fi indicativă a metastazei. Un alt indicator poate fi prezența unui revărsat pleural , care poate fi observat la auscultație .
Atunci când o malignitate ovariană este inclusă într-o listă de posibilități de diagnostic, este indicat un număr limitat de teste de laborator. De obicei se obține o analiză completă a sângelui și a electrolitului seric; atunci când este prezent un cancer ovarian, aceste teste arată adesea un număr mare de trombocite (20-25% dintre oameni) și niveluri scăzute de sodiu din sânge datorate semnalelor chimice secretate de tumoră. Un test pozitiv pentru inhibina A și inhibina B poate indica o tumoare cu celule granuloase.
Un test de sânge pentru o moleculă marker numită CA-125 este util în diagnosticul diferențial și în urmărirea bolii, dar nu s-a dovedit că este o metodă eficientă de depistare a cancerului ovarian în stadiu incipient datorită nivelului său inacceptabil de scăzut. sensibilitate și specificitate. Nivelurile de CA-125 la persoanele în premenopauză peste 200 U / ml pot indica cancer ovarian, la fel ca orice creștere a CA-125 peste 35 U / ml la persoanele aflate în post-menopauză. Nivelurile de CA-125 nu sunt exacte în cancerul ovarian în stadiu incipient, întrucât jumătate din pacienții cu cancer ovarian în stadiul I au un nivel normal de CA-125. CA-125 poate fi, de asemenea, crescut în condiții benigne (necanceroase), inclusiv endometrioză , sarcină , fibroame uterine , menstruație , chisturi ovariene , lupus eritematos sistemic , boli hepatice , boli inflamatorii intestinale , boli inflamatorii pelvine și leiomiom . HE4 este un alt candidat pentru testarea cancerului ovarian, deși nu a fost testat pe larg. Alți markeri tumorali pentru cancerul ovarian includ CA19-9 , CA72-4 , CA15-3 , proteină acidă imunosupresivă , haptoglobină-alfa , OVX1 , mezotelină , acid lizofosfatidic , osteopontină și factorul de creștere al fibroblastului 23 .
Utilizarea panourilor de testare a sângelui poate ajuta la diagnostic. Panoul OVA1 include CA-125, beta-2 microglobulină , transferină , apolipoproteină A1 și transtiretină . OVA1 peste 5,0 la persoanele aflate în premenopauză și 4,4 la persoanele aflate în postmenopauză indică un risc ridicat de cancer. Un set diferit de teste de laborator este utilizat pentru detectarea tumorilor cordon-stromale sexuale. Nivelurile ridicate de testosteron sau sulfat de dehidroepiandrosteron , combinate cu alte simptome și niveluri ridicate de inhibină A și inhibină B pot fi indicative ale unui SCST de orice tip.
Cercetările actuale caută modalități de a lua în considerare proteomica markerului tumoral în combinație cu alți indicatori de boală (de exemplu, radiologie și / sau simptome) pentru a îmbunătăți precizia diagnosticului. Provocarea într-o astfel de abordare este că prevalența dispară a cancerului ovarian înseamnă că chiar și testarea cu sensibilitate și specificitate foarte ridicate va duce în continuare la o serie de rezultate fals pozitive, care la rândul lor pot duce la probleme precum efectuarea procedurilor chirurgicale în care cancerul nu se găsește intraoperator. Abordările de genomică nu au fost încă dezvoltate pentru cancerul ovarian.
Scanarea CT este preferată pentru a evalua întinderea tumorii în cavitatea abdominopelvică, deși imagistica prin rezonanță magnetică poate fi, de asemenea, utilizată. Scanarea CT poate fi, de asemenea, utilă pentru găsirea aglomerării omentale sau diferențierea lichidului de tumoarea solidă din abdomen, în special în tumorile cu potențial malign scăzut. Cu toate acestea, este posibil să nu detecteze tumori mai mici. Uneori, o radiografie toracică este utilizată pentru a detecta metastazele în piept sau revărsatul pleural . Un alt test pentru boala metastatică, deși este folosit rar, este o clismă de bariu , care poate arăta dacă colonul rectosigmoid este implicat în boală. Tomografia cu emisie de pozitroni , scanările osoase și paracenteza sunt de utilizare limitată; de fapt, paracenteza poate determina formarea de metastaze la locul de inserare a acului și poate să nu ofere rezultate utile. Cu toate acestea, paracenteza poate fi utilizată în cazurile în care nu există masă pelviană și ascita este încă prezentă. Un medic care suspectează cancer ovarian poate efectua, de asemenea, mamografie sau biopsie endometrială (în cazul sângerării anormale) pentru a evalua posibilitatea apariției malignităților mamare și, respectiv, a celor endometriale. Ecografia vaginală este adesea studiul imagistic de primă linie efectuat atunci când se găsește o masă anexă. Mai multe caracteristici ale unei mase anexe indică malignitatea ovariană; de obicei sunt solide, neregulate, multiloculare și / sau mari; și au de obicei trăsături papilare, vase centrale și / sau septații interne neregulate. Cu toate acestea, SCST nu are caracteristici definitive în studiul radiografic.
Pentru a diagnostica definitiv cancerul ovarian, este necesară o procedură chirurgicală pentru inspectarea abdomenului. Aceasta poate fi o procedură deschisă ( laparotomie , incizie prin peretele abdominal ) sau o intervenție chirurgicală de gaură ( laparoscopie ). În timpul acestei proceduri, țesutul suspect este îndepărtat și trimis spre analiză microscopică . De obicei, aceasta include o salpingo-ooforectomie unilaterală , îndepărtarea unui singur ovar afectat și trompa uterină. Lichidul din cavitatea abdominală poate fi, de asemenea, analizat pentru celule canceroase . Dacă se constată cancer, această procedură poate fi utilizată și pentru a determina amploarea răspândirii sale (care este o formă de stadializare tumorală ).
Scorarea riscurilor
O metodă recunoscută pe scară largă de estimare a riscului de cancer ovarian malign este riscul indicelui malignitate (RMI), calculat pe baza unei inițiale workup . În general, un scor RMI de peste 200 sau 250 indică un risc ridicat de cancer ovarian.
RMI este calculat ca:
- RMI = scor ecografic × scor menopauzal x nivel CA-125 în U / ml.
Două metode pot fi utilizate pentru a determina scorul ecografic și scorul menopauzei, scorurile rezultate fiind denumite RMI 1 și respectiv RMI 2, în funcție de ce metodă este utilizată.
| Caracteristică | RMI 1 | RMI 2 |
|---|---|---|
|
Anomalii ultrasunete:
|
||
| Scorul menopauzei | ||
| CA-125 | Cantitatea în U / ml | Cantitatea în U / ml |
O altă metodă de cuantificare a riscului de cancer ovarian este algoritmul de risc al cancerului ovarian (ROCA), care observă nivelurile în timp și determină dacă acestea cresc suficient de rapid pentru a justifica ultrasunetele transvaginale. Algoritmul Risc de malignitate ovariană utilizează nivelurile CA-125 și nivelurile HE4 pentru a calcula riscul de cancer ovarian; poate fi mai eficient decât RMI. Modelele IOTA pot fi utilizate pentru a estima probabilitatea ca o tumoare anexă să fie malignă. Acestea includ modelul de risc LR2, calculul riscului regulilor simple (riscul) și evaluarea diferitelor neoplazii în modelul Adnexa (ADNEX) care pot fi utilizate pentru a evalua riscul de malignitate într-o masă anexă, pe baza caracteristicilor și a factorilor de risc. Algoritmul QCancer (ovar) este utilizat pentru a prezice probabilitatea cancerului ovarian din factorii de risc.
Patologie
Cancerele ovariene sunt clasificate în funcție de aspectul microscopic al structurilor lor ( histologie sau histopatologie ). Histologia dictează multe aspecte ale tratamentului clinic, managementului și prognosticului . Patologia brută a cancerelor ovariene este foarte similară indiferent de tipul histologic: tumorile ovariene au mase solide și chistice. Potrivit SEER , tipurile de cancer ovarian la femeile cu vârsta peste 20 de ani sunt:
| Procentul cancerelor ovariene la femeile cu vârsta peste 20 de ani |
Procentul cancerelor ovariene la femeile cu vârsta peste 20 de ani subdiviziune |
Histologie | RSR de cinci ani |
|---|---|---|---|
| 89,7 | Tumoare epitelial-stromală de suprafață ( adenocarcinom ) | 54.4 | |
| 26.4 | Cistadenocarcinom seros papilar | 21.0 | |
| 15.9 |
Adenocarcinom la limită (subestimat - interval scurt de colectare a datelor) |
98.2 | |
| 12.6 | Adenocarcinom, nespecificat altfel | 18.3 | |
| 9.8 | Tumora endometrioidă | 70,9 | |
| 5.8 | Cistadenocarcinom seros | 44.2 | |
| 5.5 | Papilar | 21.0 | |
| 4.2 | Cistadenocarcinom mucinos | 77,7 | |
| 4.0 | Tumora ovariană cu celule clare | 61,5 | |
| 3.4 | Adenocarcinom mucinos | 49.1 | |
| 1.3 | Cistadenocarcinom | 50,7 | |
| 5.5 | Carcinom | ||
| 4.1 | Carcinom nespecificat altfel | 26.8 | |
| 1.1 | Tumora sexuală a cordonului stromal | 87,8 | |
| 0,3 | Alte carcinoame, specificate | 37.3 | |
| 1.7 | Tumora mulleriană | 29,8 | |
| 1.5 | Tumora cu celule germinale | 91,0 | |
| 0,8 | Teratom | 89.1 | |
| 0,5 | Disgerminom | 96,8 | |
| 0,3 | Altele, specificate | 85.1 | |
| 0,6 | Nespecificat altfel | 23.0 | |
| 0,5 | Epidermoid ( carcinom cu celule scuamoase ) | 51.3 | |
| 0,2 | Tumora Brenner | 67,9 | |
| 0,2 | Altele, specificate | 71.7 |
Cancerele ovariene sunt divizate histologic și genetic în tipul I sau tipul II. Cancerele de tip I sunt de grad histologic scăzut și includ carcinoame endometrioide, mucinoase și cu celule limpezi. Cancerele de tip II sunt de grad histologic mai ridicat și includ carcinom seros și carcinosarcom.
Carcinom epitelial
Tumora epitelial-stromală de suprafață , cunoscută și sub numele de carcinom epitelial ovarian, este cel mai frecvent tip de cancer ovarian, reprezentând aproximativ 90% din cancerele ovariene. Include tumoare seroasă , tumoare endometrioidă și cistadenocarcinom mucinos . Tumorile mai puțin frecvente sunt cancerul ovarian endometrioid malign , cancerul ovarian cu celule clare și tumora Brenner ( carcinom cu celule de tranziție al ovarului ). Cancerele ovariene epiteliale se dezvoltă din epiteliu , un strat de celule care acoperă ovarul.
Carcinom seros
Majoritatea persoanelor cu carcinom ovarian epitelial, aproximativ două treimi, au un carcinom seros , deși această proporție este estimată la 80%. Carcinomul seros de grad scăzut este mai puțin agresiv decât carcinoamele seroase de grad înalt, deși nu răspunde de obicei bine la chimioterapie sau tratamente hormonale. Se crede că carcinoamele serioase încep în trompa uterină . Histologic, adenocarcinoamele seroase au corpuri de psammom . Adenocarcinoamele seroase de nivel scăzut seamănă cu epiteliul trompei Fallopian, în timp ce adenocarcinoamele seroase de nivel înalt prezintă anaplazie și atipie nucleară .
50% din timp, carcinoamele seroase sunt bilaterale și, în 85% din cazuri, s-au răspândit dincolo de ovar în momentul diagnosticului. Majoritatea au un diametru de peste 15 cm.
Carcinomul intraepitelial seros tubar (STIC) este acum recunoscut ca fiind leziunea precursoră a celor mai numite carcinoame seroase ovariene de grad înalt. STIC se caracterizează prin
- Colorare p53 anormală
- Indice de proliferare Ki67 peste 10%
- WT1 pozitiv (pentru a exclude metastazele)
Carcinom cu celule mici
Carcinomul ovarian cu celule mici este rar și agresiv, cu două subtipuri principale: hipercalcemic și pulmonar. Este de obicei fatală în decurs de 2 ani de la diagnostic. Carcinomul ovarian hipercalcemic cu celule mici îi afectează în mod covârșitor pe cei de 20 de ani, determină niveluri ridicate de calciu din sânge și afectează un ovar. Cancerul ovarian pulmonar cu celule mici afectează de obicei ambele ovare ale femeilor în vârstă și arată ca un carcinom cu celule de ovăz al plămânului .
Carcinom peritoneal primar
Carcinoamele peritoneale primare se dezvoltă din peritoneu , o membrană care acoperă cavitatea abdominală care are aceeași origine embrionară ca ovarul. Acestea sunt adesea discutate și clasificate cu cancerele ovariene atunci când afectează ovarul. Se pot dezvolta chiar și după îndepărtarea ovarelor și pot părea asemănătoare mezoteliomului .
Carcinom cu celule clare
Carcinoamele ovariene cu celule clare nu răspund de obicei bine la chimioterapie și pot fi legate de endometrioză. Ele reprezintă aproximativ 5% din toate tipurile de cancer endometrial. Femeile japoneze dezvoltă cancer ovarian cu celule clare mai frecvent decât alte grupuri de femei.
Adenocarcinom cu celule clare
Adenocarcinoamele cu celule clare sunt asemănătoare din punct de vedere histopatologic cu alte carcinoame cu celule clare , cu celule clare și celule hobnail . Ele reprezintă aproximativ 5-10% din cancerele ovariene epiteliale și sunt asociate cu endometrioză în cavitatea pelviană. Ele sunt de obicei în stadiu incipient și, prin urmare, vindecabile prin intervenție chirurgicală, dar adenocarcinoamele cu celule limpezi avansate (aproximativ 20%) au un prognostic slab și sunt deseori rezistente la chimioterapia cu platină.
Endometrioid
Adenocarcinoamele endometrioide reprezintă aproximativ 15-20% din cancerele ovariene epiteliale. Deoarece sunt de obicei de grad scăzut, adenocarcinoamele endometrioide au un prognostic bun. Aceste tumori coincid frecvent cu endometrioza sau cancerul endometrial.
Tumora mülleriană malignă mixtă (carcinosarcom)
Tumorile mülleriene mixte reprezintă mai puțin de 1% din cancerul ovarian. Au celule epiteliale și mezenchimale vizibile și tind să aibă un prognostic slab.
Mucinoase
Tumorile mucinoase includ adenocarcinom mucinos și cistadenocarcinom mucinos.
Adenocarcinom mucinos
Adenocarcinoamele mucinoase reprezintă 5-10% din cancerele ovariene epiteliale. Din punct de vedere histologic, acestea sunt similare cu adenocarcinoamele intestinale sau cervicale și sunt adesea de fapt metastaze ale apendicelui sau ale cancerului de colon . Adenocarcinoamele mucinoase avansate au un prognostic slab, în general mai rău decât tumorile seroase și sunt deseori rezistente la chimioterapia cu platină, deși sunt rare.
Pseudomyxoma peritonei
Pseudomiomul peritonei se referă la o colecție de material mucos sau gelatinos încapsulat în cavitatea abdominopelvică, care este foarte rar cauzată de o tumoare ovariană mucinoasă primară. Mai frecvent, este asociat cu metastaze ovariene ale cancerului intestinal.
Epitelial nediferențiat
Cancerele nediferențiate - cele în care tipul celular nu poate fi determinat - reprezintă aproximativ 10% din cancerele ovariene epiteliale și au un prognostic relativ slab. Atunci când sunt examinate la microscop, aceste tumori au celule foarte anormale care sunt aranjate în aglomerări sau foi. De obicei, există tumori recunoscute de celule seroase în interiorul tumorii.
Tumora Brenner malignă
Tumorile Brenner maligne sunt rare. Din punct de vedere histologic, au o stromă fibroasă densă cu zone de epiteliu de tranziție și o diferențiere scuamoasă. Pentru a fi clasificat ca o tumoare malignă Brenner, trebuie să aibă focare tumorale Brenner și carcinom cu celule de tranziție. Componenta de carcinom cu celule de tranziție este de obicei slab diferențiată și seamănă cu cancerul tractului urinar.
Carcinom cu celule de tranziție
Carcinoamele cu celule de tranziție reprezintă mai puțin de 5% din cancerele ovariene. Din punct de vedere histologic, acestea par similare cu carcinomul vezicii urinare . Prognosticul este intermediar - mai bun decât majoritatea cancerelor epiteliale, dar mai rău decât tumorile maligne Brenner.
Tumora sexuală a cordonului stromal
Sex tumoare cordon stromale , incluzând estrogen -producatoare tumorale celulele granuloase , benigne thecoma și virilizare celulelor tumorale Sertoli-Leydig sau arrhenoblastoma , reprezintă 7% din cazurile de cancer ovarian. Acestea apar cel mai frecvent la femeile între 50 și 69 de ani, dar pot apărea la femeile de orice vârstă, inclusiv fetele tinere. Nu sunt de obicei agresivi și sunt de obicei unilaterali; prin urmare, acestea sunt de obicei tratate numai cu o intervenție chirurgicală. Tumorile sexuale-stromale sunt principalele tumori ovariene producătoare de hormoni.
Mai multe celule diferite de mezenchim pot da naștere la sex-cord sau tumori stromale. Acestea includ fibroblaste și celule endocrine. Simptomele unei tumori de cordon sexual sau de ovar stromal pot diferi de alte tipuri de cancer ovarian. Semnele și simptomele frecvente includ torsiunea ovariană , hemoragia sau ruperea tumorii, o masă abdominală și perturbarea hormonală. La copii, pseudopubertatea precoce isosexuală poate apărea în cazul tumorilor cu celule granuloase, deoarece acestea produc estrogen. Aceste tumori provoacă anomalii ale menstruației ( sângerări excesive , menstruații rare sau lipsa menstruației ) sau sângerări postmenopauzale. Deoarece aceste tumori produc estrogen, ele pot provoca sau apărea în același timp cu cancerul endometrial sau cancerul de sân . Alte tumori sex-cordon / stromal prezintă simptome distincte. Tumorile celulare Sertoli-Leydig provoacă virilizarea și creșterea excesivă a părului datorită producției de testosteron și androstendion , care poate provoca, de asemenea , sindromul Cushing în cazuri rare. De asemenea, apar tumori stromale ale cordonului sexual care nu cauzează un dezechilibru hormonal, inclusiv fibroame benigne, care provoacă ascită și hidrotorax . Cu tumorile cu celule germinale, tumorile cordonului sexual-stromal sunt cel mai frecvent cancer ovarian diagnosticat la femeile sub 20 de ani.
Tumora cu celule granuloase
Tumorile cu celule granuloase sunt cele mai frecvente tumori stromale ale cordonului sexual, reprezentând 70% din cazuri, și sunt împărțite în două subtipuri histologice: tumori adulte pentru celule granuloase, care se dezvoltă la femeile cu vârsta peste 50 de ani, și tumori granuloase juvenile, care se dezvoltă înainte de pubertate sau înainte de vârsta de 30 de ani. Ambele se dezvoltă în foliculul ovarian dintr-o populație de celule care înconjoară celulele germinale .
Tumora adultă cu celule granuloase
Tumorile cu celule granuloase adulte se caracterizează prin debut ulterior (30+ ani, 50 în medie). Aceste tumori produc niveluri ridicate de estrogen, ceea ce cauzează simptomele sale caracteristice: menometroragie ; hiperplazie endometrială ; sânii sensibili , măriți ; sângerări postmenopauzale ; și amenoree secundară . Masa tumorii poate provoca alte simptome, inclusiv dureri abdominale și distensie, sau simptome similare unei sarcini ectopice dacă tumora sângerează și se rupe.
Tumora juvenilă cu celule granuloase
Tumora cu celule Sertoli-Leydig
Tumorile Sertoli-Leydig sunt cele mai frecvente la femei înainte de 30 de ani și deosebit de frecvente înainte de pubertate.
Tumori sclerozante stromale
Tumorile sclerozante stromale apar de obicei la fete înainte de pubertate sau la femei înainte de vârsta de 30 de ani.
Tumora cu celule germinale
Tumorile cu celule germinale ale ovarului se dezvoltă din celulele germinale ovariene . Tumorile cu celule germinale reprezintă aproximativ 30% din tumorile ovariene, dar doar 5% din cancerele ovariene, deoarece majoritatea tumorilor cu celule germinale sunt teratoame și cele mai multe teratoame sunt benigne. Teratoamele maligne tind să apară la femeile în vârstă, când unul dintre straturile germinale din tumoră se dezvoltă într-un carcinom cu celule scuamoase . Tumorile cu celule germinale tind să apară la femeile tinere (20-30 de ani) și la fete, reprezentând 70% din cancerul ovarian observat în acea grupă de vârstă. Tumorile cu celule germinale pot include disgerminoame, teratoame, tumori din gălbenuș / tumori ale sinusului endodermic și coriocarcinoame, atunci când apar în ovar. Unele tumori cu celule germinale au un izocromozom 12, unde un braț al cromozomului 12 este șters și înlocuit cu un duplicat al celuilalt. Majoritatea cancerelor cu celule germinale au un prognostic mai bun decât alte subtipuri și sunt mai sensibile la chimioterapie. Este mai probabil să fie stadiul I la diagnostic. În general, metastazează mai frecvent decât cancerele ovariene epiteliale. În plus, markerii de cancer utilizați variază în funcție de tipul tumorii: coriocarcinoamele sunt monitorizate cu beta-HCG și tumorile sinusului endodermic cu alfa-fetoproteina .
Tumorile cu celule germinale sunt de obicei descoperite atunci când devin mase mari, palpabile. Cu toate acestea, la fel ca tumorile de cordon sexual, ele pot provoca torsiune ovariană sau hemoragie și, la copii, pubertate precoce isosexuală. Se metastazează frecvent la ganglionii limfatici din apropiere, în special la ganglionii limfatici para-aortici și pelvini. Cel mai frecvent simptom al tumorilor cu celule germinale este durerea abdominală subacută cauzată de sângerarea tumorii, necrozarea sau întinderea capsulei ovariene . Dacă tumora se rupe, provoacă sângerări semnificative sau torsionează ovarul, poate provoca dureri abdominale acute , care apar la mai puțin de 10% dintre cei cu tumori cu celule germinale. De asemenea, pot secreta hormoni care schimbă ciclul menstrual . La 25% dintre tumorile cu celule germinale, cancerul este descoperit în timpul unei examinări de rutină și nu provoacă simptome.
Diagnosticarea tumorilor cu celule germinale poate fi dificilă, deoarece ciclul menstrual normal și pubertatea pot provoca dureri și simptome pelvine, iar o tânără poate chiar să creadă că aceste simptome sunt cele ale sarcinii și să nu caute tratament din cauza stigmatizării sarcinii adolescente . Testele de sânge pentru alfa-fetoproteină, cariotip , gonadotropină corionică umană și funcția hepatică sunt utilizate pentru a diagnostica tumoarea celulei germinale și potențialul disgeneză gonadică care apare simultan. O tumoare cu celule germinale poate fi confundată inițial cu un chist ovarian benign .
Disgerminom
Disgerminomul reprezintă 35% din cancerul ovarian la femeile tinere și este cea mai probabilă tumoră cu celule germinale care se metastazează la ganglionii limfatici; metastazele nodale apar în 25-30% din cazuri. Aceste tumori pot avea mutatii in KIT gena , o mutatie cunoscut pentru rolul său în tumorii stromale gastro - intestinale . Persoanele cu cariotip XY și ovare ( disgeneză gonadică ) sau cariotip X, 0 și ovare ( sindrom Turner ) care dezvoltă un disgerminom unilateral sunt expuse riscului unui gonadoblastom în celălalt ovar și, în acest caz, ambele ovare sunt de obicei îndepărtate atunci când se descoperă un disgerminom unilateral pentru a evita riscul unei alte tumori maligne. Gonadoblastoamele la persoanele cu sindrom Swyer sau Turner devin maligne în aproximativ 40% din cazuri. Cu toate acestea, în general, disgerminoamele sunt bilaterale 10-20% din timp.
Acestea sunt compuse din celule care nu se pot diferenția în continuare și se dezvoltă direct de celulele germinale sau de gonadoblastoame. Disgerminoamele conțin sincitiotrofoblaste în aproximativ 5% din cazuri și, prin urmare, pot provoca niveluri crescute de hCG. La aspect gros, disgerminoamele sunt de obicei roz până la bronz, au lobi multipli și sunt solide. Microscopic, acestea apar identice cu seminomele și foarte aproape de celulele germinale embrionare primordiale , având celule clare mari, poliedrice, rotunjite . Nucleii sunt uniformi și rotunzi sau pătrati cu nucleoli proeminenți, iar citoplasma are niveluri ridicate de glicogen . Inflamația este o altă caracteristică histologică importantă a disgerminoamelor.
Coriocarcinom
Choriocarcinomul poate apărea ca o tumoare ovariană primară care se dezvoltă dintr-o celulă germinativă, deși este de obicei o boală gestațională care se metastazează la ovar. Coriocarcinomul ovarian primar are un prognostic slab și poate apărea fără sarcină. Acestea produc niveluri ridicate de hCG și pot provoca pubertate timpurie la copii sau menometroragie (menstruație neregulată, grea) după menarhie.
Teratom imatur (solid)
Teratoamele imature sau solide sunt cel mai frecvent tip de tumoare cu celule germinale ovariene, reprezentând 40-50% din cazuri. Teratoamele se caracterizează prin prezența țesuturilor dezorganizate care provin din toate cele trei straturi germinale embrionare : ectoderm , mezoderm și endoderm ; teratoamele imature au, de asemenea, celule stem nediferențiate care le fac mai maligne decât teratoamele mature (chisturi dermoidale). Diferitele țesuturi sunt vizibile în patologia brută și includ adesea os, cartilaj, păr, mucus sau sebum , dar aceste țesuturi nu sunt vizibile din exterior, care pare a fi o masă solidă cu lobi și chisturi. Histologic, au cantități mari de neuroectoderm organizat în foi și tubuli împreună cu glia ; cantitatea de țesut neural determină gradul histologic. Teratoamele imature afectează de obicei doar un ovar (10% coincid cu chisturile dermoidale) și de obicei se metastazează pe tot peritoneul. Ele pot provoca, de asemenea, creșterea implanturilor de teratom matur în abdomen într-o boală numită sindrom de teratom în creștere ; acestea sunt de obicei benigne, dar vor continua să crească în timpul chimioterapiei și deseori necesită intervenții chirurgicale suplimentare. Spre deosebire de teratoamele mature, teratoamele imature formează multe aderențe , ceea ce le face mai puțin susceptibile de a provoca torsiunea ovariană. Nu există un marker specific pentru teratoame imature, dar antigenul carcinoembrionar (CEA), CA-125, CA19-9 sau AFP poate indica uneori un teratom imatur.
Teratoamele de stadiul I reprezintă majoritatea (75%) din cazuri și au cel mai bun prognostic, 98% dintre pacienți supraviețuind 5 ani; dacă o tumoră în stadiul I este, de asemenea, de gradul 1, poate fi tratată numai cu o intervenție chirurgicală unilaterală. Stadiul II, deși tumorile IV alcătuiesc sfertul rămas al cazurilor și au un prognostic mai prost, 73-88% dintre pacienți supraviețuind timp de 5 ani.
Teratom matur (chist dermoid)
Teratoamele mature, sau chisturile dermoide, sunt tumori rare, constând în țesut în cea mai mare parte benign, care se dezvoltă după menopauză. Tumorile constau din țesut dezorganizat cu noduli de țesut malign, care pot fi de diferite tipuri. Cele mai frecvente boli maligne este carcinomul cu celule scuamoase , dar adenocarcinom , carcinom bazocelular , tumora carcinoidă , tumoră neuroectodermală , melanomul malign , sarcom , tumora sebacee și struma ovarii pot fi , de asemenea , o parte din chist dermoid. Sunt tratați prin intervenții chirurgicale și chimioterapie adjuvantă cu platină sau radiații.
Tumora sacului galbenus / tumora sinusului endodermic
Tumorile sacului gălbenușului , numite anterior tumori ale sinusului endodermic, reprezintă aproximativ 10-20% din tumorile maligne ale celulelor germinale ovariene și au cel mai prost prognostic dintre toate tumorile celulare germinale ovariene . Ele apar atât înainte de menarhie (într-o treime din cazuri), cât și după menarhie (restul de două treimi din cazuri). Jumătate dintre persoanele cu tumori ale sacului gălbenușului sunt diagnosticate în stadiul I. De obicei, sunt unilaterale până la metastaze, care apare în cavitatea peritoneală și prin fluxul sanguin până la plămâni. Tumorile sacului gălbenușului cresc rapid și se repetă ușor și nu sunt ușor de tratat odată ce au reapărut. Tumorile sacului gălbenușului în stadiul I sunt foarte tratabile, cu o rată de supraviețuire fără boală pe 5 ani de 93%, dar tumorile în stadiul II-IV sunt mai puțin tratabile, cu rate de supraviețuire de 64-91%.
Aspectul lor grosier este solid, friabil și galben, cu zone necrotice și hemoragice. De asemenea, conțin adesea chisturi care pot degenera sau rupe. Histologic, tumorile sacului gălbenușului se caracterizează prin prezența corpurilor Schiller-Duval (care sunt patognomonice pentru tumorile sacului gălbenușului) și un model reticular. Tumorile sacului gălbenușului secretă în mod obișnuit alfa-fetoproteina și pot fi colorate imunohistochimic pentru prezența sa; nivelul alfa-fetoproteinei din sânge este un marker util de recurență.
Carcinom embrionar
Carcinoamele embrionare, un tip tumoral rar întâlnit de obicei în tumorile mixte, se dezvoltă direct din celulele germinale, dar nu sunt diferențiate terminal; în cazuri rare, se pot dezvolta în gonade disgenetice. Se pot dezvolta în continuare într-o varietate de alte neoplasme, inclusiv coriocarcinom, tumoare din gălbenuș și teratom. Acestea apar la persoanele mai tinere, cu o vârstă medie la diagnosticul de 14 ani, și secretă atât alfa-fetoproteina (în 75% din cazuri), cât și hCG.
Histologic, carcinomul embrionar apare similar cu discul embrionar , alcătuit din celule epiteliale, anaplastice în foi dezorganizate, cu spații asemănătoare glandelor și structuri papilare.
Polembriom
Polembrioamele, cea mai imatură formă de teratom și tumori ovariene foarte rare, sunt caracterizate histologic prin faptul că au mai mulți corpuri asemănătoare embrionilor cu structuri asemănătoare unui disc germinal , sac de gălbenuș și sac amniotic . Celulele uriașe sincitiotrofoblaste apar și în polembrioame.
Carcinom cu celule scuamoase
Carcinoamele ovariene primare cu celule scuamoase sunt rare și au un prognostic slab atunci când sunt avansate. Mai tipic, carcinoamele ovariene cu celule scuamoase sunt metastaze cervicale, zone de diferențiere într-o tumoare endometrioidă sau derivate dintr-un teratom matur.
Tumori mixte
Tumorile mixte conțin elemente ale mai multor clase de histologie tumorală de mai sus. Pentru a fi clasificat ca o tumoare mixtă, tipul minor trebuie să reprezinte mai mult de 10% din tumoare. Deși carcinoamele mixte pot avea orice combinație de tipuri de celule, cancerele ovariene mixte sunt de obicei seroase / endometrioide sau cu celule clare / endometrioide. Tumorile mixte ale celulelor germinale reprezintă aproximativ 25-30% din toate cazurile de cancer ovarian cu celule germinale, cu combinații de disgerminom, tumoare din gălbenuș și / sau teratom imatur. Prognosticul și tratamentul variază în funcție de tipurile de celule componente.
Cancerul ovarian secundar
Cancerul ovarian poate fi, de asemenea, un cancer secundar, rezultatul metastazării unui cancer primar în altă parte a corpului. Aproximativ 7% din cancerele ovariene se datorează metastazelor, în timp ce restul sunt cancere primare. Cancerele primare obișnuite sunt cancerul de sân , de colon , de apendiceal și de stomac (cancerele gastrice primare care se metastazează în ovar se numesc tumori Krukenberg ). Tumorile Krukenberg au celule inelare sigilate și celule mucinoase. Cancerul endometrial și limfoamele pot de asemenea să se metastazeze în ovar.
Tumori limită
Tumorile limită ovariană , numite uneori tumori ovariene cu potențial malign scăzut (LMP), au unele caracteristici benigne și unele maligne. Tumorile LMP reprezintă aproximativ 10% -15% din toate tumorile ovariene. Se dezvoltă mai devreme decât cancerul ovarian epitelial, în jurul vârstei de 40-49 de ani. De obicei, nu au invazii extinse; 10% dintre tumorile LMP au zone de microinvazie stromală (<3mm, <5% din tumoră). Tumorile LMP au alte caracteristici anormale, inclusiv mitoza crescută, modificări ale dimensiunii celulei sau dimensiunii nucleului , nuclei anormali , stratificare celulară și proiecții mici asupra celulelor (proiecții papilare). Caracteristicile seroase și / sau mucinoase pot fi observate la examenul histologic, iar histologia seroasă constituie majoritatea covârșitoare a tumorilor LMP avansate. Mai mult de 80% dintre tumorile LMP sunt în stadiul I; 15% sunt în stadiul II și III și mai puțin de 5% sunt în stadiul IV. Implanturile de tumori LMP sunt adesea neinvazive.
Punerea în scenă
Cancerul ovarian este stadializat utilizând sistemul de stadializare FIGO și folosește informațiile obținute după intervenția chirurgicală, care pot include o histerectomie abdominală totală prin laparotomia liniei medii , îndepărtarea (de obicei) a ovarelor și a trompelor uterine , (de obicei) omentul , spălările pelvine (peritoneale) , evaluarea ganglionilor limfatici retroperitoneali (inclusiv ganglionii pelvini și para-aortici ), apendicectomia în tumorile mucinoase suspectate și biopsiile pelvine / peritoneale pentru citopatologie . Aproximativ 30% din cazurile de cancer ovarian care apar limitate la ovar s-au metastazat microscopic, motiv pentru care chiar și cancerele de stadiul I trebuie să fie puse în scenă complet. Se observă că 22% dintre cancerele prezumate a fi stadiul I au metastaze limfatice. Stadiul AJCC este același cu stadiul FIGO. Sistemul de stadializare AJCC descrie amploarea tumorii primare (T), absența sau prezența metastazelor la ganglionii limfatici din apropiere (N) și absența sau prezența metastazei la distanță (M). Cea mai frecventă etapă a diagnosticului este stadiul IIIc, cu peste 70% din diagnostice.
FIGO
| Etapă | Descriere | |||
|---|---|---|---|---|
| Eu | Cancerul este complet limitat la ovar | |||
| in absenta | implică un ovar, capsulă intactă, fără tumoră pe suprafața ovariană, spălări negative | |||
| IB | implică ambele ovare; capsulă intactă; nici o tumoare pe suprafața ovariană; spălări negative | |||
| IC | tumora implică unul sau ambele ovare | |||
| IC1 | deversare chirurgicală | |||
| IC2 | capsula s-a rupt sau tumoră pe suprafața ovariană | |||
| IC3 | ascită sau spălări pozitive | |||
| II | extensia pelviană a tumorii (trebuie limitată la pelvis) sau tumora peritoneală primară, implică unul sau ambele ovare | |||
| IIA | tumoră găsită pe uter sau trompele uterine | |||
| IIB | tumoră în altă parte a pelvisului | |||
| III | cancerul găsit în afara pelvisului sau în ganglionii retroperitoneali, implică unul sau ambele ovare | |||
| IIIA | metastaze în ganglionii limfatici retroperitoneali sau metastaze microscopice extrapelvice | |||
| IIIA1 | metastaze în ganglionii limfatici retroperitoneali | |||
| IIIA1 (i) | metastaza are un diametru mai mic de 10 mm | |||
| IIIA1 (ii) | metastaza are un diametru mai mare de 10 mm | |||
| IIIA2 | metastază microscopică în peritoneu, indiferent de starea ganglionilor limfatici retroperitoneali | |||
| IIIB | metastază în peritoneu mai mică sau egală cu 2 cm în diametru, indiferent de starea ganglionilor limfatici retroperitoneali; sau metastazare la ficat sau splină capsulă | |||
| IIIC | metastază în peritoneu mai mare de 2 cm în diametru, indiferent de starea ganglionilor limfatici retroperitoneali; sau metastaze la ficat sau la capsula splinei | |||
| IV | metastază la distanță (adică în afara peritoneului) | |||
| IVA | revărsat pleural care conține celule canceroase | |||
| IVB | metastaze la organele îndepărtate (inclusiv parenchimul splinei sau ficatului) sau metastaze la ganglionii limfatici inghinali și extra-abdominali |
AJCC / TNM
Sistemul de stadializare AJCC / TNM indică locul în care s-a dezvoltat tumora, s-a răspândit la ganglioni limfatici și metastaze.
| Etapă | Descriere | ||
|---|---|---|---|
| T | Tumora primară | ||
| Tx | Nu poate fi evaluat | ||
| T0 | Nici o dovadă | ||
| T1 | Tumora limitată la ovar / ovare | ||
| T1a | Un ovar cu capsulă intactă, fără tumoră de suprafață și ascite negative / spălări peritoneale | ||
| T1b | Ambele ovare cu capsule intacte, fără tumoră de suprafață, și ascite negative / spălări peritoneale | ||
| T1c | Unul sau ambele ovare cu capsulă sau capsule rupte, tumoare de suprafață, ascită pozitivă / spălări peritoneale | ||
| T2 | Tumora se află în ovare și pelvis (extensie sau implantare) | ||
| T2a | Expansiunea la uter sau trompele uterine, ascita negativă / spălări peritoneale | ||
| T2b | Extindere în alte țesuturi pelvine, ascită negativă / spălări peritoneale | ||
| T2c | Extinderea la orice țesut pelvian, ascită pozitivă / spălări peritoneale | ||
| T3 | Tumora se află în ovare și s-a metastazat în afara pelvisului către peritoneu (inclusiv capsula hepatică) | ||
| T3a | Metastaze microscopice | ||
| T3b | Metastaze macroscopice cu diametrul mai mic de 2 cm | ||
| T3c | Metastaze macroscopice cu un diametru mai mare de 2 cm | ||
| N | Metastaze regionale ale ganglionilor limfatici | ||
| Nx | Nu poate fi evaluat | ||
| N0 | Fără metastaze | ||
| N1 | Metastază prezentă | ||
| M | Metastaze la distanță | ||
| M0 | Fără metastaze | ||
| M1 | Metastaze prezente (cu excepția capsulei hepatice, inclusiv parenchimul hepatic și revărsatul pleural confirmat citologic) |
Etapele AJCC / TNM pot fi corelate cu etapele FIGO:
| FIGO | T | N | M |
|---|---|---|---|
| Eu | T1 | N0 | M0 |
| in absenta | T1a | N0 | M0 |
| IB | T1b | N0 | M0 |
| IC | T1c | N0 | M0 |
| II | T2 | N0 | M0 |
| IIA | T2a | N0 | M0 |
| IIB | T2b | N0 | M0 |
| IIC | T2c | N0 | M0 |
| III | T3 | N0 | M0 |
| IIIA | T3a | N0 | M0 |
| IIIB | T3b | N0 | M0 |
| IIIC | T3c | N0 / N1 | M0 |
| IV | Orice | Orice | M1 |
Gradare
Tumorile de gradul 1 au celule bine diferențiate (arată foarte asemănător cu țesutul normal) și sunt cele cu cel mai bun prognostic. Tumorile de gradul 2 sunt, de asemenea, numite moderat bine diferențiate și sunt formate din celule care seamănă cu țesutul normal. Tumorile de gradul 3 au cel mai prost prognostic, iar celulele lor sunt anormale, denumite slab diferențiate.
Metastaza în cancerul ovarian este foarte frecventă în abdomen și are loc prin exfoliere, unde celulele canceroase izbucnesc prin capsula ovariană și sunt capabile să se deplaseze liber în întreaga cavitate peritoneală. Metastazele cancerului ovarian cresc de obicei pe suprafața organelor, mai degrabă decât în interior; sunt frecvente și pe oment și pe căptușeala peritoneală. Celulele canceroase pot călători, de asemenea, prin sistemul limfatic și se pot metastaza la ganglionii limfatici conectați la ovare prin intermediul vaselor de sânge; adică ganglionii limfatici de-a lungul ligamentului infundibulopelvic , al ligamentului larg și al ligamentului rotund . Grupurile cel mai frecvent afectate includ paraaortic , hipogastric , iliac extern , obturator și ganglionii limfatici inghinali . De obicei, cancerul ovarian nu metastazează ficatul, plămânul, creierul sau rinichii decât dacă este o boală recurentă; acest lucru diferențiază cancerul ovarian de multe alte forme de cancer.
Prevenirea
Persoanele cu risc genetic puternic de cancer ovarian pot considera îndepărtarea chirurgicală a ovarelor ca o măsură preventivă. Acest lucru se face adesea după terminarea anilor fertili. Acest lucru reduce șansele de a dezvolta atât cancer la sân (cu aproximativ 50%), cât și cancer ovarian (cu aproximativ 96%) la persoanele cu risc crescut. Femeilor cu mutații genice BRCA li se elimină, de obicei, trompele uterine în același timp (salpingo-ooforectomie), deoarece au și un risc crescut de cancer al trompei uterine . Cu toate acestea, aceste statistici pot supraestima reducerea riscului din cauza modului în care au fost studiate.
Persoanele cu antecedente familiale semnificative de cancer ovarian sunt adesea îndrumați către un consilier genetic pentru a vedea dacă testarea mutațiilor BRCA ar fi benefică. Utilizarea contraceptivelor orale, absența „perioadelor” în timpul ciclului menstrual și ligarea tuburilor reduc riscul. Poate exista o asociere între dezvoltarea cancerului ovarian și stimularea ovariană în timpul tratamentelor pentru infertilitate. Endometrioza a fost legată de cancerele ovariene. Infecția cu virusul papilomului uman , fumatul și talcul nu au fost identificate ca crescând riscul de a dezvolta cancer ovarian.
Screening
Nu există o modalitate simplă și fiabilă de a testa cancerul ovarian la femeile care nu prezintă semne sau simptome. Screeningul nu este recomandat la femeile cu risc mediu, deoarece dovezile nu susțin o reducere a decesului și rata ridicată a testelor fals pozitive poate duce la intervenții chirurgicale inutile, care este însoțită de propriile riscuri. Testul Papanicolau nu depistează cancerul ovarian.
Cancerul ovarian este de obicei palpabil doar în stadii avansate. Screeningul nu este recomandat folosind măsurători CA-125 , niveluri HE4 , ultrasunete sau palpare anexă la femeile cu risc mediu. Riscul de a dezvolta cancer ovarian la cei cu factori genetici poate fi redus. Cei cu predispoziție genetică pot beneficia de screening. Acest grup cu risc ridicat a beneficiat de detectarea mai devreme.
Cancerul ovarian are o prevalență scăzută, chiar și în grupul cu risc ridicat al femeilor cu vârste cuprinse între 50 și 60 de ani (aproximativ unul în 2000), iar screening-ul femeilor cu risc mediu este mai probabil să dea rezultate ambigue decât să detecteze o problemă care necesită tratament . Deoarece rezultatele ambigue sunt mai probabile decât detectarea unei probleme tratabile și deoarece răspunsul obișnuit la rezultatele ambigue sunt intervențiile invazive, la femeile cu risc mediu, potențialele prejudicii ale screening-ului fără indicații depășesc potențialele beneficii. Scopul screeningului este de a diagnostica cancerul ovarian într-un stadiu incipient, când este mai probabil să fie tratat cu succes.
Screeningul cu ultrasunete transvaginale , examinarea pelviană și nivelurile de CA-125 pot fi utilizate în locul intervenției chirurgicale preventive la femeile care au mutații BRCA1 sau BRCA2. Această strategie a demonstrat un anumit succes.
Screeningul pentru CA125, o substanță chimică eliberată de tumorile ovariene, cu urmărire cu ultrasunete, s-a dovedit a fi ineficientă în reducerea mortalității într-un studiu la scară largă din Marea Britanie.
Management
Odată ce s-a stabilit că există cancer ovarian, trompă uterină sau peritoneală primară, tratamentul este programat de un oncolog ginecologic (un medic instruit pentru tratarea cancerelor sistemului reproductiv al unei femei). Oncologii ginecologici pot efectua intervenții chirurgicale și pot oferi chimioterapie femeilor cu cancer ovarian. Se elaborează un plan de tratament.
Tratamentul implică, de obicei, intervenții chirurgicale și chimioterapie și , uneori , radioterapie , indiferent de subtipul cancerului ovarian. Tratamentul chirurgical poate fi suficient pentru tumorile maligne bine diferențiate și limitat la ovar. Adăugarea chimioterapiei poate fi necesară pentru tumorile mai agresive limitate la ovar. Pentru pacienții cu boală avansată, o combinație de reducere chirurgicală cu un regim combinat de chimioterapie este standard. Din 1980, medicamentele pe bază de platină au avut un rol important în tratarea cancerului ovarian. Tumorile limită , chiar și după răspândirea în afara ovarului, sunt gestionate bine cu o intervenție chirurgicală, iar chimioterapia nu este văzută ca fiind utilă. Nu s-a demonstrat că chirurgia cu aspect secundar și chimioterapia de întreținere oferă beneficii.
Interventie chirurgicala
Chirurgia a fost standardul de îngrijire de zeci de ani și poate fi necesară pentru obținerea unui specimen pentru diagnostic . Operația depinde de amploarea invaziei apropiate a altor țesuturi de către cancer atunci când este diagnosticat. Această măsură a cancerului este descrisă atribuindu-i o etapă, tipul presupus și gradul de cancer. Chirurgul ginecologic poate elimina una (ooforectomia unilaterală) sau ambele ovare (ooforectomia bilaterală). Trompele uterine (salpingectomia), uterul (histerectomia) și omentul (omentectomia) pot fi, de asemenea, îndepărtate. De obicei, toate aceste organe sunt îndepărtate.
Pentru cancerele de stadiu IA unilaterale de grad scăzut, vor fi îndepărtate numai ovarul implicat (care trebuie să fie neîntrerupt) și trompa uterină. Acest lucru se poate face în special la tinerii care doresc să-și păstreze fertilitatea. Cu toate acestea, există un risc de metastaze microscopice și stadializarea trebuie finalizată. Dacă se constată metastaze, este necesară o a doua intervenție chirurgicală pentru îndepărtarea ovarului și uterului rămas. Acidul tranexamic poate fi administrat înainte de operație pentru a reduce necesitatea transfuziilor de sânge din cauza pierderii de sânge în timpul intervenției chirurgicale.
Dacă se constată că o tumoare la o femeie premenopauză este o tumoare cu potențial malign scăzut în timpul intervenției chirurgicale și este în mod clar cancer în stadiul I, numai ovarul afectat este îndepărtat. Pentru femeile aflate în postmenopauză, cu tumori cu potențial malign scăzut, histerectomia cu salpingo-ooforectomie bilaterală este în continuare opțiunea preferată. În timpul etapizării, apendicele poate fi examinat sau eliminat. Acest lucru este deosebit de important în cazul tumorilor mucinoase. La copii sau adolescenți cu cancer ovarian, chirurgii încearcă de obicei să păstreze un ovar pentru a permite finalizarea pubertății , dar dacă cancerul s-a răspândit, acest lucru nu este întotdeauna posibil. Disgerminoamele, în special, tind să afecteze ambele ovare: 8-15% din disgerminoamele sunt prezente în ambele ovare. Persoanele cu tumori de grad scăzut (bine diferențiate) sunt tratate de obicei numai cu o intervenție chirurgicală, care este adesea curativă. În general, tumorile cu celule germinale pot fi tratate cu intervenții chirurgicale unilaterale, cu excepția cazului în care cancerul este răspândit sau fertilitatea nu este un factor. La femeile cu cancer ovarian epitelial avansat în stadiu chirurgical (stadiile III și IV), studiile sugerează că trebuie făcute toate încercările de a ajunge la citoreducție completă (eforturi chirurgicale pentru a elimina cea mai mare parte a tumorii).
În cazurile de cancer avansat, în cazul în care îndepărtarea completă nu este o opțiune, cât mai multă tumoră posibil este îndepărtată într-o procedură numită operație de debulking . Această intervenție chirurgicală nu are întotdeauna succes și este mai puțin probabil să aibă succes la femeile cu metastaze extinse în peritoneu, boala în stadiul IV, cancer în fisura transversă a ficatului , mezenter sau diafragmă și zone mari de ascită. Operația de dezmembrare se face de obicei o singură dată. Tomografia computerizată (CT abdominală) este adesea utilizată pentru a evalua dacă este posibilă o intervenție chirurgicală primară de debulking, dar dovezile de certitudine scăzută sugerează, de asemenea, că PET / CT fluorodeoxiglucoză-18 (FDG) și RM pot fi utile ca o adăugare pentru evaluarea debulkingului incomplet macroscopic. Dezvăluirea mai completă este asociată cu rezultate mai bune: femeile fără dovezi macroscopice de boală după dezvăluire au o supraviețuire mediană de 39 de luni, spre deosebire de 17 luni cu o intervenție chirurgicală mai puțin completă. Prin îndepărtarea metastazelor, multe celule rezistente la chimioterapie sunt îndepărtate și orice grupuri de celule care au murit sunt, de asemenea, eliminate. Acest lucru permite chimioterapiei să ajungă mai bine la celulele canceroase rămase, care sunt mai susceptibile de a fi în creștere rapidă și, prin urmare, chimiosensibile.
Intervenția chirurgicală de debulking este un alt protocol utilizat, unde se administrează chimioterapie neoadjuvantă, se efectuează o intervenție chirurgicală de debulking, iar chimioterapia este terminată după debulking. Deși nu au fost finalizate studii definitive, se arată că este aproximativ echivalent cu intervenția chirurgicală primară de debulking în ceea ce privește supraviețuirea și prezintă o morbiditate ușor mai mică.
Există mai multe proceduri chirurgicale diferite care pot fi utilizate pentru tratarea cancerului ovarian. Pentru cancerul în stadiile I și II, se poate utiliza o intervenție chirurgicală laparoscopică (gaură de cheie), dar este posibil să nu se găsească metastaze. Pentru cancerul avansat, laparoscopia nu este utilizată, deoarece metastazele dezvăluite necesită acces la întreaga cavitate peritoneală. În funcție de amploarea cancerului, procedurile pot include o salpingo-ooforectomie bilaterală, biopsii pe tot peritoneul și sistemul limfatic abdominal, omentectomie , splenectomie , rezecție intestinală , dezlipirea sau rezecția diafragmei , apendectomie sau chiar o exenterație pelviană posterioară .
Pentru a stadi complet cancerul ovarian, limfadenectomia poate fi inclusă în operație, dar este posibil să nu se întâmple un beneficiu semnificativ de supraviețuire pentru această practică. Acest lucru este deosebit de important în tumorile cu celule germinale, deoarece acestea se metastazează frecvent la ganglionii limfatici din apropiere.
Dacă cancerul ovarian reapare, chirurgia secundară este uneori o opțiune de tratament. Acest lucru depinde de cât de ușor poate fi eliminată tumoarea, de cât de mult lichid s-a acumulat în abdomen și de starea generală de sănătate. Eficiența acestei intervenții chirurgicale depinde de tehnica chirurgicală, de integritatea citoreducției și de amploarea bolii. De asemenea, poate fi util la persoanele cărora li s-a efectuat prima intervenție chirurgicală de către un generalist și la cancerul ovarian epitelial. Chirurgia secundară poate fi eficientă în disgerminoame și teratoame imature. Dovezile sugerează că intervenția chirurgicală în cancerul ovarian epitelial recurent poate fi asociată cu prelungirea vieții la unele femei cu boală sensibilă la platină.
Efectul secundar major al oforectomiei la femeile mai tinere este menopauza timpurie , care poate provoca osteoporoză . După operație, se poate lua în considerare terapia de substituție hormonală, în special la femeile mai tinere. Această terapie poate consta dintr-o combinație de estrogen și progesteron sau estrogen singur. Estrogenul singur este sigur după histerectomie; când uterul este încă prezent, estrogenul fără opoziție crește dramatic riscul de cancer endometrial . Terapia cu estrogeni după operație nu modifică ratele de supraviețuire. Persoanele care suferă o intervenție chirurgicală de cancer ovarian sunt de obicei spitalizate ulterior timp de 3-4 zile și petrec aproximativ o lună recuperându-se acasă. Rezultatele chirurgicale sunt cele mai bune la spitalele care fac un număr mare de intervenții chirurgicale pentru cancerul ovarian.
Nu este clar dacă laparoscopia sau laparotomia sunt mai bune sau mai rele pentru cancerul ovarian în stadiul FIGO I. De asemenea, nu există nicio diferență aparentă între histerectomia abdominală totală și histerectomia supracervicală pentru cancerele avansate. Aproximativ 2,8% dintre persoanele care au efectuat o primă intervenție chirurgicală pentru cancer ovarian avansat mor în decurs de două săptămâni de la intervenție ( rata de mortalitate perioperatorie de 2,8% ). Operații mai agresive sunt asociate cu rezultate mai bune în cancerul ovarian avansat (stadiul III sau IV).
Chimioterapie
Chimioterapia a fost un standard general de îngrijire pentru cancerul ovarian de zeci de ani, deși cu protocoale variabile. Chimioterapia este utilizată după operație pentru a trata orice boală reziduală, dacă este cazul. În unele cazuri, pot exista motive pentru a efectua mai întâi chimioterapia, urmată de o intervenție chirurgicală. Aceasta se numește „chimioterapie neoadjuvantă” și este obișnuită atunci când o tumoare nu poate fi complet îndepărtată sau descompusă în mod optim prin intervenție chirurgicală. Deși nu s-a demonstrat că crește supraviețuirea, poate reduce riscul de complicații după operație. Dacă se efectuează o salpingo-ooforectomie unilaterală sau altă intervenție chirurgicală, se poate administra chimioterapie suplimentară, numită „chimioterapie adjuvantă”. Chimioterapia adjuvantă este utilizată în cancerul în stadiul 1, în mod obișnuit, dacă tumora are un grad histologic ridicat (gradul 3) sau cel mai înalt stadiu (stadiul 1c), cu condiția ca cancerul să fie optimizat în timpul intervenției chirurgicale. Bevacizumab poate fi utilizat ca chimioterapie adjuvantă dacă tumora nu este complet îndepărtată în timpul intervenției chirurgicale sau dacă cancerul este în stadiul IV; poate extinde supraviețuirea fără progresie, dar nu sa demonstrat că extinde supraviețuirea generală. Chimioterapia este curativă în aproximativ 20% din cancerele ovariene avansate; este mai des curativ cu tumorile maligne ale celulelor germinale decât tumorile epiteliale. Sa constatat că chimioterapia adjuvantă îmbunătățește supraviețuirea și reduce riscul de apariție a cancerului ovarian în comparație cu terapia fără adjuvant la femeile cu cancer ovarian epitelial în stadiu incipient.
Chimioterapia în cancerul ovarian constă de obicei din platine , un grup de medicamente pe bază de platină , combinate cu non-platine. Medicamentele pe bază de platină sunt utilizate din 1980. Terapiile obișnuite pot include paclitaxel , cisplatină , topotecan , doxorubicină, epirubicină și gemcitabină . Carboplatina este administrată în mod obișnuit în combinație cu paclitaxel sau docetaxel ; combinația tipică este carboplatina cu paclitaxel. Carboplatinul este superior cisplatinei, deoarece este mai puțin toxic și are mai puține efecte secundare, permițând în general o calitate a vieții îmbunătățită în comparație, deși ambele sunt la fel de eficiente. Nu s-a constatat că trei regimuri medicamentoase sunt mai eficiente, iar platinele singure sau nonplatine singure sunt mai puțin eficiente decât platinele și nonplatinele în combinație. Există un mic beneficiu în chimioterapia pe bază de platină, comparativ cu terapia non-platină. Combinațiile de platină pot oferi o supraviețuire îmbunătățită față de o singură platină. La persoanele cu cancer ovarian recidivat, dovezile sugerează că topotecanul are un efect similar asupra supraviețuirii generale ca paclitaxel și topotecan plus talidomidă, în timp ce este superior treosulfanului și nu este la fel de eficient ca doxorubicina lipozomală pegilată la persoanele sensibile la platină.
Chimioterapia poate fi administrată intravenos sau în cavitatea peritoneală . Deși chimioterapia intraperitoneală este asociată cu supraviețuirea mai lungă fără progresie și supraviețuirea generală, provoacă, de asemenea, mai multe efecte secundare adverse decât chimioterapia intravenoasă. Este utilizat în principal atunci când cancerul a fost decolorat în mod optim. Chimioterapia intraperitoneală poate fi extrem de eficientă, deoarece cancerul ovarian se răspândește în principal în cavitatea peritoneală, iar dozele mai mari de medicamente pot ajunge la tumori în acest fel.
Chimioterapia poate provoca anemie ; s-a constatat că fierul intravenos este mai eficient decât suplimentele de fier pe cale orală în reducerea necesității transfuziilor de sânge . Ciclurile tipice de tratament implică un tratament la fiecare 3 săptămâni, repetat timp de 6 săptămâni sau mai mult. Mai puțin de 6 săptămâni (cicluri) de tratament este mai puțin eficient decât 6 săptămâni sau mai mult. Tumorile maligne ale celulelor germinale sunt tratate diferit față de alte tipuri de cancer ovarian - se utilizează un regim de bleomicină , etopozidă și cisplatină (BEP) cu 5 zile de chimioterapie administrate la fiecare 3 săptămâni timp de 3 până la 4 cicluri. Chimioterapia pentru tumorile celulelor germinale nu s-a dovedit a provoca amenoree , infertilitate, malformații congenitale sau avort spontan . Chimioterapia de întreținere nu s-a dovedit a fi eficientă.
La persoanele cu mutații BRCA , chimioterapia cu platină este mai eficientă. Tumorile cu celule germinale și tumorile maligne ale cordonului sexual / stromului sunt tratate cu chimioterapie, deși disgerminoamele și tumorile cordonului sexual nu sunt de obicei foarte receptive.
Sensibil la platină sau rezistent la platină
Dacă cancerul ovarian reapare, este considerat parțial sensibil la platină sau rezistent la platină, pe baza timpului de la ultima recurență tratat cu platine: cancerele parțial sensibile la platină au reapărut la 6-12 luni după ultimul tratament, iar cancerele rezistente la platină au o interval mai mic de 6 luni. Chimioterapia de linia a doua poate fi administrată după ce cancerul devine simptomatic, deoarece nu se observă nicio diferență de supraviețuire între tratamentul recidivelor asimptomatice (CA-125 crescute) și simptomatice.
Pentru tumorile sensibile la platină, platinele sunt medicamentele alese pentru chimioterapia de linia a doua, în combinație cu alți agenți citotoxici. Regimurile includ carboplatină combinată cu doxorubicină lipozomală pegilată , gemcitabină sau paclitaxel . Terapia cu carboplatină-dublet poate fi combinată cu paclitaxel pentru o eficacitate crescută în unele cazuri. O altă terapie adjuvantă potențială pentru recurențele sensibile la platină este olaparibul , care poate îmbunătăți supraviețuirea fără progresie, dar nu sa demonstrat că îmbunătățește supraviețuirea generală . ( Olaparib , un inhibitor PARP , a fost aprobat de FDA din SUA pentru utilizarea în cancerul ovarian asociat BRCA care fusese tratat anterior cu chimioterapie.) Pentru tumorile recurente cu celule germinale, încă 4 cicluri de chimioterapie BEP reprezintă tratamentul de primă linie pentru cei care au fost tratați cu intervenții chirurgicale sau cu platine.
Dacă se determină că tumoarea este rezistentă la platină, vincristina , dactinomicina și ciclofosfamida (VAC) sau o combinație de paclitaxel, gemcitabină și oxaliplatină pot fi utilizate ca terapie de linia a doua.
Pentru tumorile rezistente la platină, nu există opțiuni de chimioterapie cu eficiență ridicată. Regimurile cu un singur medicament (doxorubicină sau topotecan ) nu au rate de răspuns ridicate, dar regimurile cu un singur medicament de topotecan, doxorubicină lipozomală pegilată sau gemcitabină sunt utilizate în unele cazuri. Topotecanul nu poate fi utilizat la persoanele cu blocaj intestinal. Paclitaxel utilizat singur este un alt regim posibil sau poate fi combinat cu doxorubicină lipozomală, gemcitabină, cisplatină, topotecan, etopozidă sau ciclofosfamidă . (A se vedea mai jos îngrijirea paliativă.)
Se dezvoltă noi agenți pentru a inhiba dezvoltarea de noi vase de sânge (angiogeneză) pentru femeile cu cancer ovarian care dezvoltă rezistență la medicamente chimioterapice. Începând cu 2011 sunt disponibile doar rezultate preliminare.
Terapie cu radiatii
Disgerminoamele sunt tratate cel mai eficient cu radiații, deși acest lucru poate provoca infertilitate și este eliminat treptat în favoarea chimioterapiei. Radioterapia nu îmbunătățește supraviețuirea la persoanele cu tumori bine diferențiate.
În stadiile de cancer 1c și 2, radioterapia este utilizată după intervenția chirurgicală dacă există posibilitatea unei boli reziduale în pelvis, dar abdomenul este lipsit de cancer. Radioterapia poate fi utilizată și în îngrijirea paliativă a cancerelor avansate. Un curs tipic de radioterapie pentru cancerul ovarian este de 5 zile pe săptămână timp de 3-4 săptămâni. Efectele secundare frecvente ale radioterapiei includ diaree, constipație și urinare frecventă.
Terapia hormonală
În ciuda faptului că 60% din tumorile ovariene au receptori de estrogen , cancerul ovarian răspunde rar la tratamentele hormonale. O analiză Cochrane a constatat o lipsă de dovezi cu privire la efectele tamoxifenului la persoanele cu cancer ovarian recidivant. Estrogenul singur nu are efect asupra cancerului, iar tamoxifenul și letrozolul sunt rareori eficiente. Unele femei cu cancer ovarian malign la limita si cancerul ovarian stromal pot primi terapie hormonala.
Imunoterapie
Imunoterapia este un subiect al cercetărilor actuale în cancerul ovarian. În unele cazuri, medicamentul anticorp bevacizumab , deși este încă un subiect de cercetare activă, este utilizat pentru a trata cancerul avansat împreună cu chimioterapia. A fost aprobat pentru această utilizare în Uniunea Europeană.
Urmare
Urmărirea specifică depinde, de exemplu, de tipul și stadiul cancerului ovarian, de tratament și de prezența oricăror simptome. De obicei, o întâlnire de control se face aproximativ la fiecare 2 până la 3 luni inițial, urmată de două ori pe an timp de până la 5 ani. Pentru cancerele ovariene epiteliale, cel mai frecvent test la urmărire este nivelul CA-125. Cu toate acestea, tratamentul bazat doar pe niveluri crescute de CA-125 și nu pe orice simptome poate crește efectele secundare fără nicio prelungire a vieții, astfel încât implicația rezultatului unui test CA-125 poate fi discutată înainte de a-l lua. Recomandarea din 2014 este că cancerul recurent poate fi prezent dacă nivelul CA-125 este de două ori normal. Tratarea unei recurențe detectate de CA-125 nu îmbunătățește supraviețuirea.
Pentru femeile cu tumori cu celule germinale , testele de urmărire includ în general alfa-fetoproteina (AFP) și / sau gonadotropina corionică umană . Pentru femeile cu cancer de strom , testele pentru hormoni precum estrogenul, testosteronul și inhibina sunt uneori utile. Inhibina poate fi, de asemenea, utilă pentru monitorizarea progresului tumorilor din cordonul sexual, împreună cu substanța inhibitoare mulleriană . AFP poate fi, de asemenea, utilizat pentru a monitoriza tumorile Sertoli-Leydig. În disgerminoame, lactatul dehidrogenază și cele două izozime ale acestuia ( LDH-1 și LDH-2 ) sunt utilizate pentru a testa recurența.
Este posibil ca femeile cu cancer ovarian să nu aibă nevoie de imagini de supraveghere de rutină pentru a monitoriza cancerul, cu excepția cazului în care apar noi simptome sau dacă markerii tumorali încep să crească. Imagistica fără aceste indicații este descurajată, deoarece este puțin probabil să detecteze o recurență, să îmbunătățească supraviețuirea și pentru că are propriile costuri și efecte secundare. Cu toate acestea, imagistica CT poate fi utilizată dacă se dorește, deși acest lucru nu este comun. Dacă o tumoră este ușor de imaginat, imagistica poate fi utilizată pentru a monitoriza progresul tratamentului.
Îngrijire paliativă
Îngrijirea paliativă se concentrează pe ameliorarea simptomelor și creșterea sau menținerea calității vieții. Scopul acestui tip de tratament nu este de a vindeca cancerul, ci de a face femeia mai confortabilă în timp ce trăiește cu cancer care nu poate fi vindecat. A fost recomandat ca parte a planului de tratament pentru orice persoană cu cancer ovarian avansat sau pacienți cu simptome semnificative. În cazurile refractare la platină și rezistente la platină, alte chimioterapii paliative sunt tratamentul principal.
Îngrijirea paliativă poate implica tratamentul simptomelor și complicațiilor cancerului, inclusiv durere, greață, constipație, ascită, obstrucție intestinală , edem , revărsat pleural și mucozită . Mai ales dacă cancerul avansează și devine incurabil, tratamentul simptomelor devine unul dintre obiectivele principale ale terapiei. Îngrijirea paliativă poate implica, de asemenea, ajutarea la luarea deciziilor, cum ar fi dacă sau când îngrijirea hospice este adecvată și locul preferat pentru pacient la sfârșitul îngrijirii vieții.
Obstrucția intestinului poate fi tratată cu intervenții chirurgicale paliative ( colostomie , ileostomie sau bypass intern) sau medicamente, dar s-a demonstrat că intervenția chirurgicală crește timpul de supraviețuire. Chirurgia paliativă poate avea ca rezultat sindromul intestinului scurt , fistula enterocutanată sau reobstrucție; sau poate să nu fie posibil din cauza gradului de obstrucție. Alte tratamente ale complicațiilor pot include nutriție parenterală totală , o dietă cu reziduuri scăzute , gastrostomie paliativă și un control adecvat al durerii. Obstrucția intestinului poate fi tratată și cu octreotidă atunci când chirurgia paliativă nu este o opțiune. Cancerul poate bloca, de asemenea, ureterele , care pot fi ameliorate printr-o nefrostomie sau un stent ureteric . Ascita poate fi ameliorată prin paracenteza repetată sau prin plasarea unui canal de scurgere pentru a spori confortul. Revărsările pleurale pot fi tratate în mod similar, cu toracenteză repetată , pleurodeză sau plasarea unui dren.
Radioterapia poate fi utilizată ca parte a îngrijirii paliative a cancerului ovarian avansat, deoarece poate ajuta la micșorarea tumorilor care cauzează simptome. Radioterapia paliativă durează de obicei doar câteva tratamente, un curs de terapie mult mai scurt decât radioterapia non-paliativă. Este, de asemenea, utilizat pentru paliația tumorilor cu celule germinale rezistente la chimioterapie.
Îngrijirea psihosocială
Cancerul ovarian are un efect semnificativ asupra calității vieții , a sănătății psihologice și a bunăstării. Sunt disponibile intervenții pentru a vă ajuta cu nevoile și sprijinul social. Mulți supraviețuitori ai cancerului ovarian raportează o bună calitate a vieții și optimism . Alții au raportat o „schimbare spirituală” care i-a ajutat să găsească sens în timpul experienței lor. Alții și-au descris pierderea credinței după diagnosticul de cancer ovarian. Cei care au trecut prin tratament experimentează uneori izolarea socială, dar beneficiază de relațiile cu alți supraviețuitori. Frustrarea și vinovăția au fost descrise de unii care și-au exprimat incapacitatea de a-și îngriji familia.
Stima de sine și modificările imaginii corpului pot apărea din cauza căderii părului , îndepărtarea ovarelor și a altor structuri de reproducere și cicatrici . Există unele îmbunătățiri după creșterea părului. Se pot dezvolta probleme sexuale. Îndepărtarea ovarelor are ca rezultat menopauză indusă chirurgical, care poate duce la contact sexual dureros , uscăciune vaginală, pierderea dorinței sexuale și oboseală. Deși prognosticul este mai bun pentru supraviețuitorii mai tineri, impactul asupra sexualității poate fi încă substanțial.
Anxietatea , depresia și suferința sunt prezente la cei care au supraviețuit cancerului ovarian la rate mai mari decât la populația generală. Aceleași probleme psihosociale se pot dezvolta și la membrii familiei. Efectele emoționale pot include frica de moarte , tristețe , probleme de memorie și dificultăți de concentrare. Atunci când cei de la începutul tratamentului au adoptat optimismul, au fost mai puțin predispuși să dezvolte suferință. Cei care se tem de cancerul recidivant pot avea dificultăți în exprimarea bucuriei chiar și atunci când nu prezintă boli. Cu cât o femeie suferă mai multe tratamente, cu atât este mai probabilă pierderea speranței . Femeile adesea pot face față și reduce efectele psihosociale negative printr-o serie de strategii. Activități precum călătoriile, petrecerea timpului suplimentar cu familia și prietenii, ignorarea statisticilor , jurnalizarea și implicarea crescândă în evenimente bazate pe spirit sunt adaptative.
Femeile cu cancer ovarian pot întâmpina dificultăți în alimentație și sunt expuse riscului de malnutriție.
Prognoză
Cancerul ovarian are de obicei un prognostic relativ slab . Este disproporționat de mortal, deoarece nu are nici un test clar de depistare timpurie sau de screening, ceea ce înseamnă că majoritatea cazurilor nu sunt diagnosticate până când nu au atins stadii avansate.
Cancerul ovarian se metastazează la începutul dezvoltării sale, de multe ori înainte de a fi diagnosticat. Tumorile de grad înalt metastazează mai ușor decât tumorile de grad scăzut. De obicei, celulele tumorale încep să se metastazeze prin creșterea în cavitatea peritoneală. Peste 60% dintre femeile care prezintă cancer ovarian au cancer în stadiul III sau în stadiul IV, când acesta s-a răspândit deja dincolo de ovare. Cancerele ovariene aruncă celule în fluidul natural din cavitatea abdominală. Aceste celule pot fi apoi implantate pe alte structuri abdominale (peritoneale), inclusiv uterul, vezica urinară , intestinul , mucoasa peretelui intestinal și omentul , formând noi creșteri tumorale înainte ca cancerul să fie chiar suspectat.
Rata de supraviețuire pe cinci ani pentru toate etapele cancerului ovarian este de 46%; rata de supraviețuire la un an este de 72%, iar rata de supraviețuire la zece ani este de 35%. Pentru cazurile în care diagnosticul se face la începutul bolii, când cancerul este încă limitat la locul primar, rata de supraviețuire pe cinci ani este de 92,7%. Aproximativ 70% dintre femeile cu boală avansată răspund la tratamentul inițial, dintre care majoritatea ating remisiunea completă, dar jumătate dintre aceste femei au o recurență la 1-4 ani după tratament. Metastaza cerebrală este mai frecventă în cancerul în stadiul III / IV, dar poate să apară în continuare în cazurile de cancer în stadiu I / II. Persoanele cu metastaze cerebrale supraviețuiesc o mediană de 8,2 luni, deși intervenția chirurgicală, chimioterapia și radioterapia creierului întreg pot îmbunătăți supraviețuirea.
Supraviețuirea cancerului ovarian variază semnificativ în funcție de subtip. Disgerminoamele au un prognostic foarte favorabil. În stadiile incipiente, au o rată de supraviețuire pe cinci ani de 96,9%. Aproximativ două treimi din disgerminoame sunt diagnosticate în stadiul I. Disgerminoamele în stadiul III au o supraviețuire de cinci ani de 61%; când sunt tratați cu chimioterapie BEP după îndepărtarea chirurgicală incompletă, disgerminoamele au o rată de supraviețuire de 95% pe doi ani. Malignitățile sex-cordon-stromal au, de asemenea, un prognostic favorabil; deoarece sunt în creștere lentă, chiar și cei cu boli metastatice pot supraviețui un deceniu sau mai mult. Tumorile cu potențial malign scăzut au de obicei un prognostic rău numai atunci când există implanturi tumorale invazive găsite în cavitatea peritoneală.
Complicațiile cancerului ovarian pot include răspândirea cancerului la alte organe, pierderea progresivă a funcției diferitelor organe, ascită și obstrucții intestinale, care pot fi fatale. Obstrucțiile intestinale în mai multe locuri sunt cea mai frecventă cauză de deces. Obstrucția intestinală în cancerul ovarian poate fi fie o adevărată obstrucție, unde tumora blochează lumenul intestinal , fie o pseudo-obstrucție, când tumora previne peristaltismul normal . Acumularea continuă de ascită poate fi tratată prin plasarea unui dren care poate fi autodrenat.
Factori prognostici
Există o serie de factori de prognostic în cancerul ovarian. Factorii prognostici pozitivi - cei care indică șanse mai mari de supraviețuire - nu includ boală reziduală după operație (stadiul III / IV), rezecție macroscopică completă (stadiul IV), mutații BRCA2, vârstă tânără (sub 45 de ani), tip neserios, grad histologic scăzut, stadiu incipient, co-apariție cu cancer endometrial și niveluri scăzute de CA-125. Există dovezi contradictorii pentru BRCA1 ca factor de prognostic. În schimb, factorii de prognostic negativi - cei care indică o șansă mai scăzută de supraviețuire - includ ruperea capsulei ovariene în timpul intervenției chirurgicale, vârsta mai mare (peste 45 de ani), tipul mucinos, stadiul IV, grad histologic ridicat, tip de celule limpezi, afectarea abdominală superioară, niveluri ridicate de CA-125, prezența celulelor tumorale în sânge și ciclooxigenază-2 crescută .
Exprimarea diferiților ARNm poate fi, de asemenea, prognostic pentru cancerul ovarian. Nivelurile ridicate de Drosha și Dicer sunt asociate cu supraviețuirea îmbunătățită, în timp ce nivelurile ridicate de let-7b , HIF1A , EphA1 și poli (ADP-riboză) polimerază sunt asociate cu o supraviețuire mai proastă. Cancerele care sunt pozitive pentru WT1 au un prognostic mai rău; cancerele cu receptori estrogeni pozitivi au un prognostic mai bun.
Ratele de supraviețuire
Ratele globale de supraviețuire la cinci ani pentru toate tipurile de cancer ovarian sunt prezentate mai jos în funcție de stadiu și de gradul histologic:
| Etapă | Supravieţuire |
|---|---|
| Eu | 90-95% |
| II | 70-80% |
| III | 20-50% |
| IV | 1-5% |
| Grad histologic | Supravieţuire |
|---|---|
| Grad scăzut | 88% |
| Grad intermediar | 58% |
| Grad ridicat | 27% |
Ratele de supraviețuire date mai jos sunt pentru diferitele tipuri de cancer ovarian, potrivit Societății Americane de Cancer . Acestea provin de la Institutul Național al Cancerului , SEER, și se bazează pe pacienți diagnosticați între 2004 și 2010.
| Cancerul ovarian epitelial invaziv | |
|---|---|
| Etapă | Rata relativă de supraviețuire pe cinci ani |
| Eu | 90% |
| in absenta | 94% |
| IB | 92% |
| IC | 85% |
| II | 70% |
| IIA | 78% |
| IIB | 73% |
| III | 39% |
| IIIA | 59% |
| IIIB | 52% |
| IIIC | 39% |
| IV | 17% |
| Tumori stromale ovariene | |
|---|---|
| Etapă | Rata relativă de supraviețuire pe cinci ani |
| Eu | 95% |
| II | 78% |
| III | 65% |
| IV | 35% |
| Tumorile cu celule germinale ale ovarului | |
|---|---|
| Etapă | Rata relativă de supraviețuire pe cinci ani |
| Eu | 98% |
| II | 94% |
| III | 87% |
| IV | 69% |
| Carcinomul trompelor uterine | |
|---|---|
| Etapă | Rata relativă de supraviețuire pe cinci ani |
| Eu | 87% |
| II | 86% |
| III | 52% |
| IV | 40% |
| Tumori cu potențial malign scăzut | |
|---|---|
| Etapă | Rata relativă de supraviețuire pe cinci ani |
| Eu | 99% |
| II | 98% |
| III | 96% |
| IV | 77% |
Ratele de recurență
Cancerul ovarian reapare frecvent după tratament. Per total, într-o perioadă de 5 ani, 20% din cancerele în stadiul I și II se repetă. Cele mai multe recidive sunt în abdomen. Dacă apare o recurență în boala avansată, apare de obicei în decurs de 18 luni de la tratamentul inițial (18 luni de supraviețuire fără progresie ). Recurențele pot fi tratate, dar intervalul fără boală tinde să se scurte și chimiorezistența crește cu fiecare recurență. Atunci când un disgerminom reapare, este cel mai probabil să reapară în decurs de un an de la diagnostic, iar alte tumori maligne ale celulelor germinale reapar în 2 ani, 90% din timp. Tumorile cu celule germinale, altele decât disgerminoamele, au un prognostic slab atunci când recidivează, cu o rată de supraviețuire pe termen lung de 10%. Tumorile cu potențial malign scăzut rareori recidivează, chiar și atunci când intervenția chirurgicală care economisește fertilitatea este tratamentul la alegere. 15% dintre tumorile LMP recidivează după o intervenție chirurgicală unilaterală în ovarul neafectat anterior și, de obicei, sunt ușor de tratat cu o intervenție chirurgicală. Tumorile mai avansate pot dura până la 20 de ani până la recidivă, dacă recidivează, și sunt tratate numai prin intervenție chirurgicală, cu excepția cazului în care tumora și-a schimbat caracteristicile histologice sau a crescut foarte repede. În aceste cazuri și atunci când există ascită semnificativă, poate fi utilizată și chimioterapie. Recidiva este de obicei indicată de creșterea nivelului de CA-125 și apoi progresează spre recidiva simptomatică în decurs de 2-6 luni. Tumorile sexuale recurente ale cordonului stromal nu răspund la tratament, dar nu sunt agresive.
Este cel mai mortal cancer ginecologic.
Epidemiologie
În 2014, numărul de cazuri noi apărute în țările dezvoltate a fost de aproximativ 9,4 la 100 000, comparativ cu 5,0 la 100 000 în țările în curs de dezvoltare. La nivel global, aproximativ 160.000 de persoane au murit de cancer ovarian în 2010. Aceasta a fost o creștere de la 113.000 în 1990. Numărul de cazuri noi pe an în Europa este de aproximativ 5-15 la 100.000 de femei. În Europa, Lituania , Letonia , Irlanda , Slovacia și Republica Cehă au cele mai mari incidențe de cancer ovarian, în timp ce Portugalia și Cipru au cele mai mici incidențe. În 2008, rata de supraviețuire pe cinci ani a fost de 44%. Aceasta a crescut din 1977, când rata de supraviețuire a fost de 36%.
Statele Unite
În 2010, în Statele Unite, aproximativ 21.880 de cazuri noi au fost diagnosticate și 13.850 de femei au murit de cancer ovarian. Aproximativ 1.800 din noile diagnostice au fost tumori de cordon sexual sau stromale.
În 2014, peste 220.000 de diagnostice de cancer ovarian epitelial au fost făcute anual. Riscul general pe viață în SUA este de aproximativ 1,6% În SUA, cancerul ovarian afectează 1,3-1,4% și este cauza decesului a aproximativ 1% dintre femei. În Statele Unite, este, de asemenea, al cincilea cel mai frecvent cancer la femei, dar a patra cea mai frecventă cauză de deces prin cancer. Această scădere l-a făcut al nouălea cel mai frecvent cancer la femei.
Riscurile cauzate de dezvoltarea unor tipuri specifice de cancer ovarian variază. Tumorile cu celule germinale și tumorile cordonului sexual-stromal sunt mai puțin frecvente decât tumorile epiteliale. Numărul de cazuri noi pe an în SUA este de 0,4 la 100.000 de femei și respectiv de 0,2 la 100.000 de femei. La tineri, tumorile stromale ale cordonului sexual și tumorile cu celule germinale totalizează 1% din totalul cancerului ovarian. Cancerul ovarian reprezintă aproximativ 4% din cancerele diagnosticate la femei.
Regatul Unit
Este al 5-lea cel mai frecvent cancer la femeile din Marea Britanie. În Marea Britanie, rata incidenței pentru întreaga populație este de 21,6 la 100.000.
În Regatul Unit începând cu 2014, aproximativ 7.000-7.100 de diagnostic anual cu 4.200 de decese. Riscul în Marea Britanie este similar, de 1,7%. Femeile evreie Ashkenazi poartă alele BRCA mutate de cinci ori mai des decât restul populației, ceea ce le conferă un risc mai mare de a dezvolta cancer ovarian. Cancerul ovarian este al cincilea cel mai frecvent cancer la femeile din Marea Britanie (aproximativ 7.100 de femei au fost diagnosticate cu boala în 2011) și este a cincea cea mai frecventă cauză de deces prin cancer la femei (aproximativ 4.300 de femei au murit în 2012).
Etnie
Femeile negre au de două ori riscul apariției tumorilor cordon-stromale sexuale, comparativ cu femeile care nu sunt negre.
Femeie invarsta
În SUA, rata incidenței la femeile de peste 50 de ani este de aproximativ 33 la 100.000. Rata cancerului ovarian între 1993 și 2008 a scăzut la femeile din cohorta de 40-49 de ani și în cohorta de 50-64 de ani. Cancerul ovarian este cel mai frecvent diagnosticat după menopauză, între 60 și 64 de ani. Nouăzeci la sută din cancerul ovarian apare la femeile cu vârsta peste 45 de ani și 80% la femeile cu vârsta peste 50 de ani.
În timpul sarcinii
Tumorile maligne ale celulelor germinale sunt tipul de cancer ovarian cel mai probabil să apară în timpul sarcinii . De obicei, acestea sunt diagnosticate atunci când se constată o masă anexă la examinare (la 1-2% din toate sarcinile), se observă o tumoare la ultrasunete sau nivelul alfa-fetoproteinei părinților este crescut. Chisturile dermoidale și disgerminoamele sunt cele mai frecvente tumori ale celulelor germinale în timpul sarcinii. Este puțin probabil ca tumorile cu celule germinale diagnosticate în timpul sarcinii să se fi metastazat și pot fi tratate prin intervenție chirurgicală și, în unele cazuri, prin chimioterapie, care prezintă riscul de malformații congenitale. Tumorile sacului gălbenuș și teratoamele imature cresc deosebit de repede și sunt tratate de obicei cu chimioterapie chiar și în timpul sarcinii; cu toate acestea, disgerminoamele care au fost decompuse în mod optim pot fi tratate după naștere.
Alte animale
Au fost raportate tumori ovariene la iepele ecvine . Tipurile de tumori raportate includ teratom, cistadenocarcinom și, în special , tumoră cu celule granuloase .
Cercetare
Screening
Se dezvoltă screening-ul prin histeroscopie pentru a obține probe de celule obținute pentru examenul histologic. Acest lucru este similar cu frotiul actual care este utilizat pentru a detecta cancerul de col uterin. UK Collaborative Trial of Ovarian Cancer Screening testează o tehnică de screening care combină testele de sânge CA-125 cu ultrasunete transvaginale. Alte studii sugerează că această procedură de screening poate fi eficientă. Deși rezultatele publicate în 2015 nu au fost concludente, au existat unele dovezi că screeningul poate salva vieți pe termen lung. În consecință, studiul a fost extins și va publica rezultate definitive la sfârșitul anului 2019. O problemă majoră a screening-ului este că nu se observă o progresie clară a bolii de la stadiul I (neinvaziv) la stadiul III (invaziv) și poate nu este posibil să se găsească tipuri de cancer înainte de a ajunge la stadiul III. O altă problemă este că metodele de screening tind să găsească prea multe leziuni suspecte, dintre care majoritatea nu sunt cancer, dar malignitatea poate fi evaluată doar cu intervenția chirurgicală. Metoda ROCA combinată cu ultrasonografia transvaginală este cercetată la femeile cu risc ridicat pentru a determina dacă este o metodă de screening viabilă. De asemenea, este investigat la femeile cu risc normal, deoarece s-a dovedit promițător în populația mai largă. Studiile sunt, de asemenea, în desfășurare pentru a determina dacă screening-ul ajută la detectarea mai devreme a cancerului la persoanele cu mutații BRCA.
Cercetarea pronosticului
De asemenea, se desfășoară cercetări privind diferiți factori de prognostic pentru cancerul ovarian. Cercetări recente arată că trombocitoza prezice supraviețuirea mai mică și cancerul în stadiu superior. Cercetările în curs investighează, de asemenea, beneficiile intervenției chirurgicale pentru cancerul ovarian recurent.
Imunoterapie
Deși este un domeniu activ de cercetare, începând din 2018 nu există dovezi bune că imunoterapia este eficientă pentru cancerul ovarian. Cu toate acestea, studiile anticorpului și inhibitorului VEGF bevacizumab , care pot încetini creșterea de noi vase de sânge în cancer, au arătat rezultate promițătoare, în special în combinație cu pazopanib , care încetinește și procesul de creștere a vaselor de sânge. Bevacizumab a fost deosebit de eficient în studiile preliminare privind cancerul în stadiul III și -IV și a fost citat ca având o rată de răspuns de cel puțin 15%. Este investigat în special în cazurile de cancer ovarian mucinos.
Farmacologie
Inhibitorii mTOR au fost un tratament potențial foarte investigat în anii 2000 și 2010, dar efectele secundare ale acestor medicamente (în special hiperglicemia și hiperlipidemia ) nu au fost bine tolerate și beneficiul de supraviețuire nu a fost confirmat. Inhibitorii PI3 kinazei au fost de interes, dar tind să fie foarte toxici și să provoace diaree . Un alt medicament investigat este selumetinib , un inhibitor MAPK . A îmbunătățit supraviețuirea, dar nu s-a corelat cu nicio mutație găsită în tumori.
Bevacizumab poate fi, de asemenea, combinat cu chimioterapie cu platină, o combinație care a avut rezultate preliminare pozitive în SFP, dar rezultate echivoce în ceea ce privește supraviețuirea generală. Un dezavantaj al acestor tratamente este profilul efectelor secundare, care include hipertensiunea arterială și proteinuria . De asemenea, medicamentul poate exacerba boala intestinului, ducând la fistule sau perforarea intestinului . Vintafolida , care constă dintr-un antifolat conjugat cu vinblastină , este, de asemenea, în studiile clinice; se poate dovedi benefic deoarece receptorii de folat sunt supraexprimati in multe tipuri de cancer ovarian. O altă imunoterapie potențială este trastuzumab , care este activ împotriva tumorilor pozitive pentru mutațiile Her2 / neu. Alți inhibitori ai angiogenezei sunt, de asemenea, investigați ca tratamente potențiale pentru cancerul ovarian. Combretastatina și pazopanibul sunt cercetate în combinație pentru cancerul ovarian recurent. Trebananib și tasquinimodul sunt alți inhibitori ai angiogenezei care sunt investigați. Anticorp monoclonal farletuzumab este cercetat ca adjuvant la chimioterapie traditionale. Un alt tip de imunoterapie implică vaccinuri , inclusiv TroVax .
O alternativă la chimioterapia BEP, un regim de 3 cicluri de carboplatină și etopozidă , este un subiect actual de cercetare pentru tumorile maligne ale celulelor germinale.
Chimioterapia intraperitoneală a fost, de asemenea, investigată în anii 2000 și 2010 pentru potențialul său de a administra doze mai mari de agent citotoxic tumorilor. Studiile preliminare cu cisplatină și paclitaxel au arătat că nu este bine tolerat, dar îmbunătățește supraviețuirea și sunt cercetate regimuri mai tolerabile. Cisplatina și paclitaxelul sunt cercetate ambele ca agenți de chimioterapie intraperitoneală. Un regim specific de chimioterapie pentru cancerele rare cu celule limpezi este, de asemenea, în curs de investigare: irinotecan combinat cu cisplatină.
Inhibitorii PARP s-au dovedit promițători în studiile timpurii, în special la persoanele cu mutații genice BRCA , deoarece proteina BRCA interacționează cu calea PARP. De asemenea, este studiat în general în cazul cancerului ovarian recurent, unde studiile preliminare au arătat o SFP mai lungă. Mai exact, olaparibul a demonstrat o supraviețuire mai mare comparativ cu doxorubicina, deși acest tratament este încă în curs de investigare. Nu este încă clar care sunt biomarkerii care prezic reacția la inhibitorii PARP. Rucaparib este un alt inhibitor PARP care este cercetat în cancerul ovarian avansat recurent BRCA-pozitiv și BRCA-negativ. Niraparib este un inhibitor PARP testat în cancerul ovarian recurent pozitiv BRCA.
Inhibitorii tirozin kinazei sunt o altă clasă de medicament care poate avea aplicații în cancerul ovarian. Inhibitorii angiogenezei din grupul de inhibitori ai tirozin kinazei , inclusiv pazopanib , cediranib și nintedanib , s-au dovedit , de asemenea, că cresc supraviețuirea fără progresie (SFP), dar beneficiul lor pentru supraviețuirea generală nu a fost investigat începând cu 2015. Cercetările preliminare au arătat că cediranibul combinat cu platine în cancerul ovarian recurent a crescut timpul până la a doua recurență cu 3-4 luni și a crescut supraviețuirea cu 3 luni. MK-1775 este un inhibitor al tirozin kinazei care este utilizat în combinație cu paclitaxel și carboplatină în cancerele sensibile la platină cu mutații p53. Nintedanibul este cercetat ca o terapie potențială în combinație cu ciclofosfamidă pentru persoanele cu recurențe.
Inhibitorii histone deacetilazei (HDACi) sunt un alt domeniu de cercetare.
Hormoni și radiații
Terapiile hormonale sunt un subiect al cercetărilor actuale în cancerul ovarian, în special valoarea anumitor medicamente utilizate pentru tratarea cancerului de sân. Acestea includ tamoxifen , letrozol și anastrozol . Studiile preliminare au arătat un beneficiu pentru tamoxifen la un număr mic de persoane cu cancer ovarian avansat. Letrozolul poate ajuta la încetinirea sau oprirea creșterii cancerului ovarian pozitiv la receptorii de estrogen . Anastrozolul este investigat la persoanele aflate în postmenopauză cu cancer receptor estrogen pozitiv.
Cercetările privind efectele secundare atenuante ale tratamentului cancerului ovarian sunt, de asemenea, în curs de desfășurare. Fibroza radiației , formarea țesutului cicatricial într-o zonă tratată cu radiații, poate fi ameliorată cu oxigenoterapie hiperbară , dar cercetările nu au fost finalizate în acest domeniu. Tratamentul cancerului ovarian poate determina, de asemenea, persoanele să întâmpine dificultăți psihiatrice, inclusiv depresie . Cercetările sunt în curs de desfășurare pentru a determina modul în care consilierea și psihoterapia pot ajuta persoanele care au cancer ovarian în timpul tratamentului.
Inflamaţie
Există unele indicații că boala inflamatorie pelviană poate fi asociată cu cancerul ovarian, în special în țările non-occidentale. Se poate datora procesului inflamator prezent cu boala inflamatorie pelvină.
Studii clinice
Studiile clinice sunt monitorizate și finanțate de organizațiile guvernamentale americane pentru a testa opțiunile de tratament pentru a vedea dacă sunt sigure și eficiente. Acestea includ NIH Clinical Research Trials and You ( National Institutes of Health ), Learn About Clinical Trials ( National Cancer Institute ), Search for Clinical Trials (National Cancer Institute), ClinicalTrials.gov (National Institutes of Health). În Canada sunt efectuate studii clinice.
Referințe
Lecturi suplimentare
- Cannistra SA (decembrie 2004). „Cancerul ovarului”. N. Engl. J. Med . 351 (24): 2519–29. doi : 10.1056 / NEJMra041842 . PMID 15590954 .
- Petrucelli N, Daly MB, Feldman GL (2013). „Cancer ereditar sanitar și ovarian asociate cu BRCA1 și BRCA2” . BRCA1 și BRCA2 Cancer ereditar de sân / ovarian . Universitatea din Washington, Seattle. PMID 20301425 . NBK1247.
linkuri externe
- "Cancerul ovarian, trompa uterină și cancerul peritoneal primar - versiunea pacientului" . Institutul Național al Cancerului . Accesat la 30 martie 2017 .
- Ce este infografia despre cancerul ovarian, informații despre cancerul ovarian - Spitalul Mount Sinai, New York
| Clasificare | |
|---|---|
| Resurse externe |