Structură cristalină - Crystal structure

În cristalografie , structura cristalină este o descriere a aranjamentului ordonat al atomilor , ionilor sau moleculelor într-un material cristalin . Structurile ordonate apar din natura intrinsecă a particulelor constitutive pentru a forma modele simetrice care se repetă de-a lungul direcțiilor principale ale spațiului tridimensional în materie.
Cel mai mic grup de particule din materialul care constituie acest model de repetare este celula unitară a structurii. Celula unitară reflectă complet simetria și structura întregului cristal, care este construită prin traducerea repetitivă a celulei unitare de-a lungul axelor sale principale. Vectorii de translație definesc nodurile rețelei Bravais .
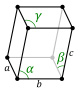
Lungimile axelor principale sau ale marginilor celulei unitare și unghiurile dintre ele sunt constante de rețea , numite și parametri de rețea sau parametri de celulă . De simetrie Proprietățile cristalului sunt descrise de conceptul de grupuri spațiale . Toate aranjamentele simetrice posibile ale particulelor în spațiul tridimensional pot fi descrise de către cele 230 de grupuri spațiale .
Structura cristalului și simetria joacă un rol critic în determinarea multor proprietăți fizice, cum ar fi clivajul , structura electronică a benzii și transparența optică .
Celula unitară
Structura cristalină este descrisă în termeni de geometrie de dispunere a particulelor în celula unitară. Celula unitară este definită ca fiind cea mai mică unitate repetată având simetria completă a structurii cristaline. Geometria celulei unitare este definită ca un paralelipiped , oferind șase parametri de rețea luate ca lungimi ale marginilor celulei ( a , b , c ) și unghiurile dintre ele (α, β, γ). Pozițiile particulelor din interiorul celulei unitare sunt descrise de coordonatele fracționate ( x i , y i , z i ) de-a lungul marginilor celulei, măsurate dintr-un punct de referință. Este necesar doar să raportați coordonatele unui cel mai mic subset asimetric de particule. Acest grup de particule poate fi ales astfel încât să ocupe cel mai mic spațiu fizic, ceea ce înseamnă că nu toate particulele trebuie să fie localizate fizic în interiorul limitelor date de parametrii rețelei. Toate celelalte particule ale celulei unitare sunt generate de operațiile de simetrie care caracterizează simetria celulei unitare. Colecția de operații de simetrie a celulei unitare este exprimată formal ca grupul spațial al structurii cristaline.
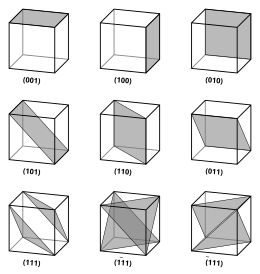
Indicii Miller
Vectorii și planurile dintr-o rețea de cristal sunt descrise prin notația indicelui Miller cu trei valori . Această sintaxă folosește indicii ℓ , m și n ca parametri direcționali.
Prin definiție, sintaxa ( ℓmn ) denotă un plan care interceptează cele trei puncte a 1 / ℓ , a 2 / m și a 3 / n , sau un multiplu al acestora. Adică, indicii Miller sunt proporționali cu inversele interceptărilor planului cu celula unitară (pe baza vectorilor de rețea). Dacă unul sau mai mulți dintre indici este zero, înseamnă că planurile nu intersectează acea axă (adică interceptarea este „la infinit”). Un plan care conține o axă de coordonate este tradus astfel încât să nu mai conțină acea axă înainte ca indicii săi Miller să fie determinați. Indicii Miller pentru un plan sunt numere întregi fără factori comuni. Indicii negativi sunt indicați cu bare orizontale, ca în (1 2 3). Într-un sistem de coordonate ortogonale pentru o celulă cubică, indicii Miller ai unui plan sunt componentele carteziene ale unui vector normal la plan.
Având în vedere numai planele ( ℓmn ) care intersectează unul sau mai multe puncte de rețea ( planele de rețea ), distanța d dintre planele de rețea adiacente este legată de (cel mai scurt) vector de rețea reciproc ortogonal cu planurile prin formula
Avioane și direcții
Direcțiile cristalografice sunt linii geometrice care leagă noduri ( atomi , ioni sau molecule ) ale unui cristal. La fel, planurile cristalografice sunt planuri geometrice care leagă noduri. Unele direcții și planuri au o densitate mai mare de noduri. Aceste planuri de înaltă densitate au o influență asupra comportamentului cristalului după cum urmează:
- Proprietăți optice : indicele de refracție este direct legat de densitate (sau fluctuații periodice de densitate).
- Adsorbție și reactivitate : adsorbția fizică și reacțiile chimice apar la sau lângă atomii sau moleculele de suprafață. Aceste fenomene sunt astfel sensibile la densitatea nodurilor.
- Tensiunea superficială : condensarea unui material înseamnă că atomii, ionii sau moleculele sunt mai stabile dacă sunt înconjurați de alte specii similare. Tensiunea superficială a unei interfețe variază astfel în funcție de densitatea de pe suprafață.
- Defecte microstructurale : Porii și cristalitele au tendința de a avea granițe drepte după planuri de densitate mai mare.
- Clivaj : Acest lucru apare de obicei în mod preferențial paralel cu planurile cu densitate mai mare.
- Deformare plastică : alunecarea de luxație apare preferențial paralelă cu planurile cu densitate mai mare. Perturbarea purtată de dislocare ( vectorul Burgers ) este de-a lungul unei direcții dense. Schimbarea unui nod într-o direcție mai densă necesită o distorsiune mai mică a rețelei de cristal.
Unele direcții și planuri sunt definite prin simetria sistemului de cristal. În sistemele monoclinice, romboedrice, tetragonale și trigonale / hexagonale există o singură axă (uneori numită axa principală ) care are o simetrie de rotație mai mare decât celelalte două axe. Planul bazal este planul perpendicular pe axa principală în aceste sisteme cristaline. Pentru sistemele de cristal triclinic, ortorombic și cubic, desemnarea axei este arbitrară și nu există o axă principală.
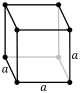
Structuri cubice
Pentru cazul special al cristalelor cubice simple, vectorii de rețea sunt ortogonali și de lungime egală (de obicei notată a ); în mod similar pentru rețeaua reciprocă. Deci, în acest caz comun, indicii Miller ( ℓmn ) și [ ℓmn ] ambii denotă pur și simplu normale / direcții în coordonate carteziene . Pentru cristalele cubice cu constantă de rețea a , spațiul d între planurile de rețea adiacente (ℓmn) este (de sus):
Datorită simetriei cristalelor cubice, este posibil să se schimbe locul și semnul numerelor întregi și să aibă direcții și planuri echivalente:
- Coordonatele din paranteze unghiulare cum ar fi ⟨100⟩ denotă o familie de direcții care sunt echivalente datorită operațiilor de simetrie, cum ar fi [100], [010], [001] sau negativul oricăreia dintre acele direcții.
- Coordonatele dintre paranteze sau paranteze, cum ar fi {100}, denotă o familie de planuri normale care sunt echivalente datorită operațiilor de simetrie, mult modul în care parantezele unghiulare indică o familie de direcții.
Pentru rețele cubice centrate pe față (fcc) și cubice centrate pe corp (bcc), vectorii rețelei primitive nu sunt ortogonali. Cu toate acestea, în aceste cazuri, indicii Miller sunt definiți în mod convențional în raport cu vectorii de rețea ai supercelulei cubice și, prin urmare, sunt din nou pur și simplu direcțiile carteziene .
Spațiere interplanară
Spațierea d între adiacente ( hkℓ ) avioane cu zăbrele este dată de:
- Cub:
- Tetragonal:
- Hexagonal:
- Romboedric:
- Orthorhombic:
- Monoclinic:
- Triclinic:
Clasificare după simetrie
Proprietatea definitorie a unui cristal este simetria sa inerentă. Efectuarea anumitor operații de simetrie pe rețeaua de cristal îl lasă neschimbat. Toate cristalele au simetrie de translație în trei direcții, dar unele au și alte elemente de simetrie. De exemplu, rotirea cristalului la 180 ° în jurul unei anumite axe poate avea ca rezultat o configurație atomică identică cu configurația inițială; cristalul are dublă simetrie de rotație în jurul acestei axe. În plus față de simetria de rotație, un cristal poate avea simetrie sub formă de planuri oglindă, precum și așa-numitele simetrii compuse, care sunt o combinație de translație și rotație sau simetrie oglindă. O clasificare completă a unui cristal se realizează atunci când sunt identificate toate simetriile inerente ale cristalului.
Sisteme de rețea
Sistemele de rețea sunt o grupare de structuri cristaline în funcție de sistemul axial utilizat pentru a descrie rețeaua lor. Fiecare sistem de rețea constă dintr-un set de trei axe într-un anumit aranjament geometric. Toate cristalele cad într-unul din cele șapte sisteme de rețea. Ele sunt similare cu cele șapte sisteme de cristale , dar nu chiar la fel .
| Familia de cristal | Sistem cu zăbrele | Grup de puncte ( notația Schönflies ) |
14 rețele Bravais | |||
|---|---|---|---|---|---|---|
| Primitiv (P) | Centrat pe bază (S) | Centrat pe corp (I) | Centrat pe față (F) | |||
| Triclinic (a) | C i |
aP |
||||
| Monoclinic (m) | C 2h |

mP |

Domnișoară |
|||
| Orthorhombic (o) | D 2h |

oP |

oS |

oI |

de |
|
| Tetragonal (t) | D 4h |

tP |

tI |
|||
| Hexagonal (h) | Romboedric | D 3d |

HR |
|||
| Hexagonal | D 6h |

hP |
||||
| Cubic (c) | O h |
cP |

cI |

cF |
||
Cel mai simplu și mai simetric, sistemul cubic sau izometric, are simetria unui cub , adică prezintă patru axe de rotație triplu orientate la 109,5 ° ( unghiul tetraedric ) unul față de celălalt. Aceste axe triple se întind de-a lungul diagonalelor corpului cubului. Celelalte șase sisteme de rețea sunt hexagonale , tetragonale , romboedrice (adesea confundate cu sistemul de cristal trigonal ), ortorombice , monoclinice și triclinice .
Grile Bravais
Rețelele Bravais , denumite și rețele spațiale , descriu dispunerea geometrică a punctelor de rețea și, prin urmare, simetria de translație a cristalului. Cele trei dimensiuni ale spațiului permit 14 rețele Bravais distincte care descriu simetria translațională. Toate materialele cristaline recunoscute astăzi, cu excepția cvasicristalelor , se încadrează într-unul dintre aceste aranjamente. Cele paisprezece rețele tridimensionale, clasificate după sistemul de rețele, sunt prezentate mai sus.
Structura cristalină constă din același grup de atomi, baza , poziționată în jurul fiecărui punct de rețea. Prin urmare, acest grup de atomi se repetă la nesfârșit în trei dimensiuni în conformitate cu dispunerea unuia dintre rețelele Bravais. Rotația caracteristică și simetriile oglinzii ale celulei unitare sunt descrise de grupul ei de puncte cristalografice .
Sisteme de cristal
Un sistem de cristal este un set de grupuri de puncte în care grupurile de puncte și grupurile lor spațiale corespunzătoare sunt atribuite unui sistem de rețea. Dintre cele 32 de grupuri de puncte care există în trei dimensiuni, majoritatea sunt atribuite unui singur sistem de rețea, caz în care sistemul de cristal și sistemul de rețea au ambele același nume. Cu toate acestea, cinci grupuri de puncte sunt atribuite a două sisteme de rețea, romboedrică și hexagonală, deoarece ambele sisteme de rețea prezintă o simetrie de rotație triplă. Aceste grupuri de puncte sunt atribuite sistemului de cristal trigonal.
| Familia de cristal | Sistem de cristal | Grup de puncte / clasa Crystal | Schönflies | Simetrie punctuală | Ordin | Grup abstract |
|---|---|---|---|---|---|---|
| triclinic | pedial | C 1 | polar enantiomorf | 1 | banal | |
| pinacoidal | C i (S 2 ) | centrosimetrice | 2 | ciclic | ||
| monoclinic | sfenoidale | C 2 | polar enantiomorf | 2 | ciclic | |
| domatic | C s (C 1h ) | polar | 2 | ciclic | ||
| prismatic | C 2h | centrosimetrice | 4 | Klein patru | ||
| ortorombic | rombic-disfenoidal | D 2 (V) | enantiomorf | 4 | Klein patru | |
| rombic- piramidal | C 2v | polar | 4 | Klein patru | ||
| rombic- dipiramidal | D 2h (V h ) | centrosimetrice | 8 | |||
| tetragonal | tetragonal-piramidal | C 4 | polar enantiomorf | 4 | ciclic | |
| tetragonal-disfenoidal | S 4 | non-centrosimetrică | 4 | ciclic | ||
| tetragonal-dipiramidal | C 4h | centrosimetrice | 8 | |||
| tetragonal-trapezoedric | D 4 | enantiomorf | 8 | diedru | ||
| ditetragonal-piramidal | C 4v | polar | 8 | diedru | ||
| tetragonal-scalenoedric | D 2d (V d ) | non-centrosimetrică | 8 | diedru | ||
| ditetragonal-dipiramidal | D 4h | centrosimetrice | 16 | |||
| hexagonal | trigonal | trigonal-piramidal | C 3 | polar enantiomorf | 3 | ciclic |
| romboedric | C 3i (S 6 ) | centrosimetrice | 6 | ciclic | ||
| trigonal-trapezoedric | D 3 | enantiomorf | 6 | diedru | ||
| ditrigonal-piramidal | C 3v | polar | 6 | diedru | ||
| ditrigonal-scalenoedric | D 3d | centrosimetrice | 12 | diedru | ||
| hexagonal | hexagonal-piramidal | C 6 | polar enantiomorf | 6 | ciclic | |
| trigonal-dipiramidal | C 3h | non-centrosimetrică | 6 | ciclic | ||
| hexagonal-dipiramidal | C 6h | centrosimetrice | 12 | |||
| hexagonal-trapezoedric | D 6 | enantiomorf | 12 | diedru | ||
| dihexagonal-piramidal | C 6v | polar | 12 | diedru | ||
| ditrigonal-dipiramidal | D 3h | non-centrosimetrică | 12 | diedru | ||
| dihexagonal-dipiramidal | D 6h | centrosimetrice | 24 | |||
| cub | tetartoidal | T | enantiomorf | 12 | alternativ | |
| diploidal | T h | centrosimetrice | 24 | |||
| gyroidal | O | enantiomorf | 24 | simetric | ||
| hextetraedrică | T d | non-centrosimetrică | 24 | simetric | ||
| hexoctaedrică | O h | centrosimetrice | 48 | |||
În total există șapte sisteme de cristale: triclinic, monoclinic, ortorombic, tetragonal, trigonal, hexagonal și cubic.
Grupuri de puncte
Grupul de puncte cristalografice sau clasa de cristal este grupul matematic care cuprinde operațiile de simetrie care lasă cel puțin un punct nemișcat și care lasă neschimbată aspectul structurii cristaline. Aceste operații de simetrie includ
- Reflecție , care reflectă structura pe un plan de reflecție
- Rotație , care rotește structura unei porțiuni specificate a unui cerc în jurul unei axe de rotație
- Inversie , care schimbă semnul coordonatei fiecărui punct în raport cu un centru de simetrie sau punct de inversiune
- Rotație necorespunzătoare , care constă dintr-o rotație în jurul unei axe urmată de o inversare.
Axele de rotație (adecvate și necorespunzătoare), planurile de reflecție și centrele de simetrie sunt denumite în mod colectiv elemente de simetrie . Există 32 de clase de cristale posibile. Fiecare poate fi clasificat într-unul dintre cele șapte sisteme de cristale.
Grupuri spațiale
În plus față de operațiile grupului de puncte, grupul spațial al structurii cristaline conține operații de simetrie translațională. Acestea includ:
- Traduceri pure , care deplasează un punct de-a lungul unui vector
- Axe de șurub , care se rotesc un punct în jurul unei axe în timp ce se traduc paralel cu axa.
- Planuri de alunecare , care reflectă un punct printr-un plan în timp ce îl traduc paralel cu planul.
Există 230 de grupuri spațiale distincte.
Coordonarea atomică
Luând în considerare aranjamentul atomilor unul față de celălalt, numerele lor de coordonare (sau numărul celor mai apropiați vecini), distanțele interatomice, tipurile de legătură etc., este posibil să se formeze o vedere generală a structurilor și modalități alternative de vizualizare a acestora.
Închideți ambalajul
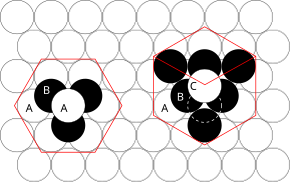
Principiile implicate pot fi înțelese luând în considerare cel mai eficient mod de împachetare a sferelor de dimensiuni egale și stivuirea planurilor atomice strânse în trei dimensiuni. De exemplu, dacă planul A se află sub planul B, există două modalități posibile de a plasa un atom suplimentar deasupra stratului B. Dacă un strat suplimentar ar fi plasat direct peste planul A, acest lucru ar da naștere următoarelor serii:
- ... ABABABAB ...
Acest aranjament de atomi într-o structură cristalină este cunoscut sub numele de ambalaj hexagonal strâns (hcp) .
Dacă totuși, toate cele trei planuri sunt eșalonate unele față de altele și abia după ce al patrulea strat este poziționat direct deasupra planului A se repetă secvența, atunci apare următoarea secvență:
- ... ABCABCABC ...
Acest tip de aranjament structural este cunoscut sub numele de ambalaj cubic închis (ccp) .
Celula unitară a unui aranjament ccp de atomi este celula centrală cubică (fcc) centrată pe față. Acest lucru nu este imediat evident deoarece straturile strâns strânse sunt paralele cu planurile {111} ale celulei unității fcc. Există patru orientări diferite ale straturilor strânse.
Eficiența ambalării poate fi calculată calculând volumul total al sferelor și împărțind la volumul celulei după cum urmează:
Eficiența de ambalare de 74% este densitatea maximă posibilă în celulele unitare construite din sfere de o singură dimensiune. Cele mai multe forme cristaline de elemente metalice sunt hcp, fcc sau bcc (cubic centrat pe corp). Numărul de coordonare al atomilor din structurile hcp și fcc este 12, iar factorul său de ambalare atomică (APF) este numărul menționat mai sus, 0,74. Acest lucru poate fi comparat cu APF al unei structuri bcc, care este 0,68.
Limitele cerealelor
Limitele cerealelor sunt interfețe în care se întâlnesc cristale de diferite orientări. O graniță de cereale este o interfață monofazată, cu cristale de fiecare parte a graniței fiind identice, cu excepția orientării. Termenul „limită cristalită” este uneori, deși rar folosit. Zonele limită de cereale conțin acei atomi care au fost perturbați de la siturile lor originale de rețea, luxații și impurități care au migrat la limita inferioară a cerealelor de energie.
Tratând geometric o graniță a granulelor ca o interfață a unui singur cristal tăiat în două părți, dintre care una este rotită, vedem că există cinci variabile necesare pentru a defini o graniță a bobului. Primele două numere provin din vectorul unitar care specifică o axă de rotație. Al treilea număr desemnează unghiul de rotație al bobului. Ultimele două numere specifică planul graniței bobului (sau un vector unitate care este normal pentru acest plan).
Limitele granulelor perturbă mișcarea dislocărilor printr-un material, astfel încât reducerea dimensiunii cristalitelor este o modalitate obișnuită de a îmbunătăți rezistența, așa cum este descris de relația Hall-Petch . Deoarece limitele granulelor sunt defecte ale structurii cristaline, acestea tind să scadă conductivitatea electrică și termică a materialului. Energia interfațială ridicată și legătura relativ slabă în majoritatea limitelor granulelor le face adesea locuri preferate pentru apariția coroziunii și pentru precipitarea de noi faze din solid. Ele sunt, de asemenea, importante pentru multe dintre mecanismele de fluare .
Limitele cerealelor au în general o lățime de doar câțiva nanometri. În materialele obișnuite, cristalitele sunt suficient de mari încât limitele cerealelor reprezintă o mică parte din material. Cu toate acestea, se pot realiza mărimi foarte mici de cereale. În solidele nanocristaline, limitele granulelor devin o fracțiune de volum semnificativă a materialului, cu efecte profunde asupra unor proprietăți precum difuzia și plasticitatea . În limita cristalitelor mici, pe măsură ce fracțiunea de volum a limitelor granulelor se apropie de 100%, materialul încetează să mai aibă orice caracter cristalin și astfel devine un solid amorf .
Defecte și impurități
Cristalele reale prezintă defecte sau nereguli în aranjamentele ideale descrise mai sus și aceste defecte determină critic multe dintre proprietățile electrice și mecanice ale materialelor reale. Când un atom înlocuiește una dintre componentele atomice principale din structura cristalină, poate rezulta modificarea proprietăților electrice și termice ale materialului. Impuritățile se pot manifesta, de asemenea, ca impurități ale spinului electronului în anumite materiale. Cercetările privind impuritățile magnetice demonstrează că alterarea substanțială a anumitor proprietăți, cum ar fi căldura specifică, poate fi afectată de concentrații mici de impurități, de exemplu, impuritățile din aliajele feromagnetice semiconductoare pot duce la proprietăți diferite, așa cum s-a prezis la sfârșitul anilor 1960. Luxațiile din rețeaua de cristal permit forfecarea la stres mai mic decât cel necesar unei structuri cristaline perfecte.
Predicția structurii
Dificultatea de a prezice structuri cristaline stabile bazate pe cunoașterea numai a compoziției chimice a constituit mult timp un obstacol în calea către proiectarea materialelor pe bază de calcul. Acum, cu algoritmi mai puternici și calcul de înaltă performanță, structurile de complexitate medie pot fi prezise folosind abordări precum algoritmi evolutivi , eșantionare aleatorie sau metadinamică.
Structurile cristaline ale solidelor ionice simple (de exemplu, NaCl sau sare de masă) au fost mult timp raționalizate în ceea ce privește regulile lui Pauling , stabilite pentru prima dată în 1929 de Linus Pauling , denumite de mulți de atunci drept „tatăl legăturii chimice”. Pauling a luat în considerare, de asemenea, natura forțelor interatomice din metale și a concluzionat că aproximativ jumătate din cele cinci orbitali d din metalele de tranziție sunt implicate în legătură, restul de orbitali ne-legători fiind responsabili pentru proprietățile magnetice. Prin urmare, el a reușit să coreleze numărul orbitalilor d în formarea legăturii cu lungimea legăturii, precum și multe dintre proprietățile fizice ale substanței. Ulterior a introdus orbitalul metalic, un orbital suplimentar necesar pentru a permite rezonanța neinhibată a legăturilor de valență printre diferite structuri electronice.
În teoria legăturilor de valență rezonante , factorii care determină alegerea uneia dintre structurile cristaline alternative ale unui compus metalic sau intermetalic se învârt în jurul energiei de rezonanță a legăturilor dintre pozițiile interatomice. Este clar că unele moduri de rezonanță ar aduce contribuții mai mari (ar fi mai stabile din punct de vedere mecanic decât altele) și că, în special, un raport simplu între numărul de obligațiuni și numărul de poziții ar fi excepțional. Principiul rezultat este că o stabilitate specială este asociată cu cele mai simple raporturi sau „numere de legătură”: 1 ⁄ 2 , 1 ⁄ 3 , 2 ⁄ 3 , 1 ⁄ 4 , 3 ⁄ 4 etc. Alegerea structurii și valoarea raportul axial (care determină lungimile legăturilor relative) sunt astfel rezultatul efortului unui atom de a utiliza valența în formarea de legături stabile cu simple numere de obligațiuni fracționare.
După postularea unei corelații directe între concentrația electronilor și structura cristalină în aliajele de fază beta, Hume-Rothery a analizat tendințele punctelor de topire, compresibilităților și lungimilor legăturilor în funcție de numărul grupului din tabelul periodic pentru a stabili un sistem de valențe ale elementele de tranziție în stare metalică. Acest tratament a subliniat astfel creșterea forței de legătură în funcție de numărul grupului. Funcționarea forțelor direcționale a fost subliniată într-un articol despre relația dintre hibrizii de legătură și structurile metalice. Corelația rezultată între structurile electronice și cristaline este rezumată printr-un singur parametru, greutatea electronilor d per orbital metalic hibridizat. „Greutatea d” se calculează la 0,5, 0,7 și 0,9 pentru structurile fcc, respectiv hcp și bcc. Relația dintre electronii d și structura cristalină devine astfel evidentă.
În predicțiile / simulările structurii cristaline, periodicitatea este de obicei aplicată, deoarece sistemul este imaginat ca fiind mare nelimitat în toate direcțiile. Pornind de la o structură triclinică fără alte proprietăți de simetrie presupuse, sistemul poate fi condus pentru a arăta câteva proprietăți de simetrie suplimentare prin aplicarea celei de-a doua legi a lui Newton asupra particulelor din celula unitară și o ecuație dinamică recent dezvoltată pentru vectorii perioadei sistemului (parametrii rețelei incluzând unghiurile ), chiar dacă sistemul este supus stresului extern.
Polimorfism

Polimorfismul este apariția mai multor forme cristaline ale unui material. Se găsește în multe materiale cristaline, inclusiv polimeri , minerale și metale . Conform regulilor de echilibru de fază ale lui Gibbs, aceste faze cristaline unice sunt dependente de variabile intensive precum presiunea și temperatura. Polimorfismul este legat de alotropie , care se referă la solidele elementare . Morfologia completă a unui material este descrisă de polimorfism și alte variabile, cum ar fi obiceiurile cristaline , fracțiunea amorfă sau defectele cristalografice . Polimorfii au stabilități diferite și se pot transforma spontan și ireversibil dintr-o formă metastabilă (sau formă instabilă termodinamic) în forma stabilă la o anumită temperatură. Ele prezintă, de asemenea, diferite puncte de topire , solubilități și modele de difracție cu raze X.
Un bun exemplu în acest sens este cuarț sub formă de dioxid de siliciu sau SiO 2 . În marea majoritate a silicaților , atomul de Si prezintă coordonare tetraedrică de către 4 oxigeni. Toate formele cristaline, cu excepția uneia, implică unități tetraedrice {SiO 4 } legate între ele prin vârfuri comune în aranjamente diferite. În diferite minerale tetraedrele prezintă grade diferite de rețea și polimerizare. De exemplu, apar individual, uniți în perechi, în grupuri finite mai mari, inclusiv inele, în lanțuri, lanțuri duble, foi și cadre în trei dimensiuni. Mineralele sunt clasificate în grupuri pe baza acestor structuri. În fiecare dintre cele 7 forme cristaline stabile termodinamic sau polimorfe de cuarț cristalin, doar 2 din 4 din fiecare margine a tetraedrelor {SiO 4 } sunt împărțite cu altele, rezultând formula chimică netă pentru silice: SiO 2 .
Un alt exemplu este staniu elementar (Sn), care este maleabil în apropierea temperaturilor ambiante, dar este fragil la răcire. Această modificare a proprietăților mecanice datorită existenței celor două alotrope majore ale sale , α- și β-staniu. Cele două alotrope care se întâlnesc la presiune și temperatură normale, α-staniu și β-staniu, sunt mai frecvent cunoscute sub numele de staniu gri și respectiv staniu alb . Încă două alotropi, γ și σ, există la temperaturi peste 161 ° C și presiuni peste mai mulți GPa. Staniul alb este metalic și este forma cristalină stabilă la temperatura camerei sau peste aceasta. Sub 13,2 ° C, staniu există sub formă gri, care are o structură cristalină cubică de diamant , similară cu diamantul , siliciul sau germaniu . Staniu cenușiu nu are deloc proprietăți metalice, este un material sub formă de pulbere cenușie și are puține utilizări, în afară de câteva aplicații specializate pentru semiconductori . Deși temperatura de transformare α – β a staniului este nominal de 13,2 ° C, impuritățile (de exemplu, Al, Zn etc.) scad temperatura de tranziție cu mult sub 0 ° C și la adăugarea de Sb sau Bi este posibil ca transformarea să nu aibă loc deloc.
Proprietăți fizice
Douăzeci din cele 32 de clase de cristale sunt piezoelectrice , iar cristalele aparținând uneia dintre aceste clase (grupuri de puncte) prezintă piezoelectricitate . Toate clasele piezoelectrice nu au simetrie de inversiune . Orice material dezvoltă o polarizare dielectrică atunci când se aplică un câmp electric, dar o substanță care are o astfel de separare naturală a sarcinii chiar și în absența unui câmp se numește material polar. Dacă un material este polar sau nu este determinat exclusiv de structura sa cristalină. Doar 10 din cele 32 de grupuri de puncte sunt polare . Toate cristalele polare sunt piroelectrice , deci cele 10 clase de cristale polare sunt uneori denumite clase piroelectrice.
Există câteva structuri cristaline, în special structura perovskitei , care prezintă un comportament feroelectric . Acest lucru este analog feromagnetismului , prin faptul că, în absența unui câmp electric în timpul producției, cristalul feroelectric nu prezintă o polarizare. La aplicarea unui câmp electric de amplitudine suficientă, cristalul devine permanent polarizat. Această polarizare poate fi inversată printr-o contra-încărcare suficient de mare, în același mod în care un feromagnet poate fi inversat. Cu toate acestea, deși sunt numite feroelectrice, efectul se datorează structurii cristaline (nu prezenței unui metal feros).
Vezi si
- Zona Brillouin - Celula primitivă în rețeaua spațială reciprocă a cristalelor
- Ingineria cristalelor
- Creșterea cristalelor - Etapa majoră a unui proces de cristalizare
- Baza de date cristalografică
- Coordonate fracționare
- Fazele Frank – Kasper
- Notare Hermann – Mauguin - Notare pentru a reprezenta simetria în grupuri de puncte, grupuri plane și grupuri spațiale
- Creșterea piedestalului încălzită cu laser
- Cristal lichid - Starea materiei cu proprietăți atât ale lichidelor convenționale, cât și ale cristalelor
- Funcția Patterson
- Tabel periodic (structură cristalină)
- Celula primitivă
- Cristal de semințe
- Celula Wigner – Seitz - Celula primitivă a rețelelor de cristal cu descompunere Voronoi aplicată
Referințe
linkuri externe
![]() Medii legate de structurile de cristal de la Wikimedia Commons
Medii legate de structurile de cristal de la Wikimedia Commons
- Structura internă a cristalelor ... Cristalografie pentru începători
- Diferite tipuri de structuri cristaline
- Anexa A din manualul pentru Atoms, software pentru XAFS
- Introducere în minerale: Clasa și sistemul Crystal
- Introducere în cristalografie și sisteme de cristale minerale
- Avioane de cristal și indici Miller
- Modele interactive 3D Crystal
- Modele specifice Crystal 3D
- Baza de date deschisă pentru cristalografie (cu peste 140.000 de structuri cristaline)