Potențial de odihnă - Resting potential
Un potențial de membrană relativ static care este denumit de obicei valoarea la sol pentru tensiunea trans-membrană.
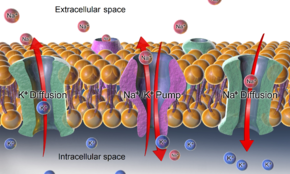
/ K +
-ATPaza , precum și efectele difuziei ionilor implicați, sunt mecanisme majore pentru menținerea potențialului de odihnă pe membranele celulelor animale.
Potențialul de membrană relativ static al celulelor în repaus este numit potențial de membrană de repaus (sau tensiune de repaus), spre deosebire de fenomenele electrochimice dinamice specifice numite potențial de acțiune și potențial de membrană gradat .
În afară de acestea din urmă, care apar în celulele excitabile ( neuroni , mușchi și unele celule secretoare din glande ), tensiunea membranei în majoritatea celulelor neexcitabile poate suferi și modificări ca răspuns la stimuli de mediu sau intracelulari. Potențialul de repaus există datorită diferențelor în permeabilitățile cu membrana de potasiu , sodiu , calciu și clorură de ioni , care , la rândul său , duce la activitatea funcțională a diferitelor canale de ioni , transportatori de ioni , și schimbătoare. În mod convențional, potențialul de membrană în repaus poate fi definit ca o valoare relativ stabilă la sol a tensiunii transmembranare în celulele animale și vegetale.
Potențialul tipic de membrană de repaus al unei celule provine din separarea ionilor de potasiu de anioni intracelulari, relativ imobili, de-a lungul membranei celulei. Deoarece permeabilitatea membranei pentru potasiu este mult mai mare decât cea pentru alți ioni și datorită gradientului chimic puternic pentru potasiu, ionii de potasiu curg din citosol în spațiul extracelular efectuând sarcină pozitivă, până când mișcarea lor este echilibrată prin acumularea de sarcină negativă pe suprafața interioară a membranei. Din nou, datorită permeabilității relative ridicate pentru potasiu, potențialul membranar rezultat este aproape întotdeauna aproape de potențialul de inversare a potasiului . Dar pentru ca acest proces să aibă loc, mai întâi trebuie stabilit un gradient de concentrație al ionilor de potasiu. Această lucrare este realizată de pompele / transportorii și / sau schimbătoarele de ioni și, în general, este alimentată de ATP .
În cazul potențialului de membrană de repaus pe membrana plasmatică a unei celule animale , gradienții de potasiu (și sodiu) sunt stabiliți de Na + / K + -ATPaza (pompă sodiu-potasiu) care transportă 2 ioni de potasiu în interior și 3 ioni de sodiu în exterior la costul unei molecule de ATP. În alte cazuri, de exemplu, un potențial de membrană poate fi stabilit prin acidificarea interiorului unui compartiment membranos (cum ar fi pompa de protoni care generează potențial de membrană pe membranele veziculelor sinaptice ).
Electroneutralitate
În majoritatea tratamentelor cantitative ale potențialului membranei, cum ar fi derivarea ecuației Goldman , se presupune electroneutralitatea ; adică nu există nici un exces de sarcină măsurabil în nicio parte a membranei. Deci, deși există un potențial electric pe membrană datorită separării sarcinii, nu există o diferență reală măsurabilă în concentrația globală a ionilor pozitivi și negativi pe membrană (așa cum se estimează mai jos ), adică nu există măsurători reale încărcați excesul de ambele părți. Acest lucru se întâmplă deoarece efectul încărcării asupra potențialului electrochimic este cu mult mai mare decât efectul concentrației, astfel încât o modificare nedetectabilă a concentrației creează o mare schimbare a potențialului electric.
Generarea potențialului de odihnă
Membranele celulare sunt de obicei permeabile doar unui subset de ioni. Acestea includ de obicei ioni de potasiu, ioni de clorură, ioni de bicarbonat și alții. Pentru a simplifica descrierea bazei ionice a potențialului membranei de repaus, este cel mai util să se ia în considerare la început doar o specie ionică și să se ia în considerare celelalte mai târziu. Deoarece potențialele membranelor trans-plasmatice sunt aproape întotdeauna determinate în primul rând de permeabilitatea potasiului, de aici trebuie să începeți.
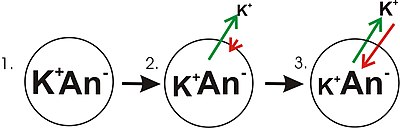
- Panoul 1 al diagramei prezintă o reprezentare schematică a unei celule simple în care a fost deja stabilit un gradient de concentrație. Acest panou este desenat ca și cum membrana nu are permeabilitate față de niciun ion. Nu există potențial de membrană deoarece, în ciuda faptului că există un gradient de concentrație pentru potasiu, nu există un dezechilibru net al sarcinii pe membrană. Dacă membrana ar deveni permeabilă la un tip de ion care este mai concentrat pe o parte a membranei, atunci acel ion ar contribui la tensiunea membranei, deoarece ionii permeanți s-ar deplasa peste membrană cu mișcarea netă a acelui tip de ioni în josul concentrației gradient. Ar exista mișcare netă din partea membranei cu o concentrație mai mare a ionului în partea cu concentrație mai mică. O astfel de mișcare a unui ion peste membrană ar avea ca rezultat un dezechilibru net de sarcină peste membrană și un potențial de membrană. Acesta este un mecanism comun prin care multe celule stabilesc un potențial de membrană.
- În panoul 2 al diagramei, membrana celulară a fost permeabilă la ioni de potasiu, dar nu și la anioni (An - ) din interiorul celulei. Acești anioni sunt în mare parte contribuiți de proteine. Există energie stocată în gradientul de concentrație a ionilor de potasiu care poate fi transformat într-un gradient electric atunci când ionii de potasiu (K + ) se deplasează în afara celulei. Rețineți că ionii de potasiu se pot deplasa peste membrană în ambele direcții, dar prin procesul pur statistic care apare din concentrația mai mare de ioni de potasiu din interiorul celulei, vor exista mai mulți ioni de potasiu care se deplasează în afara celulei. Deoarece există o concentrație mai mare de ioni de potasiu în interiorul celulelor, mișcarea lor moleculară aleatorie este mai probabil să întâmpine porii de permeabilitate ( canalul ionic ), care este cazul ionilor de potasiu care sunt în afara și la o concentrație mai mică. Un K + intern este pur și simplu „mai probabil” să părăsească celula decât un K + extracelular să intre în ea. Este o chestiune de difuzie care lucrează prin disiparea gradientului de concentrație. Pe măsură ce potasiul părăsește celula, lasă în urmă anionii. Prin urmare, se dezvoltă o separare a sarcinii pe măsură ce K + părăsește celula. Această separare a sarcinii creează o tensiune transmembranară. Această tensiune transmembranară este potențialul membranei. Pe măsură ce potasiul continuă să părăsească celula, separând mai multe sarcini, potențialul membranei va continua să crească. Lungimea săgeților (verde indicând gradientul de concentrație, roșu indicând tensiunea), reprezintă magnitudinea mișcării ionilor de potasiu datorată fiecărei forme de energie. Direcția săgeții indică direcția în care se aplică acea forță specială. Astfel, tensiunea membranei clădirii este o forță în creștere care acționează contrar tendinței de mișcare netă a ionilor de potasiu în josul gradientului de concentrație de potasiu.
- În panoul 3, tensiunea membranei a crescut în măsura în care „rezistența” sa se potrivește acum cu gradienții de concentrație. Deoarece aceste forțe (care sunt aplicate la K + ) sunt acum la aceeași forță și orientate în direcții opuse, sistemul este acum în echilibru . Cu alte cuvinte, tendința potasiului de a părăsi celula prin scăderea gradientului său de concentrație este acum potrivită cu tendința tensiunii membranei de a trage ionii de potasiu înapoi în celulă. K + continuă să se deplaseze peste membrană, dar rata la care intră și iese din celulă este aceeași, deci nu există curent net de potasiu. Deoarece K + este la echilibru, potențialul membranei este stabil sau „în repaus” (E K ).
Tensiunea de repaus este rezultatul mai multor enzime translocante de ioni ( uniportatoare , cotransportoare și pompe ) în membrana plasmatică, care funcționează constant în paralel, prin care fiecare translocator de ioni are forța sa electromotivă caracteristică (= potențial de inversare = „tensiune de echilibru”) , în funcție de concentrațiile speciale de substrat din interior și exterior ( ATP intern inclus în cazul unor pompe). ATPaza exportatoare de H + face ca tensiunea membranei din plante și ciuperci să fie mult mai negativă decât în celulele animale mai aprofundate, unde tensiunea de repaus este determinată în principal de canale ionice selective.
În majoritatea neuronilor, potențialul de odihnă are o valoare de aproximativ -70 mV. Potențialul de odihnă este determinat în principal de concentrațiile ionilor din fluidele de pe ambele părți ale membranei celulare și de proteinele de transport al ionilor care se află în membrana celulară. Modul în care concentrațiile ionilor și proteinele de transport ale membranei influențează valoarea potențialului de repaus este prezentat mai jos.
Potențialul de repaus al unei celule poate fi înțeles cel mai bine gândindu-l în termeni de potențial de echilibru. În diagrama de exemplu, celulei model i s-a dat un singur ion permeant (potasiu). În acest caz, potențialul de repaus al acestei celule ar fi același cu potențialul de echilibru pentru potasiu.
Cu toate acestea, o celulă reală este mai complicată, având permeabilități la mulți ioni, fiecare contribuind la potențialul de odihnă. Pentru a înțelege mai bine, luați în considerare o celulă cu doar doi ioni permeanți, potasiu și sodiu. Luați în considerare un caz în care acești doi ioni au gradienți de concentrație egali direcționați în direcții opuse și că permeabilitățile membranei la ambii ioni sunt egale. K + lăsând celula va tinde să trage potențialul de membrană spre E K . Na + care intră în celulă va avea tendința de a trage potențialul membranei către potențialul de inversare pentru sodiu E Na . Deoarece permeabilități la ambii ioni au fost stabilite pentru a fi egal, potențialul de membrană va, la sfârșitul Na + / K + -remorcher de război, ajunge la jumătatea distanței dintre E Na și E K . Deoarece E Na și E K erau egale, dar cu semne opuse, la jumătatea distanței între ele este zero, ceea ce înseamnă că membrana se va odihni la 0 mV.
Rețineți că, deși potențialul membranei la 0 mV este stabil, nu este o condiție de echilibru, deoarece niciunul dintre ionii care contribuie nu este în echilibru. Ionii difuzează gradienții lor electrochimici prin canale ionice, dar potențialul membranei este susținut de fluxul continuu de K + și de efluxul de Na + prin intermediul transportatorilor de ioni . O astfel de situație cu permeabilități similare pentru ionii care acționează contracarent, cum ar fi potasiul și sodiul din celulele animale, poate fi extrem de costisitoare pentru celulă dacă aceste permeabilități sunt relativ mari, deoarece este nevoie de multă energie ATP pentru a pompa ionii înapoi. Deoarece nicio celulă reală nu își poate permite permeabilități ionice egale și mari în repaus, potențialul de odihnă al celulelor animale este determinat de permeabilitatea predominantă la potasiu și ajustat la valoarea necesară prin modularea permeabilităților și gradienților de sodiu și clorură.
Într-o celulă animală sănătoasă, permeabilitatea Na + este de aproximativ 5% din permeabilitatea K + sau chiar mai mică, în timp ce potențialele de inversare respective sunt +60 mV pentru sodiu ( E Na ) și −80 mV pentru potasiu ( E K ). Astfel, potențialul membranei nu va fi corect la E K , ci mai degrabă depolarizat de la E K cu o cantitate de aproximativ 5% din diferența de 140 mV dintre E K și E Na . Astfel, potențialul de repaus al celulei va fi de aproximativ -73 mV.
Într-o notație mai formală, potențialul membranei este media ponderată a potențialului de echilibru al fiecărui ion care contribuie. Mărimea fiecărei greutăți este conductanța relativă a fiecărui ion. În cazul normal, în care trei ioni contribuie la potențialul membranei:
- ,
Unde
- E m este potențialul membranei, măsurat în volți
- E X este potențialul de echilibru pentru ionul X, de asemenea, în volți
- g X / g tot este conductanța relativă a ionului X, care este adimensională
- g tot este conductanța totală a tuturor ionilor permeanți în unități arbitrare (de exemplu, siemens pentru conductanța electrică), în acest caz g K + + g Na + + g Cl -
Proteine de transport ale membranei
Pentru determinarea potențialelor de membrană, cele mai importante două tipuri de proteine de transport de ioni de membrană sunt canalele de ioni și transportorii de ioni . Proteinele canalelor ionice creează căi prin membranele celulare prin care ionii se pot difuza pasiv fără cheltuirea directă a energiei metabolice. Au selectivitate pentru anumiți ioni, astfel există canale ionice selective de potasiu , clorură și sodiu . Diferite celule și chiar părți diferite ale unei celule ( dendrite , corpuri celulare , noduri de Ranvier ) vor avea cantități diferite de proteine de transport ionic diferite. De obicei, cantitatea anumitor canale de potasiu este cea mai importantă pentru controlul potențialului de odihnă (vezi mai jos). Unele pompe ionice, cum ar fi Na + / K + -ATPaza, sunt electrogene, adică produc dezechilibru de încărcare pe membrana celulară și pot contribui, de asemenea, direct la potențialul membranei. Majoritatea pompelor folosesc energia metabolică (ATP) pentru a funcționa.
Potențiale de echilibru
Pentru majoritatea celulelor animale, ionii de potasiu (K + ) sunt cei mai importanți pentru potențialul de odihnă. Datorită transportului activ al ionilor de potasiu, concentrația de potasiu este mai mare în interiorul celulelor decât în exterior. Majoritatea celulelor au proteine cu canale ionice selective pentru potasiu care rămân deschise tot timpul. Va exista o mișcare netă a ionilor de potasiu încărcați pozitiv prin aceste canale de potasiu, rezultând acumularea excesului de sarcină negativă în interiorul celulei. Mișcarea exterioară a ionilor de potasiu încărcați pozitiv se datorează mișcării moleculare aleatorii ( difuzie ) și continuă până când se acumulează suficientă sarcină negativă în exces în interiorul celulei pentru a forma un potențial de membrană care poate echilibra diferența de concentrație de potasiu între interiorul și exteriorul celulei. „Echilibru” înseamnă că forța electrică ( potențialul ) care rezultă din acumularea sarcinii ionice și care împiedică difuzia spre exterior, crește până când este egală în mărime, dar opusă în direcția tendinței de mișcare difuzivă spre exterior a potasiului. Acest punct de echilibru este un potențial de echilibru, deoarece fluxul net transmembranar (sau curent ) al lui K + este zero. O bună aproximare pentru potențialul de echilibru al unui ion dat are nevoie doar de concentrațiile de pe ambele părți ale membranei și de temperatură. Poate fi calculat folosind ecuația Nernst :
Unde
- E eq, K + este potențialul de echilibru pentru potasiu, măsurat în volți
- R este constanta universală a gazului , egală cu 8.314 jouli · K −1 · mol −1
- T este temperatura absolută , măsurată în kelvini (= K = grade Celsius + 273,15)
- z este numărul de sarcini elementare ale ionului în cauză implicate în reacție
- F este constanta Faraday , egală cu 96.485 coulombi · mol −1 sau J · V −1 · mol −1
- [K + ] o este concentrația extracelulară de potasiu, măsurată în mol · m −3 sau mmol·l −1
- [K + ] i este, de asemenea, concentrația intracelulară de potasiu
Potențialele de echilibru de potasiu de aproximativ −80 milivolți (negativ interior) sunt comune. Diferențele sunt observate la diferite specii, țesuturi diferite în cadrul aceluiași animal și aceleași țesuturi în condiții de mediu diferite. Aplicând ecuația Nernst de mai sus, se pot explica aceste diferențe prin modificări ale concentrației relative de K + sau diferențe de temperatură.
Pentru utilizarea obișnuită, ecuația Nernst este adesea dată într-o formă simplificată prin asumarea temperaturii tipice a corpului uman (37 ° C), reducerea constantelor și trecerea la baza Log 10. (Unitățile utilizate pentru concentrare nu sunt importante, deoarece se vor anula într-o raport). Pentru potasiu la temperatura normală a corpului se poate calcula potențialul de echilibru în milivolți ca:
De asemenea, potențialul de echilibru pentru sodiu (Na + ) la temperatura normală a corpului uman este calculat folosind aceeași constantă simplificată. Puteți calcula E presupunând o concentrație exterioară, [K + ] o , de 10mM și o concentrație interioară, [K + ] i , de 100mM. Pentru ionii clorură (Cl - ) semnul constantei trebuie inversat (-61,54 mV). Dacă se calculează potențialul de echilibru pentru calciu (Ca 2+ ), sarcina de 2+ înjumătățește constanta simplificată la 30,77 mV. Dacă se lucrează la temperatura camerei, aproximativ 21 ° C, constantele calculate sunt de aproximativ 58 mV pentru K + și Na + , −58 mV pentru Cl - și 29 mV pentru Ca 2+ . La temperatura fiziologică, aproximativ 29,5 ° C și concentrațiile fiziologice (care variază pentru fiecare ion), potențialele calculate sunt de aproximativ 67 mV pentru Na + , −90 mV pentru K + , −86 mV pentru Cl - și 123 mV pentru Ca 2 + .
Potențiale de odihnă
Potențialul de membrană de repaus nu este un potențial de echilibru, deoarece se bazează pe cheltuirea constantă a energiei (pentru pompele ionice, așa cum am menționat mai sus) pentru întreținerea sa. Este un potențial de difuzie dinamic care ia în considerare acest mecanism - cu totul diferit de potențialul de echilibru, ceea ce este adevărat indiferent de natura sistemului luat în considerare. Potențialul de membrană în repaus este dominat de speciile ionice din sistemul care are cea mai mare conductanță în membrană. Pentru majoritatea celulelor, acesta este potasiu. Deoarece potasiul este și ionul cu cel mai negativ potențial de echilibru, de obicei potențialul de repaus nu poate fi mai negativ decât potențialul de echilibru al potasiului. Potențialul de repaus poate fi calculat cu ecuația tensiunii Goldman-Hodgkin-Katz folosind concentrațiile ionilor ca pentru potențialul de echilibru, incluzând, de asemenea, permeabilitățile relative ale fiecărei specii ionice. În condiții normale, este sigur să presupunem că numai ionii de potasiu, sodiu (Na + ) și clorură (Cl - ) joacă un rol important pentru potențialul de odihnă:
Această ecuație seamănă cu ecuația Nernst, dar are un termen pentru fiecare ion permeant. De asemenea, z a fost inserat în ecuație, determinând inversarea concentrațiilor intracelulare și extracelulare ale Cl - în raport cu K + și Na + , deoarece sarcina negativă a clorurii este gestionată prin inversarea fracției din termenul logaritmic. * E m este potențialul membranei, măsurat în volți * R , T și F sunt ca mai sus * P s este permeabilitatea relativă a ionului s * [s] Y este concentrația ionilor s în compartimentul Y ca mai sus. Un alt mod de a vizualiza potențialul membranei, luând în considerare conductanța canalelor ionice, mai degrabă decât permeabilitatea membranei, este utilizarea ecuației Millman (numită și ecuația conductivității acordurilor):
sau reformulat
unde g tot este conductanța combinată a tuturor speciilor ionice, din nou în unități arbitrare. Această din urmă ecuație descrie potențialul de membrană de repaus ca o medie ponderată a potențialelor de inversare ale sistemului, unde greutățile sunt conductanțele relative ale fiecărei specii de ioni ( g X / g tot ). În timpul potențialului de acțiune, aceste greutăți se schimbă. Dacă conductanțele Na + și Cl - sunt nule, potențialul membranei se reduce la potențialul Nernst pentru K + (ca g K + = g tot ). În mod normal, în condiții de repaus g Na + și g Cl− nu sunt zero, dar sunt mult mai mici decât g K + , ceea ce face ca E m să fie aproape de E eq, K + . Afecțiuni medicale , cum ar fi hiperkaliemia in care de sange seric de potasiu (care guvernează [K + ] o ) este schimbat sunt foarte periculoase , deoarece acestea compensate E eq, K + , afectând astfel E m . Acest lucru poate provoca aritmii și stop cardiac . Utilizarea unei injecții în bolus de clorură de potasiu în execuțiile prin injecție letală oprește inima prin deplasarea potențialului de repaus la o valoare mai pozitivă, care depolarizează și contractă celulele cardiace permanent, nepermițând inima să se repolarizeze și astfel să intre în diastolă pentru a fi reumplută cu sânge.
Deși ecuația tensiunii GHK și ecuația lui Millman sunt legate, ele nu sunt echivalente. Diferența critică este că ecuația lui Millman presupune că relația curent-tensiune este ohmică, în timp ce ecuația tensiunii GHK ia în considerare rectificările mici, instantanee prezise de ecuația fluxului GHK cauzată de gradientul de concentrație al ionilor. Astfel, o estimare mai precisă a potențialului membranei poate fi calculată folosind ecuația GHK decât cu ecuația lui Millman.
Măsurarea potențialelor de odihnă
În unele celule, potențialul membranei se schimbă întotdeauna (cum ar fi celulele cardiace ). Pentru astfel de celule nu există niciodată „odihnă” și „potențialul de odihnă” este un concept teoretic. Alte celule cu funcții de transport ale membranei puțin modificate care se schimbă în timp au un potențial de membrană în repaus care poate fi măsurat prin introducerea unui electrod în celulă. Potențialele transmembranare pot fi, de asemenea, măsurate optic cu coloranți care își schimbă proprietățile optice în funcție de potențialul membranei.
Rezumatul valorilor potențiale de repaus în diferite tipuri de celule
| Tipuri de celule | Potențial de odihnă |
|---|---|
| Celulele musculare scheletice | -95 mV |
| Astroglia | -80 la -90 mV |
| Neuroni | -60 la -70 mV |
| Celulele musculare netede | -60 mV |
| Aorta Țesutul muscular neted | -45mV |
| Celulele fotoreceptoare | -40 mV |
| Celula de par ( cohleea ) | -15 până la -40mV |
| Eritrocite | -8,4 mV |
| Condrocite | -8mV |
Istorie
Curenții de odihnă în nervi au fost măsurați și descriși de Julius Bernstein în 1902, unde a propus o „Teorie a membranei” care explica potențialul de odihnă al nervilor și mușchilor ca potențial de difuzie.
Vezi si
Referințe
linkuri externe
- Neuroscience - manual online de Purves și colab.
- Neurochimie de bază Aspecte moleculare, celulare și medicale de Siegel și colab.
- Bertil Hille Canalele ionice ale membranelor excitabile , ediția a III-a, Sinauer Associates, Sunderland, MA (2001). ISBN 0-87893-321-2
- Wright, SH (2004). „Generarea potențialului de membrană în repaus” . Adv Physiol Educ . 28 (1-4): 139-42. doi : 10.1152 / advan.00029.2004 . PMID 15545342 . S2CID 5009629 .
- Potențial de membrană de repaus - Note de curs online despre potențialul de membrană de repaus
- The Origin of the Resting Membrane Potential - Tutorial interactiv online


![E_ {eq, K ^ +} = \ frac {RT} {zF} \ ln \ frac {[K ^ +] _ {o}} {[K ^ +] _ {i}},](https://wikimedia.org/api/rest_v1/media/math/render/svg/b7eb1afcc5d7a5032ff24be5c403b43b1307b01e)
![E _ {{eq, K ^ {+}}} = 61,54mV \ log {\ frac {[K ^ {+}] _ {{o}}} {[K ^ {+}] _ {{i}}} },](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d0b62ffda044574b1a52306113028c6a29c89f2)
![E _ {{m}} = {\ frac {RT} {F}} \ ln {\ left ({\ frac {P _ {{Na ^ {+}}} [Na ^ {+}] _ {{o}} + P _ {{K ^ {+}}} [K ^ {+}] _ {{o}} + P _ {{Cl ^ {-}}} [Cl ^ {-}] _ {{i}}} { P _ {{Na ^ {+}}} [Na ^ {+}] _ {{i}} + P _ {{K ^ {+}}} [K ^ {+}] _ {{i}} + P_ { {Cl ^ {-}}} [Cl ^ {-}] _ {{o}}}} \ right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/aef443116c02ee0a29c6f4d6f5a5fc571e530ec8)

