Chimiosmoza - Chemiosmosis
Chimiosmoza este mișcarea ionilor pe o structură semipermeabilă legată de membrană , în josul gradientului lor electrochimic . Un exemplu în acest sens ar fi formarea de adenozin trifosfat (ATP) prin mișcarea ionilor de hidrogen (H + ) pe o membrană în timpul respirației celulare sau fotosintezei .
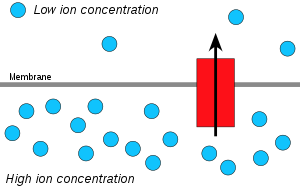
Ionii de hidrogen, sau protoni , se vor difuza de la o zonă cu concentrație mare de protoni la o zonă cu concentrație mai mică de protoni, iar un gradient de concentrație electrochimică a protonilor pe o membrană poate fi valorificat pentru a produce ATP. Acest proces este legat de osmoza , difuzia apei pe o membrană, motiv pentru care se numește „chimiozmoza”.
ATP - sintaza este enzima care face ATP prin chemiosmosis. Permite protonilor să treacă prin membrană și folosește diferența de energie liberă pentru a fosforila adenozin difosfatul (ADP), producând ATP. Generarea de ATP prin chimiozoză are loc în mitocondrii și cloroplaste , precum și în majoritatea bacteriilor și archaea , un lanț de transport de electroni pompează ioni H + (protoni) în spațiile tilacoide prin membranele tilacoide către stroma (fluid) . Energia din mișcarea electronilor prin lanțurile de transport de electroni traversează ATP sintaza, ceea ce permite protonului să treacă prin ele și să utilizeze această diferență de energie liberă pentru a fotofosforila ADP care produce ATP.
Teoria chemiosmotică
Peter D. Mitchell a propus ipoteza chemiosmotică în 1961. Teoria sugerează că , în esență , cele mai multe adenozin trifosfat (ATP) sinteza in respiring celule provine din gradientul electrochimic peste membranele interioare ale mitocondriilor prin utilizarea energiei de NADH și FADH 2 formate din descompunerea bogate în energie molecule , cum ar fi glucoza .
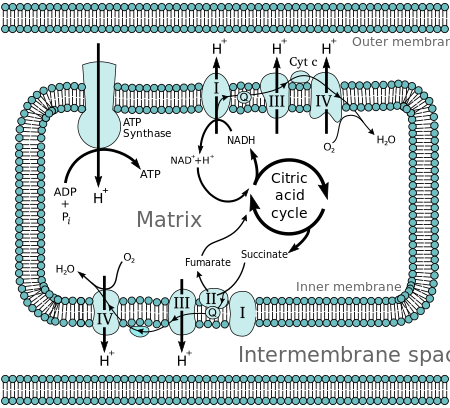
Moleculele precum glucoza sunt metabolizate pentru a produce acetil CoA ca intermediar bogat în energie. Oxidarea de acetil coenzimei A (acetil-CoA) în matricea mitocondrială este cuplat la reducerea unei molecule purtătoare cum ar fi nicotinamid adenin dinucleotid (NAD) și flavin adenin dinucleotid (FAD). Purtătorii transmit electronii către lanțul de transport al electronilor (ETC) din membrana mitocondrială interioară , care la rândul său îi transmit către alte proteine din ETC. Energia disponibilă în electroni este utilizată pentru a pompa protoni din matrice în spațiul intermembranar, stocând energia sub forma unui gradient electrochimic transmembranar . Protonii se mișcă înapoi peste membrana interioară prin enzima ATP sintază . Fluxul de protoni înapoi în matricea mitocondriei prin ATP sintază oferă suficientă energie pentru ca ADP să se combine cu fosfat anorganic pentru a forma ATP. Electronii și protonii de la ultima pompă din ETC sunt preluați de oxigen pentru a forma apă .
Aceasta era o propunere radicală la acea vreme și nu era bine acceptată. Opinia dominantă a fost că energia transferului de electroni a fost stocată ca un intermediar stabil cu potențial ridicat, un concept chimic mai conservator. Problema cu vechea paradigmă este că nu s-a găsit vreodată intermediar cu energie ridicată, iar dovezile pompării protonilor de către complexele lanțului de transfer de electroni au devenit prea mari pentru a fi ignorate. În cele din urmă, greutatea dovezilor a început să favorizeze ipoteza chemiosmotică, iar în 1978 Peter Mitchell a primit Premiul Nobel pentru chimie .
Cuplarea chemiosmotică este importantă pentru producția de ATP în mitocondrii , cloroplaste și multe bacterii și arhee .
Forța moton protonică

Mișcarea ionilor peste membrană depinde de o combinație de doi factori:
- Forța de difuzie cauzată de un gradient de concentrație - toate particulele tind să difuzeze de la o concentrație mai mare la alta.
- Forța electrostatică cauzată de gradientul de potențial electric - cationii precum protonii H + tind să difuzeze potențialul electric, de la partea pozitivă (P) a membranei la partea negativă (N). Anionii se difuzează spontan în direcția opusă.
Acești doi gradienți luați împreună pot fi exprimați ca un gradient electrochimic .
Cu toate acestea, straturile lipidice ale membranelor biologice sunt bariere pentru ioni. Acesta este motivul pentru care energia poate fi stocată ca o combinație a acestor doi gradienți pe membrană. Doar proteinele de membrană speciale, cum ar fi canalele ionice, pot uneori permite ionilor să se deplaseze peste membrană (vezi și: Transportul membranei ). În teoria chemiosmotică sintazele ATP transmembranare sunt foarte importante. Ei convertesc energia fluxului spontan de protoni prin ei în energie chimică a legăturilor ATP.
Prin urmare, cercetătorii au creat termenul forță moton protonică (PMF), derivat din gradientul electrochimic menționat anterior. Poate fi descrisă ca măsura energiei potențiale stocate ca o combinație de gradienți de proton și tensiune (potențial electric) pe o membrană. Gradientul electric este o consecință a separării sarcinii pe membrană (când protonii H + se mișcă fără un contraion , cum ar fi clorura Cl - ).
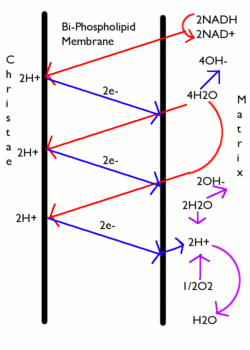
În majoritatea cazurilor, forța motrice a protonilor este generată de un lanț de transport al electronilor care acționează ca o pompă de protoni, folosind energia liberă Gibbs a reacțiilor redox pentru a pompa protoni (ioni de hidrogen) în afara membranei, separând sarcina de-a lungul membranei. În mitocondrii, energia eliberată de lanțul de transport al electronilor este utilizată pentru a muta protoni din matricea mitocondrială (partea N) în spațiul intermembranar (partea P). Mutarea protonilor în afara mitocondriei creează o concentrație mai mică de protoni încărcați pozitiv în interiorul acesteia, rezultând o sarcină negativă în exces în interiorul membranei. Gradientul de potențial electric este de aproximativ -170 mV, negativ în interior (N). Acești gradienți - diferența de încărcare și diferența de concentrație a protonilor creează ambele un gradient electrochimic combinat de-a lungul membranei, adesea exprimat ca forță moton-proton (PMF). În mitocondrii, PMF este aproape în întregime alcătuit din componenta electrică, dar în cloroplaste, PMF este alcătuit în mare parte din gradientul de pH, deoarece încărcarea protonilor H + este neutralizată de mișcarea Cl - și a altor anioni. În ambele cazuri, PMF trebuie să fie mai mare de aproximativ 460 mV (45 kJ / mol) pentru ca ATP sintază să poată produce ATP.
Ecuații
Forța moton protonică este derivată din energia liberă a lui Gibbs . Fie N să denotă interiorul unei celule și să denotă P exteriorul. Atunci
Unde
- este modificarea energiei libere Gibbs pe cantitatea unitară de cationi transferată de la P la N;
- este numărul de încărcare al cationului ;
- este potențialul electric al lui N față de P;
- și sunt concentrațiile cationice la P și respectiv N;
- este constanta Faraday ;
- este constanta gazului ; și
- este temperatura .
Schimbarea energiei libere molare Gibbs este frecvent interpretată ca un potențial ionic electrochimic molar .
Pentru un gradient electrochimic de protoni și ca o consecință:
Unde
- .
Mitchell a definit forța proton-motivantă (PMF) ca fiind
- .
De exemplu, implică . La această ecuație ia forma:
.
Rețineți că pentru importul spontan de protoni din partea P (relativ mai pozitivă și acidă) în partea N (relativ mai negativă și alcalină), este negativ (similar cu ) în timp ce PMF este pozitiv (similar cu potențialul celulelor redox ).
Este demn de remarcat faptul că, la fel ca în orice proces de transport transmembranar, PMF este direcțional. Semnul diferenței de potențial electric transmembranar este ales pentru a reprezenta schimbarea energiei potențiale pe unitate de încărcare care curge în celulă ca mai sus. Mai mult, datorită pompării de protoni condusă de redox de către locurile de cuplare, gradientul de protoni este întotdeauna alcalin în interior. Din ambele motive, protonii curg în mod spontan, din partea P în partea N; energia liberă disponibilă este utilizată pentru a sintetiza ATP (vezi mai jos). Din acest motiv, PMF este definit pentru importul de protoni, care este spontan. PMF pentru exportul de protoni, adică pomparea de protoni, catalizată de siturile de cuplare, este pur și simplu negativul PMF (import).
Spontaneitatea importului de protoni (de la P la partea N) este universală în toate membranele bioenergetice. Acest fapt nu a fost recunoscut înainte de anii 1990, deoarece lumenul tilacoid al cloroplastului a fost interpretat ca o fază interioară, dar de fapt este echivalent topologic cu exteriorul cloroplastului. Azzone și colab. a subliniat că faza interioară (partea N a membranei) este citoplasma bacteriană, matricea mitocondrială sau stroma cloroplastului; partea exterioară (P) este spațiul periplasmatic bacterian, spațiul intermembranar mitocondrial sau lumenul cloroplast. Mai mult, tomografia 3D a membranei interioare mitocondriale arată invaginațiile sale extinse care trebuie stivuite, asemănător discurilor tilacoide; prin urmare, spațiul intermembranar mitocondrial este topologic destul de similar cu lumenul cloroplastului:
Energia exprimată aici ca energie liberă a lui Gibbs, gradient electrochimic de protoni sau forță proton-mobilă (PMF), este o combinație de doi gradienți de-a lungul membranei:
- gradientul de concentrație (via ) și
- gradient de potențial electric .
Atunci când un sistem ajunge la echilibru, ; cu toate acestea, concentrațiile de pe ambele părți ale membranei nu trebuie să fie egale. Mișcarea spontană prin membrana potențială este determinată atât de concentrația, cât și de gradienții potențiali electrici.
Energia liberă molară Gibbs a sintezei ATP
se mai numește potențial de fosforilare. Raportul concentrației de echilibru poate fi calculat prin compararea și , de exemplu, în cazul mitocondriei mamiferelor:
H + / ATP = ΔG p / (Δp / 10,4 kJ · mol −1 / mV) = 40,2 kJ · mol −1 / (173,5 mV / 10,4 kJ · mol −1 / mV) = 40,2 / 16,7 = 2,4. Raportul real dintre subunitatea c care leagă protonii și numerele de copiere ale subunității beta care sintetizează ATP este de 8/3 = 2,67, arătând că în aceste condiții, mitocondriunea funcționează la o eficiență de 90% (2,4 / 2,67).
De fapt, eficiența termodinamică este mai mare în celulele eucariote, deoarece ATP trebuie exportat din matrice în citoplasmă, iar ADP și fosfat trebuie importate din citoplasmă. Acest lucru „costă” un import „suplimentar” de protoni per ATP, prin urmare eficiența reală este de numai 65% (= 2,4 / 3,67).
În mitocondrii

Defalcarea completă a glucozei în prezența oxigenului se numește respirație celulară . Ultimii pași ai acestui proces au loc în mitocondrii. Moleculele reduse NADH și FADH 2 sunt generate de ciclul Krebs , glicoliză și procesarea piruvatului . Aceste molecule trec electronii către un lanț de transport al electronilor , care folosește energia eliberată pentru a crea un gradient de protoni peste membrana mitocondrială internă . ATP sintaza folosește apoi energia stocată în acest gradient pentru a produce ATP. Acest proces se numește fosforilare oxidativă, deoarece folosește energia eliberată de oxidarea NADH și FADH2 pentru a fosforila ADP în ATP .
La plante
Cele Reacțiile ușoare ale fotosintezei generează ATP prin acțiunea chemiosmosis. Cei fotonii din lumina soarelui sunt primite de către complexul de antenă fotosistemul II , care excită electronii la o mai mare nivel de energie . Acești electroni călătoresc pe un lanț de transport al electronilor , provocând pomparea activă a protonilor peste membrana tilacoidă în lumenul tilacoid . Acești protoni curg apoi pe gradientul lor de potențial electrochimic printr-o enzimă numită ATP-sintază, creând ATP prin fosforilarea ADP în ATP. Electronii din reacția inițială a luminii ajung la Photosystem I , apoi sunt ridicați la un nivel de energie mai ridicat de energia luminii și apoi primiți de un acceptor de electroni și reduc NADP + la NADPH . Electronii pierduți din Photosystem II sunt înlocuiți de oxidarea apei, care este „împărțită” în protoni și oxigen de către complexul care evoluează oxigenul (OEC, cunoscut și sub numele de WOC, sau complexul de oxidare a apei). Pentru a genera o moleculă de oxigen diatomic, 10 fotoni trebuie absorbiți de fotosistemele I și II, patru electroni trebuie să se deplaseze prin cele două fotosisteme și se generează 2 NADPH (folosite ulterior pentru fixarea dioxidului de carbon în ciclul Calvin).
La procariote

Bacteriile si Archaea , de asemenea , se pot folosi chemiosmosis pentru a genera ATP. Cianobacteriile , bacteriile cu sulf verde și bacteriile violet sintetizează ATP printr-un proces numit fotofosforilare . Aceste bacterii folosesc energia luminii pentru a crea un gradient de protoni folosind un lanț fotosintetic de transport al electronilor . Bacteriile non-fotosintetice precum E. coli conțin, de asemenea, ATP sintază . De fapt, mitocondriile și cloroplastele sunt produsul endosimbiozei și se regăsesc în procariotele încorporate. Acest proces este descris în teoria endosimbiotică . Originea mitocondriului a declanșat originea eucariotelor, iar originea plastidului originea Archaeplastida, unul dintre principalele supergrupuri eucariote.
Fosforilarea chimiosmotică este a treia cale care produce ATP din fosfat anorganic și o moleculă ADP. Acest proces face parte din fosforilarea oxidativă.
Vezi si
Referințe
Lecturi suplimentare
- Referință manual de biochimie, din raftul NCBI - Jeremy M. Berg; John L. Tymoczko; Lubert Stryer (eds.). "18.4. Un gradient de protoni alimentează sinteza ATP". Biochimie (ed. A V-a). WH Freeman.
- Referință tehnică referitoare la un set de experimente care vizează testarea unor principii ale teoriei chemiosmotice - Seiji Ogawa și Tso Ming Lee (1984). „Relația dintre potențialul de fosforilare internă și forța motivă a protonului în mitocondrii în timpul sintezei și hidrolizei ATP”. Jurnalul de chimie biologică . 259 (16): 10004–10011. PMID 6469951 .

![{\ displaystyle \ Delta \! G = zF \ Delta \! \ psi + RT \ ln {\ frac {[\ mathrm {X} ^ {z +}] _ {\ text {N}}} {[\ mathrm {X } ^ {z +}] _ {\ text {P}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e49984fb465bfe70fdf147d5c94b4691fde30b93)




![{\ displaystyle [\ mathrm {X} ^ {z +}] _ {\ text {P}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b04667620cf542631c6a2a692aefd89310230ddd)
![{\ displaystyle [\ mathrm {X} ^ {z +}] _ {\ text {N}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f4da81b44fd243b0610ca90f2a571ffe2891ad71)





![{\ displaystyle \ Delta \! \ mu _ {\ mathrm {H} ^ {+}} = F \ Delta \! \ psi + RT \ ln {\ frac {[\ mathrm {H} ^ {+}] _ { \ text {N}}} {[\ mathrm {H} ^ {+}] _ {\ text {P}}}} = F \ Delta \! \ psi - (\ ln 10) RT \ Delta \ mathrm {pH }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9401e1568170355be3a960a583f16f2d93c5a842)













![{\ displaystyle [\ mathrm {H} ^ {+}] / [\ mathrm {ATP}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0e253bb9b194bd7dd88012ff9e7acd912dbf6931)
