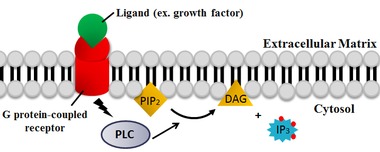
Fosfolipaza C - Phospholipase C

Fosfolipaza C ( PLC ) este o clasă de enzime asociate membranei care scindează fosfolipidele chiar înainte de gruparea fosfat (vezi figura). Cel mai frecvent se consideră că este sinonim cu formele umane ale acestei enzime, care joacă un rol important în fiziologia celulelor eucariote , în special căile de transducție a semnalului . Rolul fosfolipazei C în transducția semnalului este scindarea fosfatidilinozitolului 4,5-bisfosfat (PIP 2 ) în diacil glicerol (DAG) și inozitol 1,4,5-trisfosfat (IP 3 ), care servesc drept al doilea mesager . Activatorii fiecărui PLC variază, dar includ de obicei subunități de proteine G heterotrimerice , proteine tirozin kinaze , proteine G mici , Ca 2+ și fosfolipide.
Există treisprezece tipuri de fosfolipază C de mamifere care sunt clasificate în șase izotipuri (β, γ, δ, ε, ζ, η) în funcție de structură. Fiecare PLC are controale unice și suprapuse asupra expresiei și distribuției subcelulare.
Variante
Variante de mamifere
Numărul extins de funcții exercitate de reacția PLC necesită ca aceasta să fie strict reglementată și capabilă să răspundă la intrări multiple extra și intracelulare cu cinetică adecvată. Această nevoie a ghidat evoluția a șase izotipuri de PLC la animale, fiecare cu un mod distinct de reglare. Pre-ARNm-ul PLC poate fi, de asemenea, supus unei îmbinări diferențiale, astfel încât un mamifer poate avea până la 30 de enzime PLC.
- beta: PLCB1 , PLCB2 , PLCB3 , PLCB4
- gamma: PLCG1 , PLCG2
- delta: PLCD1 , PLCD3 , PLCD4
- epsilon: PLCE1
- eta: PLCH1 , PLCH2
- zeta: PLCZ1
- fosfolipază asemănătoare C: PLCL1 , PLCL2
Variante bacteriene
Majoritatea variantelor bacteriene ale fosfolipazei C sunt caracterizate într-unul din cele patru grupe de proteine legate structural. Fosfolipazele toxice C sunt capabile să interacționeze cu membranele celulare eucariote și să hidrolizeze fosfatidilcolina și sfingomielina, ducând în cele din urmă la liza celulară.
- Zinc-metalofosfolipaze C: toxina alfa Clostridium perfringens , Bacillus cereus PLC (BC-PLC)
- Sfingomielinaze: B. cereus , Staphylococcus aureus
- Enzime hidrolizante ale fosfatidilinozitolului: B. cereus , B. thuringiensis , L. monocytogenes (PLC-A)
- Fosfolipaze Pseudomonad C: Pseudomonas aeruginosa (PLC-H și PLC-N)
Structura enzimatică

La mamifere, PLC-urile au o structură de bază conservată și diferă în alte domenii specifice fiecărei familii. Enzima de bază include un butoi divizat triosefosfat izomerază (TIM) , domeniul omologiei pleckstrinei (PH) , patru domenii de mână EF tandem și un domeniu C2 . Butoiul TIM conține situsul activ, toate reziduurile catalitice și un situs de legare a Ca 2+ . Are un insert autoinhibitor care își întrerupe activitatea numită linker XY. S-a arătat că linkerul XY exclude site-ul activ, iar cu eliminarea acestuia este activat PLC.
Genele care codifică toxina alfa ( Clostridium perfringens ) , Bacillus cereus PLC (BC-PLC) și PLC de la Clostridium bifermentans și Listeria monocytogenes au fost izolate și nucleotide secvențiate. Există o omologie semnificativă a secvențelor, aproximativ 250 de reziduuri, de la capătul N-terminal. Alfa-toxina are încă 120 de reziduuri în capătul C-terminal. Capătul C-terminal al toxinei alfa a fost raportat ca un domeniu „asemănător C2”, făcând referire la domeniul C2 găsit în eucariote care sunt implicate în transducția semnalului și prezente în fosfoinozid fosfoipipaza C la mamifere .
Mecanism enzimatic
Reacția primară catalizată de PLC are loc pe un substrat insolubil la o interfață lipidă-apă. Reziduurile din situl activ sunt conservate în toate izotipurile PLC. La animale, PLC catalizează selectiv hidroliza fosfolipidului fosfatidilinozitol 4,5-bisfosfat (PIP 2 ) pe partea glicerol a legăturii fosfodiester. Există formarea unui intermediar slab legat de enzime, inozitol 1,2-fosfodiester ciclic și eliberare de diacilglicerol (DAG) . Intermediarul este apoi hidrolizat în inozitol 1,4,5-trisfosfat (IP 3 ) . Astfel, cele două produse finale sunt DAG și IP 3 . Cataliza acid / bază necesită două reziduuri de histidină conservate și un ion Ca2 + este necesar pentru hidroliza PIP 2 . S-a observat că site-ul activ Ca 2+ coordonează cu patru reziduuri acide și dacă oricare dintre reziduuri sunt mutate, atunci este necesară o concentrație mai mare de Ca 2+ pentru cataliză.
Regulament
Activare
Receptorii care activează această cale sunt în principal receptori cuplați la proteina G cuplați la subunitatea G αq , inclusiv:
- 5-HT 2 serotoninergici receptorilor
- Receptorii adrenergici α 1 (Alpha-1)
- Receptorii calcitoninei
- Receptorii histaminei H 1
- Receptorii glutamat metabotrop , grupa I
- M 1 , M 3 și M 5 receptorii muscarinici
- Receptorul hormonalului care eliberează tiroida în glanda pituitară anterioară
Alți activatori minori decât G αq sunt:
- MAP kinază . Activatorii acestei căi includ PDGF și FGF .
- Complexul βγ al proteinelor G heterotrimerice , ca într-o cale minoră de eliberare a hormonului de creștere de către hormonul de eliberare a hormonului de creștere .
- Receptorii canabinoizi
Inhibitie
- Molecula mică U73122: aminosteroid, inhibitor supus PLC. Cu toate acestea, specificitatea U73122 a fost pusă la îndoială. S-a raportat că U73122 activează activitatea fosfolipazei PLC-urilor purificate.
- Edelfozină : agent anti-neoplazic asemănător lipidelor (ET-18-OCH3)
- Autoinhibarea linkerului XY în celulele de mamifere: Se propune ca linkerul XY să fie format din întinderi lungi de aminoacizi acizi care formează zone dense de sarcină negativă. Aceste zone ar putea fi respinse de membrana încărcată negativ la legarea PLC de lipidele membranei. Se crede că combinația dintre respingere și constrângeri sterice îndepărtează linkerul XY de lângă locul activ și ameliorează autoinhibiția.
- Compușii care conțin schela acidului morfolinobenzoic aparțin unei clase de inhibitori PLC specifici fosfatidilcolinei de tip medicamentos
- o -fenantrolină: compus organic heterociclic, cunoscut pentru inhibarea zinc-metaloenzimelor
- EDTA: moleculă care chelează ionii Zn 2+ și inactivează eficient PLC, cunoscut pentru a inhiba zinc-metaloenzimele
Funcția biologică
PLC scindează fosfolipidul fosfatidilinozitol 4,5-bisfosfat (PIP 2 ) în diacil glicerol (DAG) și inozitol 1,4,5-trisfosfat (IP 3 ). Astfel PLC are un impact profund asupra epuizării PIP 2 , care acționează ca o ancoră a membranei sau un regulator alosteric și un agonist pentru multe canale ionice lipidice . PIP 2 acționează, de asemenea, ca substrat pentru sinteza 3,4,5-trisfosfatului lipidic mai rar fosfatidilinozitol (PIP 3 ) , care este responsabil pentru semnalizarea în reacții multiple. Prin urmare, epuizarea PIP 2 de reacția PLC este critică pentru reglarea concentrațiilor locale de PIP 3 atât în membrana plasmatică, cât și în membrana nucleară.
Cele două produse ale reacției catalizate de PLC, DAG și IP 3 , sunt mesaje secundare importante care controlează diverse procese celulare și sunt substraturi pentru sinteza altor molecule de semnalizare importante. Când PIP 2 este clivat, DAG rămâne legat de membrană și IP 3 este eliberat ca o structură solubilă în citosol . IP 3 difuzează apoi prin citosol pentru a se lega de receptorii IP 3 , în special canalele de calciu din reticulul endoplasmatic neted (ER). Acest lucru determină creșterea concentrației citosolice de calciu, provocând o cascadă de modificări și activități intracelulare. În plus, calciu și DAG lucrează împreună pentru a activa proteina kinază C , care continuă să fosforileze alte molecule, ducând la alterarea activității celulare. Efectele finale includ gustul, promovarea tumorii, precum și exocitoza veziculelor, producția de superoxid din NADPH oxidază și activarea JNK .
Atât DAG cât și IP 3 sunt substraturi pentru sinteza moleculelor reglatoare. DAG este substratul pentru sinteza acidului fosfatidic , o moleculă reglatoare. IP 3 este substratul care limitează viteza pentru sinteza polifosfaților inozitolici, care stimulează protein kinaze multiple, transcripția și procesarea ARNm. Reglarea activității PLC este astfel vitală pentru coordonarea și reglarea altor enzime ale căilor care sunt centrale în controlul fiziologiei celulare.
În plus, fosfolipaza C joacă un rol important în calea inflamației. Legarea agoniștilor, cum ar fi trombina , epinefrina sau colagenul , la receptorii de pe suprafața trombocitelor poate declanșa activarea fosfolipazei C pentru a cataliza eliberarea acidului arahidonic din două fosfolipide membranare majore, fosfatidilinozitol și fosfatidilcolină . Acidul arahidonic poate continua în calea ciclooxigenazei (producând prostoglandine (PGE1, PGE2, PGF2), prostacicline (PGI2) sau tromboxani (TXA2)) și calea lipoxigenazei (producând leucotriene (LTB4, LTC4, LTD4, LTE4)) .
Varianta bacteriană Clostridium perfringens tip A produce toxina alfa. Toxina are activitate de fosfolipază C și provoacă hemoliză , letalitate și dermonecroză. La concentrații mari, toxina alfa induce degradarea masivă a fosfatidilcolinei și sfingomielinei , producând diacilglicerol și , respectiv, ceramidă . Aceste molecule participă apoi la căile de transducție a semnalului. S-a raportat că toxina activează cascada acidului arahidonic în aorta de șobolan izolată. Contracției induse de toxine a fost legată de generarea de A tromboxan 2 din acid arahidonic. Astfel, probabil că PLC bacterian imită acțiunile PLC endogen în membranele celulare eucariote.
Vezi si
- Glicozilfosfatidilinozitol diacilglicerol-liază EC 4.6.1.14 O enzimă tripanosomală.
- Fosfatidilinozitol diacilglicerol-liază CE 4.6.1.13 O altă enzimă bacteriană înrudită
- Fosfoinozid fosfolipază C EC 3.1.4.11 Principala formă întâlnită la eucariote, în special la mamifere.
- Familia de enzime bacteriene fosfolipază C dependentă de zinc CE 3.1.4.3 care include toxinele alfa ale C. perfringens (cunoscută și sub numele de lecitinază ), P. aeruginosa și S. aureus .