Toxicitate pentru oxigen - Oxygen toxicity
| Toxicitatea oxigenului | |
|---|---|
| Alte nume | Sindrom de toxicitate a oxigenului, intoxicație cu oxigen, otrăvire cu oxigen |
 | |
| În 1942–43, guvernul britanic a efectuat teste ample pentru toxicitatea oxigenului la scafandri. Camera este presurizată cu aer la 3,7 bari . Subiectul din centru respiră 100% oxigen dintr-o mască. | |
| Specialitate | Medicină de urgență |
Toxicitatea oxigenului este o afecțiune care rezultă din efectele nocive ale respirației oxigenului molecular ( O
2) la presiuni parțiale crescute . Cazurile severe pot duce la deteriorarea celulelor și la moarte, cu efecte observate cel mai adesea în sistemul nervos central, plămâni și ochi. Istoric vorbind, sistemul nervos central condiție a fost numit Paul Bert efect , iar pulmonare de starea Lorrain Smith efectul , dupa cercetatorii care au fost pionierii descoperirile și descrierile la sfârșitul secolului al 19 - lea. Toxicitatea oxigenului este o preocupare pentru scafandrii subacvatici , cei cu concentrații mari de oxigen suplimentar (în special copiii prematuri ) și cei supuși terapiei cu oxigen hiperbar .
Rezultatul respirației presiunilor parțiale crescute de oxigen este hiperoxia , un exces de oxigen în țesuturile corpului. Corpul este afectat în moduri diferite, în funcție de tipul de expunere. Toxicitatea sistemului nervos central este cauzată de expunerea scurtă la presiuni parțiale ridicate de oxigen la o presiune mai mare decât atmosferică. Toxicitatea pulmonară și oculară rezultă din expunerea mai lungă la niveluri crescute de oxigen la presiune normală. Simptomele pot include dezorientarea, probleme de respirație și modificări ale vederii, cum ar fi miopia . Expunerea prelungită la presiuni parțiale mai sus normale de oxigen, sau expuneri mai scurte la presiuni parțiale foarte mari, pot provoca leziuni oxidative a membranelor celulare , colapsul alveolelor in plamani, dezlipirea de retină și convulsii . Toxicitatea oxigenului este gestionată prin reducerea expunerii la niveluri crescute de oxigen. Studiile arată că, pe termen lung, este posibilă o recuperare robustă de la majoritatea tipurilor de toxicitate a oxigenului.
Protocoale pentru evitarea efectelor hiperoxiei există în câmpurile în care oxigenul este respirat la presiuni parțiale mai mari decât cele normale, inclusiv scufundări subacvatice folosind gaze de respirație comprimate , medicamente hiperbare, îngrijire neonatală și zboruri spațiale umane . Aceste protocoale au dus la creșterea rarității convulsiilor datorită toxicității oxigenului, leziunile pulmonare și oculare fiind limitate în principal la problemele de gestionare a sugarilor prematuri.
În ultimii ani, oxigenul a devenit disponibil pentru uz recreativ în barele de oxigen . Administrația SUA pentru Alimente și Medicamente a avertizat pe cei care suferă de probleme precum boli de inimă sau pulmonare să nu folosească bare de oxigen. Scafandrii folosesc gaze respiratorii care conțin până la 100% oxigen și ar trebui să aibă o pregătire specifică în utilizarea acestor gaze.
Clasificare
Efectele toxicității oxigenului pot fi clasificate de organele afectate, producând trei forme principale:
- Sistemul nervos central, caracterizat prin convulsii urmate de inconștiență, care apare în condiții hiperbarice;
- Pulmonar (plămâni), caracterizat prin dificultăți de respirație și durere în piept, care apare atunci când respirați presiuni crescute de oxigen pentru perioade prelungite;
- Oculare ( afecțiuni retinopatice ), caracterizate prin modificări ale ochilor, care apar atunci când respirați presiuni crescute de oxigen pentru perioade prelungite.
Toxicitatea oxigenului din sistemul nervos central poate provoca convulsii, scurte perioade de rigiditate urmate de convulsii și inconștiență și este îngrijorătoare pentru scafandrii care se confruntă cu presiuni mai mari decât atmosferice. Toxicitatea pulmonară a oxigenului duce la deteriorarea plămânilor, provocând durere și dificultăți de respirație. Leziunile oxidative ale ochiului pot duce la miopie sau detașare parțială a retinei . Leziunile pulmonare și oculare sunt cel mai probabil să apară atunci când oxigenul suplimentar este administrat ca parte a unui tratament, în special la nou-născuți, dar sunt, de asemenea, o preocupare în timpul terapiei cu oxigen hiperbar.
Deteriorarea oxidativă poate apărea în orice celulă a corpului, dar efectele asupra celor mai sensibile trei organe vor fi principala preocupare. Poate fi, de asemenea, implicat în afectarea celulelor roșii din sânge ( hemoliză ), ficatului , inimii , glandelor endocrine ( glandele suprarenale , gonadelor și tiroidei ) sau rinichilor și afectarea generală a celulelor .
În circumstanțe neobișnuite, pot fi observate efecte asupra altor țesuturi: se suspectează că în timpul zborului spațial, concentrații mari de oxigen pot contribui la deteriorarea oaselor. Hiperoxia poate provoca, de asemenea, indirect narcoză cu dioxid de carbon la pacienții cu afecțiuni pulmonare, cum ar fi boala pulmonară obstructivă cronică sau cu depresie respiratorie centrală. Hiperventilația aerului atmosferic la presiuni atmosferice nu provoacă toxicitate la oxigen, deoarece aerul de la nivelul mării are o presiune parțială de oxigen de 0,21 bar (21 kPa), în timp ce toxicitatea nu apare sub 0,3 bar (30 kPa).
semne si simptome
| Expunere (min.) | Num. de subiecte | Simptome |
|---|---|---|
| 96 | 1 | Orbire prelungită; vărsături spasmodice severe |
| 60-69 | 3 | Răsucire severă a buzelor; Euforie; Greață și vertij; zvâcnirea brațului |
| 50-55 | 4 | Răsucire severă a buzelor; Uimi; Îngroșarea buzelor; a adormit; Amețit |
| 31-35 | 4 | Greață, vertij, zvâcniri ale buzelor; Convuls |
| 21-30 | 6 | Convuls; Somnolenţă; Răsucire severă a buzelor; aura epigastrică; zvâcnește brațul L; amnezie |
| 16–20 | 8 | Convuls; Vertij și zvâcniri severe ale buzelor; aura epigastrică; respirație spasmodică; |
| 11-15 | 4 | Predominanță inspiratorie; zvâcniri ale buzelor și sincopă; Greață și confuzie |
| 6-10 | 6 | Amețit și zvâcnit de buze; parestezii; vertij; „Spasm diafragmatic”; Greață severă |
Sistem nervos central
Toxicitatea oxigenului din sistemul nervos central se manifestă ca simptome cum ar fi modificări vizuale (în special vederea tunelului ), sunete în urechi ( tinitus ), greață , zvâcniri (în special ale feței), modificări de comportament (iritabilitate, anxietate , confuzie) și amețeli . Aceasta poate fi urmată de o criză tonico-clonică constând din două faze: contracția musculară intensă are loc timp de câteva secunde (faza tonică); urmată de spasme rapide de relaxare și contracție musculară alternativă producând sacadări convulsive ( faza clonică ). Sechestrul se încheie cu o perioadă de inconștiență ( starea postictală ). Debutul convulsiei depinde de presiunea parțială a oxigenului din gazul de respirație și de durata expunerii. Cu toate acestea, timpul de expunere înainte de debut este imprevizibil, deoarece testele au arătat o mare variație, atât în rândul indivizilor, cât și la același individ de la o zi la alta. În plus, mulți factori externi, precum imersiunea subacvatică, expunerea la frig și exercițiile fizice vor reduce timpul până la apariția simptomelor sistemului nervos central. Scăderea toleranței este strâns legată de reținerea dioxidului de carbon . Alți factori, precum întunericul și cofeina , cresc toleranța la animalele testate, dar aceste efecte nu au fost dovedite la om.
Plămânii
Simptomele de toxicitate pulmonară rezultă dintr-o inflamație care începe în căile respiratorii care duce la plămâni și apoi se răspândește în plămâni ( arborele traheobronșic ). Simptomele apar în partea superioară a pieptului (regiunea substernalå și carinal regiuni). Aceasta începe ca o gâdilă ușoară la inhalare și progresează către tuse frecventă. Dacă respirația crește presiunile parțiale de oxigen continuă, pacienții prezintă o arsură ușoară la inhalare, împreună cu tuse incontrolabilă și dificultăți de respirație ocazionale ( dispnee ). Descoperirile fizice legate de toxicitatea pulmonară au inclus sunete de barbotare auzite printr-un stetoscop ( raze de barbotare ), febră și creșterea fluxului sanguin către mucoasa nasului ( hiperaemie a mucoasei nazale ). Razele X ale plămânilor prezintă mici modificări pe termen scurt, dar expunerea extinsă duce la creșterea umbririi difuze în ambii plămâni. Măsurătorile funcției pulmonare sunt reduse, după cum se observă printr-o reducere a cantității de aer pe care plămânii o pot deține ( capacitatea vitală ) și modificări ale funcției expiratorii și ale elasticității pulmonare. Testele la animale au indicat o variație a toleranței similară cu cea constatată în toxicitatea sistemului nervos central, precum și variații semnificative între specii. Când expunerea la oxigen peste 0,5 bari (50 kPa) este intermitentă, permite plămânilor să se recupereze și întârzie debutul toxicității.
Ochi
La copiii prematuri, semne de afectare a ochiului ( retinopatie de prematuritate sau ROP) sunt observate printr-un oftalmoscop ca o delimitare între regiunile vascularizate și non-vascularizate ale retinei unui sugar. Gradul acestei delimitări este utilizat pentru a desemna patru etape: (I) delimitarea este o linie; (II) demarcația devine o creastă; (III) creșterea de noi vase de sânge are loc în jurul creastei; (IV) retina începe să se detașeze de peretele interior al ochiului ( coroida ).
Cauze
Toxicitatea oxigenului este cauzată de expunerea la oxigen la presiuni parțiale mai mari decât cele la care corpul este în mod normal expus. Acest lucru se întâmplă în trei condiții principale: scufundări subacvatice, oxigenoterapie hiperbară și furnizarea de oxigen suplimentar, în special pentru sugarii prematuri. În fiecare caz, factorii de risc sunt semnificativ diferiți.
Toxicitatea sistemului nervos central
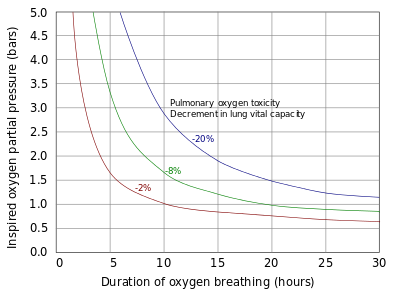
Expunerile, de la minute la câteva ore, la presiuni parțiale de oxigen de peste 1,6 bari (160 kPa ) - de aproximativ opt ori presiunea parțială atmosferică normală - sunt de obicei asociate cu toxicitatea oxigenului din sistemul nervos central și sunt cel mai probabil să apară la pacienții supuși oxigenului hiperbar. terapie și scafandri. Deoarece presiunea atmosferică la nivelul mării este de aproximativ 1 bar (100 kPa), toxicitatea sistemului nervos central poate apărea numai în condiții hiperbarice , unde presiunea ambiantă este peste normal. Scufundătorii care respiră aer la adâncimi peste 60 m (200 ft) se confruntă cu un risc crescut de toxicitate a oxigenului „lovit” (convulsie). Scafandrii care respiră un amestec de gaze îmbogățit cu oxigen, cum ar fi nitrox , pot suferi în mod similar o convulsie la adâncimi mai mici, în cazul în care acestea coboară sub adâncimea maximă de funcționare admisă pentru amestec.
Toxicitate pulmonară
Plămânii și restul căilor respiratorii sunt expuși la cea mai mare concentrație de oxigen din corpul uman și, prin urmare, sunt primele organe care prezintă toxicitate. Toxicitatea pulmonară apare numai cu expunerea la presiuni parțiale de oxigen mai mari de 0,5 bar (50 kPa), corespunzătoare unei fracțiuni de oxigen de 50% la presiunea atmosferică normală. Cele mai vechi semne de toxicitate pulmonară încep cu dovezi de traheobronșită sau inflamație a căilor respiratorii superioare, după o perioadă asimptomatică între 4 și 22 de ore cu mai mult de 95% oxigen, cu unele studii care sugerează că simptomele încep de obicei după aproximativ 14 ore la acest nivel de oxigen.
La presiuni parțiale de oxigen de 2 până la 3 bari (200 până la 300 kPa) - 100% oxigen la presiunea atmosferică de 2 până la 3 ori - aceste simptome pot începe încă din 3 ore după expunerea la oxigen. Experimentele pe șobolani care respiră oxigen la presiuni cuprinse între 1 și 3 bare (100 și 300 kPa) sugerează că manifestările pulmonare ale toxicității oxigenului nu pot fi aceleași pentru condițiile normobarice ca și pentru condițiile hiperbarice . Dovada scăderii funcției pulmonare măsurată prin testarea funcției pulmonare poate apărea la 24 de ore de expunere continuă la 100% oxigen, cu dovezi ale afectării alveolare difuze și apariția sindromului de detresă respiratorie acută care apare de obicei după 48 de ore cu 100% oxigen . Respirarea 100% oxigen duce, de asemenea, la prăbușirea alveolelor ( atelectazie ), în timp ce - la aceeași presiune parțială a oxigenului - prezența presiunilor parțiale semnificative de gaze inerte, de obicei azot, va împiedica acest efect.
Se știe că nou-născuții prematuri prezintă un risc mai mare de displazie bronhopulmonară cu expunere prelungită la concentrații mari de oxigen. Alte grupuri cu risc mai mare de toxicitate la oxigen sunt pacienții cu ventilație mecanică cu expunere la niveluri de oxigen mai mari de 50% și pacienții expuși la substanțe chimice care cresc riscul de toxicitate la oxigen, cum ar fi agentul chimioterapeutic bleomicină . Prin urmare, ghidurile actuale pentru pacienții cu ventilație mecanică în terapie intensivă recomandă menținerea concentrației de oxigen sub 60%. De asemenea, scafandrii care sunt supuși tratamentului bolii de decompresie prezintă un risc crescut de toxicitate a oxigenului, deoarece tratamentul implică expunerea la perioade lungi de respirație a oxigenului în condiții hiperbarice, în plus față de orice expunere la oxigen în timpul scufundării.
Toxicitate oculară
Expunerea prelungită la fracțiuni de oxigen inspirate provoacă daune retinei . Deteriorarea ochiului în curs de dezvoltare a sugarilor expuși la o fracțiune mare de oxigen la presiune normală are un mecanism și un efect diferit de leziunile oculare suferite de scafandrii adulți în condiții hiperbarice. Hiperoxia poate fi un factor care contribuie la tulburarea numită fibroplazie retrolentală sau retinopatie de prematuritate (POR) la sugari. La sugarii prematuri, retina nu este adesea complet vascularizată. Retinopatia prematură apare atunci când dezvoltarea vasculaturii retiniene este oprită și apoi se desfășoară anormal. Asociat cu creșterea acestor noi vase este țesutul fibros (țesutul cicatricial) care se poate contracta pentru a provoca detașarea retinei. Expunerea suplimentară la oxigen, deși este un factor de risc , nu este principalul factor de risc pentru dezvoltarea acestei boli. Restricționarea consumului suplimentar de oxigen nu reduce neapărat rata de retinopatie a prematurității și poate crește riscul de complicații sistemice legate de hipoxie.
Miopia hiperoxică a apărut la scufundătorii cu circuit închis de respirație a oxigenului cu expuneri prelungite. De asemenea, apare frecvent la cei supuși terapiei repetate cu oxigen hiperbar. Acest lucru se datorează unei creșteri a puterii de refracție a obiectivului , deoarece lungimea axială și citirile keratometriei nu dezvăluie o bază corneeană sau de lungime pentru o miopie. De obicei este reversibilă cu timpul.
Mecanism
Baza biochimică a toxicității oxigenului este reducerea parțială a oxigenului cu unul sau doi electroni pentru a forma specii reactive de oxigen, care sunt produse secundare naturale ale metabolismului normal al oxigenului și au roluri importante în semnalizarea celulară . O specie produsă de organism, anionul superoxid ( O-
2), este posibil implicat în achiziționarea fierului. Concentrații mai mari decât cele normale de oxigen duc la niveluri crescute de specii reactive de oxigen. Oxigenul este necesar pentru metabolismul celular, iar sângele îl furnizează în toate părțile corpului. Când oxigenul este respirat la presiuni parțiale ridicate, o afecțiune hiperoxică se va răspândi rapid, cele mai vascularizate țesuturi fiind cele mai vulnerabile. În perioadele de stres ambiental, nivelurile de specii reactive de oxigen pot crește dramatic, ceea ce poate deteriora structurile celulare și poate produce stres oxidativ .
În timp ce toate mecanismele de reacție ale acestor specii din corp nu sunt încă pe deplin înțelese, unul dintre cei mai reactivi produși ai stresului oxidativ este radicalul hidroxil ( · OH ), care poate iniția o reacție în lanț dăunătoare a peroxidării lipidelor în lipidele nesaturate din interior. membrane celulare . Concentrațiile mari de oxigen cresc, de asemenea, formarea altor radicali liberi , cum ar fi oxidul nitric , peroxinitritul și trioxidanul , care dăunează ADN-ului și altor biomolecule. Deși organismul are multe sisteme antioxidante , cum ar fi glutationul, care protejează împotriva stresului oxidativ, aceste sisteme sunt în cele din urmă copleșite la concentrații foarte mari de oxigen liber, iar rata de deteriorare a celulelor depășește capacitatea sistemelor care îl previn sau repară. Apoi rezultă daune celulare și moarte celulară.
Diagnostic
Diagnosticul toxicității oxigenului sistemului nervos central la scafandri înainte de convulsii este dificil, deoarece simptomele tulburărilor vizuale, problemelor urechii, amețelilor, confuziei și greaței se pot datora multor factori comuni mediului subacvatic, precum narcoză , congestie și răceală. Cu toate acestea, aceste simptome pot fi utile în diagnosticarea primelor etape ale toxicității oxigenului la pacienții supuși terapiei cu oxigen hiperbar. În ambele cazuri, cu excepția cazului în care există antecedente de epilepsie sau testele indică hipoglicemie , o criză care apare în timpul respirației oxigenului la presiuni parțiale mai mari de 1,4 bari (140 kPa) sugerează un diagnostic de toxicitate a oxigenului.
Diagnosticul displaziei bronhopulmonare la nou-născuții cu dificultăți de respirație este dificil în primele câteva săptămâni. Cu toate acestea, dacă respirația sugarului nu se îmbunătățește în acest timp, pot fi utilizate teste de sânge și raze X pentru a confirma displazia bronhopulmonară. În plus, o ecocardiogramă poate ajuta la eliminarea altor cauze posibile, cum ar fi defecte cardiace congenitale sau hipertensiune arterială pulmonară .
Diagnosticul de retinopatie de prematuritate la sugari este de obicei sugerat de cadrul clinic. Prematuritatea, greutatea redusă la naștere și antecedentele de expunere la oxigen sunt principalii indicatori, în timp ce nu s-a dovedit că există factori ereditari care să producă un model.
Prevenirea
Prevenirea toxicității oxigenului depinde în întregime de setare. Atât sub apă, cât și în spațiu, măsurile de precauție adecvate pot elimina cele mai periculoase efecte. Copiii prematuri necesită de obicei oxigen suplimentar pentru a trata complicațiile nașterii premature. În acest caz, prevenirea displaziei bronhopulmonare și a retinopatiei de prematuritate trebuie efectuată fără a compromite un aport de oxigen adecvat pentru a păstra viața sugarului.
Sub apă
Toxicitatea oxigenului este un pericol catastrofal în scufundări , deoarece o criză duce la moarte aproape sigură prin înecare. Convulsia poate apărea brusc și fără simptome de avertizare. Efectele sunt convulsii bruște și inconștiență, în timpul cărora victimele își pot pierde regulatorul și se pot îneca. Unul dintre avantajele unei măști de scufundare full-face este prevenirea pierderii regulatorului în cazul unei crize. Deoarece există un risc crescut de toxicitate a oxigenului în sistemul nervos central la scufundări adânci, scufundări lungi și scufundări în care se utilizează gaze de respirație bogate în oxigen, scafandrii sunt învățați să calculeze o adâncime maximă de funcționare pentru gazele de respirație bogate în oxigen și buteliile care conțin astfel de amestecuri ar trebui să fie clar marcate cu acea adâncime.
În unele cursuri de formare a scafandrilor pentru aceste tipuri de scufundări, scafandrii sunt învățați să planifice și să monitorizeze ceea ce se numește „ceasul cu oxigen” al scufundărilor lor. Acesta este un ceas cu alarmă noțional, care se bifează mai repede la presiunea crescută a oxigenului și este setat să se activeze la limita maximă de expunere unică recomandată în Manualul național de scufundări pentru administrația oceanică și atmosferică . Pentru următoarele presiuni parțiale de oxigen, limitele sunt: 45 minute la 1,6 bar (160 kPa), 120 minute la 1,5 bar (150 kPa), 150 minute la 1,4 bar (140 kPa), 180 minute la 1,3 bar (130 kPa) și 210 minute la 1,2 bari (120 kPa), dar este imposibil să se prevadă cu siguranță dacă sau când vor apărea simptome de toxicitate. Multe computere de scufundare capabile de nitrox calculează o încărcare de oxigen și o pot urmări pe mai multe scufundări. Scopul este de a evita activarea alarmei prin reducerea presiunii parțiale a oxigenului din gazul de respirație sau prin reducerea timpului de respirație a gazului cu o presiune parțială de oxigen mai mare. Pe măsură ce presiunea parțială a oxigenului crește odată cu fracția de oxigen din gazul de respirație și adâncimea scufundării, scafandrul obține mai mult timp pe ceasul de oxigen scufundându-se la o adâncime mai mică, respirând un gaz mai puțin bogat în oxigen sau scurtând durata expunerii la gazele bogate în oxigen.
Scufundarea sub 56 m (184 ft) pe aer ar expune un scafandru la pericolul crescut de toxicitate a oxigenului, deoarece presiunea parțială a oxigenului depășește 1,4 bari (140 kPa), deci trebuie utilizat un amestec de gaze care conține mai puțin de 21% oxigen (o amestec hipoxic). Creșterea proporției de azot nu este viabilă, deoarece ar produce un amestec puternic narcotic . Cu toate acestea, heliul nu este narcotic și un amestec utilizabil poate fi amestecat fie prin înlocuirea completă a azotului cu heliu (amestecul rezultat se numește heliox ), fie prin înlocuirea unei părți a azotului cu heliu, producând un trimix .
Toxicitatea oxigenului pulmonar este un eveniment complet evitabil în timpul scufundării. Durata limitată și natura intermitentă naturală a majorității scufundărilor fac din aceasta o complicație relativ rară (și chiar și atunci reversibilă) pentru scafandri. Liniile directoare stabilite permit scafandrilor să calculeze când sunt expuși riscului de toxicitate pulmonară. În scufundările de saturație, acesta poate fi evitat prin limitarea conținutului de oxigen al gazului în zonele de locuit la sub 0,4 bar.
Setare hiperbară
Prezența unei febre sau a unui istoric de convulsii este o contraindicație relativă la tratamentul cu oxigen hiperbar. Programele utilizate pentru tratamentul bolilor de decompresie permit perioade de respirație a aerului mai degrabă decât 100% oxigen (pauze de oxigen) pentru a reduce șansele de convulsii sau leziuni pulmonare. Marina americană utilizează tabele de tratament bazate pe perioade care alternează între 100% oxigen și aer. De exemplu, tabelul USN 6 necesită 75 de minute (trei perioade de 20 minute oxigen / 5 minute aer) la o presiune ambientală de 2,8 atmosfere standard (280 kPa), echivalentă cu o adâncime de 18 metri (60 ft). Aceasta este urmată de o reducere lentă a presiunii la 1,9 atm (190 kPa) timp de 30 de minute cu oxigen. Pacientul rămâne apoi la acea presiune încă 150 de minute, constând din două perioade de 15 minute aer / 60 minute oxigen, înainte ca presiunea să fie redusă la atmosferă timp de 30 minute cu oxigen.
Vitamina E și seleniul au fost propuse și ulterior respinse ca o metodă potențială de protecție împotriva toxicității pulmonare a oxigenului. Există totuși unele dovezi experimentale la șobolani că vitamina E și seleniu ajută la prevenirea peroxidării lipidice in vivo și a deteriorării radicalilor liberi și, prin urmare, previn modificările retinei în urma expunerilor repetate de oxigen hiperbar.
Setarea normobarică
Displazia bronhopulmonară este reversibilă în stadiile incipiente prin utilizarea perioadelor de pauză la presiuni mai mici de oxigen, dar în cele din urmă poate avea ca rezultat leziuni pulmonare ireversibile, dacă li se permite să progreseze până la leziuni severe. Este necesară una sau două zile de expunere fără pauze de oxigen pentru a provoca astfel de daune.
Retinopatia prematură este în mare măsură prevenită prin screening. Liniile directoare actuale impun ca toți copiii cu vârsta gestațională mai mică de 32 de săptămâni sau cu o greutate la naștere mai mică de 1,5 kg (3,3 lb) să fie supuși screeningului pentru retinopatie prematură cel puțin o dată la două săptămâni. Studiul Național Cooperativ din 1954 a arătat o legătură cauzală între oxigenul suplimentar și retinopatia prematură, dar reducerea ulterioară a oxigenului suplimentar a determinat o creștere a mortalității infantile. Pentru a echilibra riscurile de hipoxie și retinopatie ale prematurității, protocoalele moderne necesită acum monitorizarea nivelului de oxigen din sânge la sugarii prematuri care primesc oxigen.
Setarea hipobarică
În medii cu presiune scăzută, toxicitatea oxigenului poate fi evitată, deoarece toxicitatea este cauzată de presiunea parțială ridicată a oxigenului, nu doar de fracția ridicată de oxigen. Acest lucru este ilustrat de utilizarea modernă a oxigenului pur în costumele spațiale, care trebuie să funcționeze la presiune scăzută (de asemenea, din punct de vedere istoric, s-a folosit un procent foarte ridicat de oxigen și o presiune atmosferică mai mică decât cea normală în navele spațiale timpurii, de exemplu, navele spațiale Gemeni și Apollo ). În astfel de aplicații, cum ar fi activitatea extra-vehiculară , oxigenul cu fracțiune ridicată este netoxic, chiar și atunci când fracțiunile de amestec respirator se apropie de 100%, deoarece presiunea parțială a oxigenului nu este permisă să depășească cronic 0,3 bari (4,4 psi).
Management

În timpul terapiei cu oxigen hiperbar, pacientul va respira 100% oxigen dintr-o mască în timp ce se află într-o cameră hiperbară presurizată cu aer la aproximativ 2,8 bari (280 kPa). Convulsiile în timpul terapiei sunt gestionate prin îndepărtarea măștii de la pacient, scăzând astfel presiunea parțială a oxigenului inspirată sub 0,6 bari (60 kPa).
O criză subacvatică necesită scufundarea să fie adusă la suprafață cât mai curând posibil. Deși de mulți ani recomandarea a fost să nu ridicați scafandrul în timpul convulsiei în sine, din cauza pericolului de embolie a gazelor arteriale (AGE), există unele dovezi că glota nu obstrucționează complet căile respiratorii. Acest lucru a condus la recomandarea actuală a Comitetului de scufundări al Societății Medicale Submarine și Hiperbarice, potrivit căreia un scafandru ar trebui crescut în timpul fazei clonice (convulsive) a crizei, dacă regulatorul nu se află în gura scafandrului - deoarece pericolul de înec este mai mare decât cea a AGE - dar ascensiunea ar trebui întârziată până la sfârșitul fazei clonice altfel. Salvatorii se asigură că propria lor siguranță nu este compromisă în timpul fazei convulsive. Apoi se asigură că acolo unde este stabilită alimentarea cu aer a victimei, aceasta este menținută și efectuează un ascensor controlat . Ridicarea unui corp inconștient este predată de majoritatea agențiilor de instruire a scafandrilor recreativi ca o abilitate avansată, iar pentru scafandrii profesioniști este o abilitate de bază, deoarece este una dintre funcțiile principale ale scafandrului de așteptare . La atingerea suprafeței, serviciile de urgență sunt întotdeauna contactate, deoarece există posibilitatea unor complicații suplimentare care necesită asistență medicală. Marina SUA are proceduri pentru finalizarea opririlor de decompresie acolo unde o cameră de recompresie nu este disponibilă imediat.
Apariția simptomelor displaziei bronhopulmonare sau a sindromului de detresă respiratorie acută este tratată prin scăderea fracției de oxigen administrat, împreună cu o reducere a perioadelor de expunere și o creștere a perioadelor de pauză în care este furnizat aer normal. În cazul în care este necesar oxigen suplimentar pentru tratamentul unei alte boli (în special la sugari), poate fi necesar un ventilator pentru a se asigura că țesutul pulmonar rămâne umflat. Reducerea presiunii și a expunerii se va face progresiv și pot fi utilizate medicamente precum bronhodilatatoare și surfactanți pulmonari .
Scafandrii gestionează riscul de leziuni pulmonare prin limitarea expunerii la nivelurile dovedite a fi în general acceptabile prin dovezi experimentale, folosind un sistem de unități acumulate de toxicitate a oxigenului care se bazează pe timpul de expunere la presiuni parțiale specificate. În cazul unui tratament de urgență pentru boala de decompresie, poate fi necesar să se depășească limitele normale de expunere pentru a gestiona simptome mai critice.
Retinopatia prematură poate regresa spontan, dar în cazul în care boala progresează dincolo de un prag (definit ca cinci ore contigue sau opt ore cumulate de etapa 3 a retinopatiei prematurității ), s-a demonstrat că atât criochirurgia , cât și chirurgia cu laser reduc riscul orbirii ca rezultat. Acolo unde boala a progresat în continuare, tehnici precum flambarea sclerală și chirurgia vitrectomiei pot ajuta la reatașarea retinei.
Prognoză
Deși convulsiile cauzate de toxicitatea oxigenului sistemului nervos central pot duce la vătămarea accidentală a victimei, a rămas nesigură timp de mulți ani dacă ar putea apărea leziuni ale sistemului nervos în urma crizei și mai multe studii au căutat dovezi ale unor astfel de leziuni. O imagine de ansamblu a acestor studii realizată de Bitterman în 2004 a concluzionat că, după îndepărtarea gazului de respirație care conține fracțiuni mari de oxigen, nu rămân daune neurologice pe termen lung din criză.
Majoritatea sugarilor care au supraviețuit după o incidență a displaziei bronhopulmonare vor recupera în cele din urmă funcția pulmonară aproape normală, deoarece plămânii continuă să crească în primii 5-7 ani, iar daunele cauzate de displazia bronhopulmonară sunt într-o oarecare măsură reversibile (chiar și la adulți ). Cu toate acestea, este probabil ca acestea să fie mai susceptibile la infecții respiratorii pentru tot restul vieții, iar severitatea infecțiilor ulterioare este adesea mai mare decât cea a colegilor lor.
Retinopatia prematură (POR) la sugari regresează frecvent fără intervenție și vederea poate fi normală în anii următori. În cazul în care boala a progresat până la etapele care necesită intervenție chirurgicală, rezultatele sunt în general bune pentru tratamentul POR de stadiul 3, dar sunt mult mai grave pentru etapele ulterioare. Deși chirurgia are de obicei succes în refacerea anatomiei ochiului, deteriorarea sistemului nervos prin progresia bolii duce la rezultate comparativ mai slabe în restabilirea vederii. Prezența altor boli care complică, de asemenea, reduce probabilitatea unui rezultat favorabil.
Epidemiologie
Incidența toxicității sistemului nervos central în scafandri a scăzut de la al doilea război mondial, deoarece s-au dezvoltat protocoale pentru a limita expunerea și presiunea parțială a oxigenului inspirat. În 1947, Donald a recomandat limitarea adâncimii permise pentru respirația oxigenului pur la 7,6 m (25 ft), ceea ce echivalează cu o presiune parțială de oxigen de 1,8 bar (180 kPa). De-a lungul timpului această limită a fost redusă, până astăzi este recomandată în general o limită de 1,4 bar (140 kPa) în timpul unei scufundări recreative și 1,6 bar (160 kPa) în timpul opririlor de decompresie superficială. Toxicitatea oxigenului a devenit acum o apariție rară, alta decât atunci când este cauzată de defecțiuni ale echipamentului și de erori umane. Din punct de vedere istoric, marina SUA și-a rafinat tabelele manuale de scufundări marine pentru a reduce incidentele de toxicitate a oxigenului. Între 1995 și 1999, rapoartele au arătat 405 scufundări susținute de suprafață folosind tabelele de heliu-oxigen; dintre acestea, simptomele toxicității oxigenului au fost observate la 6 scufundări (1,5%). Drept urmare, Marina SUA în 2000 a modificat programele și a efectuat teste pe teren de 150 de scufundări, dintre care niciuna nu a produs simptome de toxicitate la oxigen. Tabelele revizuite au fost publicate în 2001.
Variabilitatea toleranței și alți factori variabili, cum ar fi volumul de muncă, au dus la abandonarea screening-ului pentru toleranța la oxigen din partea US Navy. Dintre cele 6.250 de teste de toleranță la oxigen efectuate între 1976 și 1997, au fost observate doar 6 episoade de toxicitate la oxigen (0,1%).
Toxicitatea oxigenului sistemului nervos central la pacienții supuși terapiei cu oxigen hiperbaric este rară și este influențată de mai mulți factori: sensibilitatea individuală și protocolul de tratament; și probabil indicarea terapiei și echipamentul utilizat. Un studiu realizat de Welslau în 1996 a raportat 16 incidente dintr-o populație de 107.264 de pacienți (0,015%), în timp ce Hampson și Atik în 2003 au constatat o rată de 0,03%. Yildiz, Ay și Qyrdedi, într-un rezumat de 36.500 de tratamente pentru pacienți între 1996 și 2003, au raportat doar 3 incidente de toxicitate a oxigenului, oferind o rată de 0,008%. O revizuire ulterioară a peste 80.000 de tratamente pentru pacienți a relevat o rată chiar mai mică: 0,0024%. Reducerea incidenței poate fi parțial datorată utilizării unei măști (mai degrabă decât a unei hote) pentru a furniza oxigen.
Displazia bronhopulmonară se numără printre cele mai frecvente complicații ale sugarilor născuți prematur și incidența sa a crescut odată cu creșterea supraviețuirii sugarilor extrem de prematuri. Cu toate acestea, severitatea a scăzut, deoarece o mai bună gestionare a oxigenului suplimentar a dus la boala care este acum legată în principal de alți factori decât hiperoxia.
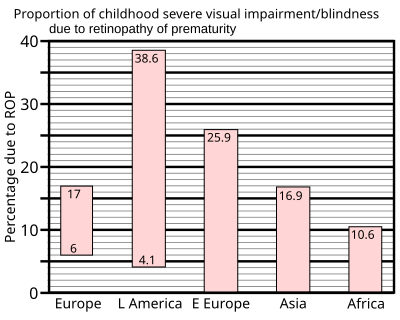
În 1997, un rezumat al studiilor efectuate pe unitățile de terapie intensivă neonatală din țările industrializate a arătat că până la 60% dintre copiii cu greutate redusă la naștere au dezvoltat retinopatie prematură, care a crescut la 72% la copiii cu greutate extrem de mică la naștere, definită ca fiind mai mică de 1 kg (2,2 lb) la naștere. Cu toate acestea, rezultatele severe sunt mult mai puțin frecvente: pentru copiii cu greutate foarte mică la naștere - cei mai mici de 1,5 kg (3,3 lb) la naștere - s-a constatat că incidența orbirii nu depășește 8%.
Istorie
Toxicitatea sistemului nervos central a fost descrisă pentru prima dată de Paul Bert în 1878. El a arătat că oxigenul este toxic pentru insecte, arahnide , miriapode , moluște, râme, ciuperci, semințe germinative, păsări și alte animale. Toxicitatea sistemului nervos central poate fi denumită „efectul Paul Bert”.
Toxicitatea pulmonară a oxigenului a fost descrisă pentru prima dată de J. Lorrain Smith în 1899, când a observat toxicitatea sistemului nervos central și a descoperit în experimente la șoareci și păsări că 0,43 bari (43 kPa) nu au avut efect, dar 0,75 bari (75 kPa) de oxigen au fost pulmonari. iritant. Toxicitatea pulmonară poate fi denumită „efectul Lorrain Smith”. Prima expunere umană înregistrată a fost efectuată în 1910 de Bornstein, când doi bărbați au respirat oxigen la 2,8 bari (280 kPa) timp de 30 de minute, în timp ce el a continuat la 48 de minute fără simptome. În 1912, Bornstein a dezvoltat crampe în mâini și picioare în timp ce respira oxigen la 2,8 bari (280 kPa) timp de 51 de minute. Smith a continuat apoi să arate că expunerea intermitentă la un gaz care respiră cu mai puțin oxigen a permis plămânilor să se recupereze și a întârziat apariția toxicității pulmonare.
Albert R. Behnke și colab. în 1935 au fost primii care au observat contracția câmpului vizual ( viziunea tunelului ) la scufundări între 1,0 bari (100 kPa) și 4,1 bari (410 kPa). În timpul celui de-al doilea război mondial, Donald și Yarbrough și colab. au efectuat peste 2.000 de experimente privind toxicitatea oxigenului pentru a susține utilizarea inițială a respiratoarelor de oxigen cu circuit închis . Scafandrii navali din primii ani ai scufundărilor de oxigen au dezvoltat o mitologie despre un monstru numit „Oxigen Pete”, care se ascundea în fundul „vasului umed” al Unității Experimentale de Scufundări a Amiralității (o cameră hiperbară plină cu apă ) pentru a prinde scafandri neatenți. Ei au numit a avea un atac de toxicitate cu oxigenul „a obține un Pete”.
În deceniul care a urmat celui de-al doilea război mondial, Lambertsen și colab. a făcut descoperiri suplimentare cu privire la efectele respirației de oxigen sub presiune și metodele de prevenire. Munca lor asupra expunerilor intermitente pentru extinderea toleranței la oxigen și a unui model de predicție a toxicității pulmonare a oxigenului bazată pe funcția pulmonară sunt documente cheie în dezvoltarea procedurilor standard de operare atunci când respirați presiuni crescute de oxigen. Lucrarea lui Lambertsen care arată efectul dioxidului de carbon în scăderea timpului până la apariția simptomelor sistemului nervos central a influențat munca de la ghidurile actuale de expunere la proiectarea viitoare a aparatelor de respirație .
Retinopatia prematurității nu a fost observată înainte de al doilea război mondial, dar odată cu disponibilitatea oxigenului suplimentar în deceniul următor, a devenit rapid una dintre principalele cauze ale orbirii infantile în țările dezvoltate. Până în 1960, utilizarea oxigenului a devenit identificată ca un factor de risc și administrarea sa a fost restricționată. Scăderea rezultată a retinopatiei prematurii a fost însoțită de o creștere a mortalității infantile și de complicații legate de hipoxie . De atunci, o monitorizare și un diagnostic mai sofisticate au stabilit protocoale pentru consumul de oxigen care urmăresc echilibrul dintre condițiile hipoxice și problemele de retinopatie a prematurității.
Displazia bronhopulmonară a fost descrisă pentru prima dată de Northway în 1967, care a subliniat condițiile care ar duce la diagnostic. Acest lucru a fost extins ulterior de Bancalari și în 1988 de Shennan, care a sugerat că nevoia de oxigen suplimentar la 36 de săptămâni ar putea prezice rezultatele pe termen lung. Cu toate acestea, Palta și colab. în 1998 a concluzionat că dovezile radiografice au fost cel mai precis predictor al efectelor pe termen lung.
Bitterman și colab. în 1986 și 1995 au arătat că întunericul și cofeina ar întârzia apariția modificărilor activității electrice a creierului la șobolani. În anii care au urmat, cercetările privind toxicitatea sistemului nervos central s-au concentrat pe metodele de prevenire și extinderea sigură a toleranței. Sensibilitatea la toxicitatea oxigenului din sistemul nervos central s-a dovedit a fi afectată de factori precum ritmul circadian , medicamentele, vârsta și sexul. În 1988, Hamilton și colab. a scris proceduri pentru Administrația Națională Oceanică și Atmosferică pentru a stabili limite de expunere la oxigen pentru operațiunile de habitat . Chiar și astăzi, modelele pentru predicția toxicității pulmonare a oxigenului nu explică toate rezultatele expunerii la presiuni parțiale ridicate de oxigen.
Societate și cultură
Scafandrii recreaționali respira de obicei nitrox conținând până la 40% oxigen, în timp ce scafandrii tehnici folosesc oxigen pur sau nitrox conținând până la 80% oxigen. Scafandrii care respiră fracțiuni de oxigen mai mari decât aerul (21%) trebuie să fie instruiți în ceea ce privește pericolele de toxicitate a oxigenului și cum să le prevină. Pentru a cumpăra nitrox, un scafandru trebuie să prezinte dovezi ale unei astfel de calificări.
De la sfârșitul anilor 1990, utilizarea recreativă a oxigenului a fost promovată de barele de oxigen, unde clienții respiră oxigen printr-o canulă nazală . S-au susținut că acest lucru reduce stresul, crește energia și reduce efectele mahmurelii și durerilor de cap, în ciuda lipsei de dovezi științifice care să le susțină. Există, de asemenea, dispozitive la vânzare care oferă „masaj cu oxigen” și „detoxifiere cu oxigen” cu pretenții de a elimina toxinele corporale și de a reduce grăsimea corporală. Lung Asociatia Americana a declarat „nu exista nici o dovada ca oxigenul la nivelurile de curgere scăzute utilizate în baruri pot fi periculoase pentru sănătatea unei persoane normale a lui“, dar US Centrul de Evaluare a Medicamentului si de cercetare atrage atentia ca persoanele cu inima sau boli pulmonare au nevoie de oxigen suplimentar reglat cu atenție și nu trebuie să folosească bare de oxigen.
Societatea victoriană a avut o fascinație pentru domeniul științei care se extinde rapid. În „ Experimentul Dr. Ox ”, o nuvelă scrisă de Jules Verne în 1872, medicul omonim folosește electroliza apei pentru a separa oxigenul și hidrogenul. Apoi pompează oxigenul pur în orașul Quiquendone, provocând locuitorii în mod normal liniștiți și animalele lor să devină agresivi și plantele să crească rapid. O explozie de hidrogen și oxigen din fabrica doctorului Ox duce la sfârșitul experimentului său. Verne și-a rezumat povestea explicând că efectele oxigenului descrise în poveste erau propria sa invenție. Există, de asemenea, un scurt episod de intoxicație cu oxigen în „ De la Pământ la Lună ”.
Vezi si
- Efectul oxigenului asupra bolii pulmonare obstructive cronice
- Narcoză cu azot - Efecte narcotice reversibile ale azotului respirator la presiuni parțiale ridicate
Referințe
Surse
- Clark, James M; Thom, Stephen R (2003). „Oxigen sub presiune”. În Brubakk, Alf O; Neuman, Tom S (eds.). Fiziologia și medicina scufundării a lui Bennett și Elliott (ediția a 5-a). Statele Unite: Saunders. pp. 358–418. ISBN 978-0-7020-2571-6. OCLC 51607923 .
- Clark, John M; Lambertsen, Christian J (1970). „Toleranța pulmonară a oxigenului la om și derivarea curbelor de toleranță pulmonară la oxigen” . Raportul IFEM nr . 1-70 . Philadelphia, PA: Centrul de date privind stresul biomedical de mediu, Institutul de Medicină de Mediu, Centrul Medical al Universității din Pennsylvania. Arhivat din original la 7 octombrie 2008 . Accesat la 29 aprilie 2008 .
- Donald, Kenneth W (1947). „Otrăvirea oxigenului la om: partea I” . British Medical Journal . 1 (4506): 667-72. doi : 10.1136 / bmj.1.4506.667 . PMC 2053251 . PMID 20248086 .
-
Donald, Kenneth W (1947). „Otrăvirea oxigenului la om: partea II” . British Medical Journal . 1 (4507): 712–17. doi : 10.1136 / bmj.1.4507.712 . PMC 2053400 . PMID 20248096 .
- Versiune revizuită a articolelor lui Donald, disponibilă și ca:
- Donald, Kenneth W (1992). Oxigenul și scafandrul . Marea Britanie: Harley Swan, 237 de pagini. ISBN 1-85421-176-5. OCLC 26894235 .
- Hamilton, Robert W; Thalmann, Edward D (2003). „Practica de decompresie”. În Brubakk, Alf O; Neuman, Tom S (eds.). Fiziologia și medicina scufundării a lui Bennett și Elliott (ediția a 5-a). Statele Unite: Saunders. pp. 475–79. ISBN 978-0-7020-2571-6. OCLC 51607923 .
- Lang, Michael A, ed. (2001). Proceduri atelier DAN nitrox . Durham, NC: Divers Alert Network, 197 pagini. Arhivat din original la 16 septembrie 2011 . Adus la 20 septembrie 2008 .
- Regillo, Carl D; Brown, Gary C; Flynn, Harry W (1998). Boala vitreoretiniană: elementele esențiale . New York: Thieme, 693 de pagini. ISBN 978-0-86577-761-3. OCLC 39170393 .
- US Navy Supervisor of Diving (2011). US Navy Diving Manual (PDF) . SS521-AG-PRO-010 0910-LP-106-0957, revizuirea 6 cu modificarea A introdusă. Comandamentul SUA pentru sistemele navale maritime. Arhivat din original (PDF) la 10 decembrie 2014 . Accesat la 29 ianuarie 2015 .
Lecturi suplimentare
- Lamb, John S. (1999). Practica măsurării oxigenului pentru scafandri . Flagstaff: Best Publishing, 120 de pagini. ISBN 0-941332-68-3. OCLC 44018369 .
- Lippmann, John; Bugg, Stan (1993). Manualul de urgență pentru scufundări . Teddington, Marea Britanie: publicații Underwater World. ISBN 0-946020-18-3. OCLC 52056845 .
- Lippmann, John; Mitchell, Simon (2005). "Oxigen". Mai adânc în scufundări (ediția a II-a). Victoria, Australia: JL Publications. pp. 121–24. ISBN 0-9752290-1-X. OCLC 66524750 .
linkuri externe
General
Următorul site extern este un compendiu de resurse:
- Rubicon Research Repository - Colecție online de cercetare a toxicității oxigenului
De specialitate
Următoarele site-uri externe conțin resurse specifice anumitor subiecte:
- Conferința tehnică de scufundări în rețeaua Divers Alert 2008 - Video al prelegerii „Oxigen Toxicity” de Dr. Richard Vann (descărcare gratuită, mp4, 86MB).
- Nosek, Thomas M. „Secțiunea 4 / 4ch7 / s4ch7_7” . Elementele esențiale ale fiziologiei umane . Arhivat din original la 24 martie 2016. - Discutarea efectelor respirației de oxigen asupra sistemului respirator.
- Rajiah, Prabhakar (11 martie 2009). „Displazia bronhopulmonară” . eMedicină . WebMD . Accesat la 29 iunie 2009 . - Prezentare clinică cu referințe.
| Clasificare |
|---|