Baricitinib - Baricitinib
| |||
| Date clinice | |||
|---|---|---|---|
| Denumiri comerciale | Olumiant, alții | ||
| Alte nume | INCB28050, LY3009104 | ||
| AHFS / Drugs.com | Monografie | ||
| MedlinePlus | a618033 | ||
| Date despre licență | |||
Categoria sarcinii |
|||
| Căi de administrare |
Pe cale orală ( comprimate ) | ||
| Codul ATC | |||
| Statut juridic | |||
| Statut juridic | |||
| Date farmacocinetice | |||
| Biodisponibilitate | 79% | ||
| Legarea proteinelor | 50% | ||
| Metabolism | CYP3A4 (<10%) | ||
| Timp de înjumătățire prin eliminare | 12,5 ore | ||
| Excreţie | 75% urină, 20% fecale | ||
| Identificatori | |||
| |||
| Numar CAS | |||
| PubChem CID | |||
| DrugBank | |||
| ChemSpider | |||
| UNII | |||
| KEGG | |||
| ChEBI | |||
| ChEMBL | |||
| Ligand PDB | |||
| CompTox Dashboard ( EPA ) | |||
| ECHA InfoCard |
100.219.080 |
||
| Date chimice și fizice | |||
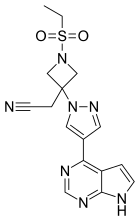
| Formulă | C 16 H 17 N 7 O 2 S | ||
| Masă molară | 371,42 g · mol −1 | ||
| Model 3D ( JSmol ) | |||
| |||
| |||
Baricitinib , vândut sub numele de marca Olumiant printre altele, este un medicament pentru tratamentul artritei reumatoide (RA) la adulți a căror boală nu a fost bine controlată de inhibitorii factorului de necroză tumorală (TNF) . Acționează ca un inhibitor al janus kinazei (JAK), blocând subtipurile JAK1 și JAK2 . Medicamentul este aprobat pentru uz medical în Uniunea Europeană și în Statele Unite. Un efect secundar important al inhibitorilor JAK este infecțiile bacteriene, micobacteriene, fungice și virale grave.
Utilizări medicale
În februarie 2017, baricitinibul a fost aprobat pentru utilizare în UE ca terapie de a doua linie pentru artrita reumatoidă activă moderată până la severă la adulți, fie singuri, fie în asociere cu metotrexat .
La 31 mai 2018, FDA a aprobat barictinib pentru tratamentul adulților cu poliartrită reumatoidă activă moderată până la severă, care au avut un răspuns inadecvat la unul sau mai multe terapii antagoniste ale TNF.
Contraindicații
În timpul sarcinii, utilizarea baricitinibului este contraindicată.
Efecte secundare
În studii, infecțiile tractului respirator superior și nivelurile ridicate de colesterol din sânge ( hipercolesterolemie ) au apărut la mai mult de 10% dintre pacienți. Efectele secundare mai puțin frecvente au inclus alte infecții, cum ar fi herpes zoster , herpes simplex , infecții ale tractului urinar și gastroenterită .
Interacțiuni
Fiind metabolizată doar într-o mică măsură, substanța are un potențial redus de interacțiuni. In studiile, inhibitori ai enzimelor hepatice CYP3A4 , CYP2C19 și CYP2C9 , precum și CYP3A4 inductor rifampicină , nu a avut nici o influență relevantă asupra concentrațiilor baricitinib in fluxul sanguin. În timp ce baricitinib blochează o serie de proteine transportoare in vitro , interacțiunile relevante din punct de vedere clinic prin acest mecanism sunt considerate foarte improbabile, cu excepția poate pentru transportorul cationic SLC22A1 (OCT1).
Nu poate fi exclus un efect aditiv cu alte imunosupresoare .
Farmacologie
Mecanism de acțiune
Baricitinib este un inhibitor al Janus kinazei (JAK) care inhibă reversibil Janus kinaza 1 cu o concentrație inhibitorie maximă jumătate (IC 50 ) de 5,9 nM și Janus kinaza 2 cu un IC 50 de 5,7 nM. Tirozin kinaza 2 , care aparține aceleiași familii de enzime, este afectată mai puțin (IC 50 = 53 nM), iar Janus kinaza 3 mult mai puțin (IC 50 > 400 nM). Printr-o cale de transducție a semnalului care implică proteine STAT , aceasta modulează în cele din urmă expresia genelor în celulele imunologice.
Alți inhibitori JAK includ tofacitinib , care este indicat pentru tratamentul artritei reumatoide, a artritei psoriazice și a colitei ulcerative; fedratinib și ruxolitinib .
Farmacocinetica
Substanța este absorbită rapid din intestin cu o biodisponibilitate absolută de 79%. Atinge nivelul cel mai mare al plasmei sanguine după aproximativ o oră; la diferiți indivizi timpul pentru a atinge acest nivel variază de la 0,5 la 3 ore. Aportul alimentar nu are nicio influență relevantă asupra farmacocineticii medicamentului. 50% din baricitinibul circulant este legat de proteinele plasmatice din sânge .
Mai puțin de 10% din substanță este metabolizată în patru produse de oxidare diferite de către CYP3A4; restul este lăsat neschimbat. Timpul de înjumătățire prin eliminare este în medie de 12,5 ore. Aproximativ 75% este eliminat prin urină și 20% prin fecale .
Istorie
În august 2016, s-au înregistrat 31 de studii clinice pentru baricitinib, dintre care 24 s-au finalizat și 4 din 6 studii de fază 3 s-au finalizat.
COVID-19
În aprilie 2020, Lilly a anunțat că investighează utilizarea baricitinibului pentru tratarea persoanelor cu COVID-19 . Activitatea antiinflamatoare a medicamentului este de așteptat să acționeze asupra cascadei inflamatorii asociate cu COVID-19.
În noiembrie 2020, cercetările publicate au arătat că barcitinibul este benefic în tratarea persoanelor cu COVID-19. Conform lucrării, „acțiunile mecaniciste ale unui inhibitor Janus kinază-1/2 care vizează intrarea virală, replicarea și furtuna de citokine și sunt asociate cu rezultate benefice, inclusiv la persoanele în vârstă grav bolnave”.
Într-un studiu clinic efectuat pe persoane spitalizate cu COVID-19, s-a demonstrat că baricitinib, în combinație cu remdesivir, reduce timpul până la recuperare în decurs de 29 de zile de la inițierea tratamentului, comparativ cu participanții care au primit un placebo cu remdesivir. Siguranța și eficacitatea acestei terapii investigaționale pentru utilizare în tratamentul COVID-19 continuă să fie evaluate.
Datele care susțin autorizația de utilizare de urgență (EUA) a Administrației SUA pentru Alimente și Medicamente (FDA) pentru baricitinib în combinație cu remdesivir se bazează pe un studiu clinic randomizat, dublu-orb, controlat cu placebo (ACTT-2), care a fost realizat de SUA Institutul Național de Alergii și Boli Infecțioase (NIAID). Acest studiu clinic a evaluat dacă baricitinib a influențat cât timp a durat până când subiecții care luau și remdesivir să se recupereze din COVID-19. Studiul a urmărit participanții timp de 29 de zile și a inclus 1.033 participanți cu COVID-19 moderat sau sever; 515 participanți au primit baricitinib plus remdesivir, iar 518 participanți au primit placebo plus remdesivir. Recuperarea a fost definită fie ca fiind externată din spital, fie că este internată, dar nu necesită oxigen suplimentar și nu mai necesită îngrijire medicală continuă. Timpul mediu până la recuperarea de la COVID-19 a fost de șapte zile pentru baricitinib plus remdesivir și opt zile pentru placebo plus remdesivir. Șansele ca starea unui pacient să progreseze până la moarte sau să fie ventilat în ziua 29 a fost mai mică în grupul cu baricitinib plus remdesivir comparativ cu grupul placebo plus remdesivir. Șansele de îmbunătățire clinică în ziua 15 au fost mai mari în grupul cu baricitinib plus remdesivir comparativ cu grupul placebo plus remdesivir. Pentru toate aceste obiective, efectele au fost semnificative statistic. EUA a fost emisă Eli Lilly and Company .
În noiembrie 2020, Organizația Mondială a Sănătății (OMS) și-a actualizat liniile directoare privind terapiile pentru COVID-19 pentru a include o recomandare condiționată împotriva utilizării remdesivirului, declanșată de rezultatele studiului OMS Solidaritate .
În noiembrie 2020, FDA a emis o autorizație de utilizare de urgență (EUA) pentru combinația de baricitinib cu remdesivir , pentru tratamentul COVID-19 suspectat sau confirmat de laborator la persoanele spitalizate cu vârsta de doi ani sau peste care necesită oxigen suplimentar, ventilație mecanică invazivă , sau oxigenarea cu membrană extracorporală (ECMO).
În iulie 2021, FDA a revizuit EUA pentru baricitinib, autorizându-l acum singur pentru tratamentul COVID-19 la persoanele spitalizate cu vârsta de doi ani sau mai mare care necesită oxigen suplimentar, ventilație mecanică neinvazivă sau invazivă sau oxigenare cu membrană extracorporală (ECMO) ). În conformitate cu EUA revizuită, baricitinibul nu mai trebuie administrat cu remdesivir.
Societate și cultură
Statut juridic
În ianuarie 2016, Eli Lilly a depus o nouă cerere de droguri la Administrația SUA pentru Alimente și Medicamente (FDA) pentru aprobarea baricitinibului pentru tratarea artritei reumatoide active moderate până la severe.
În decembrie 2016, Comitetul pentru produse medicamentoase de uz uman (CHMP) al Agenției Europene pentru Medicamente (EMA) a recomandat aprobarea baricitinibului ca terapie pentru artrita reumatoidă. Aprobarea Uniunii Europene a fost acordată în februarie 2017.
În ciuda așteptărilor pe scară largă că FDA va aproba baricitinib pentru artrita reumatoidă, în aprilie 2017, FDA a emis o respingere, invocând îngrijorări cu privire la dozare și siguranță.
În mai 2018, baricitinib a fost aprobat în Statele Unite pentru tratamentul artritei reumatoide.
În martie 2020, FDA SUA a acordat baricitinib desemnarea terapiei avansate pentru tratamentul alopeciei areata .
Nume de marcă
În Bangladesh , medicamentul este vândut sub numele comercial Baricinix și Baricent (Incepta Pharma), printre altele.
Referințe
Lecturi suplimentare
- Cingolani A, Tummolo AM, Montemurro G, Gremese E, Larosa L, Cipriani MC și colab. (Octombrie 2020). „Baricitinib ca terapie de salvare la un pacient cu COVID-19 fără răspuns complet la sarilumab” . Infecție . 48 (5): 767-771. doi : 10.1007 / s15010-020-01476-7 . PMC 7340855 . PMID 32642806 .
- Jorgensen SC, Tse CL, Burry L, Dresser LD (august 2020). "Baricitinib: o revizuire a farmacologiei, siguranței și experienței clinice emergente în COVID-19" . Farmacoterapie . 40 (8): 843-856. doi : 10.1002 / phar.2438 . PMC 7323235 . PMID 32542785 .
- Kalil AC, Patterson TF, Mehta AK, Tomashek KM, Wolfe CR, Ghazaryan V, și colab. (Martie 2021). „Baricitinib plus Remdesivir pentru adulți spitalizați cu Covid-19” . New England Journal of Medicine . 384 (9): 795–807. doi : 10.1056 / NEJMoa2031994 . PMC 7745180 . PMID 33306283 .
- Seif F, Aazami H, Khoshmirsafa M, Kamali M, Mohsenzadegan M, Pornour M, Mansouri D (2020). „Inhibarea JAK ca o nouă strategie de tratament pentru pacienții cu COVID-19” . Arhivele Internaționale de Alergie și Imunologie . 181 (6): 467–475. doi : 10.1159 / 000508247 . PMC 7270061 . PMID 32392562 .
- Stebbing J, Krishnan V, de Bono S, Ottaviani S, Casalini G, Richardson PJ și colab. (August 2020). „Mecanismul baricitinibului susține testarea prevăzută de inteligența artificială la pacienții cu COVID-19” . EMBO Medicină moleculară . 12 (8): e12697. doi : 10.15252 / emmm.202012697 . PMC 7300657 . PMID 32473600 .
- Zhang X, Zhang Y, Qiao W, Zhang J, Qi Z (septembrie 2020). „Baricitinib, un medicament cu efect potențial pentru a preveni SARS-COV-2 să pătrundă în celulele țintă și să controleze furtuna de citokine indusă de COVID-19” . Imunofarmacologie internațională . 86 : 106749. doi : 10.1016 / j.intimp.2020.106749 . PMC 7328558 . PMID 32645632 .
linkuri externe
- „Baricitinib” . Portalul de informații despre droguri . Biblioteca Națională de Medicină din SUA.