Tromboză venoasă profundă - Deep vein thrombosis
| Tromboză venoasă profundă | |
|---|---|
| Alte nume | Tromboză venoasă profundă |
 | |
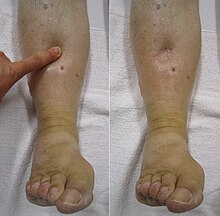
| TVP în piciorul drept cu umflături și roșeață | |
| Specialitate | Variat |
| Simptome | Durere, umflături , roșeață, vene mărite la nivelul membrului afectat |
| Complicații | Sindrom post-trombotic , TEV recurent |
| Factori de risc | Chirurgie recentă, vârstă mai înaintată, cancer activ , obezitate , infecție, boli inflamatorii, sindrom antifosfolipidic , antecedente personale sau antecedente familiale de TEV, leziuni, traume, lipsă de mișcare, control hormonal al nașterilor , sarcină și perioada următoare nașterii , factori genetici |
| Metoda de diagnosticare | Ecografie |
| Diagnostic diferentiat | Celulită , chist Baker rupt , hematom , limfedem , insuficiență venoasă cronică etc. |
| Prevenirea | Mers frecvent, exerciții la vițel, menținerea unei greutăți corporale sănătoase, anticoagulante (diluanți ai sângelui), compresie pneumatică intermitentă , ciorapi de compresie gradată , aspirină |
| Tratament | Anticoagulare, tromboliză dirijată prin cateter |
| Medicament | Anticoagulante orale directe , heparină cu greutate moleculară mică , fondaparinux , heparină nefracționată , warfarină |
| Frecvență | De la 0,8-2,7 la 1000 de persoane pe an, dar populațiile din China și Coreea sunt sub acest interval |
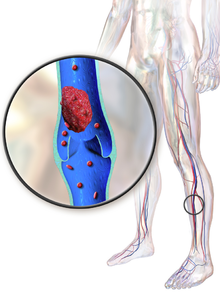
Tromboza venoasă profundă ( TVP ) este formarea unui cheag de sânge într-o venă profundă , cel mai frecvent la nivelul picioarelor sau pelvisului. O minoritate de TVP apar în brațe. Simptomele pot include durere, umflături, roșeață și venele mărite în zona afectată, dar unele TVP nu au simptome. Cea mai comună preocupare care pune viața în pericol cu TVP este potențialul ca un cheag să se embolizeze (să se detașeze de vene), să se deplaseze ca un embol prin partea dreaptă a inimii și să se depună într-o arteră pulmonară care furnizează sânge plămânilor . Aceasta se numește embolie pulmonară (PE). TVP și PE cuprind boala cardiovasculară a tromboembolismului venos (TEV). Aproximativ două treimi din TEV se manifestă numai ca TVP, cu o treime care se manifestă ca EP cu sau fără TVP. Cea mai frecventă complicație TVP pe termen lung este sindromul post-trombotic , care poate provoca dureri, umflături, senzație de greutate, mâncărime și, în cazuri severe, ulcere . TEV recurent apare la aproximativ 30% din cei din cei zece ani care urmează unui TEV inițial.
Mecanismul din spatele formării TVP implică de obicei o combinație de scăderea fluxului sanguin , tendința crescută de coagulare , modificări ale peretelui vaselor de sânge și inflamație. Factorii de risc includ intervenții chirurgicale recente, vârstă mai înaintată, cancer activ , obezitate , infecție, boli inflamatorii, sindromul antifosfolipidic , istoricul personal și istoricul familial de TEV, traume, leziuni, lipsa mișcării, controlul nașterii hormonale , sarcina și perioada următoare nașterii . TEV are o componentă genetică puternică, reprezentând aproximativ 50 până la 60% din variabilitatea ratelor TEV. Factorii genetici includ tipul de sânge non-O , deficiențele antitrombinei , proteinei C și proteinei S și mutațiilor factorului V Leiden și protrombinei G20210A . În total, au fost identificați zeci de factori de risc genetici.
Persoanele suspectate de TVP pot fi evaluate utilizând o regulă de predicție, cum ar fi scorul Wells . Un test dimer D poate fi, de asemenea, utilizat pentru a ajuta la excluderea diagnosticului sau pentru a semnala necesitatea testării ulterioare. Diagnosticul este cel mai frecvent confirmat de ultrasunetele venelor suspectate. TEV devine mult mai frecvent cu vârsta. Afecțiunea este rară la copii, dar apare la aproape 1% din cei ≥ 85 de ani anual. Indivizii asiatici, asiatici-americani, nativi americani și hispanici au un risc mai scăzut de TEV decât albii sau negrii. Populațiile din Asia au rate de TEV între 15 și 20% din ceea ce se vede în țările occidentale.
Utilizarea diluanților de sânge este tratamentul standard. Medicamentele tipice includ rivaroxaban , apixaban și warfarină . Începerea tratamentului cu warfarină necesită un anticoagulant non-oral suplimentar, adesea injecții de heparină . Prevenirea TEV pentru populația generală include evitarea obezității și menținerea unui stil de viață activ. Eforturile de prevenire în urma unei intervenții chirurgicale cu risc scăzut includ mersul devreme și frecvent. Operațiile mai riscante previn, în general, TEV cu un diluant de sânge sau aspirină combinat cu compresie pneumatică intermitentă .
semne si simptome
Simptomele afectează în mod clasic un picior și se dezvoltă de obicei în ore sau zile, deși se pot dezvolta brusc sau în câteva săptămâni. Picioarele sunt afectate în primul rând, 4-10% din TVP apare în brațe. Deși semnele și simptomele sunt foarte variabile, simptomele tipice sunt durerea, umflarea și roșeața. Cu toate acestea, aceste simptome s-ar putea să nu se manifeste la nivelul membrelor inferioare ale celor care nu pot merge. La cei care sunt capabili să meargă, TVP poate reduce capacitatea de a face acest lucru. Durerea poate fi descrisă ca pulsantă și se poate agrava cu greutatea, determinând pe cineva să suporte mai mult greutate cu piciorul neafectat. Semnele și simptomele suplimentare includ sensibilitate, edem în piele ( vezi imaginea ), dilatarea venelor de suprafață, căldură, decolorare, o „senzație de tragere” și chiar cianoză (o decolorare albastră sau purpurie) cu febră. TVP poate exista și fără a provoca simptome. Semnele și simptomele ajută la determinarea probabilității TVP, dar nu sunt utilizate singure pentru diagnostic.
Uneori, TVP poate provoca simptome la ambele brațe sau la ambele picioare, ca și în cazul TVP bilaterală. Rareori, un cheag în vena cavă inferioară poate provoca umflarea ambelor picioare. Tromboza venoasă superficială , cunoscută și sub numele de tromboflebită superficială , este formarea unui cheag de sânge (tromb) într-o venă apropiată de piele . Poate co-apărea cu TVP și poate fi simțită ca un „cordon palpabil”. Tromboflebita migratorie (sindromul Trousseau) este o constatare remarcabilă la cei cu cancer pancreatic și este asociată cu TVP.
Complicații acute
O embolie pulmonară (PE) apare atunci când un cheag de sânge dintr-o venă profundă (o TVP) se detașează de o venă (se embolizează ), se deplasează prin partea dreaptă a inimii și se depune ca o embolă într-o arteră pulmonară care furnizează sânge dezoxigenat la plămâni pentru oxigenare. Se crede că până la o pătrime din cazurile de EP duc la moarte subită. Atunci când nu este letal, PE poate provoca simptome, cum ar fi dificultăți de respirație cu debut brusc sau dureri în piept , tuse de sânge ( hemoptizie ) și leșin ( sincopă ). Durerea toracică poate fi pleuritică (agravată de respirații profunde) și poate varia în funcție de locul în care se află embolusul în plămâni. Se estimează că 30-50% dintre cei cu EP au TVP detectabilă prin ultrasunete de compresie .
O TVP rară și masivă care provoacă obstrucții și decolorări semnificative (inclusiv cianoză) este flegmazia cerulea dolens . Acesta pune viața în pericol, pune în pericol membrele și prezintă un risc de gangrenă venoasă . Phlegmasia cerulea dolens poate apărea în braț, dar afectează mai frecvent piciorul. Dacă se găsește în cadrul sindromului compartimentului acut , este necesară o fasciotomie urgentă pentru a proteja membrele. Sindromul venei cave superioare este o complicație rară a TVP la braț.
TVP se crede că poate provoca un accident vascular cerebral în prezența unui defect cardiac . Aceasta se numește embolie paradoxală, deoarece cheagul se deplasează anormal de la circuitul pulmonar la circuitul sistemic în timp ce se află în interiorul inimii. Se consideră că defectul unui foramen ovale patentat permite ca cheagurile să circule prin septul interatrial din atriul drept în atriul stâng.
O imagine CT cu săgeți roșii care indică PE (gri) în arterele pulmonare (alb)
Diagnostic diferentiat
În majoritatea cazurilor suspectate, TVP este exclusă după evaluare. Celulita este un imitat frecvent al TVP, cu triada sa de durere, umflare și roșeață. Simptomele legate de TVP se datorează mai des din alte cauze, inclusiv celulită, chist Baker rupt , hematom , limfedem și insuficiență venoasă cronică . Alte diagnostice diferențiale includ tumori, anevrisme venoase sau arteriale , tulburări ale țesutului conjunctiv , tromboză venoasă superficială , tromboză venoasă musculară și vene varicoase .
Clasificare
TVP și PE sunt cele două manifestări ale tromboembolismului venos al bolilor cardiovasculare (TEV). TEV poate apărea numai ca TVP, TVP cu PE sau numai PE. Aproximativ două treimi din TEV se manifestă numai ca TVP, cu o treime care se manifestă ca EP cu sau fără TVP. TEV, împreună cu tromboza venoasă superficială, sunt tipuri comune de tromboză venoasă.
TVP este clasificată ca acută atunci când cheagurile se dezvoltă sau s-au dezvoltat recent, în timp ce TVP cronică persistă mai mult de 28 de zile. Diferențele dintre aceste două tipuri de TVP pot fi observate cu ultrasunete. Un episod de TEV după unul inițial este clasificat ca recurent. TVP bilaterală se referă la cheaguri la ambele membre, în timp ce unilateral înseamnă că este afectat doar un singur membru.
TVP în picioare este proximală când este deasupra genunchiului și distală (sau gambei) când este sub genunchi. TVP sub vena poplitee, o venă proximală în spatele genunchiului, este clasificată ca distală și are o semnificație clinică limitată în comparație cu TVP proximală. TVP pentru vițel reprezintă aproximativ jumătate din TVP. TVP ilofemorală a fost descrisă ca implicând fie vena iliacă, fie vena femurală comună ; în altă parte, a fost definit ca implicând cel puțin vena iliacă comună , care este aproape de vârful pelvisului.
TVP poate fi clasificată în categorii provocate și neprovocate. De exemplu, TVP care apare în asociere cu cancerul sau intervenția chirurgicală poate fi clasificată ca provocată. Cu toate acestea, Societatea Europeană de Cardiologie din 2019 a cerut abandonarea acestei dihotomii pentru a încuraja evaluări mai personalizate ale riscurilor pentru TEV recurent. Distincția dintre aceste categorii nu este întotdeauna clară.
Cauze
În mod tradițional, cei trei factori ai triadei lui Virchow - staza venoasă , hipercoagulabilitatea și modificările în căptușeala vaselor de sânge endoteliale - contribuie la TEV și au fost folosiți pentru a explica formarea acesteia. Mai recent, inflamația a fost identificată ca jucând un rol cauzal clar. Alte cauze conexe includ activarea componentelor sistemului imunitar , starea microparticulelor din sânge, concentrația de oxigen și posibila activare a trombocitelor . Diversi factori de risc contribuie la TEV, inclusiv factori genetici și de mediu, deși mulți cu factori de risc multipli nu îl dezvoltă niciodată.
Factorii de risc dobândiți includ factorul de risc puternic al vârstei mai înaintate, care modifică compoziția sângelui pentru a favoriza coagularea. VTE anterioară, în special VTE neprovocat, este un factor de risc puternic. Un cheag rămas de la o TVP anterioară crește riscul unei TVP ulterioare. Chirurgia majoră și traumele cresc riscul din cauza factorului tisular din exteriorul sistemului vascular care intră în sânge. Leziunile minore, amputarea membrelor inferioare, fractura șoldului și fracturile osoase lungi sunt, de asemenea, riscuri. În chirurgia ortopedică , staza venoasă poate fi temporar provocată de încetarea fluxului sanguin ca parte a procedurii. Inactivitatea și imobilizarea contribuie la staza venoasă, la fel ca în cazul gipsurilor ortopedice , paralizie, șezut, călătorie pe distanțe lungi, odihnă la pat, spitalizare, catatonie și la supraviețuitorii unui accident vascular cerebral acut . Condițiile care implică un flux sanguin compromis în vene sunt sindromul May-Thurner , unde se comprimă o venă a bazinului, și sindromul de ieșire toracică venoasă , care include sindromul Paget-Schroetter , unde compresia are loc lângă baza gâtului.
Infecțiile, inclusiv sepsisul , COVID-19 , HIV și tuberculoza activă , cresc riscul. Bolile inflamatorii cronice și unele boli autoimune , cum ar fi bolile inflamatorii intestinale , scleroza sistemică , sindromul Behçet, sindromul antifosfolipidic primar și lupus eritematos sistemic (LES) cresc riscul. LES în sine este frecvent asociat cu sindromul antifosfolipidic secundar.
Cancerul poate crește în și în jurul venelor, provocând stază venoasă și poate stimula, de asemenea, niveluri crescute de factor tisular. Cancerele de sânge, plămâni, pancreas, creier, stomac și intestin sunt asociate cu un risc ridicat de TEV. Tumorile solide precum adenocarcinoamele pot contribui atât la TEV, cât și la coagularea intravasculară diseminată . În cazurile severe, acest lucru poate duce la coagularea și sângerarea simultană. Tratamentul chimioterapic crește, de asemenea, riscul. Obezitatea crește potențialul de coagulare a sângelui, la fel ca și sarcina. În postpartum , ruptura placentară eliberează substanțe care favorizează coagularea. Contraceptivele orale și terapia de substituție hormonală cresc riscul printr-o varietate de mecanisme, inclusiv niveluri modificate de proteine de coagulare a sângelui și fibrinoliză redusă .

Au fost identificați zeci de factori de risc genetic și aceștia reprezintă aproximativ 50 până la 60% din variabilitatea ratelor TEV. Ca atare, istoricul familial al TEV este un factor de risc pentru un prim TEV. Factorul V Leiden , care face factorul V rezistent la inactivarea proteinei C activate , crește ușor riscul de TEV de aproximativ trei ori. Deficiențele a trei proteine care în mod normal împiedică coagularea sângelui - proteina C , proteina S și antitrombina - contribuie la TEV. Aceste deficiențe ale antitrombinei , proteinei C și proteinei S sunt rare, dar puternice sau moderat puternice, factori de risc. Acestea cresc riscul de aproximativ 10 ori. Având un tip de sânge non-O dublează aproximativ riscul de TEV. Tipul de sânge non-O este comun la nivel global, făcându-l un factor de risc important. Persoanele fără grupa sanguină O au niveluri sanguine mai mari de factor von Willebrand și factor VIII decât cele cu grupa sanguină O, crescând probabilitatea de coagulare. Cei homozigoti pentru varianta de genă a fibrinogenului gamma rs2066865 prezintă un risc de 1,6 ori mai mare de TEV. Varianta genetică de protrombină G20210A , care crește nivelul de protrombină, crește riscul de aproximativ 2,5 ori. În plus, aproximativ 5% dintre oameni au fost identificați cu un risc genetic de fond comparabil cu mutațiile factorului V Leiden și protrombinei G20210A.
Modificări ale sângelui, inclusiv disfibrinogenemie , proteină S scăzută liberă, rezistență la proteina C activată , homocistinurie , hiperhomocisteinemie , niveluri ridicate de fibrinogen , niveluri ridicate de factor IX și niveluri ridicate de factor XI sunt asociate cu un risc crescut. Alte afecțiuni asociate includ trombocitopenia indusă de heparină , sindromul antifosfolipidic catastrofal , hemoglobinuria nocturnă paroxistică , sindromul nefrotic , boala renală cronică , policitemia vera , trombocitemia esențială , consumul de droguri intravenoase și fumatul.
Unii factori de risc influențează localizarea TVP în organism. În TVP distală izolată, profilul factorilor de risc apare distinct de TVP proximală. Factorii tranzitorii, cum ar fi intervenția chirurgicală și imobilizarea, par să domine, în timp ce trombofiliile și vârsta nu par să crească riscul. Factorii de risc obișnuiți pentru a avea o TVP la extremitatea superioară includ existența unui corp străin existent (cum ar fi un cateter venos central, un stimulator cardiac sau o linie PICC cu triplu lumen), cancer și intervenții chirurgicale recente.
Fiziopatologie
Sângele are tendința naturală de a se coagula atunci când vasele de sânge sunt deteriorate ( hemostaza ) pentru a minimiza pierderile de sânge. Coagularea este activată de cascada de coagulare și curățarea cheagurilor care nu mai sunt necesare se realizează prin procesul de fibrinoliză . Reducerea fibrinolizei sau creșterea coagulării poate crește riscul apariției TVP.
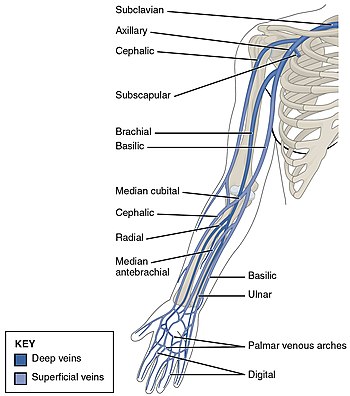
TVP se dezvoltă adesea în venele gambei și „crește” în direcția fluxului venos, spre inimă. TVP afectează cel mai frecvent venele din picior sau pelvis, inclusiv vena poplitee (în spatele genunchiului), vena femurală (a coapsei) și venele iliace ale pelvisului. TVP extinsă pentru extremitățile inferioare poate ajunge chiar în vena cavă inferioară (în abdomen). TVP la extremitatea superioară afectează cel mai frecvent venele subclaviene, axilare și jugulare .
Procesul de fibrinoliză, în care cheagurile de TVP pot fi dizolvate înapoi în sânge, acționează pentru a tempera procesul de creștere a trombului. Acesta este procesul preferat. În afară de procesul potențial mortal de embolizare, un cheag se poate rezolva prin organizare, ceea ce poate deteriora valvele venelor, poate provoca fibroza venei și poate duce la venele neconforme. Organizarea unui tromb în venă poate avea loc în a treia etapă a dezvoltării sale patologice , în care colagenul devine componenta caracteristică. Prima etapă patologică este marcată de celule roșii din sânge, iar a doua este caracterizată de fibrină cu textură medie.
În tromboza arterială, este necesară deteriorarea peretelui vaselor de sânge, deoarece inițiază coagularea , dar coagularea în vene apare mai ales fără o astfel de deteriorare mecanică. Se crede că începutul trombozei venoase apare din „activarea celulelor endoteliale, a trombocitelor și a leucocitelor, cu inițierea inflamației și formarea microparticulelor care declanșează sistemul de coagulare” prin intermediul factorului tisular. Inflamarea peretelui venelor este probabil evenimentul incitant. Important, endoteliul activat al venelor interacționează cu celulele albe din sânge (leucocite) care circulă. În timp ce leucocitele ajută în mod normal la prevenirea coagulării sângelui (la fel ca endoteliul normal), la stimulare, leucocitele facilitează coagularea. Neutrofilele sunt recrutate la începutul procesului de formare a trombilor venosi. Eliberează granule pro-coagulante și capcane extracelulare neutrofile (NET) sau componentele lor, care joacă un rol în formarea trombilor venosi. Componentele NET sunt pro-trombotice atât prin căile de coagulare intrinseci, cât și extrinseci. NET-urile oferă „o schelă pentru aderența” trombocitelor, globulelor roșii și mai mulți factori care potențează activarea trombocitelor. În plus față de activitățile pro-coagulante ale neutrofilelor, stimuli multipli determină monocitele să elibereze factorul tisular. Monocitele sunt, de asemenea, recrutate la începutul procesului.
Factorul tisular, prin complexul factorului tisular - factorul VIIa , activează calea extrinsecă a coagulării și duce la conversia protrombinei în trombină, urmată de depunerea fibrinei. Cheagurile venoase proaspete sunt bogate în celule roșii din sânge și fibrină . Trombocitele și celulele albe din sânge sunt, de asemenea, componente. Trombocitele nu sunt la fel de proeminente în cheagurile venoase ca și în cele arteriale, dar pot juca un rol. În cancer, factorul tisular este produs de celulele canceroase. Cancerul produce, de asemenea, substanțe unice care stimulează factorul Xa , citokine care promovează disfuncția endotelială și inhibitor al activatorului plasminogen-1 , care inhibă descompunerea cheagurilor (fibrinoliză).
Adesea, TVP începe în valvele venelor. Schema fluxului sanguin în valve poate provoca concentrații scăzute de oxigen în sânge ( hipoxemie ) ale sinusului valvei. Hipoxemia, care este înrăutățită de staza venoasă, activează căile - cele care includ factorul 1 inductibil de hipoxie și proteina 1 cu răspuns de creștere timpurie . Hipoxemia are ca rezultat, de asemenea, producerea de specii reactive de oxigen , care pot activa aceste căi, precum și factorul nuclear-κB , care reglează transcripția factorului-1 inductibilă prin hipoxie . Factorul-1 inductibil al hipoxiei și proteina 1 cu răspuns de creștere timpurie contribuie la asocierea monocitelor cu proteinele endoteliale, cum ar fi P-selectina , determinând monocitele să elibereze microvesicule umplute cu factor tisular , care probabil încep să se coaguleze după legarea pe suprafața endotelială.
D-dimerii sunt un produs de degradare a fibrinei , un produs secundar natural al fibrinolizei care se găsește de obicei în sânge. Un nivel ridicat poate rezulta din dizolvarea plasminei unui cheag - sau alte condiții. Pacienții spitalizați au adesea niveluri crescute din mai multe motive. Anticoagularea , tratamentul standard pentru TVP, previne creșterea în continuare a cheagurilor și PE, dar nu acționează direct asupra cheagurilor existente.
Diagnostic
O evaluare a probabilității clinice utilizând scorul Wells (a se vedea coloana dedicată din tabelul de mai jos ) pentru a determina dacă un potențial TVP este „probabil” sau „puțin probabil” este de obicei primul pas al procesului de diagnosticare. Scorul este utilizat la prima suspectată de TVP la extremități inferioare (fără simptome de PE) în asistența medicală primară și în ambulatoriu, inclusiv în secția de urgență . Rezultatul numeric (scor posibil -2 la 9) este cel mai frecvent grupat fie în categorii „improbabile”, fie „probabile”. Un scor Wells de două sau mai multe înseamnă TVP este considerat „probabil” (aproximativ 28% șanse), în timp ce cei cu un scor mai mic sunt considerate „puțin probabil” să aibă TVP (aproximativ 6% șanse). La cei puțin probabil să aibă TVP, diagnosticul este exclus de un test de sânge negativ al dimerului D. La persoanele cu TVP probabil, ultrasunetele reprezintă imagistica standard utilizată pentru a confirma sau a exclude un diagnostic. Imagistica este, de asemenea, necesară pentru pacienții spitalizați cu suspiciune de TVP și cei clasificați inițial ca fiind puțin probabil să aibă TVP, dar care au un test pozitiv al dimerului D.
În timp ce scorul Wells este regula de predicție clinică predominantă și cea mai studiată pentru TVP, are dezavantaje. Scorul Wells necesită o evaluare subiectivă cu privire la probabilitatea unui diagnostic alternativ și funcționează mai puțin la vârstnici și la cei cu TVP anterioară. De îngrijire Regula olandeză primar a fost , de asemenea , validat pentru utilizare. Conține doar criterii obiective, dar necesită obținerea unei valori a dimerului D. Cu această regulă de predicție, trei puncte sau mai puțin înseamnă că o persoană prezintă un risc scăzut de TVP. Un rezultat de patru sau mai multe puncte indică faptul că este necesară o ecografie. În loc să utilizeze o regulă de predicție, medicii cu experiență pot face o evaluare a probabilității TVT pre-test utilizând evaluarea clinică și gestalt, dar regulile de predicție sunt mai fiabile.
| Criterii | Scorul Wells pentru TVP | Regula olandeză de îngrijire primară |
|---|---|---|
| Cancer activ (tratament în ultimele 6 luni sau paliativ) | +1 punct | +1 punct |
| Umflarea gambei ≥ 3 cm comparativ cu gambele asimptomatice (măsurată la 10 cm sub tuberozitatea tibială ) | +1 punct | +2 puncte |
| Venele superficiale unilaterale umflate (non-varicoase, la nivelul piciorului simptomatic) | +1 punct | +1 punct |
| Edem unilateral cu picături (la nivelul piciorului simptomatic) | +1 punct | - |
| TVP anterioară documentată | +1 punct | - |
| Umflarea întregului picior | +1 punct | - |
| Sensibilitate localizată de-a lungul sistemului venos profund | +1 punct | - |
| Paralizia, pareza sau imobilizarea recentă a extremităților inferioare | +1 punct | - |
| Recent pus la pat ≥ 3 zile sau intervenții chirurgicale majore care necesită anestezic regional sau general în ultimele 12 săptămâni | +1 punct | +1 punct |
| Diagnostic alternativ cel puțin la fel de probabil | −2 puncte | - |
| D-dimer pozitiv (≥ 0,5 mcg / mL sau 1,7 nmol / L) | - | +6 puncte |
| Absența traumei la nivelul picioarelor | - | +1 punct |
| Sex masculin | - | +1 punct |
| Utilizarea contraceptivelor orale | - | +1 punct |
Ecografia cu compresie pentru suspiciunea de tromboză venoasă profundă este metoda de diagnostic standard și este extrem de sensibilă pentru detectarea unei TVP inițiale. O ultrasunete de compresie este considerată pozitivă atunci când pereții venelor venelor normal comprimabile nu se prăbușesc sub o presiune ușoară. Vizualizarea cheagului este uneori posibilă, dar nu este necesară. Pot fi utilizate trei tehnici de scanare cu ultrasunete, două dintre cele trei metode necesitând oa doua ultrasunete câteva zile mai târziu pentru a exclude diagnosticul. Ecografia cu picior întreg este opțiunea care nu necesită repetarea ultrasunetelor, dar ultrasunetele cu compresie proximală sunt frecvent utilizate deoarece TVP distală este rareori semnificativă clinic. Metodele cu ultrasunete, inclusiv duplex și fluxul de culori Doppler, pot fi utilizate pentru a caracteriza în continuare cheagul, iar ultrasunetele Doppler sunt utile în special în venele iliace necompresibile.
Venografia CT , venografia RMN sau un RMN fără contrast sunt, de asemenea, posibilități de diagnostic. Standardul de aur pentru evaluarea metodelor imagistice este venografia de contrast , care implică injectarea unei vene periferice a membrului afectat cu un agent de contrast și efectuarea de raze X, pentru a dezvălui dacă alimentarea venoasă a fost obstrucționată. Datorită costului, invazivității, disponibilității și a altor limitări, acest test este rareori efectuat.
Ecografie Doppler care arată absența fluxului și a conținutului hiperecogen într-o venă femurală coagulată (etichetată subartorial) distală până la punctul de ramificare a venei femurale profunde . În comparație cu acest cheag, cheagurile care în schimb obstrucționează vena femurală comună (proximală acestui punct de ramificare) provoacă efecte mai severe datorită impactului unei porțiuni semnificativ mai mari a piciorului.
Management
Tratamentul pentru TVP este justificat atunci când cheagurile sunt fie proximale, distale și simptomatice, fie la nivelul extremității superioare și simptomatice. Asigurarea anticoagulării sau medicament anticoagulant este tratamentul tipic după ce pacienții sunt verificați pentru a se asigura că nu sunt supuși sângerării . Cu toate acestea, tratamentul variază în funcție de localizarea TVP. De exemplu, în cazurile de TVP distală izolată, supravegherea cu ultrasunete (o a doua ecografie după 2 săptămâni pentru verificarea cheagurilor proximale) ar putea fi utilizată în locul anticoagulării. Deși, cei cu TVP distală izolată, cu risc crescut de recurență a TEV, sunt de obicei anticoagulați ca și cum ar fi avut TVP proximală. Cei cu un risc scăzut de recurență ar putea primi un curs de patru până la șase săptămâni de anticoagulare, doze mai mici sau deloc anticoagulare. În schimb, cei cu TVP proximală ar trebui să primească cel puțin 3 luni de anticoagulare.
Unele anticoagulante pot fi administrate pe cale orală, iar aceste medicamente orale includ warfarina (un antagonist al vitaminei K ), rivaroxaban (un inhibitor al factorului Xa ), apixaban (un inhibitor al factorului Xa), dabigatran (un inhibitor direct al trombinei ) și edoxaban (un factor Inhibitor Xa). Alte anticoagulante nu pot fi administrate pe cale orală. Aceste medicamente parenterale (non-orale) includ heparină cu greutate moleculară mică , fondaparinux și heparină nefracționată . Unele medicamente orale sunt suficiente atunci când sunt luate singure, în timp ce altele necesită utilizarea unui diluant suplimentar de sânge parenteral. Rivaroxaban și apixaban sunt medicamentele tipice de primă linie și sunt suficiente atunci când sunt administrate pe cale orală. Rivaroxaban se administrează o dată pe zi, iar apixaban se administrează de două ori pe zi. Warfarina, dabigatranul și edoxaban necesită utilizarea unui anticoagulant parenteral pentru inițierea terapiei anticoagulante orale. Atunci când warfarina este inițiată pentru tratamentul TEV, se administrează minimum 5 zile de anticoagulant parenteral împreună cu warfarină, care este urmată de terapie numai cu warfarină. Warfarina este luată pentru a menține un raport internațional normalizat (INR) de 2,0-3,0, cu 2,5 ca țintă. Beneficiul administrării warfarinei scade pe măsură ce durata tratamentului se extinde, iar riscul de sângerare crește odată cu înaintarea în vârstă. Monitorizarea periodică a INR nu este necesară atunci când se utilizează anticoagulante orale directe de primă linie. În general, terapia anticoagulantă este complexă și multe circumstanțe pot afecta modul în care aceste terapii sunt gestionate.
Durata terapiei anticoagulare (indiferent dacă va dura 4 până la 6 săptămâni, 6 până la 12 săptămâni, 3 până la 6 luni sau la nesfârșit) este un factor cheie în luarea deciziilor clinice . Când TVP proximală este provocată de o intervenție chirurgicală sau traumatism, este standard un curs de 3 luni de anticoagulare. Când un prim TEV este TVP proximală, care este fie neprovocat, fie asociat cu factor de risc tranzitoriu non-chirurgical, ar putea fi utilizată anticoagulare cu doze mici de peste 3 până la 6 luni. La cei cu un risc anual de TEV peste 9%, ca după un episod neprovocat, este posibilă o anticoagulare extinsă. Cei care termină tratamentul cu warfarină după TEV idiopatic cu un nivel ridicat de dimeri D prezintă un risc crescut de TEV recurent (aproximativ 9% față de aproximativ 4% pentru rezultatele normale), iar acest rezultat ar putea fi utilizat în luarea deciziilor clinice. Rezultatele testelor de trombofilie joacă rareori un rol în durata tratamentului.
Tratamentul pentru TVP acută la picior este sugerat să continue la domiciliu pentru TVP necomplicată în loc de spitalizare. Factorii care favorizează spitalizarea includ simptome severe sau probleme medicale suplimentare. Mersul devreme este sugerat peste pat. Ciorapii cu compresie gradată - care aplică o presiune mai mare la nivelul gleznelor și o presiune mai mică în jurul genunchilor pot fi testați pentru gestionarea simptomatică a simptomelor TVP acute, dar nu sunt recomandate pentru reducerea riscului de sindrom post-trombotic , ca potențial beneficiu al utilizării pentru acest scop „poate fi incert”. Nici ciorapii de compresie nu pot reduce recurența VTE. Cu toate acestea, acestea sunt recomandate celor cu TVP distală izolată.
Dacă cineva decide să oprească anticoagularea după un TEV neprovocat în loc să fie pe o anticoagulare pe tot parcursul vieții, aspirina poate fi utilizată pentru a reduce riscul de recurență, dar este doar aproximativ 33% la fel de eficientă ca anticoagularea în prevenirea TEV recurente. Statinele au fost, de asemenea, investigate pentru potențialul lor de a reduce ratele recurente ale TEV, unele studii sugerând eficacitatea.
Investigații pentru cancer
Un TEV neprovocat ar putea semnala prezența unui cancer necunoscut, deoarece este o afecțiune de bază în până la 10% din cazurile neprovocate. Este necesară o evaluare clinică amănunțită și ar trebui să includă o examinare fizică , o revizuire a istoricului medical și screening universal al cancerului efectuat la persoanele de această vârstă. O revizuire a imaginii anterioare este considerată utilă, la fel ca „revizuirea rezultatelor testelor de sânge de bază, inclusiv hemoleucograma completă , funcția renală și hepatică , PT și APTT ”. Nu este recomandată practica obținerii markerilor tumorali sau a CT-ului abdomenului și pelvisului la persoanele asimptomatice. NICE recomandă ca investigațiile suplimentare să fie nejustificate la cei fără semne sau simptome relevante.
Intervenții
Tromboliza este injectarea unei enzime în vene pentru dizolvarea cheagurilor de sânge și, în timp ce acest tratament s-a dovedit eficient împotriva cheagurilor de urgență care pun viața în pericol de accident vascular cerebral și atacuri de cord, studiile controlate randomizate nu au stabilit un beneficiu net la cei cu proximal acut TVP. Dezavantajele trombolizei direcționate prin cateter (metoda preferată de administrare a enzimei de coagulare) includ un risc de sângerare, complexitate și costul procedurii. Deși, în timp ce anticoagularea este tratamentul preferat pentru TVP, tromboliza este o opțiune de tratament pentru cei cu forma TVP severă de flegmasia cerula dorens ( imaginea din stânga jos ) și la unii pacienți mai tineri cu TVP care afectează venele iliace și comune ale femurelor . De remarcat, există o varietate de contraindicații la tromboliză . În 2020, NICE și-a păstrat recomandările din 2012 conform cărora ar trebui luată în considerare tromboliza dirijată prin cateter la cei cu TVP iliofemorală care au „simptome care durează mai puțin de 14 zile, stare funcțională bună, o speranță de viață de 1 an sau mai mult și un risc scăzut de sângerare . "
Un dispozitiv de trombectomie mecanică poate elimina cheagurile de TVP, în special în TVP iliofemorală acută (TVP a venelor majore din pelvis), dar există date limitate cu privire la eficacitatea acesteia. De obicei, este combinat cu tromboliză și, uneori, sunt plasate filtre IVC temporare pentru a proteja împotriva PE în timpul procedurii. Tromboliza dirijată prin cateter cu trombectomie împotriva TVP iliofemorală a fost asociată cu o reducere a severității sindromului post-trombotic la un raport cost-eficacitate estimat la aproximativ 138.000 USD pe QALY câștigat . Phlegmasia cerulea dolens ar putea fi tratată cu tromboliză și / sau trombectomie dirijată prin cateter.
În TVP în braț, prima coastă (cea mai de sus) poate fi îndepărtată chirurgical ca parte a tratamentului tipic atunci când TVP se datorează sindromului de evacuare toracică sau sindromului Paget-Schroetter . Acest tratament implică anticoagulare inițială urmată de tromboliza venei subclaviene și rezecție a primei coaste etapizate pentru ameliorarea compresiei de ieșire toracică și prevenirea TVP recurentă.
Prima coastă, care este îndepărtată într-o primă intervenție chirurgicală de rezecție a coastelor , este etichetată cu 1 în această imagine
O venogramă înaintea trombolizei direcționate prin cateter pentru sindromul Paget-Schroetter , o TVP brată rară și severă prezentată aici la un practicant de judo, cu flux de sânge foarte restrâns prezentat în venă
După tratamentul cu tromboliză dirijată prin cateter, fluxul sanguin în vena axilară și subclaviană a fost semnificativ îmbunătățit. Ulterior, o primă rezecție a coastelor a permis decompresia. Acest lucru reduce riscul apariției TVP recurente și a altor sechele din compresia de ieșire toracică.
Amplasarea unui filtru de vena cava inferior ( filtru IVC) este posibilă atunci când fie tratamentul standard pentru TVP acută, anticoagulantă, este absolut contraindicat (nu este posibil), fie dacă cineva dezvoltă un PE în ciuda faptului că este anticoagulat. Cu toate acestea, o revizuire NICE din 2020 a găsit „puține dovezi bune” pentru utilizarea lor. Un studiu din 2018 a asociat plasarea filtrului IVC cu o reducere de 50% a PE, o creștere cu 70% a TVP și o creștere cu 18% a mortalității pe 30 de zile în comparație cu lipsa plasării IVC. Alte studii, inclusiv o revizuire sistematică și meta-analiză, nu au găsit o diferență în mortalitate cu plasarea IVC. Dacă cineva dezvoltă un PE în ciuda faptului că este anticoagulat, ar trebui să se acorde atenție optimizării tratamentului anticoagulant și abordării altor preocupări conexe înainte de a lua în considerare plasarea filtrului IVC.
Domeniul medicinei
Pacienții cu antecedente de TVP pot fi gestionați de asistență medicală primară , medicină internă generală , hematologie , cardiologie , chirurgie vasculară sau medicină vasculară . Pacienții suspectați de TVP acută sunt deseori direcționați la secția de urgență pentru evaluare. Radiologia intervențională este specialitatea care plasează și recuperează de obicei filtrele IVC, iar chirurgia vasculară ar putea face tromboza direcționată prin cateter pentru unele TVP severe.
Prevenirea
Pentru prevenirea formării cheagurilor de sânge în populația generală, se recomandă încorporarea exercițiilor de picioare în timp ce stați așezat pentru perioade lungi de timp, sau să aveți pauze dintr-o poziție așezată și să vă plimbați, să aveți un stil de viață activ și să mențineți o greutate corporală sănătoasă. Mersul crește fluxul de sânge prin venele piciorului. Excesul de greutate corporală este modificabil, spre deosebire de majoritatea factorilor de risc, iar intervențiile sau modificările stilului de viață care ajută pe cineva supraponderal sau obez să piardă în greutate reduc riscul de TVP. Evitarea fumatului și a unei diete occidentale se crede că reduce riscul. Statinele au fost investigate pentru prevenirea primară (prevenirea unui prim TEV), iar studiul JUPITER , care a utilizat rosuvastatină , a furnizat câteva dovezi provizorii ale eficacității. Dintre statine, rosuvastatina pare a fi singura cu potențialul de a reduce riscul de TEV. Dacă da, se pare că reduce riscul cu aproximativ 15%. Cu toate acestea, numărul necesar pentru a trata pentru a preveni un TEV inițial este de aproximativ 2000, limitându-i aplicabilitatea.
Pacienți spitalici (non-chirurgicali)
Pacienților spitalizați grav bolnavi li se recomandă să primească un anticoagulant parenteral, deși beneficiul net potențial este incert. Pacienților spitalizați cu afecțiuni critice li se recomandă să primească heparină nefracționată sau heparină cu greutate moleculară mică în loc să renunțe la aceste medicamente.
Dupa operatie

Chirurgie ortopedică majoră - înlocuirea totală a șoldului , înlocuirea totală a genunchiului sau chirurgia fracturilor de șold - prezintă un risc ridicat de a provoca TEV. Dacă profilaxia nu este utilizată după aceste intervenții chirurgicale, TEV simptomatic are aproximativ 4% șanse să se dezvolte în termen de 35 de zile. După o intervenție chirurgicală ortopedică majoră, un diluant de sânge sau aspirină este în mod obișnuit asociat cu compresie pneumatică intermitentă , care este profilaxia mecanică preferată față de ciorapii cu compresie gradată.
Opțiunile pentru prevenirea TEV la persoanele care urmează o intervenție chirurgicală non-ortopedică includ mersul timpuriu, profilaxia mecanică și diluanții de sânge (heparină cu greutate moleculară mică și heparină fără fracțiuni în doză mică), în funcție de riscul de TEV, riscul de sângerare majoră și de persoana preferințe. După operații cu risc scăzut, mersul devreme și frecvent este cea mai bună măsură preventivă.
Sarcina
Riscul de TEV este crescut în timpul sarcinii de aproximativ patru până la cinci ori din cauza unei stări mai hipercoagulabile care protejează împotriva hemoragiei fatale postpartum . Măsurile preventive pentru TEV legate de sarcină au fost sugerate de Societatea Americană de Hematologie în 2018. Warfarina, un antagonist comun al vitaminei K, poate provoca malformații congenitale și nu este utilizată pentru prevenirea în timpul sarcinii.
Călători
Călătoria "este o cauză frecvent citată, dar relativ neobișnuită" a TEV. Sugestiile pentru călătorii cu risc lung de cursă lungă includ exerciții la vițel, mers frecvent și așezarea pe culoar în avioane pentru a ușura mersul. Ciorapii cu compresie gradată au redus brusc nivelurile de TVP asimptomatică la pasagerii companiilor aeriene, dar efectul asupra TVP simptomatică, PE sau mortalitate este necunoscut, deoarece niciunul dintre indivizii studiați nu a dezvoltat aceste rezultate. Cu toate acestea, ciorapii cu compresie gradată nu sunt sugerați pentru călătorii pe distanțe lungi (> 4 ore) fără factori de risc pentru TEV. La fel, nici aspirina, nici anticoagulantele nu sunt sugerate în populația generală care efectuează călătorii pe distanțe lungi. Celor cu factori de risc semnificativi ai TEV care efectuează călătorii pe distanțe lungi li se recomandă să utilizeze fie ciorapi de compresie gradați, fie LMWH pentru prevenirea TEV. Dacă niciuna dintre aceste două metode nu este fezabilă, atunci este sugerată aspirina.
Prognoză
TVP este cel mai frecvent o boală de vârstă mai înaintată care apare în contextul căminelor de bătrâni, spitalelor și cancerului activ. Este asociat cu o rată de mortalitate de 30 de zile de aproximativ 6%, PE fiind cauza majorității acestor decese. TVP proximală este frecvent asociată cu EP, spre deosebire de TVP distală, care este rareori asociată vreodată cu PE. Aproximativ 56% dintre cei cu TVP proximală au, de asemenea, PE, deși nu este necesară o CT toracică pur și simplu din cauza prezenței TVP. Dacă TVP proximală este lăsată netratată, în următoarele 3 luni, aproximativ jumătate dintre oameni vor avea EP simptomatică.
O altă complicație frecventă a TVP proximală și cea mai frecventă complicație cronică este sindromul post-trombotic, în care indivizii prezintă simptome venoase cronice. Simptomele pot include durere, mâncărime, umflături, parestezie , senzație de greutate și, în cazuri severe, ulcere la nivelul picioarelor . După TVP proximală, aproximativ 20-50% dintre oameni dezvoltă sindromul, 5-10% având simptome severe. Sindromul post-trombotic poate fi, de asemenea, o complicație a TVP distală, deși într-o măsură mai mică decât cu TVP proximală.
În cei 10 ani care urmează unui TEV inițial, aproximativ 30% dintre oameni vor avea o recurență. Recurența TEV la cei cu TVP anterioară este mai probabil să reapară ca TVP decât PE. Cancerul și TVP neprovocată sunt factori de risc puternici pentru recurență. După TVP inițială proximală neprovocată cu și fără PE, 16-17% dintre oameni vor avea TEV recurentă în cei 2 ani de la finalizarea cursului de anticoagulante. Recurența TEV este mai puțin frecventă în TVP distală decât TVP proximală. În TVP la extremitățile superioare, recurența anuală a TEV este de aproximativ 2-4%. După intervenția chirurgicală, o TVP proximală provocată sau PE are o rată de recurență anuală de numai 0,7%.
Epidemiologie
Aproximativ 1,5 din 1000 de adulți pe an au un prim TEV în țările cu venituri ridicate. Condiția devine mult mai frecventă odată cu vârsta. TEV apare rar la copii, dar atunci când se întâmplă, afectează predominant copiii spitalizați. Copiii din America de Nord și Olanda au rate de TEV care variază de la 0,07 la 0,49 din 10.000 de copii anual. Între timp, aproape 1% dintre cei cu vârsta peste 85 de ani experimentează TEV în fiecare an. Aproximativ 60% din toate TEV apar la acei 70 de ani sau peste. Incidența este cu aproximativ 18% mai mare la bărbați decât la femei, deși există vârste în care TEV este mai răspândită la femei. TEV apare în asociere cu spitalizarea sau reședința casei de bătrâni aproximativ 60% din timp, cancer activ aproximativ 20% din timp și un cateter venos central sau un stimulator cardiac transvenos aproximativ 9% din timp.
În timpul sarcinii și după naștere, TEV acută apare la aproximativ 1,2 din 1000 nașteri. Deși este relativ rar, este o cauză principală de morbiditate și mortalitate maternă . După intervenția chirurgicală cu tratament preventiv, TEV se dezvoltă la aproximativ 10 din 1000 de persoane după înlocuirea totală sau parțială a genunchiului și la aproximativ 5 din 1000 după înlocuirea totală sau parțială a șoldului. Aproximativ 400.000 de americani dezvoltă un TEV inițial în fiecare an, cu 100.000 de decese sau mai multe atribuite PE. Indivizii asiatici, asiatici-americani, nativi americani și hispanici au un risc mai scăzut de TEV decât albii sau negrii. Populațiile din Asia au rate de TEV la 15-20% din ceea ce se observă în țările occidentale, cu o creștere a incidenței observată în timp. În populațiile nord-americane și europene, aproximativ 4-8% dintre oameni au o trombofilie, cel mai frecvent factor V leiden și protrombină G20210A. Pentru populațiile din China, Japonia și Thailanda, predomină deficiențele în proteina S, proteina C și antitrombina. Tipul de sânge non-O este prezent la aproximativ 50% din populația generală și variază în funcție de etnie și este prezent la aproximativ 70% dintre cei cu TEV.
TVP apare la extremitățile superioare în aproximativ 4-10% din cazuri, cu o incidență de 0,4-1,0 persoane din 10 000 pe an. O minoritate a TVP ale extremităților superioare se datorează sindromului Paget-Schroetter, numit și tromboză de efort, care apare la 1-2 persoane din 100.000 pe an, de obicei la bărbații sportivi cu vârsta de aproximativ 30 de ani sau la cei care fac cantități semnificative de cheltuieli generale. muncă manuală.
Social

A fi sub formă de diluanți de sânge din cauza TVP poate schimba viața, deoarece poate preveni activitățile stilului de viață, cum ar fi contactul sau sporturile de iarnă, pentru a preveni sângerarea după posibile leziuni. Leziunile la cap care determină sângerări cerebrale sunt de o preocupare deosebită. Acest lucru a făcut ca pilotul NASCAR Brian Vickers să renunțe la participarea la curse. Jucătorii profesioniști de baschet, inclusiv jucătorii NBA Chris Bosh și sala renumitului Hakeem Olajuwon s-au ocupat de cheaguri de sânge recurente, iar cariera lui Bosh a fost în mod semnificativ împiedicată de TVP și PE.
Vedeta de tenis Serena Williams a fost internată în spital în 2011, pentru că PE se crede că provine din TVP. Ani mai târziu, în 2017, datorită cunoștințelor sale despre TVP și PE, Serena a pledat cu precizie pentru ea însăși pentru a avea un EP diagnosticat și tratat. În timpul acestei întâlniri cu TEV, a fost internată în spital după o intervenție chirurgicală a secțiunii C și nu mai avea diluanți de sânge. După ce a simțit apariția bruscă a unui simptom PE, dificultăți de respirație, i-a spus asistentei sale și a solicitat o scanare CT și o picurare heparină IV, toate în timp ce gâfâia pentru aer. Ea a început să primească o ecografie pentru a căuta TVP în picioare, determinând-o să-și exprime nemulțumirea personalului medical că nu căutau cheaguri în care avea simptome (plămânii ei) și încă nu-i tratau presupusa PE. După ce a fost diagnosticată cu PE și nu cu TVP și după ce a primit heparină prin IV, tuse din PE a determinat deschiderea locului chirurgical al secțiunii C, iar heparina a contribuit la sângerare la locul respectiv. Mai târziu, Serena a primit un filtru IVC în timp ce se afla la spital.
Alte persoane notabile au fost afectate de TVP. Fostul președinte al Statelor Unite (SUA), Richard Nixon, a avut TVP recurentă, la fel și fostul secretar de stat Hillary Clinton . Ea a fost diagnosticată pentru prima dată în timpul primei doamne în 1998 și din nou în 2009. Dick Cheney a fost diagnosticat cu un episod în timp ce vicepreședinte și gazda emisiunii TV Regis Philbin au avut TVP după o intervenție chirurgicală de înlocuire a șoldului. TVP a contribuit și la moartea unor oameni celebri. De exemplu, TVP și PE au jucat un rol în moartea rapperului Heavy D la vârsta de 44 de ani. Jurnalistul NBC David Bloom a murit la 39 de ani în timp ce acoperea războiul din Irak de la un PE despre care se credea că a progresat de la o TVP ratată, și actorul Jimmy Stewart a avut TVP care a progresat la un PE când avea 89 de ani.
Istorie
Cartea Sushruta Samhita , un text ayurvedic publicat în jurul anilor 600–900 î.Hr., conține ceea ce a fost citat ca prima descriere a TVP. În 1271, simptomele TVP la nivelul piciorului unui bărbat de 20 de ani au fost descrise într-un manuscris francez, care a fost citat ca primul caz sau prima referință occidentală la TVP.
În 1856, medicul și patologul german Rudolf Virchow și-a publicat analiza după inserarea corpurilor străine în venele jugulare ale câinilor, care au migrat către arterele pulmonare. Aceste corpuri străine au provocat embolii pulmonare, iar Virchow s-a concentrat pe explicarea consecințelor lor. El a citat trei factori, care sunt acum înțelese ca hipercoaguabilitate, stază și leziuni endoteliale. Abia în 1950 acest cadru a fost citat ca triada lui Virchow, dar învățătura triadei lui Virchow a continuat în lumina utilității sale ca cadru teoretic și ca o recunoaștere a progresului semnificativ pe care Virchow l-a făcut în extinderea înțelegerii TEV.
Metodele de observare a TVP prin ultrasunete au fost stabilite în anii 1960. Diagnosticele au fost efectuate în mod obișnuit prin pletismografie de impedanță în anii 1970 și 1980, dar ultrasunetele, în special după ce utilitatea comprimării sondei a fost demonstrată în 1986, au devenit metoda de diagnostic preferată. Cu toate acestea, la mijlocul anilor 1990, venografia de contrast și pletismografia de impedanță erau încă descrise ca fiind obișnuite.
Terapii farmacologice multiple pentru TVP au fost introduse în secolul al XX-lea: anticoagulante orale în anii 1940, injecții subcutanate de LDUH în 1962 și injecții subcutanate de LMWH în 1982. 1974 a fost momentul în care inflamația vasculară și tromboza venoasă s-au propus pentru prima dată să fie corelate. Timp de aproximativ 50 de ani, un regim de warfarină (Coumadin) de o lună a constituit pilonul principal al tratamentului farmacologic. Pentru a evita monitorizarea sângelui necesară cu warfarină și injecțiile necesare pentru heparină și medicamente asemănătoare heparinei, au fost dezvoltate anticoagulante orale directe (DOAC). La sfârșitul anilor 2000 până la începutul anilor 2010, DOAC - inclusiv rivaroxaban (Xarelto), apixaban (Eliquis) și dabigatran (Pradaxa) - au venit pe piață. New York Times a descris o „luptă furioasă” între cei trei producători ai acestor medicamente „pentru tampoanele de prescripție ale medicilor”.
Economie
VTE costă sistemului de sănătate din SUA aproximativ 7-10 miliarde de dolari anual. Costurile inițiale și medii ale TVP pentru un pacient din SUA internat este de aproximativ 10.000 USD (estimare 2015). În Europa, costurile pentru o spitalizare inițială pentru TEV sunt semnificativ mai mici, costând aproximativ 2000-4000 EUR (estimare 2011). Sindromul post-trombotic contribuie semnificativ la costurile urmăririi TVP. Tratamentul ambulatoriu reduce semnificativ costurile, iar costurile tratamentului pentru EP depășesc cele ale TVP.
Direcții de cercetare
Un studiu din 2019 publicat în Nature Genetics a raportat mai mult decât dublarea loci genetici cunoscuți asociați cu TEV. În ghidurile lor actualizate de practică clinică din 2018, Societatea Americană de Hematologie a identificat 29 de priorități de cercetare separate, dintre care majoritatea au legătură cu pacienții bolnavi acut sau critic. Inhibarea factorului XI , P-selectina , E-selectina și o reducere a formării capcanelor extracelulare neutrofile sunt terapii potențiale care ar putea trata TEV fără a crește riscul de sângerare.
Note
Referințe
- Literatură citată
- Dalen JE (2003). Tromboembolism venos . CRC Press. ISBN 978-0824756451.
- Guyatt GH, Akl EA, Crowther M, Gutterman DD, Schuünemann HJ (februarie 2012). "Rezumat: terapie antitrombotică și prevenirea trombozei, ediția a IX-a: Colegiul American al Medicilor Chest Medici bazate pe dovezi, ghiduri de practică clinică" . Piept . 141 (2 Suppl): 7S – 47S. doi : 10.1378 / chest.1412S3 . PMC 3278060 . PMID 22315257 .
| Clasificare | |
|---|---|
| Resurse externe |