Ixazomib - Ixazomib
 | |
| Date clinice | |
|---|---|
| Denumiri comerciale | Ninlaro |
| Alte nume | MLN2238 |
| AHFS / Drugs.com | Monografie |
| MedlinePlus | a616008 |
| Date despre licență | |
Categoria sarcinii |
|
| Căi de administrare |
Pe cale orală ( capsule ) |
| Codul ATC | |
| Statut juridic | |
| Statut juridic | |
| Date farmacocinetice | |
| Biodisponibilitate | 58% |
| Legarea proteinelor | 99% |
| Metabolism | Hepatic ( CYP : 3A4 (42%), 1A2 (26%), 2B6 (16%) și altele) |
| Timp de înjumătățire prin eliminare | 9,5 zile |
| Excreţie | Urină (62%), fecale (22%) |
| Identificatori | |
| |
| Numar CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ECHA InfoCard |
100.238.319 |
| Date chimice și fizice | |
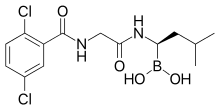
| Formulă | C 14 H 19 B Cl 2 N 2 O 4 |
| Masă molară | 361,03 g · mol −1 |
| Model 3D ( JSmol ) | |
| |
| |
Ixazomib (denumirea comercială Ninlaro ) este un medicament pentru tratamentul mielomului multiplu , un tip de cancer al globulelor albe , în combinație cu alte medicamente. Se ia pe cale orală sub formă de capsule.
Reacțiile adverse frecvente includ diaree, constipație și număr scăzut de trombocite . La fel ca bortezomibul mai vechi (care poate fi administrat doar prin injecție), acționează ca un inhibitor al proteazomului , are statutul de medicament orfan în SUA și Europa și este un derivat al acidului boronic .
Medicamentul a fost dezvoltat de Takeda . În SUA, este aprobat din noiembrie 2015, iar în UE din noiembrie 2016.
Utilizări medicale
Ixazomib este utilizat în asociere cu lenalidomidă și dexametazonă pentru tratamentul mielomului multiplu la adulți după cel puțin un tratament anterior. Nu există experiențe cu copii și tineri sub 18 ani.
Studiul relevant pentru aprobare a inclus 722 de persoane. În acest studiu, ixazomib a crescut timpul mediu de supraviețuire fără progresie de la 14,7 luni (în brațul de studiu placebo + lenalidomidă + dexametazonă incluzând 362 de persoane) la 20,6 luni (sub ixazomib + lenalidomidă + dexametazonă, 360 de persoane), ceea ce a fost statistic efect semnificativ ( p = 0,012). 11,7% dintre pacienții din grupul cu ixazomib au avut un răspuns complet la tratament, comparativ cu 6,6% în grupul placebo. Rata de răspuns globală (completă plus parțială) a fost de 78,3% față de 71,5%.
Un studiu de fază 3 a demonstrat o îmbunătățire semnificativă a supraviețuirii fără progresie (SFP) cu ixazomib-lenalidomidă-dexametazonă (IRd) comparativ cu placebo. Anomaliile citogenetice cu risc ridicat au fost definite ca del (17p), t (4; 14) și / sau t (14; 16); în plus, pacienții au fost evaluați pentru amplificarea 1q21. Din 722 de pacienți randomizați, 552 au avut rezultate citogenetice; 137 (25%) au avut anomalii citogenetice cu risc ridicat și 172 (32%) au avut amplificare 1q21 singură. PFS a fost îmbunătățit cu IRd versus placebo atât la subgrupurile de citogenetică cu risc ridicat, cât și la cele standard: la pacienții cu risc ridicat, cu PFS median de 21,4 față de 9,7 luni; la pacienții cu risc standard, cu SFP mediană de 20,6 față de 15,6 luni. Acest beneficiu PFS a fost consecvent în toate subgrupurile cu anomalii citogenetice individuale cu risc crescut, inclusiv pacienții cu del (17p). PFS a fost, de asemenea, mai lungă cu IRd versus placebo- la pacienții cu amplificare 1q21 și în grupul „cu risc crescut extins”, definit ca cei cu anomalii citogenetice cu risc ridicat și / sau amplificare 1q21. IRd a demonstrat beneficii substanțiale în comparație cu placebo la pacienții cu mielom multiplu recidivat / refractar cu citogenetică cu risc ridicat și cu risc standard și îmbunătățește PFS slab asociat cu anomalii citogenetice cu risc ridicat.
Sarcina și alăptarea
Ixazomib și lenalidomida sunt teratogene în studiile la animale. Acesta din urmă este contraindicat femeilor însărcinate, ceea ce face ca acest regim de terapie să nu fie adecvat pentru acest grup. Nu se știe dacă ixazomib sau metaboliții săi trec în laptele matern.
Efecte secundare
Reacțiile adverse frecvente ale tratamentului studiului ixazomib + lenalidomidă + dexametazonă au inclus diaree (42% versus 36% sub placebo + lenalidomidă + dexametazonă), constipație (34% versus 25%), trombocitopenie ( număr scăzut de trombocite ; neuropatie periferică (28% față de 21%), greață (26% față de 21%), edem periferic (umflare; 25% față de 18%), vărsături (22% față de 11%) și dureri de spate (21% față de 16%) . Diareea gravă sau trombocitopenia au apărut la 2% dintre pacienți, respectiv.
Efectele secundare ale ixazomibului singur au fost evaluate doar la un număr mic de persoane. Diareea de gradul 2 sau mai mare a fost găsită la 24% dintre acești pacienți, trombocitopenia de gradul 3 sau mai mare la 28% și oboseala de gradul 2 sau mai mare la 26%.
Interacțiuni
Medicamentul are un potențial redus de interacțiuni prin intermediul enzimelor hepatice ale citocromului P450 (CYP) și proteinelor transportoare . Singura constatare relevantă din studii a fost o reducere a nivelurilor sanguine de ixazomib atunci când este combinată cu un puternic inductor al rifampicinei CYP3A4 . C max a fost redus cu 54% , iar aria de sub curba de 74% în acest studiu.
Farmacologie
Mecanism de acțiune
La concentrații terapeutice, ixazomib inhibă selectiv și reversibil subunitatea proteinei beta tip 5 (PSMB5) cu un timp de înjumătățire de disociere de 18 minute. Acest mecanism este același ca al bortezomibului , care are un timp de înjumătățire de disociere mult mai lung de 110 minute; medicamentul asociat carfilzomib , în schimb, blochează PSMB5 ireversibil. Subunitățile proteazomice beta tip-1 și tip-2 sunt inhibate numai la concentrații mari atinse în modelele de cultură celulară.
PSMB5 face parte din complexul proteazomului 20S și are activitate enzimatică similară cu chimotripsina . Induce apoptoza , un tip de moarte celulară programată , în diferite linii celulare canceroase. Un efect sinergic al ixazomibului și lenalidomidei a fost găsit într-un număr mare de linii celulare de mielom.
Farmacocinetica
Medicamentul este administrat pe cale orală sub formă de promedicament , citrat de ixazomib, care este un ester boronic ; acest ester hidrolizează rapid în condiții fiziologice până la forma sa activă biologic, ixazomib, un acid boronic. Biodisponibilitatea absolută este de 58%, iar cele mai mari concentrații plasmatice ale ixazomibului sunt atinse după o oră. Legarea proteinelor plasmatice este de 99%.
Substanța este metabolizată de numeroase enzime CYP (procente in vitro , la concentrații clinice mai mari decât: CYP3A4 42,3%, CYP1A2 26,1%, CYP2B6 16,0%, CYP2C8 6,0%, CYP2D6 4,8%, CYP2C9 4,8%, CYP2C9 <1%) ca enzime non-CYP, care ar putea explica potențialul redus de interacțiune. Clearance-ul este de aproximativ 1,86 litri pe oră, cu o variabilitate largă de 44% între indivizi, iar timpul de înjumătățire plasmatică este de 9,5 zile. 62% din ixazomib și metaboliții săi sunt excretați prin urină (din care mai puțin de 3,5% sub formă nemodificată) și 22% prin fecale.
Chimie
Ixazomib este un analog al acidului boronic și al peptidelor ca și bortezomibul mai vechi. Conține un derivat al aminoacidului leucină , gruparea acidului carboxilic fiind înlocuită cu un acid boronic; iar restul moleculei a fost asemănat cu fenilalanina . Structura a fost găsită printr-un screening la scară largă a moleculelor care conțin bor.
Istorie
Medicamentul a fost dezvoltat de Takeda. A obținut statutul de medicament orfan din SUA și Europa pentru mielomul multiplu în 2011 și pentru amiloidoza AL în 2012. Takeda a depus o nouă cerere de medicament din SUA pentru mielomul multiplu în iulie 2015. În septembrie 2015, Administrația pentru Alimente și Medicamente (FDA) a acordat ixazomib combinată cu lenalidomidă și dexametazonă, o denumire de revizuire prioritară pentru mielom multiplu. La 20 noiembrie 2015, FDA a aprobat această combinație pentru tratamentul de linia a doua.
Cererea de autorizare de introducere pe piață în Europa a fost inițial refuzată de Agenția Europeană pentru Medicamente (EMA) în mai 2016 din cauza datelor insuficiente care arată un beneficiu al tratamentului. După ce Takeda a solicitat o reexaminare, EMA a acordat o autorizație de introducere pe piață pe 21 noiembrie 2016, cu condiția efectuării unor studii suplimentare de eficacitate. Indicația de aprobare este aceeași ca în SUA.
Cercetare
Începând din ianuarie 2017, ixazomib este, de asemenea, în studiile clinice de fază III pentru tratamentul amiloidozei AL și plasmocitomului oaselor și în studiile de fază I / II pentru diferite alte afecțiuni.
Referințe
linkuri externe
- „Ixazomib” . Portalul de informații despre droguri . Biblioteca Națională de Medicină din SUA.
- „Citrat de Ixazomib” . Portalul de informații despre droguri . Biblioteca Națională de Medicină din SUA.

