Anemie cu deficit de vitamina B 12 -Vitamin B12 deficiency anemia
| Anemie cu deficit de vitamina B 12 | |
|---|---|
| Alte nume | Anemie periculoasă, anemie Biermer, anemie Addison, anemie Addison – Biermer |
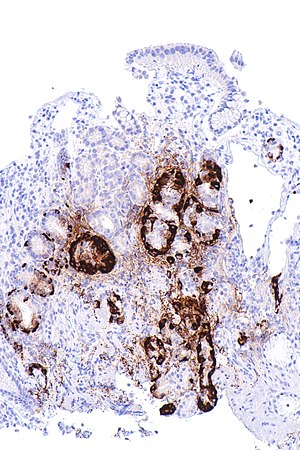 | |
| Micrografie care prezintă hiperplazie celulară asemănătoare enterocromafinei, așa cum s-a demonstrat cu imunocolorarea cromograninei A , în corpul stomacului . Celulele parietale nu sunt ușor de văzut. Aceste modificări sunt în concordanță cu gastrita metaflastică atrofică autoimună, un corelat histologic al anemiei cu deficit de vitamina B 12 . | |
| Specialitate | Hematologie |
| Simptome | Senzație de oboseală, dificultăți de respirație , piele palidă, amorțeală la mâini și picioare, reflexe slabe , confuzie |
| Debut obișnuit | > 60 de ani |
| Cauze | Nu este suficientă vitamina B 12 |
| Metoda de diagnosticare | Analize de sânge , analize ale măduvei osoase |
| Tratament | Vitamina B 12 pastile sau injecții |
| Prognoză | Cu tratament o viață normală |
| Frecvență | 1 la 1000 de persoane |
Anemia cu deficit de vitamina B 12 , dintre care anemia pernicioasă ( PA ) este un tip, este o boală în care nu se produc suficiente celule roșii din sânge din cauza unui deficit de vitamina B 12 . Cel mai frecvent simptom inițial este senzația de oboseală și slăbiciune . Alte simptome pot include dificultăți de respirație , piele palidă, senzație de dispariție (senzație de amețeală), dureri în piept, bătăi rapide ale inimii , amorțeală la nivelul mâinilor și picioarelor, echilibru slab, scăderea frecventă a tensiunii arteriale , pierderea poftei de mâncare, limbă roșie, reflexe slabe și, în cazuri severe, chiar depresie și confuzie. Fără tratament, unele dintre aceste probleme pot deveni permanente.
Anemia periculoasă se referă la anemia care rezultă din lipsa vitaminei B12. Lipsa factorului intrinsec se datorează cel mai frecvent unui atac autoimun asupra celulelor care îl creează în stomac . Poate apărea și după îndepărtarea chirurgicală a unei părți a stomacului sau dintr-o tulburare moștenită. Alte cauze ale scăderii vitaminei B 12 includ un aport alimentar insuficient (care poate fi un risc într-o dietă vegană ), boala celiacă sau infecția cu tenie . Când este suspectat, diagnosticul se face prin teste de sânge și, ocazional, de măduvă osoasă. Testele de sânge pot arăta celule roșii din sânge mai puține, dar mai mari , un număr scăzut de globule roșii tinere , niveluri scăzute de vitamina B 12 și anticorpi împotriva factorului intrinsec.
Anemia periculoasă poate fi tratată cu injecții cu vitamina B 12 . Dacă simptomele sunt severe, injecțiile sunt de obicei recomandate inițial. Pentru cei care au probleme cu înghițirea pastilelor, este disponibil un spray nazal. Adesea, tratamentul este pe tot parcursul vieții.
Anemia periculoasă din cauza problemelor autoimune apare la aproximativ una din 1000 de persoane. Dintre cei cu vârsta peste 60 de ani, aproximativ 2% au această afecțiune. Afectează mai frecvent persoanele de origine nord-europeană. Femeile sunt mai frecvent afectate decât bărbații. Cu un tratament adecvat, majoritatea oamenilor duc o viață normală. Din cauza unui risc mai mare de cancer de stomac , cei cu anemie pernicioasă ar trebui să fie verificați în mod regulat pentru acest lucru. Prima descriere clară a fost făcută de Thomas Addison în 1849. Termenul „pernicios” înseamnă „mortal”, iar acest termen a intrat în uz deoarece, înainte de tratamentul disponibil, boala era adesea fatală.
semne si simptome
Progresia anemiei pernicioase apare încet. Poate fi dificil să recunoști simptomele, deoarece se poate obișnui să nu te simți bine. netratată, poate duce la complicații neurologice și, în cazuri grave, la moarte. Multe dintre semne și simptome se datorează anemiei în sine, atunci când este prezentă anemie. Simptomele pot include:
- senzație de oboseală, slăbiciune constantă (oboseală)
- amețeli sau senzație de leșin ( amețeală )
- mâini și picioare reci
- tulburări de durere și greață
- o limba rosie dureroasa ( glossita ), numita si limba cires
- bătăi rapide ale inimii (fluturare sau bătăi neregulate ale inimii)
- o scădere frecventă a tensiunii arteriale (hipotensiune arterială)
- o piele gălbuie, palidă ( icter )
- senzație de respirație „oftele”
- febră slabă , tremurături și senzație constantă de frig
- pierderea poftei de mâncare și pierderea în greutate
- diaree sau constipație
- Cheilită unghiulară (leziuni inflamatorii la colțurile gurii)
- pierderea și slăbiciunea părului, îngrășarea timpurie a părului
- durere toracică ( angină )
În cazurile mai severe sau prelungite de anemie pernicioasă; poate duce la afectarea nervilor, care provoacă complicații neurologice, poate include:
- Senzații anormale, inclusiv furnicături sau amorțeală la degete și degetele de la picioare ( ace și ace ), pierderea simțului, dificultate în propriocepție și durere neuropatică ( anemia cu deficit de vitamina B 12 este singura anemie care afectează sistemul nervos și creierul)
- abilități mentale scăzute, inclusiv modificări ale personalității, depresie , iritabilitate , confuzie, stupoare , tulburări cognitive (inclusiv dificultăți de concentrare și răspunsuri lente, denumite în mod colocvial ceață cerebrală )
- modificări ale mobilității; incluzând mersul instabil ( ataxie ), echilibrul slab și pierderea senzației la picioare
- vedere încețoșată (tulburată)
- probleme de memorie
- slăbiciune musculară , dureri articulare severe ( artralgii )
Cel mai frecvent simptom inițial este senzația de oboseală și slăbiciune (în general), deși; anemia poate prezenta o serie de alte simptome frecvente, inclusiv ulcere bucale, sângerări ale gingiei, un aspect de epuizare cu buze palide și deshidratate sau crăpate și cercuri întunecate în jurul ochilor, precum și unghii fragile. Deoarece PA afectează sistemul nervos, care provoacă complicații neurologice, simptomele pot include, de asemenea, pierderi și modificări ale reflexelor, modificări ale dispoziției, tinitus, urinare afectată, mers nesigur, probleme de fertilitate, anxietate, psihoză și stângăcie. de asemenea, poate apărea scăderea gustului sau a mirosului. Anemia poate duce, de asemenea, la sufluri cardiace, alterarea tensiunii arteriale ( scăzută sau ridicată ). Deficiența se poate prezenta și cu tulburări tiroidiene. În cazurile severe, anemia poate provoca dovezi ale insuficienței cardiace congestive. O complicație a AP cronice severe este degenerarea combinată subacută a măduvei spinării , care duce la pierderea senzorială distală (coloana posterioară), reflexul absent al gleznei, răspunsul crescut al reflexului genunchiului și răspunsul plantar extensor. În afară de anemie, simptomele hematologice pot include citopenii , hemoliză intramedulară și microangiopatie pseudotrombotică. Anemia pernicioasă poate contribui la o întârziere a creșterii fizice la copii și poate fi, de asemenea, o cauză a întârzierii pubertății pentru adolescenți.
Cauze
Vitamina B 12 nu poate fi produsă de corpul uman și trebuie obținută din dietă. Când se consumă alimente care conțin B 12 , vitamina este de obicei legată de proteine și este eliberată de proteaze eliberate de pancreas în intestinul subțire. Dupa lansare, cele mai multe B 12 este absorbit de către organism în intestinul subțire ( ileum ) după legarea de o proteină cunoscută ca factor intrinsec . Factorul intrinsec este produs de celulele parietale ale mucoasei gastrice ( mucoasa stomacului), iar complexul factor intrinsec-B 12 este absorbit de receptorii de cubilină de pe celulele epiteliale ale ileonului . PA este caracterizat prin B 12 deficiență cauzată de absența factorului intrinsec.
PA poate fi considerat ca un stadiu final al gastritei imune , o boală caracterizată prin atrofia stomacului și prezența anticorpilor împotriva celulelor parietale și a factorului intrinsec. O formă specifică de gastrită cronică, gastrită de tip A sau gastrită atrofică a corpului, este puternic asociată cu PA. Această tulburare autoimună este localizată în corpul stomacului, unde se află celulele parietale. Anticorpii împotriva factorului intrinsec și a celulelor parietale determină distrugerea mucoasei gastrice oxintice, în care se află celulele parietale, ducând la pierderea ulterioară a sintezei factorului intrinsec. Fără factor intrinsec, ileonul nu mai poate absorbi B 12 .
Deși rolul exact al infecției cu Helicobacter pylori în PA rămâne controversat, dovezile indică faptul că H. pylori este implicat în patogeneza bolii. O infecție cu H. pylori de lungă durată poate provoca autoimunitate gastrică printr-un mecanism cunoscut sub numele de mimică moleculară . Anticorpii produși de sistemul imunitar pot fi reactivi încrucișat și se pot lega atât de antigenele H. pylori, cât și de cele găsite în mucoasa gastrică . Anticorpii sunt produși de celulele B activate care recunosc atât peptidele patogene, cât și peptidele auto-derivate. Cei autoantigene crede ca a provoca autoreactivitatea sunt subunitățile alfa și beta ale H + / K + -ATPaza. Într-un studiu, deficiența de B12 cauzată de Helicobacter pylori a fost corelată pozitiv cu pozitivitatea CagA și activitatea inflamatorie gastrică, mai degrabă decât cu atrofia gastrică.
Mai puțin frecvent, H. pylori și sindromul Zollinger-Ellison pot provoca, de asemenea, o formă de gastrită nonautoimună care poate duce la anemie pernicioasă.
Absorbția afectată a B 12 poate apărea și în urma îndepărtării gastrice ( gastrectomie ) sau a unei intervenții chirurgicale de by-pass gastric. În aceste intervenții chirurgicale, fie părțile stomacului care produc secreții gastrice sunt îndepărtate, fie sunt ocolite. Acest mijloc de factor intrinsec, precum și alți factori necesari pentru B 12 de absorbție, nu sunt disponibile. Cu toate acestea, B 12 deficit după intervenția chirurgicală gastrică nu devine , de obicei , o problemă clinică. Acest lucru se datorează probabil faptului că organismul stochează B 12 în valoare de mulți ani în ficat, iar pacienții cu chirurgie gastrică sunt suplimentați în mod adecvat cu vitamina.
Deși nu au fost identificate gene specifice de susceptibilitate la PA, un factor genetic este probabil implicat în boală. Anemia pernicioasă se găsește adesea împreună cu alte tulburări autoimune, sugerând că genele susceptibile autoimune comune pot fi un factor cauzal. Cu toate acestea, studiile anterioare de familie și rapoartele de caz care se concentrează asupra AP au sugerat că există o tendință de moștenire genetică a AP în special, iar rudele apropiate ale pacienților cu PA par să aibă o incidență mai mare a AP și a afecțiunilor PA asociate. Mai mult, s-a indicat în continuare că formarea anticorpilor împotriva celulelor gastrice a fost determinată de gena autosomală dominantă, iar prezența anticorpilor la celulele gastrice ar putea să nu fie neapărat legată de apariția gastritei atrofice legate de PA.
Fiziopatologie
Deși corpul sănătos stochează B 12 în valoare de trei până la cinci ani în ficat, activitatea autoimună de obicei nedetectată în intestinul cuiva pe o perioadă prelungită de timp duce la epuizarea B 12 și anemia rezultată. B 12 este necesar de către enzime pentru două reacții: conversia metilmalonil CoA în succinil CoA și conversia homocisteinei în metionină . În ultima reacție, gruparea metil a 5-metiltetrahidrofolatului este transferată la homocisteină pentru a produce tetrahidrofolat și metionină. Această reacție este catalizată de enzima metionină sintază cu B 12 ca cofactor esențial. In timpul B 12 deficiență, această reacție nu poate trece, ceea ce duce la acumularea de 5-methyltetrahydrofolate. Această acumulare epuizează celelalte tipuri de folat necesare pentru sinteza purinei și timidilatului , care sunt necesare pentru sinteza ADN-ului. Inhibarea replicării ADN-ului în maturarea globulelor roșii are ca rezultat formarea de eritrocite megaloblastice mari și fragile . Aspectele neurologice ale bolii se crede ca provin din acumularea metilmalonil CoA datorită cerinței de B 12 ca un cofactor pentru enzima metilmalonil CoA mutază.
Diagnostic

Se consideră că anemia pernicioasă este în principal o tulburare autoimună care dăunează celulelor parietale ale stomacului - deoarece duce la scăderea producției factorului intrinsec și la absorbția afectată a B- 12 ; Cu toate acestea, anemia pernicioasă poate avea, de asemenea, o componentă genetică, de asemenea, care poate să apară în familii. Anemia periculoasă poate fi suspectată atunci când frotiul de sânge al unui pacient prezintă eritrocite mari, fragile, imature, cunoscute sub numele de megaloblaste . un diagnostic de anemie pernicioasă. Este nevoie de un test de hemogramă și un frotiu de sânge, iar aceste teste includ:
- Număr complet de sânge și frotiu de sânge periferic; PA necesită mai întâi demonstrarea anemiei megaloblastice prin efectuarea unui număr total de sânge și frotiu de sânge, care evaluează volumul corpuscular mediu (MCV), precum și concentrația medie a hemoglobinei corpusculare (MCHC). PA este identificată cu un MCV ridicat ( anemie macrocitară ) și un MCHC normal (anemie normocromatică ). De asemenea, ovalocitele sunt de obicei observate pe frotiul de sânge, iar ocaracteristică patognomonică a anemiilor megaloblastice (care includ PA și altele) sunt neutrofilele hipersegmentate.
- Vitamina B 12 din ser ; nivelurile serice sunt folosite pentru a detecta deficiența acestuia, dar nu distinge cauzele acestuia. nivelurile devitamina B 12 pot fi fals ridicate sau scăzute, iar datele privind sensibilitatea și specificitatea variază foarte mult. Nivelurile serice normale pot fi găsite în cazurile de deficit în caresunt prezente tulburări mieloproliferative , boli hepatice ,deficit de transcobalamină II sau supra-creștere bacteriană intestinală .
- Factorul intrinsec și anticorpii celulelor parietale ; Sângele este verificat pentru anticorpi împotriva IF și a celulelor parietale din stomac. Prezența anticorpilor împotriva celulelor parietale gastrice și IF este frecventă în PA. Anticorpii cu celule parietale se găsesc în alte tulburări autoimune și, de asemenea, la până la 10% dintre persoanele sănătoase. Cu toate acestea, aproximativ 85% dintre pacienții cu PA au anticorpi cu celule parietale, ceea ce înseamnă că sunt un marker sensibil pentru boală. Anticorpii cu factor intrinsec sunt mult mai puțin sensibili decât anticorpii cu celule parietale, dar sunt mult mai specifici. Acestea se găsesc la aproximativ jumătate dintre pacienții cu PA și sunt foarte rar întâlnite în alte tulburări. Aceste teste de anticorpi pot distinge între PA și malabsorbția alimentară-B 12 .
- Acid metilmalonic și / sau homocisteină ; vitamina B 12 joacă un rol important în procesele metabolice și funcțiile celulare. Prin urmare, deficiența sa duce la acumularea unor produse metabolice. Acidul metilmalonic și / sau homocisteina este unul dintre produsele metabolice care pot fi măsurate în sânge. deoarece creșterea nivelurilor ambelor ajută la diferențiereadeficienței devitamina B 12 și a deficitului de acid folic , deoarece homocisteina singură crește în aceasta din urmă.
Nivelurile crescute de gastrină pot fi găsite în aproximativ 80-90% din cazurile de AP, dar pot fi găsite și în alte forme de gastrită. Scăderea nivelului de pepsinogen I sau scăderea raportului pepsinogen I / pepsinogen II pot fi de asemenea găsite, deși aceste descoperiri sunt mai puțin specifice PA și pot fi găsite în malabsorbția alimentară-B 12 și în alte forme de gastrită.
Diagnosticul gastritei atrofice de tip A trebuie confirmat prin gastroscopie și biopsie în trepte. Aproximativ 90% dintre persoanele cu PA au anticorpi pentru celulele parietale; cu toate acestea, doar 50% din toți indivizii din populația generală cu acești anticorpi au anemie pernicioasă.
Formele de deficit de vitamina B 12 , altele decât PA, trebuie luate în considerare în diagnosticul diferențial al anemiei megaloblastice. De exemplu, o stare deficientă B 12 care provoacă anemie megaloblastică și care poate fi confundată cu PA clasică poate fi cauzată de infecția cu tenia Diphyllobothrium latum , posibil din cauza concurenței parazitului cu gazda pentru vitamina B 12 .
Testul clasic pentru PA, testul Schilling , nu mai este utilizat pe scară largă, deoarece sunt disponibile metode mai eficiente. Acest test istoric a constat, în primul său pas, în administrarea unei doze orale de vitamina B 12 marcată radioactiv , urmată de cuantificarea vitaminei în urina pacientului pe o perioadă de 24 de ore prin măsurarea radioactivității . Un al doilea pas al testului repetă regimul și procedura primului pas, cu adăugarea factorului intrinsec oral. Un pacient cu AP prezintă cantități mai mici decât cele normale de factor intrinsec; prin urmare, adăugarea factorului intrinsec în a doua etapă are ca rezultat o creștere a absorbției vitaminei B 12 (peste linia de bază stabilită în prima). Testul Schilling a distins PA de alte forme de deficit de B 12 , în mod specific, de Sindromul Imerslund-Grasbeck (IGS), o deficiență de vitamina B12 cauzată de mutații în cubilina receptorului de cobalamină.
Tratament
Tratamentul PA variază în funcție de țară și zonă. Opiniile variază în ceea ce privește eficacitatea administrării (parenterală / orală), cantitatea și intervalul de timp al dozelor sau formele de vitamina B 12 (de exemplu, cianocobalamină / hidroxocobalamină). Sunt încă necesare studii mai cuprinzătoare pentru a valida fezabilitatea unei anumite metode terapeutice pentru AP în practicile clinice. Un tratament permanent pentru PA lipsește, deși completarea B 12 ar trebui să aibă ca rezultat încetarea simptomelor legate de anemie, oprirea deteriorării neurologice și în cazurile în care problemele neurologice nu sunt avansate, recuperarea neurologică și o remisie completă și permanentă dintre toate simptomele, atâta timp cât B 12 este suplimentat. Completarea B 12 poate fi realizată într-o varietate de moduri.
Injecții intramusculare
Tratamentul standard pentru PA a fost injecțiile intramusculare de cobalamină sub formă de cianocobalamină (CN-Cbl), hidroxocobalamină (OH-Cbl) sau metilcobalamină .
Doze orale
Tratamentul cu doză mare de vitamina B 12 1000 mcg (1 mg) formă orală apare, de asemenea, la fel de eficient și mai ieftin decât forma parenterală.
Prognoză
O persoană cu AP bine tratată poate duce o viață sănătoasă. Eșecul de a diagnostica și trata în timp, poate duce la leziuni neurologice permanente, oboseală excesivă, depresie, pierderi de memorie și alte complicații. În cazurile severe, complicațiile neurologice ale anemiei pernicioase pot duce la moarte - de unde și numele, „ pernicios ”, adică mortal.
S-a observat o asociere între anemia pernicioasă și anumite tipuri de cancer gastric, dar nu a fost stabilită o legătură cauzală.
Epidemiologie
PA este estimat a afecta 0,1% din populația generală și 1,9% dintre cei peste 60 de ani , reprezentând 20-50% din B 12 deficiență la adulți. O revizuire a literaturii arată că prevalența AP este mai mare în Europa de Nord, în special în țările scandinave și în rândul persoanelor de origine africană, și că o conștientizare sporită a bolii și instrumente de diagnostic mai bune ar putea juca un rol în ratele de incidență aparent mai mari.
Istorie
Simptomele sunt descrise pentru prima dată în 1822 de Dr. James Scarth Combe în Tranzacțiile Societății Medico-Chirurgice din Edinburgh , sub titlul Istoria unui caz de anemie .
Cu toate acestea, acest lucru nu a fost investigat mai în profunzime decât în 1849, de către medicul britanic Thomas Addison , de la care a dobândit denumirea comună de anemie a lui Addison. În 1871, medicul german Michael Anton Biermer (1827–1892) a observat caracteristica particulară a anemiei la unul dintre pacienții săi; ulterior a inventat termenul de „anemie pernicioasă progresivă”. În 1907, Richard Clarke Cabot a raportat o serie de 1200 de pacienți cu PA; supraviețuirea lor medie a fost între unu și trei ani. Castelul William Bosworth a efectuat un experiment prin care a ingerat carne crudă de hamburger și a regurgitat-o după o oră și apoi a hrănit-o unui grup de 10 pacienți. Carnea de hamburger crudă netratată a fost alimentată grupului de control. Primul grup a prezentat un răspuns la boală, în timp ce al doilea grup nu. Aceasta nu a fost o practică durabilă, dar a demonstrat existența unui „factor intrinsec” din sucul gastric.
Anemia pernicioasă a fost o boală fatală înainte de anul 1920, când George Whipple a sugerat ficatul crud ca tratament. Primul tratament fezabil pentru anemia pernicioasă a început când Whipple a făcut o descoperire în timpul experimentelor în care a sângerat câini pentru a le face anemici, apoi i-a hrănit cu diverse alimente pentru a vedea care să-i facă să se recupereze cel mai rapid (căuta tratamente pentru anemie de la sângerare, nu anemie pernicioasă). Whipple a descoperit că ingerarea unor cantități mari de ficat părea să vindece anemia de pierderea de sânge și a încercat ingestia hepatică ca tratament pentru anemia pernicioasă, raportând o îmbunătățire acolo, de asemenea, într-o lucrare în 1920. George Minot și William Murphy au început apoi să izoleze parțial proprietate curativă în ficat, iar în 1926 a arătat că era conținută în suc de ficat crud (în acest proces, arătând, de asemenea, fierul din țesutul hepatic, nu factorul solubil din sucul de ficat, care a vindecat anemia de sângerare la câini); astfel, descoperirea factorului de suc de ficat ca tratament pentru anemia pernicioasă a fost prin coincidență. Frieda Robscheit-Robbins a lucrat îndeaproape cu Whipple, fiind co-autor al a 21 de lucrări din 1925 până în 1930. Pentru descoperirea vindecării unei boli fatale anterioare de cauză necunoscută, Whipple, Minot și Murphy au împărtășit Premiul Nobel pentru medicină din 1934 .
După verificarea rezultatelor lui Whipple de către Minot și Murphy în 1926, victimele anemiei pernicioase au mâncat sau au băut cel puțin o jumătate de kilogram de ficat crud sau au băut suc de ficat crud, în fiecare zi. Acest lucru a continuat timp de câțiva ani, până când a devenit disponibil un concentrat de suc de ficat. În 1928, chimistul Edwin Cohn a preparat un extract de ficat care a fost de 50 până la 100 de ori mai puternic decât alimentele naturale (ficatul). Extractul poate fi chiar injectat în mușchi, ceea ce înseamnă că pacienții nu mai au nevoie să mănânce cantități mari de ficat sau suc. Acest lucru a redus considerabil costul tratamentului.
Ingredientul activ din ficat a rămas necunoscut până în 1948, când a fost izolat de doi chimiști, Karl A. Folkers din Statele Unite și Alexander R. Todd din Marea Britanie. Substanța a fost o cobalamină , pe care descoperitorii au numit-o vitamina B 12 . Noua vitamină din sucul de ficat a fost în cele din urmă complet purificată și caracterizată în anii 1950 și au fost dezvoltate alte metode de producere a acesteia din bacterii. Poate fi injectat în mușchi cu chiar mai puțină iritare, făcând posibilă tratarea PA cu și mai multă ușurință. Anemia periculoasă a fost în cele din urmă tratată fie cu injecții, fie cu doze orale mari de B 12 , de obicei între 1 și 4 mg pe zi.
Un scriitor a emis ipoteza că Mary Todd Lincoln , soția președintelui american Abraham Lincoln , a avut anemie pernicioasă de zeci de ani și a murit din cauza ei.
Cercetare
Complexul SNAC
Deși megadozele orale și injecțiile intramusculare sunt cele mai comune metode de tratament disponibile în prezent, sunt testate mai multe metode noi, cu promisiuni mari pentru încorporarea viitoare în metodele de tratament obișnuite. Deoarece injecțiile sunt vehicule nefavorabile pentru administrarea medicamentelor, cercetările actuale implică îmbunătățirea difuziei pasive în ileon după ingestia orală a derivaților de cobalamină. Cercetătorii au profitat recent de noul compus N- [8- (2-hidroxibenzoil) amino] caprilat de sodiu (SNAC), care îmbunătățește foarte mult biodisponibilitatea și stabilitatea metabolică. SNAC este capabil să formeze un complex noncovalent cu cobalamină, păstrându-și în același timp integritatea chimică. Acest complex este mult mai lipofil decât vitamina B 12 solubilă în apă , deci este capabil să treacă prin membranele celulare cu mai mare ușurință.
Factor intrinsec recombinant
O altă metodă pentru creșterea absorbției prin ileon este de a ingera un complex Cbl de care IF este deja legat. Lipsa factorului intrinsec produs de corpul pacientului poate fi completată prin utilizarea IF sintetic uman produs din recombinanți ai plantelor de mazăre . Cu toate acestea, în cazurile în care anticorpii IF sunt motivul malabsorbției în ileon, acest tratament ar fi ineficient.
Livrare sublinguală
Tratamentele sublinguale au fost, de asemenea, postulate a fi mai eficiente decât tratamentele orale singure. Un studiu din 2003 a constatat, deși această metodă este eficientă, o doză de 500 μg de cianocobalamină administrată oral sau sublingual, este la fel de eficientă în restabilirea concentrațiilor fiziologice normale de cobalamină.
Referințe
linkuri externe
| Clasificare | |
|---|---|
| Resurse externe |

