Sindromul Brugada - Brugada syndrome
| Sindromul Brugada | |
|---|---|
| Alte nume | Sindromul de moarte nocturnă brusc inexplicabil, bangungut, sindromul morții pokkuri |
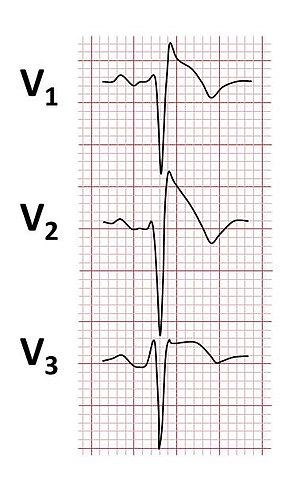 | |
| Modificări tipice ale ECG de tip 1 observate în sindromul Brugada | |
| Specialitate | Cardiologie |
| Simptome | Stingere , moarte subită cardiacă |
| Debut obișnuit | Maturitate |
| Cauze | Genetica, anumite medicamente |
| Factori de risc | Istorie familială, descendență asiatică , bărbat |
| Metoda de diagnosticare | Electrocardiogramă (ECG), testare genetică |
| Diagnostic diferentiat | Sindromul Romano-Ward , cardiomiopatia aritmogenă , distrofia musculară Duchenne |
| Tratament | Expectativa , defibrilator cardioverter implantabil (DCI) |
| Frecvență | 1 pe 2000 |
| Decese | 8% din moartea subită cardiacă |
Sindromul Brugada ( BrS ) este o tulburare genetică în care activitatea electrică din inimă este anormală. Crește riscul de ritm cardiac anormal și de moarte subită cardiacă . Cei afectați pot avea episoade de dispariție . Ritmurile cardiace anormale observate la cei cu sindrom Brugada apar adesea în repaus. Acestea pot fi declanșate de febră .
Aproximativ un sfert dintre cei cu sindrom Brugada au un membru al familiei care are și această afecțiune. Unele cazuri pot fi cauzate de o nouă mutație genetică sau de anumite medicamente. Cea mai frecvent implicată genă este SCN5A care codifică canalul cardiac de sodiu . Diagnosticul se face de obicei prin electrocardiogramă (ECG), cu toate acestea, este posibil ca anomaliile să nu fie prezente în mod constant. Medicamente precum ajmalina pot fi utilizate pentru a releva modificările ECG. Modele similare de ECG pot fi observate în anumite tulburări electrolitice sau atunci când aportul de sânge la inimă a fost redus .
Nu există nici un remediu pentru sindromul Brugada. Cei cu risc mai mare de moarte subită cardiacă pot fi tratați cu ajutorul unui defibrilator implantabil cardioverter (ICD). La cei fără simptome, riscul de deces este mult mai mic, iar modul de tratare a acestui grup este mai puțin clar. Isoproterenolul poate fi utilizat pe termen scurt pentru cei cu ritm cardiac anormal care pune viața în pericol, în timp ce chinidina poate fi utilizată pe termen lung. Se poate recomanda testarea membrilor familiei oamenilor.
Condiția afectează între 1 și 30 la 10.000 de persoane. Este mai frecvent la bărbați decât la femele și la cei de origine asiatică. Debutul simptomelor este de obicei la vârsta adultă. Acesta este numit după cardiologii spanioli Pedro și Josep Brugada care au descris starea în 1992. Fratele lor Ramon Brugada a fost primul care a descris o potențială cauză genetică în 1998.
semne si simptome
Deși mulți dintre cei cu sindrom Brugada nu prezintă niciun simptom, sindromul Brugada poate provoca leșin sau moarte subită cardiacă din cauza ritmurilor cardiace anormale grave, cum ar fi fibrilația ventriculară sau tahicardia ventriculară polimorfă . Întreruperile pot fi cauzate de scurte ritmuri cardiace anormale care revin spontan la un ritm normal. Dacă un ritm cardiac periculos nu se oprește singur și este lăsat netratat, persoana poate avea un stop cardiac fatal. Cu toate acestea, pot avea loc întreruperi la cei cu sindrom Brugada, în ciuda unui ritm cardiac normal datorat unei scăderi bruște a tensiunii arteriale, cunoscută sub numele de sincopă vasovagală .
Ritmurile cardiace anormale observate în sindromul Brugada apar adesea în repaus, după o masă abundentă sau chiar în timpul somnului. Aceste situații sunt legate de perioadele în care nervul vag este activat, denumite perioade de tonus vagal ridicat . Ritmurile cardiace anormale pot apărea, de asemenea, în timpul febrei sau după alcool excesiv. Anumite medicamente pot agrava, de asemenea, tendința către ritmuri cardiace anormale la pacienții cu sindrom Brugada și ar trebui evitate de acești pacienți.
Cauze
Celulele individuale ale inimii comunică între ele cu semnale electrice, iar aceste semnale electrice sunt perturbate la cele cu sindrom Brugada. Ca afecțiune genetică , sindromul este în cele din urmă cauzat de modificări ale ADN - ului unei persoane , cunoscute sub numele de mutații genetice . Primele mutații descrise în asociere cu sindromul Brugada au fost într-o genă responsabilă pentru o proteină sau un canal ionic care controlează fluxul ionilor de sodiu prin membrana celulară a celulelor musculare cardiace - canalul cardiac de sodiu . Multe dintre mutațiile genetice care au fost descrise ulterior în asociere cu sindromul Brugada influențează într-un fel curentul de sodiu sau afectează alți curenți ionici.
A fost descrisă o listă lungă de factori care pot genera un model ECG Brugada, inclusiv anumite medicamente, tulburări electrolitice, cum ar fi o scădere a nivelului de potasiu din sânge și o reducere a aportului de sânge către zonele cheie ale inimii, în special tractul de evacuare ventricular drept . Medicamentele care au fost implicate includ medicamente antiaritmice , cum ar fi flecainida , verapamil și propranolol , antidepresive precum amitryptilina și medicamente care îmbunătățesc tonusul vagal, cum ar fi acetilcolina . Modelul ECG poate fi observat și în urma consumului excesiv de alcool sau cocaină .
Genetica
Sindromul Brugada este moștenit într-un mod autosomal dominant , ceea ce înseamnă că este necesară o singură copie a genei defecte pentru a produce sindromul. Cu toate acestea, o persoană diagnosticată cu această afecțiune poate fi prima din familia sa care are sindromul Brugada dacă a apărut ca o nouă mutație. Gena în care mutațiile se găsesc cel mai frecvent în sindromul Brugada, cunoscut sub numele de SCN5A , este responsabilă pentru canalul cardiac de sodiu. Mutațiile din SCN5A asociate cu sindromul Brugada determină în general scăderea fluxului de ioni de sodiu. Cu toate acestea, doar 20% din cazurile de sindrom Brugada sunt asociate cu mutații în SCN5A, deoarece la majoritatea pacienților cu sindrom Brugada testarea genetică este incapabilă să identifice mutația genetică responsabilă. Până la 290 de mutații ale genei SCN5A au fost descoperite până în prezent, fiecare modificând funcția canalului de sodiu în moduri subtil diferite. Această variație explică parțial diferențele de severitate a afecțiunii între diferite persoane, variind de la o afecțiune extrem de periculoasă care provoacă moartea la o vârstă fragedă la o afecțiune benignă care nu poate provoca deloc probleme. Cu toate acestea, genetica sindromului Brugada este complexă și este probabil ca starea să rezulte din interacțiunile multor gene. Datorită acestor interacțiuni complexe, unii membri ai unei familii care poartă o anumită mutație pot prezenta dovezi ale sindromului Brugada, în timp ce alții care poartă aceeași mutație nu, denumită penetranță variabilă . Mutațiile genei SCN5A par să aibă o valoare prognostică.
Mai multe alte gene au fost identificate în asociere cu sindromul Brugada. Unele sunt responsabile de alte proteine care fac parte din canalul de sodiu, cunoscut sub numele de subunități β ale canalului de sodiu ( SCN1B , SCN2B , SCN3B ), în timp ce altele formează diferite tipuri de canal de sodiu ( SCN10A ). Unele gene codifică canale ionice care transportă ioni de calciu sau potasiu ( CACNA1C , CACNB2 , KCND3 , KCNE3 , KCNJ8 ), în timp ce altele generează proteine care interacționează cu canalele ionice. ( GPD1L , PKP2 , MOG1, FGF12 ). O altă genă asociată cu această afecțiune este RRAD . Genele asociate cu sindromul Brugada și descrierea lor includ:
| Tip | OMIM | Gene | Note |
|---|---|---|---|
| BrS1 | 601144 | SCN5A | Na V 1,5 - subunitate α a canalului cardiac de sodiu care transportă curentul de sodiu I Na . |
| BrS2 | 611778 | GPD1L | Glicerol-3-fosfat dehidrogenază ca peptida - activitatea redusă GPD1-L duce la fosforilarea Na V 1,5 și scăderea I Na . |
| BrS3 | 114205 | CACNA1C | Ca V 1.2 - subunitatea α a canalului de calciu dependent de tensiune care transportă curentul de calciu de tip L I Ca (L) . |
| BrS4 | 600003 | CACNB2 | Ca V β2B - β-2 subunitate a canalului de calciu cu tensiune care transportă curentul de calciu de tip L I Ca (L) . |
| BrS5 | 600235 | SCN1B | Subunitatea Na V β1 - β-1 a canalului de sodiu care transportă curentul de sodiu I Na . |
| BrS6 | 604433 | KCNE3 | MiRP2 - subunitate β la canale de potasiu cu tensiune. Modulează tranzitorie de potasiu curent exterior I a . |
| BrS7 | 608214 | SCN3B | Subunitatea Na V β3 - β-3 a canalului cardiac de sodiu care transportă curentul de sodiu I Na . |
| BrS8 | 600935 | KCNJ8 | Kir6.1, transportă curentul de potasiu rectificator interior I Kir . |
| BrS9 | 114204 | CACNA2D1 | Subunitate α2δ a canalului de calciu cu tensiune care transportă curentul de calciu de tip L I Ca (L) . |
| BrS10 | 605411 | KCND3 | K V 4.3, α-subunitate a tranzient spre exterior al canalului de potasiu I la . |
| BrS11 | 607954 | RANGRF | Codifică MOG1 - influențează traficul de Na V 1.5. |
| BrS12 | 602701 | SLMAP | Proteina asociată membranei sarcolemale, o componentă a tubulilor T și a reticulului sarcoplasmatic - influențează traficul de Na V 1.5. |
| BrS13 | 601439 | ABCC9 | SUR2A, transportorul de casete care leagă adenozin trifosfat (ATP) al canalului I K (ATP) . |
| BrS14 | 601327 | SCN2B | Na V β2 - Subunitate beta-2 a canalului cardiac de sodiu care transportă curentul de sodiu I Na . |
| BrS15 | 602861 | PKP2 | Plakophillin-2 - interacționează cu I Na . |
| BrS16 | 601513 | FGF12 | Factorul de creștere al fibroblastului factor omolog 1-mutația scade I Na . |
| BrS17 | 604427 | SCN10A | Na V 1,8 - subunitate α a canalului neuronal de sodiu. |
| BrS18 | 604674 | HEY2 | Factorul de transcripție identificat în studiul de asociere la nivel de genom . |
| BrS19 | 603961 | SEMA3A | Semaforina. |
| BrS20 | 601142 | KCNAB2 | K V β2, subunitate β2 a canalului de potasiu cu tensiune - mutația crește de la I la . |
Unele mutații asociate cu sindromul Brugada pot provoca și alte afecțiuni cardiace. Cei care prezintă mai multe afecțiuni cardiace în același timp cauzate de o singură mutație sunt descriși ca având un „ sindrom de suprapunere ”. Un exemplu de sindrom de suprapunere este sindromul Brugada și QT lung (LQT3) cauzat de o mutație în SCN5A care reduce curentul maxim de sodiu, dar lasă simultan o scurgere persistentă de curent. Sindromul Brugada a fost descris ca suprapunându-se cu cardiomiopatia ventriculară dreaptă aritmogenă (ARVC) cauzată de o mutație a genei PKP2, provocând un model ECG Brugada, dar modificări structurale ale inimii caracteristice ARVC.
Mecanisme
Ritmurile cardiace anormale observate la cei cu sindrom Brugada sunt de obicei aritmii periculoase, cum ar fi fibrilația ventriculară sau tahicardia ventriculară polimorfă, dar cei cu BRS sunt, de asemenea, mai susceptibili de a experimenta ritmul cardiac rapid din cauza aritmiilor mai puțin periculoase, cum ar fi tahicardia reintroducătoare nodală AV și ritmuri cardiace anormal de lente, cum ar fi disfuncția nodului sinusal . Există mai multe mecanisme prin care mutațiile genetice care cauzează această afecțiune ar putea produce aceste aritmii.
Unii susțin că principalul motiv pentru care apar aceste aritmii se datorează conducerii electrice anormal de lente în zonele inimii, în special ventriculul drept . Variantele genetice asociate cu BrS susțin conceptul ca SCN5A, gena cel mai frecvent asociată cu afecțiunea, împreună cu SCN10A, SCN1B, SCN2B și SCN3B, toate afectează în mod direct curentul de sodiu I Na . Curentul de sodiu contribuie major la fluxul caracteristic al sarcinii electrice prin membrana celulelor musculare ale inimii, care are loc la fiecare bătăi ale inimii, cunoscut sub numele de potențial de acțiune . I Na provoacă accentuarea rapidă inițială a potențialului de acțiune (faza 0) și scăderea curentului de vârf timpuriu, așa cum se întâmplă în variantele genetice asociate BrS, duce la încetinirea conducerii electrice prin mușchiul inimii. Această conducție lentă permite formarea „scurtcircuitelor”, blocând valurile de activitate electrică în unele zone, permițând în același timp trecerea undelor în altele într-un fenomen cunoscut sub numele de val de rupere. Având în vedere circumstanțele potrivite, această rupere de undă poate permite undelor de electricitate să efectueze o întoarcere în interiorul mușchiului, călătorind în direcția inversă înainte de a începe să se rotească rapid în jurul unui punct, denumit reintrare și provocând un ritm cardiac anormal. . Cei care susțin această viziune (cunoscută sub numele de ipoteza depolarizării) susțin că încetinirea conducerii poate explica de ce aritmiile la cei cu sindrom Brugada tind să apară la vârsta mijlocie, când alți factori precum cicatrizarea sau fibroza care însoțesc bătrânețea au exacerbat tendința către conducere. încetinirea cauzată de mutația genetică.
Alții sugerează că principala cauză a aritmiilor este o diferență în proprietățile electrice dintre interior ( endocard ) și exterior ( epicard ) al inimii (cunoscută sub numele de ipoteza repolarizării). Forma potențialului de acțiune diferă între epicard și endocard. Potențialul de acțiune din celulele din epicard prezintă o crestătură proeminentă după vârful inițial datorită unui curent interior tranzitoriu. Această crestătură este mult mai puțin evidentă în celulele din endocard, iar diferența dintre endocard și epicard se observă cel mai clar în ventriculul drept. La cei cu sindrom Brugada, aceste diferențe sunt crescute, creând o scurtă perioadă în cadrul fiecărui ciclu cardiac când curentul curge de la endocard la epicard creând modelul ECG caracteristic. Diferențele dintre proprietățile electrice dintre epi și endocard sunt descrise ca o „dispersie transmurală a repolarizării” care, dacă este suficient de mare, poate duce la blocarea impulsurilor electrice în unele regiuni, dar nu și în altele. care, de obicei, călătoresc într-o singură direcție pentru a începe, în schimb, să se învârtă în jurul unui punct ca un circuit de reintrare, provocând o aritmie.
Un alt factor care promovează aritmiile în sindromul Brugada este modificarea structurii inimii. În timp ce inima celor cu sindrom Brugada poate părea normală, cicatricile sau fibroza sunt adesea observate în anumite regiuni ale inimii, în special în tractul de ieșire ventricular drept. Deoarece sindromul Brugada poate fi cauzat de mutații în multe gene diferite, este posibil ca mecanisme diferite să fie responsabile pentru aritmiile observate la diferiți pacienți.
Diagnostic
Electrocardiografie

Sindromul Brugada este diagnosticat prin identificarea tiparelor caracteristice pe o electrocardiogramă . Modelul văzut pe ECG include creșterea ST în conductele V 1 -V 3 cu aspect de bloc de ramură dreaptă (RBBB). Pot exista dovezi ale unei încetiniri a conducției electrice în interiorul inimii, după cum se arată printr-un interval PR prelungit . Aceste tipare pot fi prezente tot timpul, dar pot apărea numai ca răspuns la anumite medicamente (vezi mai jos), atunci când persoana are febră , în timpul exercițiului sau ca urmare a altor declanșatoare. Modelul ECG poate deveni mai evident prin efectuarea unui ECG în care unii dintre electrozi sunt așezați în poziții diferite de cele obișnuite, în special prin plasarea cablurilor V 1 și V 2 mai sus în peretele toracic în spațiile intercostale 1 sau 2.
În mod istoric au fost descrise trei forme ale modelului Brugada ECG, deși modelul de tip 3 nu mai este utilizat în practica contemporană.
- Tipul 1 are o înălțime ST de tip coved cu cel puțin 2 mm (0,2 mV) înălțime în punct J și un segment ST descendent treptat , urmat de o undă T negativă .
- Tipul 2 are un model în șa cu o înălțime a punctului J de cel puțin 2 mm și o înălțime de cel puțin 0,5 mm a segmentului ST terminal cu o undă T pozitivă sau bifazică. Un tipar de tip 2 poate fi ocazional observat la subiecții sănătoși.
- Tipul 3 are un model în spate (tip 2), cu o înălțime de cel puțin 2 mm în punct J, dar mai puțin de 1 mm înălțime a segmentului ST terminal. Un tipar de tip 3 este relativ frecvent la subiecții sănătoși și nu mai este considerat sugestiv pentru sindromul Brugada.
Conform recomandărilor actuale, doar un model ECG de tip 1, care apare fie spontan, fie ca răspuns la medicație, poate fi utilizat pentru a confirma diagnosticul sindromului Brugada, deoarece tipurile de tip 2 și 3 nu sunt rareori observate la persoanele fără boală.
Testarea provocării
Unele medicamente, în special medicamentele antiaritmice care blochează curentul de sodiu cardiac I Na, pot dezvălui un tip Brugada de tip 1 la persoanele susceptibile. Aceste medicamente pot fi utilizate pentru a ajuta la stabilirea unui diagnostic la cei suspectați că au sindromul Brugada (de exemplu, supraviețuitorii unui stop cardiac inexplicabil, membrii familiei unei persoane cu sindromul Brugada), dar la care nu s-a văzut un model de diagnostic ECG. În aceste cazuri, medicamentele care blochează curentul de sodiu pot fi administrate într-un mediu controlat. Cele mai utilizate medicamente în acest scop sunt ajmalina , flecainida și procainamida , cu unele sugestii care indică faptul că ajmalina poate fi cea mai eficientă. Trebuie luate măsuri de precauție la administrarea acestor medicamente, deoarece există un risc mic de a provoca ritmuri cardiace anormale.
Testarea genetică
Testarea genetică poate fi utilă pentru identificarea pacienților cu sindrom Brugada, cel mai frecvent la membrii familiei unei persoane cu sindrom Brugada, dar uneori efectuate la o persoană care a murit brusc și neașteptat. Cu toate acestea, interpretarea rezultatelor testării genetice este dificilă. La membrii familiei care au toți o anumită variantă genetică asociată cu sindromul Brugada, unii membri ai familiei pot prezenta dovezi ale sindromului Brugada pe ECG-urile lor, în timp ce alții nu. Aceasta înseamnă că purtarea unei mutații genetice asociate cu sindromul Brugada nu înseamnă neapărat că o persoană este cu adevărat afectată de afecțiune. Pentru a complica mai mult lucrurile, multe variații frecvente ale genei SCN5A nu cauzează probleme și, prin urmare, sunt identificate uneori variante genetice la persoanele cu sindrom Brugada care nu cauzează cu adevărat boala.
Alte investigații
Studiile electrofiziologice invazive , în care firele sunt trecute printr-o venă pentru a stimula și înregistra semnale electrice din inimă, pot fi uneori folosite pentru a evalua riscul ca o persoană cu sindrom Brugada să experimenteze ritmuri cardiace anormale periculoase. Stratificarea riscului este, de asemenea, realizată uneori folosind un ECG mediu semnal . Monitorizarea ECG ambulatorie , inclusiv implantarea unui loop recorder , este uneori utilizată pentru a evalua dacă amețeala sau leșinul la o persoană cu sindrom Brugada se datorează ritmurilor cardiace anormale sau alte cauze precum sincopa vasovagală.
Tratament
Scopul principal al tratamentului persoanelor cu sindrom Brugada este reducerea riscului de moarte subită din cauza ritmurilor cardiace anormale grave , cum ar fi fibrilația ventriculară sau tahicardia ventriculară polimorfă. În timp ce unii cu această afecțiune prezintă un risc crescut de tulburări grave ale ritmului cardiac, alții prezintă un risc mult mai mic, ceea ce înseamnă că unii pot necesita un tratament mai intensiv decât alții. În plus față de tratarea persoanei care are sindromul Brugada, este adesea important să investigați membrii familiei lor imediate pentru a vedea dacă și ei suferă de această afecțiune.
Mod de viata
Prima linie de tratament, potrivită tuturor persoanelor cu sindrom Brugada, indiferent de riscul lor de aritmii, este sfatul stilului de viață. Oamenii ar trebui sfătuiți să recunoască și să evite lucrurile care pot crește riscul de aritmii grave. Acestea includ evitarea consumului excesiv de alcool, evitarea anumitor medicamente și tratarea febrei cu paracetamol . Deși ritmurile cardiace anormale observate în sindromul Brugada sunt, în general, mai susceptibile să apară în repaus sau chiar în timpul somnului, unele persoane cu sindrom Brugada au aritmii în timpul exercițiilor fizice intense. Prin urmare, unii medici pot sfătui persoanele cu sindrom Brugada că, deși exercițiile fizice ușoare sunt utile, trebuie evitat exercițiile fizice foarte extenuante.
Defibrilator implantabil
La persoanele care prezintă un risc mai mare de deces subit cardiac, poate fi recomandat un cardioverter-defibrilator implantabil (ICD). Aceste mici dispozitive implantate sub piele monitorizează continuu ritmul cardiac. Dacă dispozitivul detectează o aritmie care poate pune viața în pericol, poate da inimii un șoc electric mic, uimind inima într-un ritm normal. Un ICD poate funcționa și ca stimulator cardiac , prevenind ritmul cardiac anormal de lent, care poate apărea și la persoanele cu sindrom Brugada.
Implantarea unui ICD este o procedură cu risc relativ scăzut și se efectuează frecvent ca caz de zi sub anestezic local . Cu toate acestea, pot apărea complicații precum infecții, sângerări sau șocuri inutile, care uneori pot fi grave. Datorită riscului mic asociat implantării unui ICD, precum și a costului dispozitivelor, ICD-urile nu sunt recomandate tuturor persoanelor cu sindrom Brugada, ci sunt rezervate în schimb persoanelor cu risc crescut de deces subit cardiac.
Medicament
Chinidina este un medicament antiaritmic care poate reduce șansa apariției unor ritmuri cardiace anormale grave la unele persoane cu sindrom Brugada. Este cel mai frecvent utilizat la persoanele cu sindrom Brugada care au un DCI și au prezentat mai multe episoade de aritmii care pun viața în pericol, dar poate fi utilizat și la persoanele cu risc crescut de aritmii, dar la care un DCI nu este adecvat.
Isoprenalina , un medicament care are asemănări cu adrenalina , poate fi utilizată în caz de urgență pentru persoanele cu sindrom Brugada care au aritmii repetate care pun viața în pericol, cunoscute sub numele de „furtună electrică”. Acest medicament trebuie administrat sub formă de perfuzie continuă într-o venă și, prin urmare, nu este potrivit pentru utilizarea pe termen lung.
Ablația cateterului
O altă opțiune de tratament pentru persoanele cu sindrom Brugada este ablația cu cateter de radiofrecvență . În această procedură, firele sunt trecute printr-o venă a piciorului în inimă sau printr-o mică gaură sub stern . Aceste fire sunt folosite pentru a găsi zona inimii responsabile de inițierea aritmiilor. Vârful unuia dintre aceste fire este folosit pentru a produce o serie de arsuri minuscule, deteriorând în mod intenționat zona mușchiului cardiac anormal care a cauzat problema. Recomandările actuale sugerează că acest tratament ar trebui rezervat celor cu sindrom Brugada care au avut șocuri repetate de la un ICD.
Epidemiologie
Între 1 și 30 la 10.000 de persoane sunt afectate de sindromul Brugada. Deși cei afectați se nasc cu această afecțiune, simptomele încep de obicei doar la vârsta adultă. În timp ce cazurile rare observate în copilărie sunt la fel de probabil să fie bărbați sau femei, la maturitate simptomele apar mai frecvent la bărbați decât la femei, potențial datorită nivelurilor mai ridicate de testosteron găsite la bărbați.
Sindromul Brugada este mai frecvent la persoanele de origine asiatică și este cea mai frecventă cauză de deces subit la bărbații tineri fără boală cardiacă de bază cunoscută în Thailanda și Laos . În aceste țări, sindromul Brugada este probabil responsabil pentru multe cazuri de sindrom de moarte nocturnă neașteptată (SUNDS). Numele locale variază - în Filipine afecțiunea a fost cunoscută sub numele de Bangungut care înseamnă „un țipăt urmat de moarte subită în timpul somnului”, în timp ce în Thailanda a fost cunoscută sub numele de Lai Tai și în Japonia Pokkuri . Tiparele ECG de tip 1 Brugada sunt observate mai frecvent la populațiile asiatice (0-0,36%) decât la cele din Europa (0-0,25%) și Statele Unite (0,03%). În mod similar, tiparele ECG de tip 2 și tip 3 sunt mai răspândite în Asia (0,12-2,23%) decât în Europa (0,0-0,6%) sau Statele Unite (0,02%).
Istorie
Sindromul Brugada poartă numele cardiologilor spanioli Josep și Pedro Brugada care au descris starea în 1992, deși asocierea dintre modelul caracteristic ECG și moartea subită cardiacă fusese raportată în 1989. Sindromul Brugada a fost descris ca fiind o cauză a morții subite inexplicabile. sindrom observat la bărbații thailandezi în 1997. Primele mutații genetice care afectează gena SCN5A asociată cu sindromul au fost identificate de fratele lor Ramon Brugada în 1998, cu multe alte mutații care afectează cel puțin 19 gene identificate ulterior de alții. Studiile din anii 2000 au condus la teorii concurente în jurul mecanismelor prin care au fost generate ritmuri cardiace anormale. Cercetările privind sindromul Brugada sunt în curs de desfășurare, identificând noi variante genetice, explorând mecanismele aritmiilor și căutând tratamente mai bune.
Societate și cultură
- Un segment din 1992 al seriei de televiziune Unsolved Mysteries a profilat familia Guamanian Santos care pierduse diverși membri din cauza unor probleme cardiace. Membrii familiei supraviețuitori au fost diagnosticați în cele din urmă cu sindromul Brugada.
- Telenovela britanică EastEnders a prezentat o poveste în care unul dintre personaje a suferit un stop cardiac din cauza sindromului Brugada.
- În episodul 8 al sezonului 8 al serialului TV Scrubs („Avocatul meu este îndrăgostit”), Perry Cox pune o întrebare finală a stagiarului Ed la care nu poate răspunde. Ulterior este concediat. Un răspuns corect la întrebarea sa este sindromul Brugada, în timp ce sindromul QT lung ar fi fost, de asemenea, un răspuns acceptabil.
Vezi si
Referințe
linkuri externe
| Clasificare | |
|---|---|
| Resurse externe |
-
 Mass-media legată de sindromul Brugada la Wikimedia Commons
Mass-media legată de sindromul Brugada la Wikimedia Commons - BrugadaDrugs.org , conține o listă de medicamente de evitat la persoanele cu sindromul Brugada
- GeneReviews: sindromul Brugada




