TRPV6 - TRPV6
TRPV6 este o proteină canal membrana de calciu (Ca 2+ ) care este implicată în special în prima etapă a absorbției de Ca 2+ în intestin .
Clasificare
Potențialul receptorului tranzitoriu Subfamilia vaniloidă membru 6 (TRPV6) este un canal epitelial Ca 2+ care aparține familiei potențiale de receptor tranzitoriu (TRP) a proteinelor. Familia TRP este un grup de proteine de canal critice pentru homeostazia ionică și percepția diferiților stimuli fizici și chimici. Canalele TRP pot detecta temperatura , presiunea osmotică , olfacția , gustul și forțele mecanice. The genomului uman codifica pentru 28 de canale TRP, care includ șase TRPV canale. Selectivitatea ridicată a Ca 2+ a TRPV5 și TRPV6 face ca aceste canale să fie distincte de celelalte patru canale TRPV (TRPV1-TRPV4). TRPV5 și TRPV6 sunt implicați în transportul Ca 2+ , în timp ce TRPV1 prin TRPV3 sunt senzori de căldură cu prag de temperatură diferit pentru activare, iar TRPV4 este implicat în detectarea osmolarității . Defectele genetice ale genei TRPV6 sunt legate de hiperparatiroidismul neonatal tranzitor și de pancreatita cronică cu debut precoce . Dereglarea TRPV6 este, de asemenea, implicată în hipercalciurie , formarea de calculi renali , tulburări osoase, defecte în diferențierea keratinocitelor , deformări scheletice, osteoartrita , sterilitatea masculină , sindromul Pendred și anumite subtipuri de cancer .
Identificare
Peng și colab. Au identificat TRPV6 în 1999 din duodenul șobolanului într-un efort de a căuta proteinele de transport de Ca2 + implicate în absorbția de Ca2 + . TRPV6 a mai fost numită inițial proteina de transport calciu 1 (CaT1) inițial, deși denumirile canalului de calciu epitelial 2 (ECaC2) și CaT1-like (CaT-L) au fost de asemenea utilizate în studiile timpurii pentru a descrie canalul. Umane și de șoarece ortologi de TRPV6 au fost donate de către Peng și colab și Weber și colaboratorii, respectiv. Numele TRPV6 a fost confirmat în 2005.
Localizarea genei, localizarea cromozomială și filogenia
Gena TRPV6 umană este localizată pe locusul cromozomial 7q33-34 în imediata apropiere a omologului său TRPV5 pe 7q35. TRPV6 Gena in codeaza umane pentru 2906 lung bp ARNm . Spre deosebire de majoritatea celorlalte proteine, care inițiază traducerea cu un codon AUG , traducerea TRPV6 este inițiată prin lectură care nu este mediată de codon AUG. Proteina TRPV6 poartă o extensie N-terminală lungă de 40 de aa în placentă și în unele setări fiziologice în comparație cu versiunea adnotată a proteinei utilizate în studiile biologice. Cu toate acestea, este încă de stabilit dacă versiunea lungă a proteinei TRPV6 este forma dominantă în diferite țesuturi.
| Specii | Uman | Şobolan | Șoarece |
| Localizare cromozomială | 7q33-q34 | 4q22 | 6B2 |
| Adnotat o lungime | 725 | 727 | 727 |
| In vivo aa lungime a | 765 | 767 | 767 |
| RefSeq nucleotidă | NM_018646 | NM_053686 | NM_022413 |
| Proteina RefSeq | NP_061116 | NP_446138 | NP_071858 |
a De verificat în diferite țesuturi.
S - a emis ipoteza ca Trpv5 si Trpv6 gene au fost generate dintr - o singură genă ancestrală de gene duplicarea evenimente. Analiza filogenetică a arătat că paralogii TRPV6 la mamifere , sauropside , amfibieni și chondrichthyes au apărut din evenimente de duplicare independente în strămoșul fiecărui grup. Se speculează că doi omologi selectivi Trpv selectivi Ca 2+ au apărut ca o adaptare pentru a atinge un grad mai mare de specializare funcțională pentru navigarea provocărilor renale distincte ale animalelor terestre.
Două alele ale genei TRPV6 au fost identificate la om (menționate inițial ca CaT-La și CaT-Lb). Aceste alele prezintă polimorfisme cuplate generând două versiuni ale aceleiași gene. Polimorfismele dau naștere unei „variante ancestrale” și a unei „variante derivate” care diferă în cinci baze și trei aminoacizi. Codurile de alele ancestrale pentru C197 (157, între paranteze sunt numerotarea de aminoacizi adnotată), M418 (378) și M721 (681), în timp ce codurile de alele derivate pentru R197 (157), V418 (378) și T721 (681). Frecvența alelei ancestrale TRPV6 variază în funcție de diferite grupuri de populație. Se presupune că presiunile de selecție care ar fi putut schimba distribuția alelei TRPV6 includ schimbări în tiparele de consum de lapte, domesticirea animalelor, schimbarea expunerii la lumină ultravioletă datorită migrației trans-ecuatoriale, adaptări genomice care oferă avantaje imune populațiilor care întâmpină noi agenți patogeni.
Distribuția țesuturilor
Proteina TRPV6 este exprimată în țesuturile epiteliale , cum ar fi intestinul , rinichii , placenta , epididimul și glandele exocrine, cum ar fi pancreasul , prostata și salivele , sudoarea și glandele mamare . Expresia proteinei TRPV6 la om a fost demonstrată în esofag , stomac , intestin subțire , colon , pancreas, glande mamare, ovar , tiroidă și prostată prin abordări imunohistochimice . Expresia TRPV6 se limitează în principal la membrana apicală a celulelor epiteliale. În intestin, proteina este exprimată pe membrana de la marginea periei a enterocitului .
Diferențele în profilul de expresie TRPV6 au fost raportate posibil datorită variației în astfel de proiecte de grund dependente de testare , sonde de hibridizare , PCR față de Northern Blot , PCR semi-cantitativ vs. RT-PCR și anticorpi utilizați pentru imunodetecție. Profilul de expresie TRPV6 este, de asemenea, influențat de vârstă, sex, nivelurile de Ca 2+ și vitamina D 3 din alimente, starea hormonală, localizarea în țesut, localizarea celulară, starea reproductivă și starea de înțărcare (vezi secțiunea Regulamentul ).
La om, transcripțiile TRPV6 au fost detectate în placentă, pancreas, cancer de prostată și duoden și prostată prin blot nordic; iar în duoden, jejun, placentă, pancreas, testicul, rinichi, creier și colon prin PCR semicantitativă. La rozătoare, expresia TRPV6 a fost validată în duoden, cecum, intestin subțire, colon, placentă, pancreas, prostată și epididim prin Northern Blot. La șoarece, abundența transcriptului TRPV6 măsurată prin RT-PCR este după cum urmează: prostată> stomac, creier> plămâni> duoden, cec, inimă, rinichi, os> colon> mușchi scheletic> pancreas.
Datele din Atlasul de proteine umane și ARN-Seq bazate sugerează că ARNm TRPV6 este scăzut în majoritatea țesuturilor, cu excepția placentei, glandei salivare, pancreasului și prostatei. TRPV6 mARN este exprimat în domeniul apical al osteoclastelor murine ale osului cortical. Osteocitele corticale și trabeculare nu exprimă mRNA TRPV6 în timp ce osteoblastele prezintă o expresie slabă.
Structura și proprietățile biofizice
Structura primară și secundară
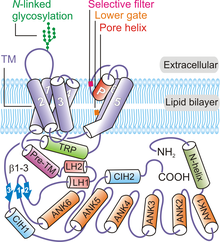
În general, patru subunități ale TRPV6 aranjează pentru a forma un canal tetrameric care afișează o simetrie de patru ori . Începând de la capătul N-terminal și deplasându-se către capătul C-terminal al proteinei, fiecare polipeptidă TRPV6 conține: o helix N-terminală, un domeniu de repetare a ankirinei (ARD) care conține șase repetări de ankirină, un domeniu de legătură a structurii β-acului de păr alcătuit din două β -toroane , un motiv helix-turn-helix, un helix pre-SI, domeniu TM format din șase helici TM (S1 până la S6), o buclă de pori (numită și buclă P), helix TRP amfipatică , C-terminal cârlig și o șublă β cu șase reziduuri (β3) ( Figura 1 ).
Structura terțiară și cuaternară

Proteina canalului TRPV6 prezintă simetrie de patru ori și conține două compartimente principale: un domeniu transmembranar de 30 Å înălțime cu un por de canal ionic central și o fustă intracelulară de ~ 70 Å înălțime și o ~ 110 Å lățime care conține o 50 Å × 50 Å cavitate largă cavitate sub canalul ionic. Gruparea a patru subunități TRPV6 formează un por apos care prezintă o simetrie de patru ori ( Figura 2 ). O helix pre-SI leagă porțiunea intracelulară a proteinei de domeniul TM printr-un domeniu linker alcătuit din structura β-ac de păr și un motiv helix-turn-helix. Helicele S1 până la S4 formează un pachet elicoidal transmembranar sau un domeniu TM care este inserat aproape perpendicular pe planul membranei plasmatice.
Elementele modulului porilor sunt alcătuite din S5, S6 și bucla P din domeniile TM. Modulul porilor din fiecare polipeptidă TRPV6 participă la interacțiunile inter-subunități pentru a forma un por ionic central ( Figura 1 ). Elementele formatoare de pori ale fiecărei subunități TRPV6 interacționează, de asemenea, cu domeniile S1-S4 ale polipeptidei adiacente într-un aranjament schimbat de domeniu. Interacțiunile intersubunități apar, de asemenea, între buclele extracelulare S1-S2 și buclele S5-P și S6-P ale subunităților vecine TRPV6. Situl de glicozilare N-legat conservat pe bucla S1-S2 este necesar pentru activarea mediată de Klotho . Porțiunea de fustă intracelulară a proteinei TRPV6 este alcătuită în principal din repetițiile de ankirină. Domeniul TRP este orientat paralel cu membrana și participă la interacțiunile hidrofobe cu domeniul TM și la interacțiunile hidrofile din fusta intracelulară. Elica N-terminală, cârligul C-terminal și foile β (formate din structura acului β în domeniul linker) din canal participă la interacțiuni intersubunitare cu ARD-urile pentru a oferi un cadru pentru deținerea elementelor fustei intracelulare împreună.
Arhitectura porilor și site-urile de legare a cationilor
Porul TRPV6 are patru elemente principale, și anume, vestibulul extracelular, un filtru de selectivitate, o cavitate hidrofobă și o poartă inferioară. Cu fața la lumenul central al canalului, un filtru de selectivitate cu patru reziduuri ( 538 TIID 541 ) conținând patru lanțuri laterale Aspartate 541 (D541) (unul din fiecare protomer) este esențial pentru selectivitatea Ca 2+ și alte proprietăți biofizice ale canalului. Acest filtru formează un inel încărcat negativ care discrimină între ioni în funcție de mărimea și încărcarea lor. Mutații în reziduul critic de formare a porilor TRPV6 blochează absorbția Ca 2+ , a fost utilizată o strategie pentru a genera modele de pierdere a funcției TRPV6 pentru a examina rolul canalului în fiziologia animalelor. Se crede că există patru tipuri diferite de site-uri de legare a cationilor în canalul TRPV6. Site-ul 1 este situat în porul central și are același plan pe care îl ocupă reziduurile selective cheie D541. Site-ul 2 este considerat a fi prezent la aproximativ 6-8 Å sub Site-ul 1 urmat de Site-ul 3, care este situat în axa porului central la aproximativ 6,8 Å sub Site-ul 2. Se consideră că site-ul 2 și 3 interacționează cu parțial hidratat la ecuatorial-hidratat Ca 2+ ioni. În cele din urmă, patru site-uri de legare cationice simetrice din vestibulul extracelular mediază recrutarea cationilor către vestibulul extracelular al TRPV6 și sunt denumite site-uri de recrutare.
Permeabilitatea ionică
Conductanța TRPV6 pentru cationii divalenți urmează preferința: Ca 2+ > Ba 2+ > Sr 2+ > Mn 2 . Mg 2+ intracelular inhibă TRPV6 și contribuie la puternica rectificare interioară prezentată de canal. Activitatea de absorbție a TRPV6 este inhibată de cationii divalenți Pb 2 , Cu 2+ , Cd 2+ , Zn 2 , Co 2+ , Fe 2+ și cationii trivalenți La 3+ , Fe 3+ , Gd 3+ . Concentrația ionilor pentru a obține inhibarea variază de la 1 la 10 μM. Proteina TRPV6 este constitutivă cu o conductanță monocanal de 42-58 ps. La concentrații scăzute de Ca2 + , un singur ion Ca2 + se leagă în filtrul de selectivitate format de D541 și permite permeabilitatea Na + . La o concentrație ridicată de Ca 2+ , permeația de Ca 2+ are loc printr-un mecanism de eliminare care implică formarea unor conformații de scurtă durată care implică legarea a trei ioni de Ca 2+ la reziduul D541.
Canal de canalizare

Modificările conformaționale implicate în deschiderea canalului sunt articulate în jurul reziduului de Alanină 566 (A566) și apar în helixul de căptușire a porilor S6 ( Figura 3 ). Porțiunea superioară a spiralei S6 suferă o tranziție elicoidală α-la-π care forțează porțiunea inferioară a spiralei să se întoarcă cu 100 de grade și să se încline de la axa porilor cu 11 grade. Această schimbare conformațională mută porțiunea inferioară a helixului care pornește porii și astfel lărgește dimensiunea porilor. Schimbarea conformațională modifică reziduurile care se confruntă cu axa porilor și declanșează formarea de noi subunități de legături electrostatice și punți de sare care compensează costul energetic ridicat al tranziției elicoidale nefavorabile de la α la π care are loc în timpul deschiderii canalului.
Reglarea prin fosfatidilinozitol 4,5-bisfosfat (PIP 2 ) și calmodulină (CaM)
Afluxul de Ca 2+ în interiorul celulei declanșează mecanisme de feedback negativ pentru a suprima activitatea TRPV6 și a preveni supraîncărcarea cu Ca 2+ . Activitatea canalului TRPV6 este reglată de nivelul intracelular al fosfatidilinozitol fosfolipid 4,5-bisfosfat (PIP 2 ) și de interacțiunile cu complexul Ca 2+ - Calmodulin (CaM). Depleția PIP 2 sau legarea CaM inactivează TRPV6. Afluxul de Ca 2+ în celulele care exprimă TRPV6 activează fosfolipaza C (PLC) care la rândul său hidrolizează PIP 2 . Epuizarea nivelurilor PIP 2 are ca rezultat o scădere a activității canalului, deoarece majoritatea canalelor TRP necesită această lipidă pentru activare. Lipidul PIP 2 poate suprascrie inhibarea mediată de Ca2 + -CaM a TRPV6. În general, inactivarea TRPV6 de către calmodulină este orchestrată de un echilibru al concentrației intracelulare de Ca 2+ și PIP 2 .
Proteinele care interacționează
Dintre 20 de interacțiuni TRPV6 identificate până acum, consecințele funcționale ale proteinei de legare Ca 2+ Calmodulin (CaM) și Glucuronidase Klotho au fost caracterizate cel mai pe larg [36, 37, 41, 42]. Consecințele funcționale ale activării canalului TRPV6 sunt rezumate în tabelul de mai jos).
| Interactor | Consecinţă |
| BSPRY | N / A |
| Calbindin-D 28k | N / A |
| Calmodulin | Inhibitie |
| Ciclofilina B | Activare |
| FYN | PO 4 lichidare |
| I-MFA | N / A |
| Klotho | Activare, glicozilare (Asn-357) |
| NHERF4 | Activare |
| NIPSNAP1 | Inhibitie |
| AMORȚIT | Inhibitie |
| PTEN | N / A |
| PTP1B | DEPO 4 lyation
(Tyr-161 și Tyr-162) |
| RAB11A | Activare,
Creșterea nivelului membranei plasmatice |
| RGS2 | N / A |
| RYR1 | N / A |
| S100A10 | Activare,
Creșterea nivelului membranei plasmatice |
| SRC | PO 4 lyation (Tyr-161, 162) |
| TRPC1 | Păstrează în ER, Inhibiție |
| TRPML3 | N / A |
| TRPV5 | Formarea tetramerului,
Creație canal nou |
Abrevieri
Interactor cu proteine
BSPRY: B-Box și Spry Domain Conținând proteine; FYN: Fyn Kinase aparținând familiei Src a kinazelor; I-MFA: Inhibitorul familiei Myo D; NHERF: Factor de reglementare al schimbătorului de Na; Domeniul NIPSNAP14-Nitrofenilfosfatază și omolog 1 al proteinelor SNAP25 similare non-neuronale; Numb: mutație Drosophila care elimină majoritatea neuronilor senzoriali din sistemul nervos periferic în curs de dezvoltare; PTP: Proteină tirozin fosfatază; Rab11a: Membru RAS Oncogene Family; RGS2: Regulator al semnalizării proteinei G 2; RyR1: Receptorul Ryanodinei 1; TRPC1: receptor tranzitoriu potențial canonic 1; TRPML3: potențialul receptorului tranzitoriu Mucolipin-3.
Funcții fiziologice
Proteinele canalului selectiv Ca 2+ TRPV6 și TRPV5 cooperează pentru a menține concentrația de calciu în organe specifice. TRPV6 funcționează ca canale apicale de intrare Ca 2+ care mediază transportul transcelular al acestui ion în intestin, placentă și, eventual, în alte organe exocrine. TRPV6 joacă, de asemenea, roluri importante în transportul de calciu materno-fetal, diferențierea keratinocitelor și homeostazia Ca 2+ în sistemul endolimfatic al sistemului vestibular și menținerea fertilității masculine.
C a 2+ absorbție în intestin
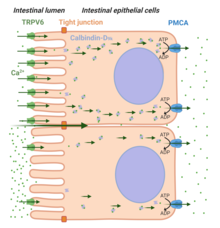
Sunt recunoscute două căi de absorbție a Ca 2+ : transportul paracelular și transportul celular (vezi Figura 4 ). O dietă bogată în Ca 2+ favorizează transportul paracelular al ionului pe lungimea intestinului, permițându-le să treacă între joncțiunile strânse intercelulare care leagă celulele epiteliale. Spre deosebire de condițiile în care [Ca 2+ ] în lumenul intestinului este mai scăzut în comparație cu concentrația sa în plasmă (de exemplu în timpul Ca 2+ dietetic scăzut ), calea transcelulară este necesară pentru o absorbție adecvată a Ca 2+ . Trei pași importanți în transcelular Ca 2+ de transport sunt recunoscute: intrarea celulară de Ca 2+ ion pe partea apicală prin TRPV6 (Pas-1), legarea Ca 2+ ion cu calbindin D 9k (Step 2) , și ieșirea Ca 2+ din partea basolaterală prin membrana plasmatică Ca 2+ ATPaza (PMCA1b). Hormonul Vitamina D 3 (sau 1,25 (OH) 2 D 3 ) joacă un rol important în absorbția de Ca 2+ intestinal mediată de TRPV6 ).
Reabsorbție de Ca 2+ în rinichi
Spre deosebire de intestin, unde TRPV6 este gardianul absorbției de Ca 2+ , reabsorbția transcelulară a acestui ion în rinichi are loc prin TRPV5. Deși TRPV5 este un agent de protecție recunoscut pentru reabsorbția transcelulară a ionului Ca 2+ în rinichi, șoarecii knockout (KO) TRPV6 se luptă, de asemenea, să-și concentreze urina și să prezinte hipercalciurie. TRPV6 este cunoscut pentru a co-localiza cu TRPV5 Calbindin-D 28K în domenii apicale ale tubilor distorsionați și tubulilor de legătură [20]. Șoarecii TRPV5 KO compensează pierderea de Ca 2+ crescând expresia TRPV6 în duoden. Mai mult, un studiu recent care a analizat genele responsive la vitamina D la rinichi ovin , canin și ecvin sugerat că TRPV6, calD 9k / calD 28k și PMCA ar putea fi principalele căi de orchestrare a transportului transcelular Ca 2+ în rinichiul ovinelor, câinilor și cai.
Transportul Ca- 2+ materno-fetal
TRPV6 joacă un rol indispensabil în transportul Ca 2+ placentar . Mineralizarea oaselor fetale atinge vârfurile în timpul sarcinii târzii. În acest stadiu, sângele fetal are o concentrație mai mare de Ca 2+ în comparație cu sângele matern, creând astfel condiții care necesită transport transcelular activ de Ca 2+ de la mamă la făt. Acest proces este foarte important, deoarece defectele în transportul placentar al calciului pot fi precursori pentru sindroamele de deficit de Ca 2+ și restricțiile de creștere intrauterină . Expresia TRPV6 crește de 14 ori în ultimele 4 zile ale perioadei de gestație murină și coincide cu faza de vârf a mineralizării osoase fetale. Proteina TRPV6 este exprimată abundent în țesuturile placentare ale mamiferelor. Într-adevăr, expresia TRPV6 este de ~ 1000 de ori mai mare în comparație cu TRPV5. În placentă, TRPV6 este exprimat în trofoblaste și sinciotrofoblaste . La șoareci, mARN-ul și proteina TRPV6 sunt exprimate în sacul galbenus intraplacentar și stratul visceral al sacului galbenus extraplacentar. Cel mai important, fetușii TRPV6 KO prezintă o reducere de 40% a activității de transport 45 Ca 2+ și o scădere dramatică a greutății cenușii (o măsură a sănătății oaselor fetale). La om, se știe că stresul de forfecare fluid al trofoblastelor (FSS) induce un influx de Ca 2+ mediat de TRPV6 și promovează formarea de microvilli printr-un mecanism care implică Ezrin și fosforilarea Akt.
Reglarea epididimului Ca 2+ și implicații asupra fertilității masculine
Reglarea concentrației de calciu în lumenul epididimal este esențială pentru motilitatea spermei . Reducerea mediată de TRPV6 a concentrației luminale de Ca 2+ în epididim este critică pentru fertilitatea masculină la șoareci. Șoarecii TRPV6 KO sau șoarecii care exprimă versiunea pierderii funcției canalului TRPV6 ( șoarecii homozigoți Trpv6 D541A ) au o fertilitate grav afectată . Șoarecii care exprimă TRPV6 nefuncțional au o concentrație de 10 ori mai mare de Ca 2+ în lumenul epididimal și absorbția de Ca 2+ în acest spațiu este redusă de 7 până la 8 ori. Creșterea ionului Ca 2+ în concentrația lumenului epididimal duce la defecte semnificative ale motilității, capacității de fertilizare și viabilității spermatozoizilor la șoarecii TRPV6 D541A . Se pare că TRPV6 și canalul de clorură în mod transmembranar 16 A ( TMEM16A ) acționează în cooperare pentru a reduce concentrația luminală de Ca 2+ în lumenul epididimal.
Sănătatea oaselor
În condiții de Ca 2+ dietetic sub-optim , nivelurile normale de calciu seric la șoarecii TRPV6 KO sunt menținute în detrimentul osului. TRPV6 joacă un rol important în osteoclaste, dar nu și în osteoblaste. La șoareci, epuizarea TRPV6 are ca rezultat o diferențiere crescută a osteoclastelor, în timp ce TRPV5 este esențială pentru resorbția corectă a osteoclastelor osoase.
Diferențierea keratinocitelor
Diferențiere Keratinocitele este orchestrată de comutator de calciu, un proces care presupune un influx de Ca 2+ in keratinocit care induce modificări necesare transcripțional largi pentru desmosome formare, stratificare și cornificarii. Șoarecii TRPV6 KO prezintă straturi mai subțiri de strat cornos și 20% dintre șoareci prezintă, de asemenea, alopecie și dermatită . Tacerea TRPV6 afectează diferențierea mediată de Ca 2+ a keratinocitelor primare umane și reglează în jos markerii de diferențiere, cum ar fi involucrina , transglutaminaza-1 și citokeratina-10 . Hormonul 1,25-dihidroxivitamină-D3 reglează în sus TRPV6 în keratinocite și declanșează un influx de Ca 2+ . La rândul său, aceasta induce expresia căilor specifice diferențierii keratinocitelor.
Rol în urechea internă
Proteinele TRPV5 și TRPV6 sunt exprimate în mai multe regiuni ale urechii interne , precum și în culturile primare ale epiteliului canalului semicircular (SCCD). Unele studii au indicat faptul că TRPV5 și TRPV6 sunt necesare pentru scăderea concentrației de Ca 2+ în lumenul endolimfei mamiferelor , o cerință esențială pentru auzul și echilibrul normal .
Expresia uterină și placentară a TRPV6 și implicațiile în sarcină
Expresia endometrială și uterină a TRPV6 a fost raportată la mamifere. Se consideră că expresia TRPV6 în uter este reglată hormonal de 17β-estradiol și progesteron la rozătoare. La rozătoare, ARNm TRPV6 este exprimat în zona labirintului și spongios, precum și în zonele uterului lipsite de placentă. Stadiul sarcinii este un regulator important al expresiei TRPV6. Se consideră că reglarea descendentă a expresiei TRPV5 / 6 și o scădere rezultată a transportului Ca 2+ modifică profilul proliferativ al trofoblastelor umani; un proces care la rândul său este legat de dezvoltarea preeclampsiei . Această juxtapunere a expresiei TRPV6 și reglarea sa strictă de către hormonii sexuali în timpul sarcinii sugerează că proteina poate fi importantă pentru implantarea embrionilor , cu toate că nu există dovezi concludente pentru această legătură.
Implicații în bolile umane
Hiperparatiroidism neonatal tranzitoriu
Pierderea TRPV6 în placenta murină afectează grav transportul Ca 2+ peste trofoblast și reduce creșterea embrionilor, induce calcificarea osoasă și afectează dezvoltarea osoasă. La om, transportul matern-fetal insuficient cauzat de variantele genomice patogene ale TRPV6 este considerat a fi o cauză a defectelor scheletice observate în rapoarte de cazuri selectate de cazuri de hiperparatiroidism neonatal tranzitor (TNHP). Se crede că aceste variante compromit localizarea membranei plasmatice a proteinei. Secvențierea exomului unui sugar cu insuficiență toracică cu debut prenatal sever cu anomalii scheletice fetale însoțitoare indică rolul critic al TRPV6 în transportul materno-fetal. Studiul a indicat faptul că variantele compuse heterozigote ale TRPV6 duc la submineralizare severă și displazie severă a scheletului fetal.
Pancreatită cronică
Dovezi recente indică faptul că pierderea TRPV6 naturală a variantelor funcționale predispune anumite date demografice la pancreatită cronică (CP) prin neregularizarea homeostaziei calciului în celulele pancreatice. Secvențiere studii la pacienții cu pancreatită cronică a relevat prezența a 33 deleții și 2 prostii variante predispuse japoneză , germană și franceză pacienții cu un risc mai mare de CP. În general, aceste studii au arătat că variantele genomice de pierdere a funcției TRPV6 care induc boala sunt supra-reprezentate la pacienții cu CP germană, franceză, chineză și japoneză în comparație cu controalele din grupurile lor respective. Variantele de pierdere a funcției sunt considerate a compromite transportul de calciu în pancreas prin acțiune, fie prin reducerea nivelului total de proteine și / sau compromiterea activității de absorbție a Ca 2+ de către canal.
Formarea pietrei la rinichi
Rolul TRPV6 în formarea calculilor renali a fost sugerat prin studii secvențiale efectuate pe o cohortă de 170 de pacienți din Elveția . Studiile au arătat că frecvența haplotipului de câștig al funcției TRPV6 este semnificativ mai mare la formatorii de piatră Ca 2 + ( nefrolitiaza ) în comparație cu non-formatorii. Fenotipurile de hipercalciurie observate din studii pe animale și studii pe polimorfisme cu nucleotidă unică TRPV6 (SNP) sugerează că haplotipul TRPV6 ar putea fi un factor de risc important pentru hipercalciurie absorbantă și renală (calculi renali datorate absorbției intestinale afectate și, respectiv, reabsorbției renale). Incidența mai scăzută a bolilor de calculi renali la afro-americani și o prevalență relativ mai mare a haplotipului ancestral sugerează teoria conform căreia acest haplotip conferă un avantaj al reabsorbției crescute a Ca 2+ în acest demografic și reduce incidența calculilor renali.
Boli resorptive osoase
Șoarecii TRPV6 KO prezintă simptome asemănătoare osteoporozei, cum ar fi densitatea minerală osoasă redusă și hipercalciuria. Hormonul estrogen , al cărui deficit este legat de osteoporoza post-menopauză , reglează, de asemenea, expresia TRPV6 la om. Într-adevăr, o absorbție mai scăzută a calciului observată la femeile în vârstă în postmenopauză este atribuită TRPV6 redus. Porțiunea C-terminală a Soricidinei este un medicament care inhibă activitatea de absorbție a Ca 2+ prin legarea la TRPV6. Studiile preclinice ale acestui medicament au arătat o mare promisiune în tratamentul bolilor resorptive osoase.
Gradul ridicat de asemănare între simptomele ereditare ale bolii rahitice rezistente la vitamina D (HVDRR) și fenotipurile observate la șoarecii TRPV6 KO a determinat unii experți să postuleze conexiuni patologice între boală și disfuncția TRPV6. TRPV6 joacă un rol condroprotector important prin reglarea mai multor aspecte ale funcției condrocitelor , cum ar fi secreția matricei extracelulare , eliberarea enzimelor care degradează matricea, proliferarea celulară și apoptoza . Mai mult, șoarecii knockout TRPV6 prezintă fenotipuri multiple de osteoartrită (OA), cum ar fi fibrilația cartilajului , eburnarea și pierderea proteoglicanilor .
Sindromul Pendred
Gena disfuncționalității Slc26a4 a fost legată de sindromul Pendred - o tulburare genetică care duce la surditate sindromică la copii. Boala este cauzata de mutatii in care compromit funcția proteinei codificate pendrin - un anion Cl - / HCO3 - Schimbător exprimată în urechea internă. Se consideră că pierderea funcției în această genă reduce valoarea pH - ului endolimfei mamiferelor și afectează absorbția Ca 2+ prin TRPV5 și TRPV6. La rândul său, acest lucru ar putea preveni absorbția de Ca 2+ și afectează reducerea luminală a concentrației de Ca 2+ în cadrul sistemului endolimfatic al urechii.
Cancer
Supraexpresia de TRPV6 a fost validat în colon, paratiroide , pancreatic și cancer tiroidian în timp ce expresia sa este relatărilor downregulated in cancer esofagian , cancer pulmonar cu celule non-mici și cancer renal . TRPV6 este considerat a fi un canal oncocanal care se presupune că mediază progresia cancerului prin declanșarea unor aberații induse de Ca 2+ în factorii moleculari care reglementează procesele precum ciclul celular , apoptoza și migrația ; conferind astfel avantaje proliferative și de supraviețuire celulelor canceroase. Supraexprimarea TRPV6 se corelează puternic cu stadiul patologic , gradul tumoral , invazia extraprostatică, metastazarea ganglionilor limfatici și rezistența la terapiile orientate către androgen în cancerul de prostată . Expresia TRPV6 a fost susținută ca un marker de prognostic pentru cancerul de prostată avansat, deoarece expresia sa este puternic dependentă de gradul tumorii. Exprimarea TRPV6 este semnificativ crescută în țesutul adenocarcinomului mamar în comparație cu țesutul mamar normal. Expresia TRPV6 a fost raportată pe mai multe linii celulare de cancer de sân și linii celulare de cancer de prostată. Liniile celulare de cancer de prostată PC-3 și LnCAP supraexprimă TRPV6 în raport cu celulele epiteliale benigne PrEC și BPH-1. Tacerea TRPV6 în celulele canceroase de prostată scade rata de proliferare, acumularea fazei S și expresia expresiei antigenului nuclear celular (PCNA) de marker tumoral . Se consideră că supraexpresia TRPV6 induce absorbția anormală de Ca 2 + în linia cancerului de prostată și activează factorul de transcripție Factorul nuclear al celulelor T activate (NFAT).
Expresia TRPV6 este reglată în sus de estrogen, progesteron și estradiol în linia celulară de cancer mamar T47D . În acord cu aceste observații, antagonistul receptorilor de estrogen Tamoxifen reduce expresia TRPV6 în celulele T47D și suprimă captarea Ca 2+ a canalului atât în liniile celulare ER-pozitive cât și ER-negative ale cancerului de sân. Expresia excesivă a TRPV6 este asociată cu cancerul de colon în stadiu incipient , iar reducerea acestuia la cancer de colon induce apoptoza și inhibă proliferarea celulelor canceroase. În ceea ce privește mecanismul, mutațiile din domeniile de legare a calmodulinei canalelor TRPV6 conferă proprietăți invazive celulelor adenocarcinomului de colon. Proteinele p38a si GADD45α se crede ca semnalizarea upregulate expresia TRPV6 in celulele cancerului de colon SW480 prin creșterea vitaminei D de semnalizare. S-a raportat că TRPV6 amplifică semnalizarea PI3K - PDK1 - Akt indusă de factorii de creștere asemănători insulinei (IGF) în cancerul de colon uman și promovează cancerul de colon.
TRPV6 este supra-reglementat în țesuturile canceroase primare de la pacienții cu cancer pancreatic și promovează proliferarea mecanismelor dependente de NFAT ale tumorilor neuroendocrine pancreatice . Tacerea TRPV6 induce apoptoza și oprirea ciclului celular în celulele cancerului pancreatic și inhibă invazia, proliferarea și migrația acestora. Exprimarea forțată a TRPV6 în celulele canceroase gastrice mărește sensibilitatea acestora la apoptoza indusă de capsaicină, în timp ce silențierea canalului mediată de siARN suprimă această sensibilitate. S- a sugerat că reglarea descendentă a TRPV6 în carcinomul esofagian este un marker de prognostic al supraviețuirii specifice bolii la pacienții care suferă de cancer esofagian . Coexpresia TRPV5 scăzută și TRPV6 au sugerat ca markeri predictivi pentru supraviețuirea slabă fără recurență în cancerul pulmonar cu celule mici .
Direcționare farmacologică
Se știe că mai mulți inhibitori chimici inhibă TRPV6. Unii compuși care au demonstrat activitate inhibitorie față de TRPV6 includ TH-1177, 2-Aminoetoxidifenil borat (2-APB), 2-APB derivat 22b, Econazol , Miconazol , derivat de piperazină Cis-22a, Capsaicin , Δ 9 - tetrahidrocannabivarină , Xestospongin C, Lidocaină , nanoparticulă cușcă aurie (PTX-PP @ Au NPs ) și peptidă sintetică Sorcidin C-13 (SOR-C13). Printre diferitele strategii de inhibare testate până acum, peptida 13-aminoacizi SOR-C13 a arătat cea mai promițătoare. Această peptidă de 13 aminoacizi derivată din peptida de 54 de aminoacizi care se găsește în veninul paralitic al musaricii cu coadă scurtă din nord ( Blarina brevicauda ) reduce creșterea cancerului la modelele celulare și animale. Acest agent anticancer a finalizat recent un studiu de siguranță clinică de fază I care a înrolat 23 de pacienți cu tumori solide avansate de origine epitelială care nu răspundeau la toate tratamentele standard de îngrijire .
Regulament
Reglarea TRPV6 poate fi examinată în principal în contextul factorilor săi fiziologici, hormonali și moleculari. Reglarea hormonală a TRPV6 a fost caracterizată cel mai pe larg. În acest sens, reglarea acestuia de către hormonul vitamina D 3 și hormoni sexuali a fost examinată în detaliu considerabil. Studiile pe rozătoare sugerează că canalul TRPV6 este reglementat de o gamă largă de factori fiziologici, cum ar fi dieta, vârsta, sexul, sarcina, alăptarea, hormonii sexuali, exercițiile fizice, vârsta și sexul. Unii agenți biologici și farmacologici cunoscuți pentru reglarea TRPV6 includ glucocorticoizi , medicamente imunosupresoare și diuretice .
Vitamina D
Experimente multiple de răspuns la doză și de timp în rozătoare și linii celulare de cancer de colon au demonstrat în mod concludent că ARNm TRPV6 este indus în mod robust de această vitamină D la concentrații extrem de scăzute. Cel puțin cinci elemente de răspuns la vitamina D (VDRE) la pozițiile -1,2, -2,1, -3,5, -4,3 și -5,5 kb relativ la locul de început transcripțional (TSS) au fost identificate pe transcrierile TRPV6. Dintre aceste cinci situri, VDRE-urile la pozițiile -1,2, -2,1 și -4,3 kb sunt semnificativ mai sensibile la 1,25- (OH) 2 D 3 în comparație cu VDRE-urile situate la -3,5 și -5,5 kb, care nu par contribuie substanțial la reglarea transcripțională mediată de vitamina D în intestin. Din punct de vedere mecanic, transcrierea TRPV6 este inițiată ca răspuns la semnalizarea intermediară a receptorului de vitamina D (VDR), deși alte mecanisme non-directe nu pot fi excluse. Pașii importanți în reglarea transcripțională mediată de vitamina D includ 1) legarea vitaminei D de receptorul său de vitamina D (VDR), 2) translocarea receptorului de vitamina D (VDR) - complexul heterodimer al receptorului retinoid X în nucleu , 3) legarea VDR -Complexul RXR pe promotorul genei TRPV6 , 4) recrutarea coactivatorului receptorilor steroizi 1 și ARN polimeraza II pe promotor și 5) activarea transcripțională mediată prin evenimente de acetilare a histonei H4 .
Dietă
Nivelul de Ca 2+ și vitamina D din dietă sunt cei mai importanți regulatori ai expresiei TRPV6. Se consideră că expresia TRPV6 este puternic modulată pentru a regla fin absorbția de Ca 2+ din dietă, mai ales în condițiile în care disponibilitatea dietei de Ca 2+ este redusă. La rozătoare, restricționarea disponibilității de Ca 2+ în dietă induce o reglare dramatică în expresia duodenală a TRPV6. Afluxul de calciu din dietă și legarea sa ulterioară de calbindin-D 9k ar putea fi etapa de limitare a ratei care modulează reglarea TRPV6 dependentă de vitamina D. Când Ca 2+ din dietă este insuficient, nivelurile normale de calciu din sânge la șoarecii TRPV6 KO sunt menținute în detrimentul osului. În multe linii de rozătoare, variațiile genetice ale TRPV6, calbindin-D 9k , ARNm PMCA1b influențează absorbția intestinală a Ca și impactul acesteia asupra densității măduvei osoase.
Sarcina și alăptarea
Expresia duodenală a transcrierilor TRPV6 este reglată în sus la șoareci WT și VDR KO în timpul sarcinii și alăptării . Hormonul prolactină reglează transcripția TRPV6 și facilitează o creștere a absorbției intestinale de Ca 2+ la șobolanii care alăptează și care sunt gravide, posibil ca mecanism adaptativ pentru depășirea pierderii conținutului de mineralizare osoasă în timpul alăptării.
Îmbătrânire
Expresia intestinală a TRPV6 la șoareci variază dramatic în funcție de vârstă și localizarea relativă a țesutului. Expresia duodenală a TRPV6 este nedetectabilă la P1 și crește de 6 ori pe măsură ce șoarecii îmbătrânesc la P14. În mod similar, expresia variază și în funcție de vârstă în jejun , unde nivelurile TRPV6 cresc de la P1 la P14, devin slabe la vârsta de 1 lună și devin nedetectabile la șoareci mai în vârstă. Expresia TRPV6 la șobolani mai în vârstă (12 luni) este cu cel puțin 50% mai mică în comparație cu omologii mai tineri (2 luni). La șoarecii WT și VDR KO, scăderea asociată vârstei a absorbției intestinale a Ca 2+ este însoțită de o scădere a expresiei duodenale a TRPV6.
Hormoni sexuali
Hormonii sexuali joacă un rol important în reglarea TRPV6. În comparație cu șoarecii masculi, șoarecii femele prezintă o creștere de 2 ori mai mare a expresiei duodenale a mRNA TRPV6 după tratamentul cu vitamina D. Se consideră că reglarea diferențială a TRPV6 asociată hormonului sexual între sexe este corelată cu diferențele de risc relativ la osteoporoză la femeile în vârstă aflate în postmenopauză, despre care s-a raportat că au o expresie TRPV6 și VDR mai scăzută în comparație cu bărbații.
Tratamentul cu estrogen reglează în sus transcrierile TRPV6 de 8 ori la șoarecii VDR KO și de 4 ori la șoarecii ovariectomizați . S-a observat o reducere mai mare de 50% a mRNA TRPV6 la șoarecii α KO ai receptorilor de estrogen . Se crede că estrogenul ar putea regla diferențial absorbția de Ca 2+ în duoden prin creșterea expresiei TRPV6 prin ERα. Agentul anti-progesteron RU486 și agentul anti-estrogen ICI 182,780 suprimă expresia TRPV6 la rozătoare prin acțiunea lor antagonistă respectivă asupra receptorilor de progesteron și estrogen . Se știe că estrogenul, progesteronul și dexametazona reglează în sus expresia TRPV6 în cortexul cerebral și hipotalamusul șoarecilor, sugerând o implicare potențială a TRPV6 în absorbția calciului în creier .
Glucocorticoizi
Administrarea subcutanată de glucocorticoizi dexametazonă induce atât expresia renală, cât și cea intestinală a TRPV6 la șoareci în decurs de 24 de ore de la aplicarea orală a reducerii prednisolonului în TRPV6, care este însoțită și de o absorbție redusă a Ca 2+ în duoden. Reglarea intestinală a TRPV6 ca răspuns la glucocorticoizi pare să fie dependentă de VDR. Serul enzimatic și kinaza 1 reglată de glucocorticoizi ( SKG1 ) reglează expresia TRPV6 prin îmbunătățirea fosfatidilinozitol-3-fosfat-5-kinazei PIKfyve (PIP5K3). Această kinază este esențială pentru generarea de mesager secundar PIP 2 , un activator de lipide cunoscut al TRPV6.
- TRPV
- TRPV5
- canale de calciu
- absorbția calciului
- calea transcelulară
- mecanism de închidere
- calmodulină
- transportul materno-fetal
- hiperparatiroidism neonatal tranzitor
- pancreatită cronică
- pietre la rinichi
- cancer
Referințe
Lecturi suplimentare
- Heiner I, Eisfeld J, Lückhoff A (2004). "Rolul și reglarea canalelor TRP în granulocitele neutrofile". Calciu celular . 33 (5-6): 533-40. doi : 10.1016 / S0143-4160 (03) 00058-7 . PMID 12765698 .
- Clapham DE, Julius D, Montell C, Schultz G (decembrie 2005). "Uniunea Internațională de Farmacologie. XLIX. Nomenclatura și relațiile structură-funcție ale canalelor potențiale ale receptorilor tranzitorii". Revizuiri farmacologice . 57 (4): 427-50. doi : 10.1124 / pr.57.4.6 . PMID 16382100 . S2CID 17936350 .
- Wissenbach U, Niemeyer BA (2007). „TRPV6”. Canale cu potențial de receptor tranzitoriu (TRP) . Manual de farmacologie experimentală. 179 . pp. 221–34. doi : 10.1007 / 978-3-540-34891-7_13 . ISBN 978-3-540-34889-4. PMID 17217060 .
- Schoeber JP, Hoenderop JG, Bindels RJ (februarie 2007). „Acțiunea concertată a proteinelor asociate în reglarea TRPV5 și TRPV6”. Tranzacțiile societății biochimice . 35 (Pt 1): 115-9. doi : 10.1042 / BST0350115 . PMID 17233615 .
linkuri externe
- TRPV + Cation + Canale la Biblioteca Națională de Medicină din SUA Titlurile subiectului medical (MeSH)
- TRPV6 + proteine, + umane la Biblioteca Națională de Medicină din SUA Titlurile subiectului medical (MeSH)





