Purpura trombotică trombocitopenică - Thrombotic thrombocytopenic purpura
| Purpura trombotică trombocitopenică | |
|---|---|
| Alte nume | Sindromul Moschcowitz, purpura trombotică idiopatică trombocitopenică |
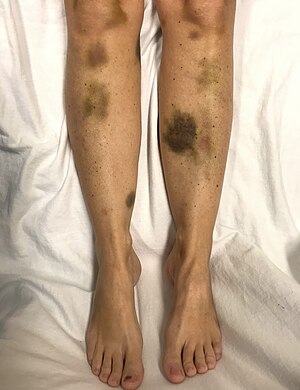 | |
| Vânătăi spontane la o femeie cu trombocite extrem de scăzute | |
| Specialitate | Hematologie |
| Simptome | Vânătăi mari , febră , slăbiciune, respirație scurtă , confuzie, cefalee |
| Debut obișnuit | Maturitate |
| Cauze | Necunoscut, infecții bacteriene , anumite medicamente, boli autoimune , sarcină |
| Metoda de diagnosticare | Pe baza simptomelor și a analizelor de sânge |
| Diagnostic diferentiat | Sindromul hemolitic-uremic (HUS), sindromul hemolitic uremic atipic (aHUS) |
| Tratament | Schimb plasmatic , imunosupresoare |
| Prognoză | <20% risc de deces |
| Frecvență | 1 din 100.000 de oameni |
Purpura trombocitopenică trombotică ( TTP ) este o tulburare de sânge care are ca rezultat formarea de cheaguri de sânge în vasele de sânge mici din tot corpul. Acest lucru are ca rezultat un număr scăzut de trombocite , scăderea globulelor roșii din cauza degradării lor și, adesea , disfuncții renale , cardiace și cerebrale . Simptomele pot include vânătăi mari , febră , slăbiciune, dificultăți de respirație , confuzie și cefalee . Pot apărea episoade repetate.
În aproximativ jumătate din cazuri este identificat un declanșator, în timp ce în rest cauza nu este cunoscută. Factorii declanșatori cunoscuți includ infecții bacteriene , anumite medicamente, boli autoimune, cum ar fi lupusul și sarcina . Mecanismul de bază implică de obicei anticorpi care inhibă enzima ADAMTS13 . Acest lucru duce la descompunerea scăzută a multimerilor mari ai factorului von Willebrand (vWF) în unități mai mici. Mai puțin frecvent TTP este moștenit de la părinții unei persoane , cunoscut sub numele de sindrom Upshaw-Schulman , astfel încât disfuncția ADAMTS13 este prezentă încă de la naștere. Diagnosticul se bazează de obicei pe simptome și teste de sânge. Poate fi susținut prin măsurarea activității sau a anticorpilor împotriva ADAMTS13.
Odată cu schimbul de plasmă , riscul de deces a scăzut de la peste 90% la mai puțin de 20%. De asemenea , pot fi utilizați imunosupresori , cum ar fi glucocorticoizii și rituximab . Transfuziile de trombocite nu sunt în general recomandate.
Aproximativ 1 la 100.000 de persoane sunt afectate. Debutul este de obicei la vârsta adultă, iar femeile sunt mai des afectate. Aproximativ 10% din cazuri încep în copilărie. Starea a fost descrisă pentru prima dată de Eli Moschcowitz în 1924. Mecanismul de bază a fost determinat în anii 1980 și 1990.
semne si simptome
Semnele și simptomele TTP pot fi la început subtile și nespecifice. Mulți oameni se confruntă cu o boală asemănătoare gripei sau diareică înainte de a dezvolta TTP. Simptomele neurologice sunt foarte frecvente și variază foarte mult ca severitate. Simptomele raportate frecvent includ senzația de oboseală , confuzie și dureri de cap . Se pot observa și convulsii și simptome similare cu cele ale unui accident vascular cerebral . Alte simptome includ, dar nu se limitează la icter sau paloare a pielii, o frecvență cardiacă rapidă sau dificultăți de respirație sau puncte purpurii sau roșiatice de dimensiuni precise pe piele, cunoscute sub numele de petechii.
Pe măsură ce TTP progresează, se formează cheaguri de sânge în vasele de sânge mici (microvasculatură) și se consumă trombocite (celule de coagulare). În consecință, pot apărea vânătăi și rareori sângerări. Învinețirea ia adesea forma purpurei , în timp ce cel mai frecvent loc de sângerare, dacă apare, este de la nas sau gingii. Se pot dezvolta și vânătăi mai mari ( echimoze ). Prezentarea clasică a TTP, care apare la mai puțin de 10% dintre oameni, include cinci semne medicale. Acestea sunt:
- Febră
- Modificări ale stării mentale
- Trombocitopenie
- Funcția renală redusă
- Anemie hemolitică ( anemie hemolitică microangiopatică ).
Hipertensiunea arterială ( hipertensiune arterială ) poate fi găsită la examinare.
Cauze
TTP, ca și în cazul altor anemii hemolitice microangiopatice (MAHA), este cauzată de agregarea spontană a trombocitelor și de activarea coagulării în vasele mici de sânge. Trombocitele sunt consumate în procesul de agregare și leagă vWF. Aceste complexe de trombocite-vWF formează mici cheaguri de sânge care circulă în vasele de sânge și provoacă forfecarea globulelor roșii, rezultând ruperea și formarea schistocitelor . Cele două cauze cele mai bine înțelese ale TTP se datorează autoimunității și un deficit moștenit de ADAMTS13 (cunoscut sub numele de sindrom Upshaw-Schülman). Majoritatea cazurilor rămase sunt secundare unui alt factor.
Autoimun
TTP de cauză necunoscută a fost mult timp cunoscut sub numele de TTP idiopatic, dar în 1998 s-a demonstrat că majoritatea cazurilor sunt cauzate de inhibarea enzimei ADAMTS13 de către anticorpi . Relația ADAMTS13 redusă cu patogeneza TTP este cunoscută sub numele de ipoteza Furlan-Tsai, după cele două grupuri independente de cercetători care și-au publicat cercetările în același număr al New England Journal of Medicine . Aceste cazuri sunt clasificate acum ca o boală autoimună și sunt cunoscute sub numele de TTP autoimun (nu trebuie confundat cu purpura trombocitopenică imună / idiopatică ).
ADAMTS13 este o metaloproteinază responsabilă pentru descompunerea factorului von Willebrand (vWF), o proteină care leagă trombocitele, cheagurile de sânge și peretele vaselor de sânge în procesul de coagulare a sângelui. Multimerii vWF foarte mari sunt mai predispuși să conducă la coagulare. Prin urmare, fără clivarea adecvată a vWF de către ADAMTS13, coagularea are loc la o rată mai mare, în special în microvasculatură, o parte a sistemului vaselor de sânge în care vWF este cel mai activ datorită stresului de forfecare ridicat . În TTP idiopatic, activitatea ADAMTS13 sever scăzută (<5% din normal) poate fi detectată la majoritatea (80%) persoane, iar inhibitorii sunt adesea găsiți în acest subgrup (44-56%).
Genetic
Această afecțiune poate fi, de asemenea, congenitală. Astfel de cazuri pot fi cauzate de mutații ale genei ADAMTS13. Această formă ereditară de TTP se numește sindrom Upshaw-Schulman . Persoanele cu această deficiență moștenită ADAMTS13 au un fenotip surprinzător de ușor, dar dezvoltă TTP în situații clinice cu niveluri crescute ale factorului von Willebrand, de exemplu infecție. Se pare că mai puțin de 1% din toate cazurile de TTP se datorează sindromului Upshaw-Schulman. Persoanele cu acest sindrom au, în general, 5-10% din activitatea normală ADAMTS-13.
Secundar
TTP secundar este diagnosticat atunci când istoricul persoanei menționează una dintre caracteristicile cunoscute asociate cu TTP. Acesta cuprinde aproximativ 40% din toate cazurile de TTP. Factorii predispozanți sunt:
- Cancer
- Transplant de măduvă osoasă
- Sarcina
-
Utilizarea medicamentelor :
- Medicamente antivirale ( aciclovir )
- Anumite medicamente pentru chimioterapie , cum ar fi gemcitabina și mitomicina C
- Chinină
- Oximorfona
- Quetiapina
- Bevacizumab
- Sunitinib
- Inhibitori ai agregării plachetare ( ticlopidină , clopidogrel și prasugrel )
- Imunosupresoare ( ciclosporină , mitomicină , tacrolimus / FK506, interferon-α )
- Medicamente care modifică hormonii (estrogeni, contraceptive, terapie de substituție hormonală)
- HIV-1 infectie
Mecanismul TTP secundar este slab înțeles, deoarece activitatea ADAMTS13 nu este în general la fel de deprimată ca în TTP idiopatică, iar inhibitorii nu pot fi detectați. Etiologia probabilă poate implica, cel puțin în unele cazuri, leziuni endoteliale, deși formarea trombilor care rezultă în ocluzia vaselor poate să nu fie esențială în patogeneza TTP secundar. Acești factori pot fi, de asemenea, considerați o formă de aHUS secundar; persoanele care prezintă aceste caracteristici sunt, prin urmare, potențiali candidați la terapia anticomplementară.
Fiziopatologie
Mecanismul de bază implică de obicei inhibarea mediată de autoanticorpi a enzimei ADAMTS13 , o metaloprotează responsabilă de scindarea multimerilor mari ai factorului von Willebrand (vWF) în unități mai mici. Creșterea multimerilor circulanți de vWF crește aderența trombocitelor la zonele cu leziuni endoteliale , în special acolo unde se întâlnesc arteriolele și capilarele , ceea ce duce la formarea unor mici cheaguri de trombocite numite trombi. Deoarece trombocitele sunt consumate în formarea trombilor, acest lucru duce apoi la o scădere a numărului total de trombocite circulante, care poate provoca apoi sângerări care pun viața în pericol. Globulele roșii din sânge care trec de cheagurile microscopice sunt supuse la stres de forfecare , care le afectează membranele, ducând la ruperea globulelor roșii din vasele de sânge, ceea ce duce la formarea de anemie și schistocite . Prezența acestor cheaguri de sânge în vasele de sânge mici reduce fluxul de sânge către organe, rezultând leziuni celulare și deteriorarea organelor finale .
Diagnostic
Diagnostic diferentiat
TTP se caracterizează prin microangiopatie trombotică (TMA), formarea cheagurilor de sânge în vasele de sânge mici din tot corpul, care poate duce la anemie hemolitică microangiopatică și trombocitopenie. Această caracteristică este împărtășită de două sindroame înrudite, sindromul hemolitic-uremic (HUS) și sindromul hemolitic uremic atipic (aHUS). În consecință, diagnosticul diferențial al acestor boli cauzatoare de TMA este esențial. În plus față de TMA, unul sau mai multe dintre următoarele simptome pot fi prezente în fiecare dintre aceste boli: simptome neurologice (de exemplu confuzie, convulsii cerebrale convulsii); insuficiență renală (de exemplu creșterea creatininei , scăderea ratei de filtrare glomerulară estimată [eGFR], analiză urinară anormală); și simptome gastrointestinale (GI) (de exemplu diaree greață / vărsături, dureri abdominale, gastroenterită. Spre deosebire de HUS și aHUS, TTP este cunoscut a fi cauzat de un defect dobândit în proteina ADAMTS13, deci un test de laborator care arată ≤5% din nivelurile normale ADAMTS13 este indicativ al TTP. Nivelurile ADAMTS13 peste 5%, împreună cu un test pozitiv pentru shiga-toxină / E. coli enterohemoragică (EHEC), sunt mai probabil indicative ale HUS, în timp ce absența shiga-toxinei / EHEC poate confirma un diagnostic de SHUS .
Tratament
Datorită mortalității ridicate a TTP netratat, se face un diagnostic prezumtiv al TTP chiar și atunci când se observă doar anemie hemolitică microangiopatică și trombocitopenie și se începe terapia. Transfuzia este contraindicată în TTP trombotic, deoarece alimentează coagulopatia. De la începutul anilor 1990, plasmafereza a devenit tratamentul preferat pentru TTP. Aceasta este o transfuzie de schimb care implică îndepărtarea plasmei sanguine a persoanei prin afereză și înlocuirea cu plasmă donatoare (plasmă proaspătă congelată sau criosupernatant ); procedura trebuie repetată zilnic pentru a elimina inhibitorul și a reduce simptomele. Dacă afereza nu este disponibilă, plasma proaspătă congelată poate fi perfuzată, dar volumul care poate fi administrat în condiții de siguranță este limitat din cauza pericolului de supraîncărcare a lichidului. Infuzia de plasmă singură nu este la fel de benefică ca schimbul de plasmă. De obicei se administrează corticosteroizi ( prednison sau prednisolon ). Rituximab , un anticorp monoclonal care vizează molecula CD20 de pe limfocitele B , poate fi utilizat la diagnostic; se crede că acest lucru distruge celulele B și, prin urmare, reduce producția de inhibitor. O recomandare mai puternică pentru rituximab există în cazul în care TTP nu răspunde la corticosteroizi și la plasmafereză.
Caplacizumab este o opțiune alternativă în tratarea TTP, deoarece s-a demonstrat că induce o rezoluție mai rapidă a bolii în comparație cu acei oameni care au fost tratați cu placebo. Cu toate acestea, utilizarea caplacizumab a fost asociată cu tendințe crescute de sângerare la subiecții studiați.
Persoanele cu TTP refractară sau recidivantă pot primi terapie imunosupresivă suplimentară , de exemplu vincristină , ciclofosfamidă , ciclosporină A sau splenectomie .
Copiii cu sindrom Upshaw-Schülman primesc plasmă profilactică la fiecare două până la trei săptămâni; aceasta menține niveluri adecvate de funcționare ADAMTS13. Unii tolerează intervale mai mari între perfuziile cu plasmă. Infuzii de plasmă suplimentare pot fi necesare pentru declanșarea evenimentelor, cum ar fi intervenția chirurgicală; alternativ, numărul trombocitelor poate fi monitorizat îndeaproape în jurul acestor evenimente, cu plasmă administrată dacă numărul scade.
Măsurătorile nivelurilor sanguine de lactat dehidrogenază , trombocite și schistocite sunt utilizate pentru a monitoriza progresia bolii sau remisiunea. Activitatea ADAMTS13 și nivelurile inhibitorilor pot fi măsurate în timpul urmăririi, dar la cei fără simptome nu se recomandă utilizarea rituximabului.
Prognoză
Rata mortalității este de aproximativ 95% pentru cazurile netratate, dar prognosticul este rezonabil favorabil (80-90% supraviețuire) pentru persoanele cu TTP idiopatic diagnosticat și tratat precoce cu plasmafereză .
Epidemiologie
Incidența TTP este de aproximativ 4-5 cazuri pe milion de persoane pe an. TTP idiopatic apare mai des la femeile și persoanele de origine africană, iar TTP secundar tulburărilor autoimune, cum ar fi lupusul eritematos sistemic, apare mai frecvent la persoanele de origine africană, deși alte forme secundare nu prezintă această distribuție. Femeile gravide și femeile din perioada post-partum au reprezentat o parte notabilă (12-31%) din cazuri în unele studii; TTP afectează aproximativ una din 25.000 de sarcini.
Istorie
TTP a fost descris inițial de Eli Moschcowitz la Spitalul Beth Israel din New York în 1925. Moschcowitz a atribuit boala (incorect, așa cum se știe acum) unei cauze toxice. Moschcowitz a remarcat că pacientul său, o fată de 16 ani, avea anemie, vânătăi mici și mari, hematurie microscopică și, la autopsie, trombi microvasculari diseminați . În 1966, o revizuire a 16 cazuri noi și 255 de cazuri raportate anterior a condus la formularea pentadei clasice a simptomelor și a constatărilor (de exemplu, trombocitopenie, anemie hemolitică microangiopatică, simptome neurologice, insuficiență renală, febră); în această serie, ratele mortalității s-au dovedit a fi foarte mari (90%).
În timp ce un răspuns la transfuzia de sânge fusese observat anterior, un raport din 1978 și studii ulterioare au arătat că plasma sanguină a fost extrem de eficientă în îmbunătățirea procesului bolii. În 1991, schimbul de plasmă a fost raportat pentru a oferi rate de răspuns mai bune comparativ cu perfuzia de plasmă. În 1982, boala fusese asociată cu factori von Willebrand anormal de mari. Identificarea unei proteaze deficitare la persoanele cu TTP a fost făcută în 1998. Localizarea ADAMTS13 în genomul uman a fost identificată în 2001.
Referințe
linkuri externe
| Clasificare | |
|---|---|
| Resurse externe |

