Limfom folicular - Follicular lymphoma
| Limfom folicular | |
|---|---|
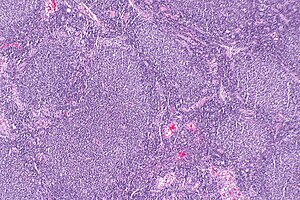 | |
| Micrografia unui limfom folicular, care prezintă foliculii limfoizi anormali în mod caracteristic care au dat numele afecțiunii. Pata H&E . | |
| Specialitate | Hematologie și oncologie |
Limfomul folicular (FL) este un cancer care implică anumite tipuri de celule albe din sânge cunoscute sub numele de limfocite . Cancerul provine din divizarea necontrolată a tipurilor specifice de celule B cunoscute sub numele de centrocite și centroblaste . Aceste celule ocupă în mod normal foliculii (vârtejuri nodulare ale diferitelor tipuri de limfocite) în centrele germinale ale țesuturilor limfoide, cum ar fi ganglionii limfatici . Celulele canceroase din FL formează de obicei structuri foliculare sau foliculare (vezi Figura alăturată) în țesuturile pe care le invadează. Aceste structuri sunt de obicei caracteristica histologică dominantă a acestui cancer.
Există mai mulți termeni sinonimi și învechi pentru FL, cum ar fi limfom CB / CC (limfom centroblastic și centrocitar), limfom nodular, boala Brill-Symmers și denumirea subtipului, limfom folicular cu celule mari. În SUA și Europa, această boală este a doua formă cea mai frecventă de limfoame non-Hodgkin , depășită doar de limfomul difuz cu celule B mari . FL reprezintă 10-20% din limfoamele non-Hodgkin, cu ~ 15.000 de cazuri noi de diagnosticare nouă în fiecare an în SUA și Europa. Studii recente indică faptul că FL este predominant în Japonia.
FL este o entitate clinică largă și extrem de complexă, cu o gamă largă de manifestări care nu au fost încă complet sistematizate. În mod obișnuit este precedată de o tulburare precanceroasă benignă în care se acumulează centrocite anormale și / sau centroblaste în țesutul limfoid. Apoi, acestea pot circula în sânge pentru a provoca o afecțiune asimptomatică denumită neoplazie limfoidă in situ de tipul limfomului folicular (adică ISFL). Un mic procent din aceste cazuri progresează către FL. Cu toate acestea, cel mai frecvent, FL se prezintă ca o umflare a ganglionilor limfatici în gât, axile și / sau inghină. Mai rar, se prezintă ca un cancer al tractului gastro-intestinal , un cancer la copii care implică țesuturi limfoide ale zonei capului și gâtului (de exemplu, amigdalele ) sau una sau mai multe mase în țesuturi nelimfoide, cum ar fi testiculele .
FL are de obicei o evoluție lentă a bolii care persistă esențial neschimbată de ani de zile. Cu toate acestea, în fiecare an, 2-3% din cazurile de FL progresează către o formă extrem de agresivă denumită adesea stadiu 3B FL, către un limfom agresiv difuz cu celule B mari sau către un alt tip de cancer agresiv cu celule B. Aceste limfoame foliculare transformate (t-FL) sunt în esență incurabile. Cu toate acestea, progresele recente în tratamentul t-FL (de exemplu adăugarea la chimioterapie standard a unor agenți precum rituximab ) au îmbunătățit timpul de supraviețuire global. Aceste regimuri mai noi pot întârzia, de asemenea, transformarea FL în t-FL. Progrese suplimentare în înțelegerea FL pot duce la îmbunătățiri suplimentare în tratarea bolii.
Fiziopatologie
Alterări genomice
Progresiile serie de in situ FL la FL și FL la t-FL par să implice acumularea unui număr crescând de modificari genomice ( de exemplu , anomalii cromozomiale și mutații genetice ) în formatoare precursorii celulă B la aceste tulburări. Cel puțin unele dintre aceste modificări par să provoace supraexprimarea sau subexprimarea produselor genelor care reglează susceptibilitatea acestor celule de a dezvolta alte modificări genomice , de a supraviețui, de a prolifera și / sau de a se răspândi în alte țesuturi. În consecință, mai multe clone de celule B care prezintă modificări genomice în creștere și comportamente maligne populează tulburarea. Nicio modificare genomică nu pare responsabilă pentru dezvoltarea fiecărui spectru al tulburărilor FL. Mai degrabă, interacțiunile dintre modificările genomice multiple par să stea la baza acestei progresii seriale.
Limfom folicular in situ
Limfomul folicular in situ este o acumulare de celule B monoclonale (adică celule descendente dintr-o singură celulă ancestrală) în centrele germinale ale țesutului limfoid. Aceste celule poartă în mod obișnuit o anomalie genomică patologică, adică o translocație între poziția 32 pe brațul lung (adică „q”) al cromozomului 14 și poziția 21 pe brațul q al cromozomului 18. Această translocație juxtapune gena limfomului 2 al celulelor B ( BCL2 ) pe cromozomul 18 în poziția q21.33 în apropierea locusului lanțului greu al imunoglobulinei ( IGH @ ) pe cromozomul 14 în poziția q21. În consecință, BCL2 își supraexprimă produsul, regulatorul de apoptoză BCL2 (adică Bcl2). Bcl2 funcționează pentru a inhiba moartea celulară programată prelungind astfel supraviețuirea celulei. Se consideră că supraexprimarea Bcl2 în celulele B ale ISFL este un factor critic în acumularea lor patologică și progresia ulterioară malignă. Un număr mic (de exemplu, 1 din 100.000) de celule sanguine nucleate circulante care poartă această translocație t (14:18) q32: q21) se găsesc la 50-67% dintre indivizii altfel sănătoși. Prevalența acestei descoperiri crește odată cu vârsta și cu anii de fumat. Deoarece majoritatea indivizilor cu această translocație în celulele sanguine nu dezvoltă ISFL, translocația t (14:18) (q32: q21), în timp ce prelungește supraviețuirea celulară, trebuie să fie doar un pas în dezvoltarea ISFN. Se propune ca această translocație să apară în timpul dezvoltării timpurii a celulelor B imature ale măduvei osoase (adică celule pre-B / celule pro-B) după care aceste celule circulă liber și, în cazuri rare, se acumulează și se maturizează până la centrocite și / sau centroblaste. în centrele germinale ale foliculilor limfoizi pentru a forma ISFL. Mecanismul care favorizează această localizare și acumularea în continuare nu este clar.
Persoanele cu ISFL progresează la FL la o rată de 2-3% / an pentru cel puțin primii 10 ani după diagnostic. Această progresie implică probabil achiziționarea de aberații genomice pe lângă translocația t (14:18) q32: q21) în celulele B ISFL. Mutațiile suspecte includ cele din următoarele gene: 1) EZH2 (codifică proteina familiei complexului policomborepresiv 2 care este implicată în menținerea stării represive transcripționale a diferitelor gene și se găsește în până la 27% din cazurile de FL); 2) CREBBP (codifică proteina care leagă CREB, care contribuie la activarea diferitelor gene); 3) TNFSF14 (codifică membrul 14 al superfamiliei factorului de necroză tumorală, un membru al superfamiliei factorului de necroză tumorală care poate funcționa ca un factor co-stimulator pentru activarea celulelor limfoide); și 4) KMT2D (codifică histona-lizina N-metiltransferaza 2D, o histonă metiltransferază care reglează expresia diferitelor gene). ISFL poate dobândi, de asemenea, numeroase variații ale numărului de copii (adică duplicări și ștergeri ale unei porțiuni ale unui cromozom împreună cu oricare dintre genele conținute în acesta) care pot contribui la FL. În toate cazurile, numărul anomaliilor genetice dobândite în celulele B ale ISFL sunt mult mai mici decât cele din FL.
Limfom folicular
Modificările genomice găsite în FL includ 1 ) translocarea t (14:18) (q32: q21.3) (85-90% din cazuri); 2) deleții 1p36 (adică deleții în brațul q al cromozomului 1 în poziția 36, [60-70% din cazuri]) care duc la pierderea TNFAIP3 (codifică factorul de necroză tumorală, proteina 3 indusă de alfa care inhibă activarea NF -κB , blochează moartea celulelor datorită apoptozei și reglează răspunsurile imune pe bază de limfocite prin activitatea sa de ubiquitin ligază ); 3) mutații în PRDM1 (codifică proteina degetului de zinc din domeniul PR care promovează maturarea și proliferarea celulelor B); și 4) aceleași mutații observate în ISFL, inclusiv KMT2D (85-90% din cazuri), CREEBP (40-65% din cazuri), BCL2 (40-65% din cazuri) și EZH2 (20-30% din cazuri) precum și alte mutații, cum ar fi cele din gena modificatoare de histone HIST1H1E (20-30% din cazuri), gena RRAGC (~ 17% din cazuri) care reglează creșterea celulelor, supraviețuirea, moartea și proliferarea și, în ≤ 15% din cazuri alte câteva gene, inclusiv MEF2B , STAT6 , EP300 , ARID1A , SLC22A2 , CARD11 , FOXO1 , GNA12 , B2M (adică gena pentru beta-2 microglobulină ) și SGK1 . Cu excepția translocației t (14:18) (q32: q21.3) și a mutațiilor EZH2 care duc la câștiguri în expresia și funcția respectivă a produselor lor, modificările genetice conduc în general la o pierdere a producției sau funcției produsele genelor citate. Cu toate acestea, rolurile exacte, dacă există, ale acestor anomalii genomice în promovarea progresiei ISFL la FL sunt neclare.
Limfom folicular transformat
Transformarea FL într-o stare mai agresivă sau alt tip de limfom agresiv este asociată cu: 1) în principal mutații care activează genele în CREEBP, KMT2D, STAT6, CARD11 (codificând o guanilat kinază care interacționează cu BCL10 și activează NF-κB pentru a regla supraviețuirea celulelor); 2) schimbări în expresia diverselor gene; 3) supraproducția diferitelor citokine care activează celula și CD79B (codificând componenta proteinei Ig-beta a receptorului celulei B ); 4) mutații care inactivează genele în TNFAIP3, CD58 (care codifică molecula de adeziune celulară , antigenul asociat funcției limfocitelor 3, care este implicat în activarea celulelor T ), CDKN2A (care codifică proteinele supresoare tumorale p16INK4a și p14arf ) sau CDKN2B (codifică ciclina dependentă) inhibitor de kinază 2B supresor tumoral multiplu 2) (inactivarea oricărei gene CDKN2 determină instabilitatea genomului , adică frecvența crescută a altor mutații genetice) și TNFRSF4 (care codifică un tip de receptor al factorului de necroză tumorală ); și 5) mutații care activează sau -inactivează genele în sau alte cauze ale sub-sau supraexprimării c-MYC ((care codifică factorul de transcripție proto- oncogenă c-Myc care reglează expresia genelor diverse dintre care favorizează proliferarea celulară).
Mediul tumoral
Celulele imune și stromale non-neoplazice , precum și matricea extracelulară din țesuturi pot permite celulelor foliculare neoplazice să supraviețuiască, să prolifereze și să evite supravegherea de către sistemul imunitar . De exemplu, studiile de laborator arată că: 1) celule dendritice foliculare , celule reticulate fibroblastice și celulele T helper furniza semnale de creștere și supraviețuire neoplazice celulelor B foliculare; 2) celulele B foliculare neoplazice recrutează celule T reglatoare care acționează pentru a suprima răspunsurile imune la acestea; 3) a celulelor T citotoxice care ucid în mod normal , celulele neoplazice devin disfunctionale , în prezența celulelor foliculare neoplazice care sunt încorporate în acest mediu multicelulare; și 4) celulele stromale ale măduvei osoase susțin în mod direct creșterea celulelor foliculare neoplazice. Nivelurile reduse de imun-infiltrare s-au dovedit a fi puternic asociate cu progresia precoce a bolii.
Prezentare și curs
Limfom folicular in situ
FL este în mod obișnuit precedat de, dar neobișnuit progresează la ISFL, o tulburare asimptomatică care este de obicei descoperită în țesuturile care sunt biopsiate din alte motive. Limfomul FL poate fi diagnosticat în cazurile mai puțin frecvente în care se constată că persoanele cu ISFL au FL la examinări ulterioare. În mod similar, indivizii cu> 1 din 10.000 limfocite circulante care conțin translocația t (14:18) q32: q21) prezintă un risc crescut, dar încă mic, de a dezvolta FL și de a avea diagnostice ca având FL la examinările de urmărire.
Limfom folicular
FL se prezintă în mod obișnuit ca o mărire asimptomatică a ganglionilor limfatici la nivelul gâtului, axilei, inghinei, canalului femural sau a altor locuri la indivizi (vârsta medie 65) fără antecedente cunoscute de ISFL sau cu un număr anormal de t circulant (14:18) q32 : q21-limfocite conatianing. Este posibil ca aceste măriri să fi fost prezente de luni până la ani și în acest timp s-au înălțat și au scăzut în dimensiuni. Mai puțin frecvent, FL se prezintă ca mase extra-nodale în piele, glanda tiroidă, glanda salivară, sânul, testiculele. splină , ficat și / sau plămân. Indiferent de tipul de prezentare, FL este de obicei (~ 80% din cazuri) într-un stadiu avansat la diagnostic, așa cum este indicat prin implicarea măduvei osoase (50% până la 70% din cazuri), mai mulți ganglioni limfatici în diferite părți ale corpului , și / sau alte țesuturi. O minoritate (<33%) dintre pacienții cu FL prezintă simptome B , adică febră inexplicabilă recurentă , transpirații nocturne recurente și / sau pierdere în greutate ≥10% în ultimele 6 luni. În general, boala are un curs indolent și prelungit, cu o speranță de viață mediană de 15-20 de ani: un procent mare de pacienți mor din alte cauze decât boala FL. Cu toate acestea, în fiecare an, inclusiv în primii ani după diagnostic, aproximativ 2-3% din cazurile de FL se transformă în t-FL; Supraviețuirea mediană a fost de ~ 4,5 ani de la debutul acestei transformări.
Există subtipuri mai puțin frecvente de FL care diferă nu numai prin prezentarea lor, ci și prin histopatologie , anomalii genetice și curs. Aceste subtipuri, care sunt acum (adică FL tractului gastro-intestinal primar) sau pot fi considerate în viitor (FL de tip pediatric) boli distinctive, sunt:
Limfom folicular de tip duodenal
Limfomul folicular de tip duodenal (DFL) a fost inițial considerat a fi un tip de limfom folicular al tractului gastrointestinal primar (tractul GI) (PGTFL), adică un limfom folicular în care leziunile tractului gastrointestinal erau părți proeminente ale bolii. Cu toate acestea, un subset de cazuri de PGTFL a avut leziuni care au fost localizate la duoden și alte părți ale intestinului subțire, de obicei, fără a implica alte părți ale tractului gastrointestinal sau țesuturi în afara tractului gastrointestinal. Acest lucru contrastează cu celelalte cazuri de PGTFL care au fost boli sistemice care implică o gamă largă de țesuturi ale tractului GI și non-GI. În consecință, Organizația Mondială a Sănătății (2017) a eliminat boala localizată din categoria limfomului folicular al tractului gastro-intestinal primar, a reclasificat-o ca entitate distinctă a bolii și a denumit-o limfom folicular de tip duodenal. DFL este cel mai adesea o boală asimptomatică care este diagnosticată la examinarea endoscopică a tractului GI efectuată din alte motive. Mai puțin frecvent, prezintă simptome vagi abdominale. Într-o revizuire a studiilor anterioare, leziunile la 85% din limfomul folicular duodenal primar au fost localizate nu numai în duoden, ci și în alte locuri din intestin (de exemplu, jejun și / sau ileon ), cu cazuri rare cu leziuni în rect sau cecum. PDF-ul este o boală indolentă care poate remite și recidiva spontan, dar care rareori progresează către o formă mai agresivă. O strategie de urmărire și așteptare a fost o metodă general recomandată pentru tratamentul inițial al bolii.
Limfom folicular al tractului gastrointestinal primar
PGTFL este un limfom folicular (care, așa cum este definit în prezent, exclude cazurile de limfom folicular de tip duodenal) care are o componentă proeminentă a afectării tractului GI. Boala poate prezenta semne și simptome tipice tipului comun de limfom folicular. De exemplu, mărirea ganglionilor limfatici în gât, axilă, inghinală, canal femural și / sau alte zone și / sau semne și simptome ale bolii tractului gastrointestinal cauzate de leziuni în stomac, intestin subțire, intestin gros sau rect văzut. Aceste semne și simptome pot include dureri abdominale, obstrucție intestinală , greață și vărsături persistente, hematochezie (adică trecerea de sânge proaspăt de obicei pe fecale prin rect) sau melena (adică trecerea fecalelor gudronate care conțin sânge care a fost digerat în stomac sau intestinului superior). PGTFL este, în general, tratat ca și cazuri de limfom folicular comun: în funcție de gravitatea bolii și de simptomele acesteia, pacienții sunt tratați cu așteptare atentă , intervenție chirurgicală, chimioterapie, radiații, imunoterapie plus radioterapie sau combinații ale acestor modalități.
Limfom folicular predominant difuz cu deleție 1p36
Limfomul folicular predominant difuz cu deleție 1p36 este un subtip rar de FL în care ganglionii limfatici implicați prezintă infiltrații de centrocite și centoblaste care, în general, nu formează tiparele nodulare, învârtitoare, caracteristice majorității tipurilor de FL. În plus, acestor celule le lipsește translocația t (14:18) (q32: q21.3) întâlnită în mod obișnuit în alte tipuri de FL, dar, similar multor cazuri FL, au o ștergere în partea terminală a scurtului (adică „p” ) brațul cromozomului 1 care codifică gena TNFRSF14 (vezi secțiunea de fiziopatologie). Limfomul folicular predominant difuz cu deleție 1p36 se prezintă de obicei cu măriri voluminoase ale ganglionilor limfatici inghinali (adică inghinale), dar se poate prezenta cu măriri ale ganglionilor axilari (adică axila) sau cervicală (adică gâtul) . În cazuri rare, poate exista afectarea măduvei osoase . În ciuda dovezilor bolii voluminoase și diseminate, limfomul folicular predominant difuz cu deleție 1p36 pare a fi o tulburare indolentă care poate necesita o observație pe termen lung mai degrabă decât un tratament excesiv.
Limfom folicular de tip pediatric
Limfomul folicular de tip pediatric (PTFL) a fost raportat inițial la copii cu vârste cuprinse între 1-17 ani (vârsta mediană ~ 13-14), dar mai recent a fost raportat că apare la adulți. Tulburarea a fost definită recent de Organizația Mondială a Sănătății (2016) ca o entitate distinctă care apare mai ales la bărbați și implică ganglioni limfatici umflați în cap (inclusiv amigdalele și adenoidele ), gâtul sau, rareori, axilare sau inghinale sau țesuturi nelimfoide. În prezent, totuși, pacienții care au prezentat sau prezintă implicarea unor zone sau țesuturi în afara capului, gâtului, axilei sau zonelor inghinale sunt acum considerați mult mai susceptibili de a avea o boală nouă și provizoriu definită, limfom cu celule B mari cu Rearanjare IRF4 .
Leziunile din PTFL sunt formate din infiltrate care conțin centrocite cu proliferare rapidă și centroblaste care nu au translocația t (14:18) (q32: q21.3), dar totuși deseori supraexprimă gena BCL2 . Aceste celule pot prezenta o pierdere de heterozigozitate la 1p36 (20-50% din cazuri) care duce la scăderea exprimării genei TNFRSF14 (vezi secțiunea Fiziopatologie), precum și mutații în IRF8 (10-50% din cazuri), ceea ce contribuie la dezvoltarea și funcția celulelor B și a genei MAP2K1 (10-40% din cazuri), care reglează activarea căii de semnalizare a celulelor ERK. S-a raportat că peste două duzini de alte gene au fost mutate în cazuri rare de PTFL, dar, în general, anomaliile genetice găsite în această tulburare sunt mai puține și mai puțin complexe decât cele din alte tipuri de FL. PTFL are un curs indolent, recidivant și remisiv, cu o rată de supraviețuire la 5 ani> 95%. Pacienții diagnosticați cu PTFL au fost tratați cu chimioterapie, intervenții chirurgicale și combinații ale acestor tratamente. În general, acești pacienți s-au descurcat bine (supraviețuire 100% cu <5% din cazuri recidivante, indiferent de modalitatea de tratament). Mai recent, 36 de pacienți au fost tratați numai cu rezecție chirurgicală, urmată de observare; toți acești pacienți au supraviețuit, cu un singur recidiv. Astfel, PTFL pare a fi un tip de FL foarte indolent în care mai multe studii au raportat rate de supraviețuire globale și fără progresie de 100% și, respectiv,> 90%, pentru> 2 ani și o probabilitate estimată de 5 ani fără evenimente rata de supraviețuire de ~ 96%. Regimurile terapeutice versus observațiile de urmărire care tratează cel mai bine această tulburare la copii, adolescenți și adulți (adulții pot necesita tratamente diferite decât copiii și adolescenții) necesită studii suplimentare.
Limfomul folicular primar al testiculului
Limfomul folicular primar al testiculului (PFLT), denumit și limfom folicular testicular, a fost clasificat ca o formă distinctă de FL de către Organizația Mondială a Sănătății în 2016. Este o boală extrem de rară, care a fost recunoscută ca apărând în primul rând la copii și adolescenți, dar de asemenea, a fost raportat la 5 adulți. PFLT diferă de cazurile de limfom folicular tipic care implică testiculul prin faptul că apare mai des la copii și adolescenți; implică celule B maligne care au translocarea t (14:18) q32: q21); și prezintă o boală strict limitată la testicul. Deși este similar cu limfomul folicular de tip pediatric în care nu implică celule care poartă translocația t (14:18) q32: q21), PFLT diferă de boala anterioară prin faptul că este limitată la testicul și implică celule maligne care nu exprimă Bcl2 . PFTL este o boală extrem de indolentă care se manifestă prin leziuni care prezintă o histologie tipică FL sau, mai frecvent, o histologie mixtă a limfomului cu celule mari difuze FL. De obicei implică o leziune de 2-4 centimetri într-un singur testicul. Pacienții au fost tratați cu îndepărtarea testiculelor implicate, urmate de diferite regimuri standard de chimioterapie anti-limfom pentru a obține rezultate excelente, adică remisii completate 100% fără reapariția bolii la 15 pacienți copii și adolescenți observați timp de 4-96 luni. Nu s-au raportat cazuri de limfom folicular primar al testiculului care evoluează spre t-FL. Intervenția chirurgicală urmată de o chimioterapie mai puțin intensă sau chiar absentă se poate dovedi a fi tratamentul optim pentru această boală.
Limfom folicular transformat
FL progresează cu o rată de 2-3% pe an timp de cel puțin primii 10 ani de la diagnostic până la o formă mai agresivă, în principal limfom difuz cu celule B mari (~ 93% din cazuri) sau limfom tip Burkitt (~ 7%) de cazuri) sau, în cazuri rare, prezintă histologie asemănătoare cu precursorul leucemiei limfoblastice cu celule B , limfomul plasmablastic , subtipul de grad înalt al limfomului cu celule B , limfomul Hodgkin de tipul celulelor B, leucemia limfocitară cronică / limfomul limfatic celular mic sau sarcom histiocitar . T-FL este aproape întotdeauna diagnosticat la pacienții urmăriți pentru FL. Acești pacienți cu FL prezintă: creșterea rapidă a ganglionilor limfatici; formarea leziunilor extra-nodale în siturile extra-nodale, cum ar fi sistemul nervos central , ficatul sau osul; debutul simptomelor B (adică febră, transpirații nocturne , scădere în greutate); dezvoltarea hipercalcemiei (adică niveluri serice ridicate de calciu); și / sau creșteri bruște ale nivelurilor serice ale enzimei lactat dehidrogenază . O minoritate a pacienților cu T-FL prezenți fără antecedente de FL. Acești pacienți prezintă în general o boală voluminoasă avansată, care poate fi însoțită de leziuni extra-nodale și simptome B. De obicei, toate diferitele forme de t-FL sunt boli agresive, rapid progresive, cu timpi de supraviețuire a mediului în general la pacienții tratați cu ~ 4,5 ani. Transformarea FL în DLBCL este în peste 70% din cazuri asociate cu câștigul activității MYC prin mecanisme genetice sau non-genetice.
Diagnostic

Diagnosticul FL depinde de examinarea țesuturilor implicate pentru anomalii histologice , imunologice și cromozomiale care sunt indicative ale bolii. FL implică de obicei la scară mărită a ganglionilor limfatici populate de foliculi anormale (vezi imaginea adiacentă) , care , atunci când examinate histologic conțin un amestec de centrocitele sau centroblast înconjurate de celule non-maligne, majoritatea celulelor T . Centrocitele, care depășesc în mod obișnuit centroblastele, sunt limfocite cu celule B de dimensiuni mici și mijlocii, care prezintă caracteristic nuclei scindați ; centroplastele sunt limfocite cu celule B mai mari, fără nuclei scindați. Cazurile rare de FL pot prezenta leziuni care conțin infiltrații tisulare dominate de celule B cu caracteristici ale celulelor precursoare (adică "blast") , monocite sau celule maligne ale mantalei, cum ar fi cele găsite în limfomul celulelor mantalei . Analizele imunochimice relevă faptul că aceste celule exprimă în general markeri de suprafață a celulelor B, inclusiv CD10 (60% din cazuri), CD20 , CD19 , CD22 și CD79, dar nu CD5 , CD11c sau CD23 proteine de suprafață; analizele genomice relevă faptul că aceste celule conțin translocație t (14:18) (q32: q21.3) (85-90% din cazuri), ștergeri 1p36 (60-70% din cazuri) și cu mult mai mică frecvență celelalte anomalii genomice enumerate în secțiunile de mai sus despre Fiziopatologie și prezentare și curs. Niciunul dintre acești markeri proteici sau anomalii genomice nu este diagnosticat pentru FL, de exemplu translocația t (14:18) (q32: q21.3) se găsește în 30% din limfomul difuz cu celule B mari și într-un număr mic de limfă benignă reactivă noduri. Mai degrabă, diagnosticul se face printr-o combinație de anomalii histologice, imunologice și genomice. Conform criteriilor Organizației Mondiale a Sănătății (OMS), diferențele în morfologia determinată microscopic a acestor țesuturi pot fi utilizate pentru a diagnostica și clasifica FL în următoarele 3 clase cu gradul 3 având subtipuri A și B:
- Gradul 1: foliculii au <5 centroblaste pe câmp de putere mare (hpf).
- Gradul 2: foliculii au 6 până la 15 centroblaste pe HPF.
- Gradul 3: foliculii au> 15 centroblasti pe hpf.
- Gradul 3A: Gradul 3 în care foliculii conțin predominant centrocite.
- Gradul 3B: Gradul 3 în care foliculii constau aproape în întregime din centroblaste.
Clasele 1 și 2 sunt considerate FL de grad scăzut; Gradul 3A este, de obicei, considerat și FL de grad scăzut, deși unele studii l-au considerat FL de grad înalt; iar gradul 3B este considerat ca un FL extrem de agresiv în categoria t-FL.
În plus față de boala de gradul 3B, examinările histologice pot dezvălui alte dovezi ale t-FL, cum ar fi constatări histologice în concordanță cu FL și limfom difuz cu celule mari în același țesut (denumit limfoame compozite ) sau în țesuturi separate (denumit ( discordant) limfoame ) sau descoperiri histologice similare celor găsite în limfomul Burkitt, precursor leucemie limfoblastică cu celule B, limfom plasmablastic, subtipul de grad înalt al limfomului cu celule B, limfom Hodgkin de tip celulă B, leucemie limfocitară cronică / limfom limfocitar cu celule mici , sau sarcomul histiocitar. Alte descoperiri care indică prezența acestei transformări includ creșterea rapidă a dimensiunii ganglionilor limfatici, simptome recent dobândite sau B , dezvoltarea recentă a leziunilor FL în țesutul non-nodal, creșteri rapide ale nivelurilor serice de lactat dehidrogenază și prezența unor niveluri ridicate de calciu seric .
Diagnostic diferentiat
FL poate fi confundat cu limfomul cu celule B din zona marginală , limfomul cu celule de manta și varianta de limfom limfocitar mic de leucemie limfocitară cronică . Celulele maligne din limfomul cu celule B din zona marginală pot forma structuri foliculare, dar în mod obișnuit proliferează în zona marginală, mai degrabă decât în centrul germinal al țesuturilor limfoide. Aceste celule maligne prezintă adesea caracteristici ale monocitelor sau ale celulelor plasmatice . Limfoamele cu celule mantale prezintă limfocite monotone, de dimensiuni medii, monocite și centre germinale atrofiate; spre deosebire de FL, limfocitele maligne din această boală sunt pozitive pentru ciclina D1 prin colorare imunohistochimică . Limfoamele limfocitare mici sunt compuse din structuri nodulare cu celule maligne de dimensiuni mici și mijlocii care înconjoară limfocite imature și imunoblaste . Celulele maligne din această boală, spre deosebire de FL, se colorează pozitiv pentru CD5 și CD23 .
Tratament și prognostic
FL este de obicei un limfom cu creștere lentă, cu o speranță de viață mediană generală pentru pacienții tratați de 10-15 ani, cu multe cazuri de creștere și descreștere în mărimea leziunilor lor și cazuri rare de remitere spontană. Aceste considerații favorizează utilizarea observației în locul intervenției la pacienții a căror formă particulară de FL are un prognostic favorabil sau care sunt intoleranți la tratamentele agresive. Cu toate acestea, majoritatea cazurilor de FL au un prognostic mai puțin favorabil într-un anumit stadiu al bolii lor și, prin urmare, vor necesita intervenție. Există un consens mic în ceea ce privește liniile directoare care trebuie utilizate pentru a defini prognosticul și tratamentul pentru FL la prezentarea acestuia sau în cursul acestuia. Indicatorii utilizați în prezent pentru aceasta includ boala: 1) histologie; 2) subtip; 3) indolență și potențial de transformare prezise; și 4) gradul de boală măsurat prin examinări clinice, biopsia măduvei osoase pentru determinarea afectării măduvei osoase și imagistica PET / CT a pieptului, abdomenului, bazinului și a oricăror zone din afara acestor regiuni, dacă examenul fizic sugerează implicarea. Unele recomandări sugerate care utilizează acești parametri pentru a indica prognosticul și necesitatea tratamentului în FL includ:
- Criteriile OMS care utilizează gradul histologic (a se vedea secțiunea anterioară): Pacienții cu boala de clasele 1, 2 și 3A sunt prezice să aibă același prognostic cu risc scăzut care se observă în cazurile de FL tipic, în timp ce pacienții cu boală de gradul 3B se prezintă prognostic cu risc ridicat tipic t-FL.
- Indicele internațional de prognostic al limfomului folicular (FLIPI) : FLIPI utilizează următoarele criterii: vârsta ≥60 de ani; Boala Ann Arbor stadiul III (adică leziuni situate atât deasupra cât și sub diafragma toracică ) sau IV (adică leziuni diseminate care implică unul sau mai multe organe nelimfatice); hemoglobină din sânge <12 grame / decilitru; nivel seric de lactoză dehidrogenază peste normal; și implicarea a> 4 ganglioni limfatici. Pacienții pozitivi pentru 0-1, 2 sau ≥3 dintre acești factori sunt clasificați ca fiind în grupul cu risc scăzut, intermediar și, respectiv, cu risc ridicat, iar după tratamentul cu regimente care includ rituximab au supraviețuit fără progrese pe o perioadă de 2 ani de 84, 72, și, respectiv, 65% și supraviețuirea globală de 98, 94 și respectiv 87%.
- Indicele FLIP2. Această modificare a FLIP1 folosește vârsta ≥60; hemoglobină din sânge <12 grame / decilitru; nivel seric de lactoză dehidrogenază peste normal; nivel seric de beta-2 microglobulină peste normal; ≥1 ganglion limfatic cu un diametru> 6 centimetri; și implicarea măduvei osoase. Procentul prezis de pacienți tratați cu terapie cu supraviețuire fără progresie la 5 ani pentru indivizii pozitivi pentru 0, 1-2 și ≥3 dintre acești factori sunt 80, 51 și, respectiv, 19%.
- Imagistica CT / PET: Această metodă măsoară volumul total al tumorii corporale, astfel cum este detectat prin absorbția țesutului de fludeoxiglucoză radioactivă (F 18 ). Supraviețuirea fără progresie și supraviețuirea globală la 5 ani pentru pacienții cu volume tumorale estimate peste versus sub 510 centimetri cubi sunt raportate a fi de 32,7 și 84,8% față de 65,1 și respectiv 94,7%.
- Stadializare Lugano: această metodă clasifică boala Stadiul I ca implicând o singură regiune limfatică sau situs extra-limfatic; Boala în stadiul II ca implicând ≥2 situsuri limfatice sau 1 situs limfatic plus 1 situs extralimpatic, cu toate leziunile pe aceeași parte a diafragmei; Boala în stadiul III ca implicând ≥2 regiuni limfatice care se află pe părțile opuse ale diafragmei; și boala în stadiul IV ca leziuni diseminate care se găsesc în ≥1 organe nelimfatice.
- Prognostic pe bază de răspuns: pacienții cu FL a căror boală progresează în decurs de 24 de luni de la inițierea tratamentului cu chimioterapie și imunoterapie versus pacienții a căror boală nu progresează în termen de 24 de luni se estimează că vor avea rate de supraviețuire la 5 ani de 50-74%, respectiv ~ 90%.
Prognosticul și tratamentul pentru prezentările specifice cazurilor tipice de FL (vezi secțiunile de mai sus pentru prognoze și recomandări de tratament pentru FL tractului gastro-intestinal primar, FL predominant difuz cu deleție 1p36, FL de tip pediatric și FL primar al testiculului) utilizarea obișnuită sunt după cum urmează:
Limfom folicular in situ
ISFL este o afecțiune benignă care poate fi reevaluată periodic pentru a detecta cazurile rare ale acesteia care progresează spre FL; în caz contrar, ISFL nu este tratat.
Limfom folicular localizat
În 10-20% din cazuri, FL apare limitat la un singur câmp de radiații, nu implică măduva osoasă și, prin urmare, este considerat ca FL în stadiu incipient localizat. În aceste cazuri, care sunt uneori clasificate ca Ann Arbor stadiul I (adică boala limitată la o singură regiune restricționată) sau stadiul II (adică boala limitată la două locații care se află pe aceeași parte a diafragmei), radioterapia atinge 10 ani în total rate de supraviețuire de 60-80% și perioade medii globale de supraviețuire de 19 ani. Se pare că multe dintre recăderile din aceste cazuri se datorează bolii nedetectate în afara câmpului de radiații în momentul tratamentului cu radiații. Utilizarea imagisticii PET / CT este foarte recomandată pentru a se asigura că FL este localizat. În orice caz, rezultatele excelente obținute prin radioterapie susțin cu tărie utilizarea sa în boala localizată. Utilizarea unui agent imunoterapeutic, cum ar fi Rituximab singur sau în combinație cu un regim chimioterapeutic, cum ar fi CVP (de exemplu , ciclofosfamidă , vincristină , prednison și rituximab ), în cazurile de boală localizată, în stadiu incipient, pot fi alegeri adecvate pentru unele dintre aceste stadii incipiente. pacienți. Cu toate acestea, această din urmă abordare este recomandată pentru cazurile de boală localizată în care boala se extinde dincolo de un singur domeniu: 56% dintre pacienții tratați în acest mod au avut o supraviețuire fără progresie la 10 ani, în timp ce pacienții tratați cu alte regimuri au avut supraviețuiri fără progresie de 41 %. Cu toate acestea, supraviețuirea generală nu a diferit între cele două grupuri.
Limfom folicular asimptomatic
Pacienții cu FL asimptomatic, dar nu localizat de grad scăzut, FL al tractului gastro-intestinal și limfom folicular de tip pediatric au fost deserviți de o monitorizare atentă fără intervenție terapeutică. Chiar și FL de grad înalt, agresiv, recidivant sau transformat poate fi, de asemenea, servit cu observație la pacienții asimptomatici. Rezultatele la pacienții asimptomatici cărora li s-a recomandat ca declanșatoare pentru începerea tratamentului includ unul sau mai multe dintre următoarele: dimensiunea tumorii ≥7 cm în diametru; implicarea a ≥3 noduri în 3 zone distincte, fiecare dintre ele având diametrul de ≥3 cm; compresie de organe; prezența ascitei sau revărsării pleurale (adică acumularea de lichid în cavitățile abdominale sau pleurale ); stare slabă de performanță din cauza bolii; niveluri crescute de lactoză dehidrogenază serică sau beta-2 microglobulină ; prezența leziunilor osoase localizate; afectarea rinichilor; niveluri reduse de trombocite circulante sau oricare dintre diferitele tipuri de celule albe din sânge ; debutul pruritului semnificativ (adică senzație de mâncărime) sau a altor simptome B; și mărirea (adică o creștere cu ≥50% a dimensiunii pe o perioadă de cel puțin 6 luni) a ganglionilor limfatici, splinei sau a altor organe sau țesuturi infiltrate de limfom folicular.
Limfom folicular simptomatic
FL simptomatic necesită tratamente îndreptate spre ameliorarea simptomelor prin reducerea încărcăturii celulelor tumorale. Pentru aceasta s-au folosit diferite regimuri chimioterapeutice, inclusiv combinații de agenți antineoplazici alchilanți , analogi nucleozidici și / sau antracicline . Două regimuri chimioterapeutice utilizate frecvent sunt CVP (vezi secțiunea FL localizată) și CHOP (adică CVP plus antraciclină adriamicină ). Agenții mai noi utilizați pentru tratarea FL includ anticorpi monoclonali precum rituximab , obinutuzumab , galiximab , inotuzumab ozogamicin sau epratuzumab și imunomodulatori precum lenalidomida și interferonul . Ultimele medicamente au fost utilizate în asociere sau singure pentru tratamentul FL simptomatic. Majoritatea acestor regimuri adaugă rituximab (un anticorp monoclonal care se leagă și astfel ucide proteina de suprafață a celulei CD20 pe celulele B) cu regimuri CVP sau CHOP (denumite regimuri R-CVP și R-CHOP).
Regimul R-CHOP pare superior regimului R-CVP cu, de exemplu, un studiu care a constatat rate de supraviețuire fără progresie pe 8 ani de 57% față de 46% pentru cele două regimuri respective. Mai recent, pacienții cu FL au fost tratați cu alte regimuri, inclusiv: 1) rituximab combinat cu agentul alchilant chimioterapeutic bendamustină ; 2) rituximab combinat cu agentul chimioterapeutic fludarabină și inhibitorul topoizomerazei de tip II , mitoxantronă ; și 3) rituximab combinat cu un alt agent imunoterapeutic, cum ar fi galiximab , epratuzumab (anticorpi monoclonali direcționați, respectiv, împotriva proteinelor de suprafață ale celulelor CD80 sau CD22 pe celulele imune, inclusiv celulele B), sau medicamentul imunomodulator , lenalidomida . Deși este prea devreme pentru a judeca rezultatele pe termen lung ale ultimelor regimuri, regimurile au prezentat rezultate similare atunci când au fost analizate pe baza răspunsurilor slabe la tratament (~ 10-20% răspunsuri slabe). Bendamustina cu rituximab poate fi preferabilă R-CHOP sau R-CVP pentru tratarea FL de grad scăzut (de exemplu, clasele 1, 2 și, eventual, 3A); R-CHOP poate fi preferat în FL care are caracteristici de risc ridicat (de exemplu, niveluri ridicate de Beta-2 macroglobulină sau afectarea măduvei osoase). Combinația dintre lenalidomidă și rituximab a demonstrat un potențial bun în tratarea cazurilor indolente de FL.
Studiile indică faptul că terapia de întreținere cu rituximab după terapia de inducție cu succes prelungește supraviețuirea fără progresie; de exemplu, un studiu a constatat că supraviețuirea fără progresie după 6 ani de tratament a fost de 59,2% la pacienții tratați cu rituximab și 42,7% fără această întreținere; cu toate acestea, supraviețuirea globală la 6 ani a fost similară în cele două grupuri, respectiv 87,4% și 88,7%. Un alt studiu a constatat că întreținerea prelungită cu rituximab nu a avut niciun beneficiu pe o perioadă de întreținere de opt luni. În cele din urmă, intervenția chirurgicală și radiațiile sunt terapii suplimentare care pot fi utilizate pentru ameliorarea simptomelor cauzate de boala t-FL voluminoasă sau pentru tratarea leziunilor la pacienții care nu pot rezista altor tipuri de tratament.
Limfom folicular transformat
Studiile timpurii asupra tratamentului t-FL cu diferite regimuri pur chimioterapice au dat rezultate slabe cu perioade medii de supraviețuire globale de 1-2 ani. Cu toate acestea, adăugarea de rituximab la regimuri, cum ar fi CVP și CHOP, ca parte a terapiilor de inducție și de întreținere (de exemplu, R-CVP și R-CHOP) au îmbunătățit mult supraviețuirea generală la 5 ani până la rate de 73%. Regimul R-CHOP este o opțiune bună pentru tratarea acestor cazuri. Cu toate acestea, aceste regimuri nu trebuie inițiate la persoanele cu FL asimptomatice și cu sarcini tumorale scăzute: rezultatele la astfel de pacienți nu arată nicio diferență între tratamentul precoce și cel întârziat. Unele studii recente au constatat că utilizarea rituximabului în combinație cu bendamustina (adică regimul RB) a oferit rezultate mai bune decât R-CHOP: timpii de supraviețuire fără progresie într-un studiu au fost de 69,5 luni pentru RB și 31,2 luni pentru R-CHOP. Rezultate similare s-au obținut atunci când RB a fost comparat cu R-CVP. De asemenea, aceste studii nu au găsit niciun beneficiu global de supraviețuire între regimurile RB și R-CHOP. Alte regimuri examinate recent includ: 1) utilizarea obinutuzumab în loc de rituximab în regimentele R-CHOP și R-CVP pentru a obține rate de supraviețuire fără progresie la 3 ani, 80% pentru regimul obinutuzumab-chimioterapie versus 73% pentru rituximab- regim de chimioterapie și 2) combinația de rituximab cu lenalidomidă (fără agent de chimioterapie) versus diferite chimioterapie plus imunoterapie (în principal rituximab) pentru a obține remisie completă similară și rate de supraviețuire fără progresie de 3 ani, dar cu rituximab plus lenalidomidă, cauzând mai puțină toxicitate (adică neutropenie severă ). Multe dintre aceste studii au folosit terapia de întreținere a rituximabului după terapia de inducție.
Prevenirea
Mai multe studii, deși nu sunt concludente, sugerează că tratamentul precoce al FL cu risc scăzut reduce incidența bolii care progresează spre t-FL. Tratamentele utilizate în aceste studii includ chimioterapie, radioterapie și combinații de imunoterapie plus terapia de întreținere cu rituximab.
Limfom folicular recidivant
Pacienții care recidivează după terapia inițială pentru FL pot fi urmăriți îndeaproape fără tratament dacă sunt asimptomatici. Când este necesar un tratament, pacienții pot fi tratați cu schema inițială de tratament atunci când un astfel de tratament a dus la o remisie care a durat cel puțin un an; în caz contrar, se utilizează un regim alternativ. Regimurile utilizate în mod obișnuit în limfomul recidivat includ R-CHOP, R-CVP, RFM (adică rituximab, fludarabină și mitoxantronă ) și RB (Bendamustină plus rituximab). Pacienții care suferă un eșec precoce al tratamentului (de exemplu, în termen de 1-2 ani de la tratamentul inițial) sau recidive multiple au fost, de asemenea, tratați fie cu măduva osoasă a celulelor stem autologe (adică celule stem prelevate de la pacient), fie alogene (adică celule stem prelevate de la un donator) transplant. În timp ce studiile sunt neconcludente, transplantul de măduvă osoasă cu celule stem autologe pare să prelungească supraviețuirea la pacienții cu eșec precoce al tratamentului, care sunt suficient de sănătoși pentru a rezista acestei terapii. Pacienții nepotrivi pot beneficia de un tratament inițial cu obinutuzumab plus bendamustină urmat de un tratament de întreținere cu obinutuzumab (dacă nu au fost tratați anterior cu obinutuzumab).
Alte tratamente în mare parte experimentale în curs de studiu la pacienții cu eșecuri multiple ale tratamentului includ: 1) Inhibitori de fosfoinozidă 3-kinază, cum ar fi copanlisib , duvelisib și idelalisib, care blochează calea de semnalizare a fosfoinozitidei 3-kinazei care promovează supraviețuirea, proliferarea și alte potențial maligne comportamentele celulelor; 2) perfuzie de celule T receptor receptor antigen himeric tiselecleucel (adică celule T CAR) (adică celule T care au fost izolate de la pacienți, concepute pentru a exprima un receptor pentru proteina CD19 pe celule T și, prin urmare, ucide, și apoi infuzate înapoi în pacientul donator); 3) Inhibitorul tirozin kinazei Bruon , ibrutinib , pentru a bloca acțiunile de maturare a celulelor B ale acestei kianaze; 4) Venetoclax inhibitor BCL pentru a bloca acțiunea Bcl2 în promovarea supraviețuirii și proliferării celulelor B; 5) inhibitori ai histonei deacetilazei abexinostat și tazemetostat pentru a modifica expresia diferitelor gene; și 6) Inhibitori ai punctului de control nivolumab , pidilizumab și pembrolizumab pentru a promova capacitatea sistemului imunitar de a suprima creșterea celulelor canceroase. În studiile preliminare asupra pacienților cu FL care erau cunoscuți sau considerați că sunt refractori la terapii mai convenționale, aceste medicamente, atunci când sunt combinate cu medicamente mai convenționale, în special rituximab, au produs rezultate promițătoare. Inhibitorii 3-kinazei fosfoionitidici au produs rate de răspuns generale de 10-12,5 luni în 42-59%; celulele tisagenecleuce au produs o rată de răspuns globală fără progresie de 70% după o monitorizare de 28 de luni; inhibitorii 3-kinazei fosfoinozidici au produs rate de răspuns globale de ~ 40% și rate de răspuns complete de 1-20%; Inhibitorul de tirozin kinază al lui Bruton a produs rate de răspuns generale și complete de 38%, respectiv 18%; inhibitorul Bcl produce rate de răspuns globale și complete de 33%, respectiv 14%; inhibitorii histone deacetilazei produc rate de răspuns globale de 35% -71%; iar inhibitorii punctului de control produc rate de răspuns globale de 40% -80% și rate de răspuns complete de 10-60%.
Vezi si
Referințe
linkuri externe
| Clasificare | |
|---|---|
| Resurse externe |
- Intrarea limfomului folicular cu celule mari în domeniul public NCI Dictionary of Cancer Terms
