Sindromul Lesch – Nyhan - Lesch–Nyhan syndrome
| Sindromul Lesch – Nyhan | |
|---|---|
| Alte nume | Guta juvenilă, sindromul hiperuricemiei primare, sindromul auto-mutilării coreoatetozei, hiperuricemia primară legată de X, deficitul HGPRT |
| Specialitate |
Endocrinologie |
| Simptome | auto-vătămare , distonie , coree , spațialitate, dizabilitate intelectuală , hiperuricemie , |
| Complicații | insuficiență renală , anemie megaloblastică |
| Diagnostic diferentiat | paralizie cerebrală , distonie , sindrom Cornelia de Lange , autism , disautonomie familială, sindrom Tourette |
| Frecvență | 1 din 380.000 |
Sindromul Lesch-Nyhan ( LNS ) este o tulburare moștenită rară cauzată de o deficiență a enzimei hipoxantină-guanină fosforibosiltransferază (HGPRT). Această deficiență se produce din cauza mutatii in HPRT1 gena situat pe cromozomul X . LNS afectează aproximativ 1 din 380.000 de nașteri vii. Tulburarea a fost recunoscută pentru prima dată și caracterizată clinic de către studentul american de medicină Michael Lesch și de mentorul său, pediatrul William Nyhan , la Johns Hopkins .
Deficitul de HGPRT determină acumularea de acid uric în toate fluidele corporale. Combinația dintre sinteza crescută și utilizarea scăzută a purinelor duce la niveluri ridicate de producție de acid uric. Acest lucru are ca rezultat atât niveluri ridicate de acid uric în sânge, cât și în urină , asociate cu gută severă și probleme renale. Semnele neurologice includ un control muscular slab și dizabilitate intelectuală moderată . Aceste complicații apar de obicei în primul an de viață. Începând cu al doilea an de viață, o caracteristică deosebit de izbitoare a LNS este comportamentele de auto-mutilare , caracterizate prin mușcătura buzelor și a degetelor. Simptomele neurologice includ grimase faciale, zvârcoliri involuntare și mișcări repetitive ale brațelor și picioarelor similare cu cele observate în boala Huntington . Cauza anomaliilor neurologice ramane necunoscut. Deoarece lipsa HGPRT face ca organismul să utilizeze prost vitamina B 12 , unii bărbați pot dezvolta anemie megaloblastică .
LNS este moștenit într-un mod recesiv legat de X ; mutația genică este de obicei purtată de mamă și transmisă fiului ei, deși o treime din toate cazurile apar de novo (din mutații noi) și nu au antecedente familiale. LNS este prezent la naștere la băieți. Majoritatea, dar nu toate, persoanele cu această deficiență au probleme mentale și fizice severe pe tot parcursul vieții. Cazurile la femei sunt foarte rare.
Simptomele cauzate de acumularea de acid uric ( simptome de gută și rinichi ) răspund bine la tratamentul cu medicamente precum alopurinol care reduc nivelurile de acid uric din sânge. Deficitul mental și comportamentul de auto-mutilare nu răspund bine tratamentului. Nu există leac, dar mulți oameni afectați trăiesc până la maturitate. Mai multe tratamente experimentale noi pot atenua simptomele.
semne si simptome
LNS se caracterizează prin trei semnale principale: disfuncție neurologică , tulburări cognitive și comportamentale , inclusiv auto-mutilare și supraproducție de acid uric ( hiperuricemie ). Deteriorarea ganglionilor bazali determină bolnavii să adopte o poziție de garduri caracteristică din cauza naturii leziunii. Unii pot fi, de asemenea, afectați de anemie macrocitară din cauza sintezei deficitare a ADN-ului, cel mai probabil din cauza sintezei deficitare a purinei care duce la un decalaj al diviziunii celulare în ceea ce privește creșterea masei celulare. Practic toți pacienții sunt bărbați; bărbații suferă întârzierea creșterii și a pubertății , iar majoritatea dezvoltă testicule micșorate sau atrofie testiculară . Femeile purtătoare prezintă un risc crescut de artrită gută, dar de obicei nu sunt afectate.
Supraproducerea acidului uric
Unul dintre primele simptome ale bolii este prezența cristalelor de nisip de acid uric în scutecele sugarului afectat. Supraproducția de acid uric poate duce la dezvoltarea de cristale sau pietre de acid uric în rinichi , uretere sau vezică . Astfel de cristale depuse în articulații mai târziu în boală pot produce artrită asemănătoare gutei , cu umflături și sensibilitate. Supraproducția de acid uric este prezentă la naștere, dar nu poate fi recunoscută prin metode de testare clinică de laborator de rutină. Concentrația serică de acid uric este adesea normală, deoarece excesul de purine este eliminat rapid în urină. Cristalele apar, de obicei, ca un material granulat portocaliu sau se pot uni pentru a forma fie pietre mici, fie pietre mari distincte, care sunt greu de trecut. Pietrele sau calculii cauzează de obicei hematurie (sânge în urină) și cresc riscul de infecție a tractului urinar . Unele victime suferă leziuni la rinichi din cauza acestor pietre la rinichi . Pietrele pot fi caracteristica prezentatoare a bolii, dar pot rămâne nedetectate luni sau chiar ani.
Insuficiență a sistemului nervos
Perioadele anterioare și în jurul nașterii sunt de obicei normale la persoanele cu LNS. Cele mai frecvente caracteristici ale prezentării sunt scăderea anormală a tonusului muscular ( hipotonie ) și întârzierea dezvoltării, care sunt evidente la vârsta de trei până la șase luni. Persoanele afectate întârzie să stea în picioare, în timp ce majoritatea nu se târăsc niciodată sau nu merg . Lipsa vorbirii este, de asemenea, o trăsătură foarte comună asociată cu LNS.
Iritabilitatea este observată cel mai adesea împreună cu primele semne de afectare a sistemului nervos. În primii câțiva ani de viață, implicarea extrapiramidală determină contracții musculare involuntare anormale, cum ar fi pierderea controlului motor ( distonie ), mișcări de încordare ( coreoatetoza ) și arcuirea coloanei vertebrale ( opistoton ). De asemenea, apar semne de implicare a sistemului piramidal , inclusiv spasticitate, reflexe hiperactive ( hiperreflexie ) și reflexe plantare extensoare . Asemănarea cu paralizia cerebrală atetoidă este evidentă în aspectele neurologice ale LNS. Drept urmare, majoritatea persoanelor sunt diagnosticate inițial ca având paralizie cerebrală. Dizabilitatea motorie este atât de extinsă încât majoritatea indivizilor nu merg niciodată și devin utilizatori de scaune cu rotile pe tot parcursul vieții.
Comportament de auto-vătămare
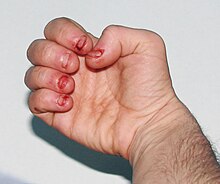
Persoanele afectate sunt afectate cognitiv și au tulburări de comportament care apar între doi și trei ani. Auto-vătămarea incontrolabilă asociată cu LNS începe de obicei la vârsta de trei ani. Autolesionarea începe cu mușcătura buzelor și a limbii; pe măsură ce boala progresează, indivizii afectați dezvoltă frecvent mușcăturile degetelor și capul. Auto-vătămarea poate crește în perioadele de stres. Autovătămarea este o caracteristică distinctivă a bolii și este evidentă la 85% dintre bărbații afectați.
Majoritatea indivizilor sunt afectați cognitiv, ceea ce este uneori dificil de distins de alte simptome din cauza tulburărilor de comportament și a deficitelor motorii asociate sindromului. În multe privințe, comportamentele pot fi văzute ca o extensie psihologică a constrângerii de a provoca auto-vătămare și includ respingerea tratamentelor dorite sau călătoriei, rambursarea bunătății cu răceală sau furie, eșecul în a răspunde corect la întrebările testului în ciuda studiului și a dorinței de a reuși , provocând furie de la îngrijitori atunci când este dorită afecțiunea.
De asemenea, apar comportamente compulsive, inclusiv agresivitate, vărsături , scuipat și coprolalia (înjurături involuntare). Dezvoltarea acestui tip de comportament este uneori văzută în primul an sau în copilăria timpurie, dar alții nu îl pot dezvolta decât mai târziu în viață.
LNS la femei
În timp ce femelele purtătoare sunt, în general, o afecțiune asimptomatică , ele experimentează o creștere a excreției de acid uric, iar unele pot dezvolta simptome de hiperuricemie și suferă de gută în ultimii ani. Testarea în acest context nu are nicio consecință clinică, dar poate dezvălui posibilitatea transmiterii trăsăturii copiilor de sex masculin. De asemenea, femeile pot necesita teste dacă un copil de sex masculin dezvoltă LNS. În acest caz, un test negativ înseamnă că boala fiului este rezultatul unei noi mutații, iar riscul la frați nu este crescut.
Femeile care poartă o copie a genei defecte sunt purtători cu 50% șanse de a transmite boala fiilor lor. Pentru ca o femeie să fie afectată, ar trebui să aibă două copii ale genei mutante, dintre care una ar fi moștenită de la tatăl ei. Bărbații afectați de LNS nu au de obicei copii din cauza efectelor debilitante ale bolii. Este posibil ca o femeie să moștenească un cromozom X de la tatăl său neafectat, care poartă o nouă mutație a genei HGPRT. În aceste condiții, o fată s-ar putea naște cu LNS și, deși există câteva rapoarte despre acest lucru, este foarte rar. Majoritatea covârșitoare a pacienților cu LNS sunt bărbați.
Forme mai puțin severe
O boală mai puțin gravă, asociată, cu deficit parțial de HPRT, este cunoscută sub numele de sindrom Kelley-Seegmiller (sindromul Lesch-Nyhan implică un deficit total de HPRT). Simptomele implică în general mai puțină afectare neurologică, dar boala provoacă în continuare gută și pietre la rinichi.
Genetica

LNS se datorează mutațiilor în HPRT1 genei , numit astfel pentru ca coduri pentru enzima fosforiboziltransferazei hipoxantin-guanină (hprt sau HGPRT, CE 2.4.2.8 ). Această enzimă este implicată în căile biochimice pe care corpul le folosește pentru a produce purine , una dintre componentele ADN și ARN . Defectele acestei enzime duc la creșterea producției de acid uric . Deoarece gena HPRT este localizată pe cromozomul X , LNS este o boală moștenită legată de X.
Tatăl unui bărbat afectat nu va fi purtătorul alelei mutante și nu va avea boala. Un transportator obligat ar fi o femeie care are un fiu afectat și o altă rudă afectată în linia maternă.
Dacă o femeie este prima din familia ei cu un fiu afectat, regula lui Haldane prezice o șansă de 2/3 ca ea să fie purtătoare și o șansă de 1/3 ca fiul să aibă o nouă mutație a liniei germinale .
Riscul pentru frații unei persoane afectate depinde de statutul de purtător al mamei. O șansă de 50% este acordată oricărei femei care este purtătoare să transmită mutația HPRT1 în fiecare sarcină . Fiii care moștenesc mutația vor fi afectați, în timp ce fiicele care moștenesc mutația sunt purtători. Prin urmare, la fiecare sarcină, o femeie purtătoare are o șansă de 25% să aibă un bărbat afectat, o șansă de 25% să aibă o femeie care este purtătoare și o șansă de 50% să aibă un bărbat sau o femeie normală.
Bărbații cu LNS nu se reproduc din cauza caracteristicilor bolii. Cu toate acestea, dacă un bărbat cu un fenotip mai puțin sever se reproduce, toate fiicele sale sunt purtătoare și niciunul dintre fiii săi nu va fi afectat.
Fiziopatologie
Ca și în alte boli legate de X , bărbații sunt afectați, deoarece au doar o copie a cromozomului X. În sindromul Lesch-Nyhan, gena defectă este cea pentru hipoxantină-guanină fosforibosiltransferază (HPRT), un participant la „reciclarea” nucleotidelor purinice . Femeile purtătoare au un al doilea cromozom X, care conține o copie „normală” a HPRT, împiedicând dezvoltarea bolii, deși ar putea avea un risc crescut de hiperuricemie.
Se cunoaște un număr mare de mutații ale HPRT. Mutațiile care scad ușor doar funcția enzimei nu cauzează în mod normal forma severă a LNS, dar produc o formă mai ușoară a bolii care prezintă în continuare supraproducție de purină însoțită de susceptibilitate la gută și la nefrolitiaza acidului uric .
Formarea ADN-ului (în timpul diviziunii celulare ) necesită nucleotide , molecule care sunt elementele constitutive ale ADN-ului. Bazele purinice ( adenină și guanină ) și bazele pirimidinice ( timină și citozină ) sunt legate de dezoxiriboză și fosfat și sunt încorporate după cum este necesar. În mod normal, nucleotidele sunt sintetizate de novo din aminoacizi și alți precursori. O mică parte, totuși, este „reciclată” din ADN-ul degradat al celulelor descompuse. Aceasta este denumită „calea salvării”.
HGPRT este „enzima de salvare” pentru purine: canalizează hipoxantina și guanina înapoi în sinteza ADN-ului. Eșecul acestei enzime are două rezultate:
- Produsele de descompunere a celulelor nu pot fi reutilizate și, prin urmare, sunt degradate. Acest lucru duce la creșterea acidului uric , un produs de descompunere a purinelor.
- Calea de novo este stimulată datorită unui exces de PRPP (5-fosfo-D-ribozil-1-pirofosfat sau pur și simplu fosforibosil-pirofosfat).
Anterior, nu era clar dacă anomaliile neurologice din LNS erau cauzate de neurotoxicitatea acidului uric sau de o lipsă relativă în nucleotidele purine „noi” în timpul etapelor esențiale de sinteză. Mutațiile genetice care afectează enzimele căii de sinteză de novo pot contribui la boală, deși acestea sunt rare sau necunoscute. Acidul uric a fost sugerat ca o posibilă cauză de neurotoxicitate, dar acest lucru nu este dovedit.
Foarte important, dovezile sugerează că una sau mai multe leziuni în căile dopaminergice striatale pot fi esențiale pentru deficitele neurologice, în special dischinezia coreoatetoidă și auto-mutilarea. Toxicitatea 6-hidroxidopaminei la rozătoare poate fi un model animal util pentru sindrom, deși acest lucru nu este dovedit. Cu toate acestea, legătura dintre sinteza dopaminei și purinelor este o nucleotidă numită guanozin trifosfat sau „GTP”. Primul pas al sintezei dopaminei este ciclohidrolaza GTP și semnificativ o deficiență a acestei etape produce un sindrom care are o neuropatologie similară cu LNS. Astfel, lipsa HGPRT poate produce o tulburare de deficit de nucleotide (în special: deficit de GTP), rezultând deficit de dopamină.
Un alt model animal pentru LNS a fost propus să apară din deteriorarea oxidativă, cauzată de hiperuricemia care însoțește LNS. Aceasta se bazează pe teoria conform căreia acidul uric este un puternic agent de reducere și probabil un important antioxidant uman , în concentrație mare în sânge. Astfel, s-a sugerat că radicalii liberi , stresul oxidativ și speciile reactive de oxigen pot juca un rol în neuropatologia LNS.
Cu toate acestea, unele dovezi sugerează un rol al acidului uric în neuropatologia sindromului Lesch-Nyhan:
- Hiperuricemia asociată cu guta primară clasică , care este cauzată de clearance-ul renal scăzut al acidului uric, mai degrabă decât de supraproducția acidului uric, nu este asociată cu neuropatologia.
- Hipuricemia apare într-o serie de tulburări purinice, în special xantinuria . În ciuda absenței complete a acidului uric din sânge, pacienții cu xantinurie nu au nicio neuropatologie și nici alte stări de boală - altele decât pietrele la rinichi cauzate de acumularea de xantină insolubilă în locul acidului uric.
În mod similar, acidul uric nu pătrunde bine în bariera hematoencefalică. Cu toate acestea, se crede că stresul oxidativ datorat acidului uric apare acum în sindromul metabolic , ateroscleroza și accidentul vascular cerebral , toate sindroamele asociate cu niveluri ridicate de acid uric. În mod similar, Superoxid dismutaza ("SOD") și SOD-mimetice, cum ar fi TEMPOL, ameliorează efectele hiperuricemiei. La fel, 6-hidroxidopamina (modelul animal supus pentru neuropatia Lesch – Nyhan) acționează aparent ca o neurotoxină prin generarea de specii reactive de oxigen. Este posibil ca stresul oxidativ indus de alte oxipurine, cum ar fi xantina, să provoace boala.
Diagnostic
Atunci când o persoană afectată a dezvoltat pe deplin cele trei elemente clinice ale supraproducției acidului uric, disfuncției neurologice și tulburărilor cognitive și comportamentale, diagnosticul LNS se face cu ușurință. Diagnosticul este mai puțin ușor în primele etape, când cele trei caracteristici nu sunt încă evidente. Semnele comportamentului auto-vătămător (SIB), rezultatele analizei genealogice și ale biologiei moleculare noi cu teste genetice (denumite triade de diagnostic pentru LNS), confirmă adesea diagnosticul. Suspiciunea apare adesea atunci când întârzierea de dezvoltare a individului este asociată cu hiperuricemie. În caz contrar, diagnosticul ar trebui susținut atunci când întârzierea dezvoltării este asociată cu pietre la rinichi ( nefrolitiază ) sau sânge în urină ( hematurie ), cauzate de calculi cu acid uric. În cea mai mare parte, sindromul Lesch-Nyhan este suspectat pentru prima dată când se dezvoltă un comportament auto-provocat. Cu toate acestea, comportamentele autodistructiv apar în alte condiții, inclusiv nespecifice dizabilitatea intelectuală , autismul , sindromul Rett , sindromul Cornelia de Lange , sindromul Tourette , disautonomia familială , choreoacanthocytosis , neuropatie senzorială inclusiv ereditară de tip neuropatie senzorială 1, și mai multe afectiuni psihice. Dintre acestea, numai persoanele cu sindrom Lesch-Nyhan, sindrom de Lange și disautonomie familială prezintă recurent pierderea de țesut ca o consecință. Mușcarea degetelor și a buzelor este o caracteristică definitivă a sindromului Lesch-Nyhan; în alte sindroame asociate cu auto-vătămarea, comportamentele constau de obicei în lovitură a capului și auto-mutilare nespecifică, dar nu mușcături ale obrajilor, buzelor și degetelor. Sindromul Lesch-Nyhan ar trebui să fie clar luat în considerare numai atunci când un comportament auto-vătămător are loc împreună cu hiperuricemia și disfuncția neurologică.
Abordarea diagnosticului
Raportul de concentrație a uratului la creatinină (produs de descompunere a fosfatului de creatină în mușchi) este crescut în urină. Acesta este un bun indicator al supraproducției acide. Pentru copiii cu vârsta sub zece ani cu LNS, se găsește de obicei un raport de urat la creatinină peste doi. Excreția de urat de 24 de ore de peste 20 mg / kg este, de asemenea, tipică, dar nu este diagnosticată . Hiperuricemia (concentrația serică de acid uric> 8 mg / dL) este adesea prezentă, dar nu este suficient de fiabilă pentru diagnostic. Activitatea enzimei HGPRT în celule din orice tip de țesut (de exemplu, sânge , fibroblaste cultivate sau limfoblaste ) care este mai mică de 1,5% din activitatea enzimatică normală confirmă diagnosticul sindromului Lesch-Nyhan. Studiile genetice moleculare ale mutațiilor genei HPRT pot confirma diagnosticul și sunt deosebit de utile pentru „testarea purtătoare” ulterioară la femeile cu risc, cum ar fi rudele apropiate ale familiei, pe partea feminină.
Testarea
Utilizarea testării biochimice pentru detectarea purtătorilor este tehnic solicitantă și nu este adesea utilizată. Analizele biochimice care au fost efectuate pe bulbii de păr de la femeile cu risc au avut un număr mic de rezultate atât pozitive, cât și fals negative. Dacă doar o femeie purtătoare suspectată este disponibilă pentru testarea mutației, ar putea fi adecvat să-i crească limfocitele în 6-tioguanină (un analog de purină ), ceea ce permite supraviețuirea numai a celulelor cu deficit de HGPRT. O frecvență mutantă de 0,5-5,0 × 10 −2 se găsește la femelele purtătoare, în timp ce o femeie care nu este purtătoare are o frecvență de 1-20 × 10 −6 . Această frecvență este de obicei diagnosticată de la sine.
Testarea genetică moleculară este cea mai eficientă metodă de testare, deoarece HPRT1 este singura genă despre care se știe că este asociată cu LNS. Persoanele care prezintă fenotipul Lesch-Nyhan complet au toate mutații în gena HPRT1. Analiza secvenței ARNm este disponibilă clinic și poate fi utilizată pentru a detecta mutațiile HPRT1 la bărbații afectați de sindrom Lesch-Nyhan. Tehnici precum RT-PCR, multiplex genomic PCR și analiza secvenței (ADNc și ADN genomic), utilizate pentru diagnosticul bolilor genetice, sunt efectuate pe bază de cercetare. Dacă testele RT-PCR au ca rezultat ADNc care arată absența unui exon sau exoni întregi , atunci se efectuează testarea multiplexă a PCR genomică. Testarea PCR genomică multiplexă amplifică cei nouă exoni ai genei HPRT1 ca opt produse PCR. Dacă exonul în cauză este șters, banda corespunzătoare va lipsi din PCR multiplex. Cu toate acestea, dacă exonul este prezent, exonul este secvențiat pentru a identifica mutația, provocând astfel excluderea exonului din ADNc. Dacă nu se creează ADNc prin RT-PCR, atunci PCR multiplex se efectuează pe noțiunea că cea mai mare parte a genei sau toate sunt obliterate.
Tratament
Tratamentul pentru LNS este simptomatic. Guta poate fi tratată cu alopurinol pentru a controla cantități excesive de acid uric . Pietrele la rinichi pot fi tratate cu litotriție , o tehnică de rupere a pietrelor la rinichi folosind unde de șoc sau raze laser. Nu există un tratament standard pentru simptomele neurologice ale LNS. Unii pot fi ameliorați cu medicamentele carbidopa / levodopa , diazepam , fenobarbital sau haloperidol .
Este esențial ca supraproducția de acid uric să fie controlată pentru a reduce riscul de nefropatie , nefrolitiază și artrită gută. Medicamentul alopurinol este utilizat pentru a opri conversia oxipurinelor în acid uric și pentru a preveni dezvoltarea ulterioară a tofilor artritici (produși după apariția gutei cronice), a pietrelor la rinichi și a nefropatiei , boala renală rezultată. Alopurinolul se administrează pe cale orală, la o doză tipică de 3-20 mg / kg pe zi. Doza este apoi ajustată pentru a reduce nivelul acidului uric în intervalul normal (<3 mg / dL). Majoritatea persoanelor afectate pot fi tratate cu alopurinol pe tot parcursul vieții.
Nici un medicament nu este eficient în controlul caracteristicilor motorii extrapiramidale ale bolii. Cu toate acestea, spasticitatea poate fi redusă prin administrarea de baclofen sau benzodiazepine .
Nu a existat anterior o metodă eficientă de tratament pentru aspectele neurocomportamentale ale bolii. Chiar și copiii tratați de la naștere cu alopurinol dezvoltă probleme de comportament și neurologice, deși nu au avut niciodată concentrații serice ridicate de acid uric. Comportamentele auto-vătămătoare și alte comportamente sunt cel mai bine gestionate printr-o combinație de intervenții medicale, fizice și comportamentale. Auto-mutilarea este adesea redusă prin utilizarea de restricții. Șaizeci la sută dintre indivizi au dinții extrasați pentru a evita auto-vătămarea, ceea ce familiile au considerat a fi o tehnică eficientă de gestionare. Deoarece stresul crește auto-vătămarea, managementul comportamentului prin tehnici aversive (care în mod normal ar reduce auto-vătămarea) crește de fapt auto-vătămarea la persoanele cu LNS. Aproape toate persoanele afectate au nevoie de restricții pentru a preveni autovătămarea și sunt reținute mai mult de 75% din timp. Acest lucru este adesea la cererea lor și implică ocazional restricții care par a fi ineficiente, deoarece nu împiedică fizic mușcătura. Familiile declară că persoanele afectate se simt mai în largul lor atunci când sunt reținute.
Centrul Medical și Educațional Matheny [2] din Peapack, NJ, are șase pacienți cu sindrom Lesch – Nyhan, considerat a fi cea mai mare concentrație de cazuri de LNS într-o singură locație și este recunoscut ca fiind sursa principală de informații cu privire la problemele de îngrijire.
Tratamentul pentru pacienții cu LNS, potrivit Gary E. Eddey, MD, director medical, ar trebui să includă: 1) utilizarea judicioasă a dispozitivelor de protecție; 2) Utilizarea unei tehnici comportamentale denumită în mod obișnuit „ignorare selectivă” cu redirecționarea activităților; și 3) Utilizarea ocazională a medicamentelor.
Un articol din numărul din 13 august 2007 al revistei The New Yorker , scris de Richard Preston , discută despre „ stimularea creierului profund ” ca un posibil tratament. Acesta a fost efectuat pe câțiva pacienți cu sindrom Lesch-Nyhan de către Dr. Takaomi Taira din Tokyo și de un grup din Franța condus de Dr. Philippe Coubes. Unii pacienți au prezentat o scădere a simptomelor spastice auto-vătămătoare. Tehnica a fost dezvoltată pentru tratarea persoanelor cu boala Parkinson , potrivit Preston, în urmă cu peste 20 de ani. Tratamentul implică o intervenție chirurgicală invazivă pentru a plasa fire care transportă un curent electric continuu într-o anumită regiune a creierului.
Un progres încurajator în tratamentul aspectelor neurobehaviourale ale LNS a fost publicarea în numărul din octombrie 2006 al Journal of Inherited Metabolic Disease al unei terapii experimentale care dă S-adenosil-metionină orală (SAMe). Acest medicament este un precursor de nucleotide care oferă o purină ușor absorbită, despre care se știe că este transportată peste bariera hematoencefalică . Administrarea SAMe la pacienții adulți cu LNS s-a dovedit a oferi îmbunătățiri ale caracteristicilor neurocomportamentale și ale altor caracteristici neurologice. Medicamentul este disponibil fără prescripție medicală și a fost utilizat pe scară largă pentru depresie , dar utilizarea acestuia pentru tratarea LNS ar trebui să fie întreprinsă numai sub supraveghere medicală strictă, deoarece sunt cunoscute efectele secundare.
Prognoză
Prognosticul pentru persoanele cu LNS sever este slab. Moartea se datorează de obicei insuficienței renale sau complicațiilor de la hipotonie, în primul sau al doilea deceniu de viață. Formele mai puțin severe au prognoze mai bune.
Istorie
Michael Lesch era student la medicină la Johns Hopkins și William Nyhan , medic pediatru și genetician biochimic, a fost mentorul său atunci când cei doi au identificat LNS și hiperuricemia asociată la doi frați afectați, cu vârste cuprinse între 4 și 8 ani. Lesch și Nyhan și-au publicat concluziile în 1964. În termen de trei ani, cauza metabolică a fost identificată de J. Edwin Seegmiller și colegii săi de la NIH .
Referințe
linkuri externe
- Sindromul Lesch-Nyhan la Biroul NIH pentru Boli Rare
- Intrare GeneReview / NIH / UW pe sindromul Lesch-Nyhan
- Institutul Național pentru Sănătatea Copilului și Dezvoltarea Umană (NICHD)
| Clasificare | |
|---|---|
| Resurse externe |

