Insuficiență cardiacă cu fracție de ejecție conservată - Heart failure with preserved ejection fraction
| Disfuncție diastolică | |
|---|---|
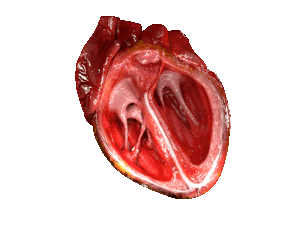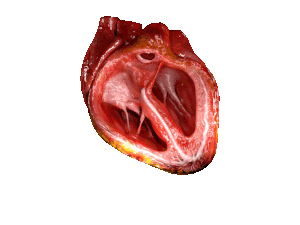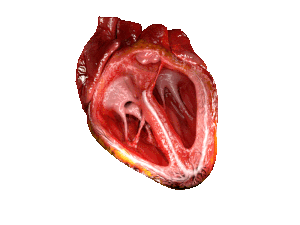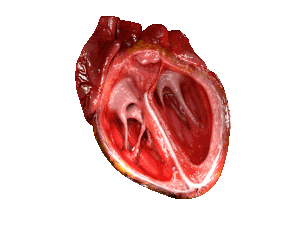 | |
| La cei cu HFpEF, ventriculul stâng al inimii (camera mare din partea dreaptă a imaginii) este rigidizat și are o relaxare afectată după pomparea 🩸 sângelui din inimă. | |
| Specialitate | Cardiologie |
Insuficiența cardiacă cu fracția de ejecție conservată ( HFpEF ) este o formă de insuficiență cardiacă în care fracția de ejecție - procentul din volumul de sânge evacuat din ventriculul stâng cu fiecare bătăi de inimă împărțit la volumul de sânge atunci când ventriculul stâng este umplut maxim - este normal, definit ca mai mare de 50%; aceasta poate fi măsurată prin ecocardiografie sau cateterism cardiac . Aproximativ jumătate dintre persoanele cu insuficiență cardiacă au conservat fracția de ejecție, în timp ce cealaltă jumătate au o reducere a fracției de ejecție, numită insuficiență cardiacă cu fracție de ejecție redusă (HFrEF).
Factorii de risc pentru HFpEF includ hipertensiunea , hiperlipidemia , diabetul , fumatul și apneea obstructivă în somn .
HFpEF se caracterizează prin funcție diastolică anormală : există o creștere a rigidității ventriculului stâng , ceea ce determină o scădere a relaxării ventriculare stângi în timpul diastolei, cu presiunea crescută și / sau umplerea afectată. Există un risc crescut de fibrilație atrială și hipertensiune pulmonară .
Există controverse cu privire la relația dintre insuficiența cardiacă diastolică și HFpEF.
semne si simptome
Manifestările clinice ale HFpEF sunt similare cu cele observate în HFrEF și includ dificultăți de respirație, inclusiv dispnee indusă de efort , dispnee și ortopnee nocturne paroxistice , intoleranță la efort, oboseală, presiune venoasă jugulară crescută și edem .
Pacienții cu HFpEF tolerează prost stresul, în special modificările hemodinamice ale încărcării ventriculare sau presiunile diastolice crescute. Adesea, există o creștere mai dramatică a tensiunii arteriale sistolice în HFpEF decât este tipic pentru HFrEF.
Factori de risc
Diverse mecanisme contribuie la dezvoltarea HFpEF, dintre care multe sunt subinvestigate și rămân obscure. În ciuda acestui fapt, există factori de risc clari care contribuie la dezvoltarea HFpEF.
Hipertensiunea , obezitatea , sindromul metabolic și sedentarismul au fost identificate ca fiind factori de risc importanți pentru diverse tipuri de boli de inimă, inclusiv HFpEF. Există dovezi mecaniciste și epidemiologice pentru o legătură între rezistența la insulină și HFpEF.
Această stare pro-inflamatorie poate induce, de asemenea, modificări ale endoteliului vascular al inimii. Mai exact, prin reducerea disponibilității de oxid nitric , un important vasodilatator și regulator al protein kinazei G activitate. Pe măsură ce activitatea protein kinazei G se diminuează, cardiomiocitele suferă modificări hipertrofice. Celulele endoteliale sunt, de asemenea, responsabile pentru producerea de E-selectină , care recrutează limfocite în țesutul de sub endoteliu care eliberează ulterior factorul de creștere beta transformant , încurajând fibroza și astfel rigidizarea ventriculară. Se crede că macrofagele cardiace joacă un rol important în dezvoltarea fibrozei, deoarece acestea sunt crescute în HFpEF și eliberează citokine pro-fibrotice , cum ar fi IL-10. Este necesară o investigație suplimentară a rolului inflamației în HFpEF.
Hipertensiune
Condițiile, cum ar fi hipertensiunea, care încurajează creșterea postîncărcării ventriculare stângi pot duce la modificări structurale ale inimii la nivel brut , precum și la nivel microscopic. Se crede că presiunea crescută, în concordanță cu o stare pro-inflamatorie (rezistență la insulină, obezitate), încurajează rigidizarea și remodelarea ventriculară care duc la un debit cardiac slab observat în HFpEF. Modificările sunt rezultatul hipertrofiei mușchiului ventricular stâng cauzată de presiunea ridicată, ceea ce duce la rigidizarea ventriculului stâng.
Ischemie
Ischemia sau oxigenarea inadecvată a miocardului este observată la o proporție ridicată de pacienți cu HFpEF. Această ischemie poate fi secundară bolii coronariene sau poate fi rezultatul modificărilor descrise anterior ale microvasculaturii . Ischemia poate duce la afectarea relaxării inimii; atunci când miocitele nu reușesc să se relaxeze în mod corespunzător, punțile încrucișate ale miozinei rămân intacte și generează tensiune pe toată diastola și astfel cresc stresul asupra inimii. Aceasta se numește sistolă parțială persistentă . Ischemia se poate manifesta în moduri distincte, fie ca urmare a creșterii cererii de oxigen tisular, fie a capacității diminuate a inimii de a furniza oxigen țesutului. Primul este rezultatul stresului, cum ar fi exercițiile fizice, în timp ce cel din urmă este rezultatul reducerii fluxului coronarian .
Îmbătrânire
Senescența cardiacă sau deteriorarea celulară care apare ca parte a îmbătrânirii normale, seamănă foarte mult cu manifestările HFpEF. Mai exact, pierderea rezervei cardiace , diminuarea complianței vasculare și disfuncția diastolică sunt caracteristice ambelor procese. S-a sugerat că HFpEF reprezintă doar o accelerare a unui proces normal de îmbătrânire.
Amiloidoza sistemică senilă , rezultată din acumularea de transtiretină de tip sălbatic agregat ca parte a procesului de îmbătrânire degenerativă , apare ca un factor important și subdiagnosticat la HFpEF odată cu vârsta.
Alte
Orice afecțiune sau proces care duce la rigidizarea ventriculului stâng poate duce la disfuncții diastolice. Alte cauze ale rigidizării ventriculului stâng includ:
- Stenoza aortică de orice cauză în care mușchiul ventricular devine hipertrofiat și de acolo rigid, ca urmare a sarcinii crescute de presiune plasată asupra acestuia de către stenoză.
- Diabet
- Vârstă - pacienți vârstnici, în special dacă au hipertensiune.
Cauzele insuficienței diastolice ventriculare drepte izolate sunt mai puțin frecvente. Aceste cauze includ:
- Pericardită constrictivă
- Cardiomiopatia restrictivă , care include amiloidoza (cea mai frecventă restrictivă), sarcoidoza și fibroza.
Fiziopatologie
Anomalii structurale brute
Modificările structurale care apar cu HFpEF sunt adesea radical diferite de cele asociate cu insuficiența cardiacă cu fracție de ejecție redusă (HFrEF). Mulți pacienți au o îngroșare crescută a peretelui ventricular în comparație cu dimensiunea camerei, denumită hipertrofie concentrică . Acest lucru duce la creșterea masei ventriculare stângi și este însoțit de obicei de un volum de umplere diastolic normal sau ușor redus. În schimb, HFrEF este de obicei asociat cu hipertrofie excentrică , caracterizată printr-o creștere a dimensiunii camerei cardiace fără o creștere însoțitoare a grosimii peretelui. Acest lucru duce la o creștere corespunzătoare a volumului diastolic al capătului ventriculului stâng.
Anomalii celulare
Modificările celulare stau la baza modificărilor structurii cardiace. În HFpEF s-a demonstrat că cardiomiocitele prezintă un diametru crescut fără o creștere a lungimii; acest lucru este în concordanță cu hipertrofia ventriculară concentrică observată și cu creșterea masei ventriculare stângi. Cardiomiocitele HFrEF prezintă morfologia opusă; lungime crescută fără diametru celular crescut. Și acest lucru este în concordanță cu hipertrofia excentrică observată în această afecțiune.
Modificările mediului extracelular sunt de o importanță semnificativă în bolile de inimă. În special, reglarea genelor care modifică fibroza contribuie la dezvoltarea și progresia HFrEF. Această reglare este dinamică și implică modificări ale colagenilor fibrilari prin depunerea crescută, precum și prin inhibarea enzimelor care descompun componentele matricei extracelulare ( metaloproteinazele matricei , colagenazele ). În timp ce HFrEF în stadiu incipient este asociat cu o perturbare semnificativă a proteinelor matricei extracelulare inițial, pe măsură ce progresează poate să apară înlocuirea fibrotică a miocardului , ducând la cicatrizare și la creșterea colagenului interstițial. Modificările fibrotice în HFpEF sunt mai variabile. Deși în mod obișnuit se observă o cantitate crescută de colagen la acești pacienți, de obicei nu diferă dramatic de persoanele sănătoase.
Disfuncție diastolică
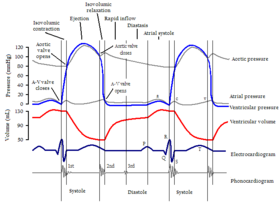
Modificările diastolice ale HFpEF sunt factorul predominant în afectarea funcției cardiace și a prezentării clinice ulterioare. Disfuncția diastolică este multiformă și un anumit pacient poate exprima diverse combinații dintre următoarele: relaxare miocardică incompletă, rata afectată a umplerii ventriculare, creșterea presiunii atriale stângi în umplere, rigiditate pasivă crescută și distensibilitate scăzută a ventriculului, capacitate limitată de a exploata Frank -Mecanism Starling cu solicitări crescute de producție , creștere diastolică a inimii stângi sau presiune venoasă pulmonară.
Eșecul diastolic apare atunci când ventriculul nu poate fi umplut corect, deoarece nu se poate relaxa, deoarece peretele său este gros sau rigid. Această situație prezintă de obicei o hipertrofie concentrică . În schimb, insuficiența cardiacă sistolică are de obicei o hipertrofie excentrică .
Eșecul diastolic se caracterizează printr-o presiune diastolică crescută în ventriculul stâng, în ciuda unui volum diastolic final (EDV) esențial normal / fiziologic. Dovezile histologice care susțin disfuncția diastolică demonstrează hipertrofia ventriculară , depunerea crescută a colagenului interstițial și infiltrarea miocardului. Aceste influențe conduc colectiv la o scădere a distensibilității și elasticității (capacitatea de a se întinde) a miocardului. În consecință, debitul cardiac devine diminuat. Când presiunea diastolică a ventriculului stâng este crescută, presiunea venoasă din plămâni trebuie de asemenea să fie crescută: rigiditatea ventriculară stângă face ca sângele să intre mai greu din atriul stâng. Ca urmare, presiunea crește în atriu și este transmisă înapoi la sistemul venos pulmonar, crescând astfel presiunea sa hidrostatică și promovând edemul pulmonar .
Poate fi greșit să clasificăm inima supraîncărcată de volum ca având disfuncție diastolică dacă se comportă într-un mod rigid și neconform. Termenul de disfuncție diastolică nu trebuie aplicat inimii dilatate. Inimile dilatate („remodelate”) au un volum crescut față de cantitatea de presiune diastolică și, prin urmare, au crescut ( nu au scăzut) distensibilitatea. Termenul de disfuncție diastolică este uneori aplicat în mod eronat în această circumstanță, atunci când retenția crescută a volumului de lichid determină supraîncărcarea inimii ( insuficiență cardiacă de mare producție ).
Deși termenul de insuficiență cardiacă diastolică este adesea folosit atunci când există semne și simptome de insuficiență cardiacă cu funcție sistolică normală a ventriculului stâng, acest lucru nu este întotdeauna adecvat. Funcția diastolică este determinată de volumul diastolic final relativ în raport cu presiunea diastolică finală și, prin urmare, este independentă de funcția sistolică a ventriculului stâng. O schimbare spre stânga a relației presiune-volum diastolică finală (adică scăderea distensibilității ventriculare stângi) poate apărea atât la cei cu funcție sistolică ventriculară stângă scăzută. La fel, insuficiența cardiacă poate apărea la cei cu ventricul stâng dilatat și funcție sistolică normală. Acest lucru se observă adesea în bolile cardiace valvulare și în insuficiența cardiacă cu randament ridicat. Niciuna dintre aceste situații nu constituie o insuficiență cardiacă diastolică.
Rigidizarea ventriculului stâng contribuie la insuficiența cardiacă cu fracția de ejecție conservată, o afecțiune care poate fi prevenită prin exerciții fizice.
În insuficiența cardiacă diastolică, volumul de sânge conținut în ventriculi în timpul diastolei este mai mic decât ar trebui, iar presiunea sângelui în camere este crescută.
Diastolă
În timpul diastolei, presiunea ventriculară scade de la vârful atins la sfârșitul sistolei . Când această presiune scade sub presiunea atrială, se deschid valvele atrio-ventriculare ( valva mitrală în partea stângă și valva tricuspidă în partea dreaptă), iar sângele trece din atrii în ventriculi. În primul rând, ventriculele sunt umplute de un gradient de presiune, dar aproape de final, atria se contractă (lovitură atrială) și forțează mai mult sânge să treacă în ventriculi. Contracția atrială este responsabilă pentru aproximativ 20% din volumul total de sânge de umplere. (În fibrilația atrială, acest volum suplimentar de umplere de 20% se pierde și pacientul poate prezenta simptome de insuficiență cardiacă sistolică). Umplerea completă a ventriculului stâng este esențială pentru a menține debitul cardiac maxim. Umplerea ventriculară stângă este dependentă de relaxare și complianță ventriculară , zona valvei mitrale, gradientul atrio-ventricular, contracția atrială și volumul sistolic final. Diastola are patru faze: relaxare izovolumetrică, umplere rapidă, diastază și contracție atrială. Toate aceste faze pot fi evaluate prin ecocardiografie Doppler .
Disfuncție non-diastolică
Deși HFpEF se caracterizează printr-o fracție de ejecție normală, acest parametru este un indice destul de slab al funcției contractile a inimii. Unele studii au arătat că metricele contractilității independente de sarcină (cum ar fi rigiditatea ventriculară stângă) relevă funcția sistolică diminuată la pacienții cu HFpEF în comparație cu controalele sănătoase și sunt coroborate de constatări Doppler tisulare care relevă modificări ale contracției longitudinale și anomaliilor de mișcare. În timp ce aceste deficiențe sistolice pot fi minime în repaus, ele devin mai exagerate odată cu creșterea cererii, așa cum se vede în exerciții.
Hipertensiune pulmonară și disfuncție ventriculară dreaptă
Majoritatea pacienților cu HFpEF prezintă hipertensiune pulmonară care este semnificativ asociată cu creșterea morbidității și mortalității. Presiunea venoasă atrială și pulmonară crește în HFpEF datorită insuficienței diastolice crescând astfel presiunea arterială pulmonară. La pacienții cu HFpEF avansat se pot dezvolta modificări ale vasculaturii pulmonare, ceea ce duce la hipertensiune pulmonară pre-capilară. Disfuncția ventriculară dreaptă este, de asemenea, frecventă la pacienții cu HFpEF, care apare la 20-35% dintre pacienți. Această disfuncție ventriculară dreaptă este mai frecventă la pacienții cu HFpEF mai avansat, precum și la cei cu hipertensiune pulmonară și fracțiuni de ejecție mai mici.
Ritm cardiac
Debitul cardiac depinde de volumul accidentului vascular cerebral și de ritmul cardiac . O parte semnificativă (55-77%) din pacienții cu HFpEF nu sunt în măsură să mărească ritmul cardiac pentru a compensa creșterea cererii de ieșire (ca în cazul exercițiului); aceasta se numește incompetență cronotropă . Combinat cu deficitul caracteristic al volumului de accident vascular cerebral observat la pacienții cu HFpEF, mulți indivizi prezintă o toleranță slabă la efort.
Disincronie
Contracția non-simultană a ventriculului stâng și drept, disicronie , este prezentă la până la 58% dintre pacienții cu HFpEF. Cu toate acestea, disincronia este de asemenea frecventă în HFrEF și rolul său în HFpEF rămâne în special obscur. În timp ce terapiile pentru disincronie, cum ar fi stimularea biventriculară, oferă beneficii pacienților cu HFrEF, niciun beneficiu nu este apreciat la pacienții cu HFpEF în acest moment.
Anomalii sistemice
Pacienții cu HFpEF, pe lângă anomalii cardiace, prezintă modificări ale metabolismului muscular scheletic și ale distribuției și caracterului grăsimilor. Importanța acestor schimbări este demonstrată prin faptul că pacienții stabili, nedecompensați, par să beneficieze de exerciții; specific VO2 max crescut și toleranță la efort. Cu toate acestea, acest beneficiu pare a fi derivat din modificări ale mușchilor și vasculaturii, spre deosebire de direct pe inimă, care prezintă o schimbare minimă a producției după antrenamentul exercițiilor fizice.
Diagnostic
HFpEF este de obicei diagnosticat cu ecocardiografie . Tehnici precum cateterizarea sunt proceduri invazive și, prin urmare, rezervate pacienților cu afecțiuni comorbide sau celor despre care se suspectează că au HFpEF, dar care nu au descoperiri clare neinvazive. Cateterizarea reprezintă o evaluare diagnostică mai definitivă, deoarece măsurătorile de presiune și volum sunt luate simultan și direct. În ambele tehnici, inima este evaluată pentru funcția diastolică a ventriculului stâng. Parametrii importanți includ, rata de relaxare izovolumică , rata de umplere ventriculară și rigiditatea.
Frecvent, pacienții sunt supuși ecocardiografiei de stres, ceea ce implică evaluarea mai sus a funcției diastolice în timpul exercițiului. Acest lucru este întreprins deoarece perturbările din diastolă sunt exagerate în timpul cerințelor crescute de exercițiu. Exercițiul necesită umplere ventriculară stângă crescută și ieșire ulterioară. De obicei, inima răspunde prin creșterea ritmului cardiac și a timpului de relaxare. Cu toate acestea, la pacienții cu HFpEF ambele răspunsuri sunt diminuate din cauza rigidității ventriculare crescute. Testarea în această stare solicitantă poate dezvălui anomalii care nu sunt atât de discernibile în repaus.
Disfuncția diastolică trebuie diferențiată de insuficiența cardiacă diastolică. Disfuncția diastolică poate fi găsită la pacienții vârstnici și aparent destul de sănătoși. Dacă disfuncția diastolică descrie o proprietate mecanică anormală, insuficiența cardiacă diastolică descrie un sindrom clinic. Matematica care descrie relația dintre raportul dintre sistolă și diastolă în termeni acceptați de volumul sistolic final la volumul diastolic final implică multe soluții matematice pentru insuficiența cardiacă înainte și înapoi.
Criteriile pentru diagnosticarea disfuncției diastolice sau a insuficienței cardiace diastolice rămân imprecise. Acest lucru a făcut dificilă efectuarea de studii clinice valide ale tratamentelor pentru insuficiența cardiacă diastolică. Problema este agravată de faptul că insuficiența cardiacă sistolică și diastolică coexistă de obicei atunci când pacienții prezintă multe etiologii ischemice și nonischemice ale insuficienței cardiace. Strâns definit, insuficiența diastolică a fost adesea definită ca „insuficiență cardiacă cu funcție sistolică normală” (adică o fracție de ejecție a ventriculului stâng de 60% sau mai mult). Boala cardiacă chagasică poate reprezenta un model academic optim de insuficiență cardiacă diastolică care economisește funcția sistolică.
Se spune că un pacient are disfuncție diastolică dacă are semne și simptome de insuficiență cardiacă, dar fracția de ejecție a ventriculului stâng este normală. O a doua abordare este de a utiliza un nivel crescut de BNP în prezența unei fracțiuni normale de ejecție pentru a diagnostica insuficiența cardiacă diastolică. Concordanța măsurătorilor volumetrice și biochimice și a markerilor conferă o terminologie și mai puternică în ceea ce privește expresia științifică / matematică a insuficienței cardiace diastolice. Ambele sunt probabil o definiție prea largă pentru insuficiența cardiacă diastolică, iar acest grup de pacienți este descris mai precis ca având insuficiență cardiacă cu funcție sistolică normală. Ecocardiografia poate fi utilizată pentru a diagnostica disfuncția diastolică, dar este o modalitate limitată, cu excepția cazului în care este completată de imagistica prin stres . Imagistica MUGA este o încercare matematică anterioară de a distinge sistolica de insuficiența cardiacă diastolică.
Niciun parametru ecocardiografic unic nu poate confirma un diagnostic de insuficiență cardiacă diastolică. Mai mulți parametri ecocardiografici au fost propuși ca fiind suficient de sensibili și specifici, incluzând modele de viteză de intrare mitrală, modele de curgere a venelor pulmonare, inversare E / A, măsurători Doppler tisular și măsurători ecou în modul M (adică dimensiunea atrială stângă). Au fost, de asemenea, dezvoltați algoritmi care combină parametri ecocardiografici multipli pentru a diagnostica insuficiența cardiacă diastolică.
Există patru modele ecocardiografice de bază ale insuficienței cardiace diastolice, care sunt clasificate de la I la IV:
- Cea mai ușoară formă se numește „model anormal de relaxare” sau disfuncție diastolică de gradul I. Pe mitral ecocardiografie Doppler aflux, există inversare a normale raportul E / A . Acest model se poate dezvolta în mod normal odată cu vârsta la unii pacienți, iar mulți pacienți de gradul I nu vor avea semne clinice sau simptome de insuficiență cardiacă.
- Disfuncția diastolică de gradul II se numește „dinamică de umplere pseudonormală”. Aceasta este considerată disfuncție diastolică moderată și este asociată cu presiuni crescute de umplere a atrialului stâng. Acești pacienți au mai frecvent simptome de insuficiență cardiacă și mulți au mărit atrialul stâng din cauza presiunilor crescute în inima stângă.
Disfuncția diastolică de gradul III și IV se numește „dinamică de umplere restrictivă”. Acestea sunt ambele forme severe de disfuncție diastolică, iar pacienții tind să prezinte simptome avansate ale insuficienței cardiace:
- Pacienții cu disfuncție diastolică de clasa III vor demonstra inversarea anomaliilor lor diastolice pe ecocardiogramă atunci când efectuează manevra Valsalva. Aceasta este denumită „disfuncție diastolică restrictivă reversibilă”.
- Pacienții cu disfuncție diastolică de clasa IV nu vor demonstra reversibilitatea anomaliilor ecocardiogramei și, prin urmare, se spune că suferă de „disfuncție diastolică restrictivă fixă”.
Prezența oricărei disfuncții diastolice de clasa III și IV este asociată cu un prognostic semnificativ mai rău. Acești pacienți vor avea mărire atrială stângă și mulți vor avea o fracție redusă de ejecție a ventriculului stâng, care indică o combinație de disfuncții sistolice și diastolice.
Definiția volumetrică imagistică a performanței cardiace sistolice este de obicei acceptată ca fracție de ejecție . Definiția volumetrică a inimii în sistolă a fost descrisă pentru prima dată de Adolph Fick ca debit cardiac . Fick poate fi ușor și ieftin inversat la debitul cardiac și fracția de ejecție pentru a descrie matematic diastola . Declinul fracției de ejecție asociat cu declinul raportului E / A pare un argument mai puternic în sprijinul unei definiții matematice a insuficienței cardiace diastolice.
Un alt parametru pentru evaluarea funcției diastolice este Raportul E / E ' , care este raportul dintre viteza de vârf mitrală a umplerii timpurii (E) și viteza anulară mitrală diastolică timpurie (E'). Disfuncția diastolică este presupusă atunci când raportul E / E 'depășește 15.
Tehnici ecocardiografice mai noi, cum ar fi urmărirea speckle pentru măsurarea tulpinii, în special pentru atriul stâng, sunt din ce în ce mai utilizate pentru diagnosticarea HFpEF.
Tratament
În pofida creșterii incidenței HFpEF, incursiunile eficiente în terapeutică au fost în mare parte nereușite. În prezent, recomandările pentru tratament se adresează ameliorării simptomelor și afecțiunilor comorbide. În mod frecvent, aceasta implică administrarea de diuretice pentru ameliorarea complicațiilor asociate cu supraîncărcarea volumului, cum ar fi umflarea picioarelor și hipertensiunea arterială.
Condițiile întâlnite în mod obișnuit care trebuie tratate și care au recomandări independente pentru standardul de îngrijire includ fibrilația atrială , boala coronariană, hipertensiunea și hiperlipidemia. Există factori particulari unici pentru HFpEF care trebuie luați în considerare în cadrul terapiei. Din păcate, studiile clinice randomizate disponibile în prezent care abordează aventura terapeutică pentru aceste afecțiuni în HFpEF prezintă dovezi contradictorii sau limitate.
Aspectele specifice terapeutice trebuie evitate în HFpEF pentru a preveni deteriorarea stării. Considerațiile generalizabile pentru insuficiența cardiacă includ evitarea ritmului cardiac rapid, creșterea tensiunii arteriale, dezvoltarea ischemiei și fibrilația atrială. Mai specific HFpEF include evitarea reducerii preîncărcării . Deoarece pacienții prezintă o fracțiune de ejecție normală, dar debitul cardiac redus, aceștia sunt deosebit de sensibili la modificările de preîncărcare și pot prezenta rapid semne de eșec al ieșirii. Aceasta înseamnă că administrarea de diuretice și vasodilatatoare trebuie monitorizată cu atenție.
HFrEF și HFpEF reprezintă entități distincte în ceea ce privește dezvoltarea și managementul terapeutic eficient. În mod specific, resincronizarea cardiacă, administrarea de beta-blocante și inhibitori ai enzimei de conversie a angiotensinei sunt aplicate cu un efect bun în HFrEF, dar sunt în mare măsură ineficiente la reducerea morbidității și mortalității în HFpEF. Multe dintre aceste terapii sunt eficiente în reducerea gradului de dilatație cardiacă și în creșterea fracțiunii de ejecție la pacienții cu HFrEF. Nu este surprinzător faptul că aceștia nu reușesc să îmbunătățească la pacienții cu HFpEF, având în vedere fenotipul lor nedilatat și fracția relativă de ejecție normală. Înțelegerea și mecanismele de direcționare unice pentru HFpEF sunt, prin urmare, esențiale pentru dezvoltarea terapiei.
Studiile randomizate efectuate pe pacienți cu HFpEF au arătat că exercițiile fizice îmbunătățesc funcția diastolică a ventriculului stâng , capacitatea inimii de a se relaxa și este asociată cu o capacitate de exercițiu aerobă îmbunătățită . Beneficiile pe care pacienții le derivă din exerciții fizice nu par a fi un efect cardiac direct, ci mai degrabă se datorează modificărilor vasculaturii periferice și ale mușchilor scheletici, care prezintă anomalii la pacienții cu HFpEF.
Pacienții trebuie evaluați în mod regulat pentru a determina progresia stării, răspunsul la intervenții și necesitatea modificării terapiei. Abilitatea de a efectua sarcini zilnice, starea hemodinamică, funcția renală, echilibrul electrolitic și nivelurile serice de peptide natriuretice sunt parametri importanți. Managementul comportamental este important la acești pacienți și se recomandă ca persoanele cu HFpEF să evite alcoolul, fumatul și aportul ridicat de sodiu.
Terapia farmacologică
Indicații
Tratamentul HFpEF depinde în primul rând de tratamentul simptomelor și de condițiile exacerbante. Rolul tratamentelor specifice pentru disfuncția diastolică în sine este încă neclar.
Beneficiu
În prezent, tratamentul cu inhibitori ai ECA, blocanți ai canalelor de calciu, beta-blocanți și blocanți ai receptorilor de angiotensină sunt folosiți, dar nu au un beneficiu dovedit la pacienții cu HFpEF. În plus, utilizarea diureticelor sau a altor terapii care pot modifica condițiile de încărcare sau tensiunea arterială trebuie utilizată cu precauție. Nu se recomandă ca pacienții să fie tratați cu inhibitori de fosfodiesterază-5 sau digoxină .
Agenți
Antagoniști ai receptorilor mineralocorticoizi
În prezent, se recomandă un antimineralocorticoid la pacienții cu HFpEF care prezintă niveluri crescute de peptide natriuretice cerebrale . Spironolactona este primul membru al acestei clase de medicamente și cel mai frecvent angajat. Trebuie acordată atenție monitorizării nivelului seric de potasiu, precum și a funcției rinichilor, în special rata filtrării glomerulare în timpul tratamentului.
Blocante beta
Blocanții beta joacă un rol destul de obscur în tratamentul cu HFpEF, deși există sugestia unui rol benefic în managementul pacienților. Dovezile dintr-o meta-analiză au demonstrat reduceri semnificative ale mortalității în toate cauzele cu terapia beta-blocantă, deși efectele generale au fost determinate în mare parte de studii mici, mai vechi, la pacienți cu infarct post-miocardic. Unele dovezi sugerează că beta-blocantele vasodilatatoare, cum ar fi nebivololul , pot oferi un beneficiu pacienților cu insuficiență cardiacă, indiferent de fracțiunea de ejecție. În plus, din cauza perturbației cronotrope și a umplerii diminuate a LV observate în HFpEF, efectul bradicardic al beta-blocantelor poate permite umplerea îmbunătățită, reduce necesarul de oxigen miocardic și scade tensiunea arterială. Cu toate acestea, acest efect poate contribui și la reducerea răspunsului la solicitările de efort și poate duce la o reducere excesivă a ritmului cardiac.
Beta-blocantele sunt terapia de primă linie: scad frecvența cardiacă și oferă astfel mai mult timp pentru umplerea ventriculelor. De asemenea, pot îmbunătăți supraviețuirea. Există unele dovezi că blocantele canalelor de calciu pot fi benefice în reducerea rigidității ventriculare. În unele cazuri ( verapamilul are avantajul de a reduce frecvența cardiacă).
Inhibitori ai enzimei de conversie a angiotensinei (ECA)
De asemenea, tratamentul cu inhibitori ai enzimei de conversie a angiotensinei , cum ar fi enalapril , ramipril și mulți alții, poate fi benefic datorită efectului lor asupra prevenirii remodelării ventriculare, dar sub control pentru a evita hipotensiunea. Inhibitorii ECA nu par să îmbunătățească morbiditatea sau mortalitatea asociată numai cu HFpEF. Cu toate acestea, acestea sunt importante în gestionarea hipertensiunii , un jucător semnificativ în fiziopatologia HFpEF.
Blocante ale receptorilor angiotensinei II (ARB)
Tratamentul ARB are ca rezultat o îmbunătățire a disfuncției diastolice și a hipertensiunii, care este comparabilă cu alte medicamente antihipertensive.
Diuretice
Diureticele pot fi utile dacă se dezvoltă congestie semnificativă, dar pacienții trebuie monitorizați deoarece dezvoltă frecvent tensiune arterială scăzută .
Experimental
A fost sugerată utilizarea unui dispozitiv cu autoexpansiune care se atașează la suprafața externă a ventriculului stâng, dar încă așteaptă aprobarea FDA. Când mușchiul inimii se strânge, energia este încărcată în dispozitiv, care absoarbe energia și o eliberează în ventriculul stâng în faza diastolică. Acest lucru ajută la păstrarea elasticității musculare.
Prognoză
Progresia HFpEF și evoluția sa clinică este slab înțeleasă în comparație cu HFrEF. În ciuda acestui fapt, pacienții cu HFrEF și HFpEF par să aibă rezultate comparabile în ceea ce privește spitalizarea și mortalitatea. Cauzele morții la pacienți variază substanțial. Cu toate acestea, în rândul pacienților cu insuficiență cardiacă mai avansată (clasele II-IV NYHA), moartea cardiovasculară, inclusiv atacurile de cord și moartea subită cardiacă , a fost cauza predominantă în studiile bazate pe populație.
Până nu demult, se presupunea că prognosticul pentru persoanele cu disfuncție diastolică și edem pulmonar intermitent asociat era mai bun decât cei cu disfuncție sistolică. De fapt, în două studii apărute în New England Journal of Medicine în 2006, au fost prezentate dovezi care sugerează că prognosticul în disfuncția diastolică este același cu cel din disfuncția sistolică .
Referințe
Bibliografie
- Estafanous, FG (2001). Anestezie cardiacă 2 Ed: Principii și practică clinică (2 ed.). Lippincott Williams și Wilkins. ISBN 978-0781721950.
- O'Rouke, RA, Fuster, V. (2001). Hurst's The Heart (10 (ediția internațională) ed.). McGraw-Hill. pp. 658-60. ISBN 978-0-07-116296-8.
linkuri externe
| Clasificare |
|---|

