Boala cu celule falciforme -Sickle cell disease
| Siclemie | |
|---|---|
| Alte nume | Tulburarea celulelor falciforme |
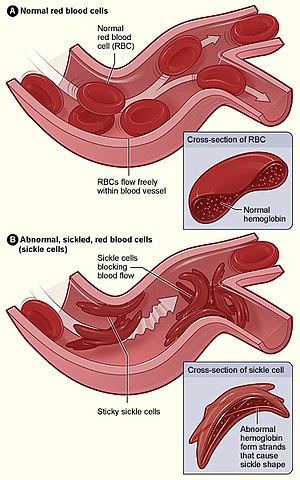 | |
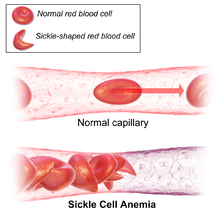
| Figura (A) prezintă celule roșii normale care curg liber printr-un vas de sânge. Insertul arată o secțiune transversală a unui globule roșu normal cu hemoglobină normală . Figura (B) prezintă celule roșii anormale, secerate, care se lipesc la punctul de ramificare a unui vas de sânge. Imaginea inserată arată o secțiune transversală a unei celule seceră cu fire lungi de hemoglobină seceră polimerizată (HbS) care se întind și deformează forma celulei pentru a arăta ca o semilună. | |
| Specialitate | Hematologie , genetică medicală |
| Simptome | Atacurile de durere, anemie , umflarea mâinilor și picioarelor , infecții bacteriene , accident vascular cerebral |
| Complicații | Durere cronică , accident vascular cerebral , necroză osoasă aseptică , calculi biliari , ulcere ale picioarelor , priapism , hipertensiune pulmonară , probleme de vedere, probleme renale |
| Debut obișnuit | varsta de 5-6 luni |
| Cauze | Genetic |
| Metoda de diagnosticare | Test de sange |
| Tratament | Vaccinări , antibiotice , consum mare de lichide, suplimente de acid folic , medicamente pentru durere , transfuzii de sânge |
| Prognoză | Speranța de viață 40–60 de ani (lumea dezvoltată) |
| Frecvență | 4,4 milioane (2015) |
| Decese | 114.800 (2015) |
Siclemia ( SCD ) este un grup de tulburări de sânge moștenite de obicei de la părinții unei persoane . Cel mai frecvent tip este cunoscut sub denumirea de anemie cu celule falciforme . Are ca rezultat o anomalie a hemoglobinei proteice care transportă oxigen, găsită în celulele roșii din sânge . Acest lucru duce la o formă rigidă, asemănătoare secerului , în anumite circumstanțe. Problemele în drepano încep de obicei în jurul vârstei de 5 până la 6 luni. Pot apărea o serie de probleme de sănătate, cum ar fi atacuri de durere (cunoscute sub numele de criză de celule falciforme ), anemie , umflarea mâinilor și picioarelor , infecții bacteriene și accident vascular cerebral . Durerea pe termen lung se poate dezvolta pe măsură ce oamenii îmbătrânesc. Speranța medie de viață în lumea dezvoltată este de 40 până la 60 de ani.
Drepanocitoarea apare atunci când o persoană moștenește două copii anormale ale genei β-globinei ( HBB ) care produce hemoglobină, câte una de la fiecare părinte. Această genă apare în cromozomul 11 . Există mai multe subtipuri, în funcție de mutația exactă a fiecărei gene a hemoglobinei. Un atac poate fi declanșat de schimbările de temperatură, stres, deshidratare și altitudine mare. O persoană cu o singură copie anormală nu are de obicei simptome și se spune că are trăsătura celulelor falciforme . Astfel de persoane sunt denumite și transportatori . Diagnosticul se face printr-un test de sânge , iar unele țări testează toți bebelușii la naștere pentru boală. Diagnosticul este posibil și în timpul sarcinii.
Îngrijirea persoanelor cu drepano poate include prevenirea infecțiilor cu vaccinare și antibiotice , aport mare de lichide, suplimentare cu acid folic și medicamente pentru durere . Alte măsuri pot include transfuzia de sânge și medicamentul hidroxicarbamidă (hidroxiuree). Un mic procent de oameni pot fi vindecați printr-un transplant de celule de măduvă osoasă .
Începând cu 2015, aproximativ 4,4 milioane de oameni suferă de drepanocită, în timp ce alte 43 de milioane au trăsături de celule secerante. Se crede că aproximativ 80% dintre cazurile de boală secerată apar în Africa Subsahariană . De asemenea, apare relativ frecvent în unele părți ale Indiei , Peninsula Arabică și printre oamenii de origine africană care trăiesc în alte părți ale lumii. În 2015, s-a soldat cu aproximativ 114.800 de decese. Condiția a fost descrisă pentru prima dată în literatura medicală de către medicul american James B. Herrick în 1910. În 1949, transmiterea ei genetică a fost determinată de EA Beet și JV Neel. În 1954, a fost descris efectul protector împotriva malariei a trăsăturii celulelor falciforme.
semne si simptome
Semnele de drepano încep de obicei în copilărie timpurie. Severitatea simptomelor poate varia de la o persoană la alta. Drepanocitoarea poate duce la diverse complicații acute și cronice, dintre care multe au o rată ridicată a mortalității.
Criza celulelor falciforme
Termenii „criză falciformă” sau „criză falciformă” pot fi utilizați pentru a descrie mai multe afecțiuni acute independente care apar la pacienții cu MSC, care au ca rezultat anemie și crize care ar putea fi de mai multe tipuri, inclusiv criza vaso-ocluzivă , criza aplastică , criza de sechestrare splenică , criza hemolitică și altele. Majoritatea episoadelor de crize de drepanoi durează între cinci și șapte zile. „Deși infecția, deshidratarea și acidoza (toate care favorizează secerizarea) pot acționa ca declanșatori, în cele mai multe cazuri, nu este identificată nicio cauză predispozantă”.
Criza vaso-ocluzivă
Criza vaso-ocluzivă este cauzată de globulele roșii în formă de seceră care obstrucționează capilarele și restricționează fluxul sanguin către un organ, ducând la ischemie , durere , necroză și adesea leziuni ale organelor. Frecvența, severitatea și durata acestor crize variază considerabil. Crizele dureroase sunt tratate cu hidratare, analgezice și transfuzii de sânge ; gestionarea durerii necesită administrarea de medicamente opioide la intervale regulate până la aplanarea crizei. Pentru crizele mai ușoare, un subgrup de pacienți se descurcă cu medicamente antiinflamatoare nesteroidiene, cum ar fi diclofenacul sau naproxenul . Pentru crize mai severe, cei mai mulți pacienți necesită tratament în spital pentru opioidele intravenoase; dispozitivele de analgezie controlate de pacient sunt utilizate în mod obișnuit în acest cadru. Crizele vaso-ocluzive care implică organe precum penisul sau plămânii sunt considerate o urgență și sunt tratate cu transfuzii de globule roșii. Se recomandă spirometria stimulativă , o tehnică de încurajare a respirației profunde pentru a minimiza dezvoltarea atelectaziei .
Criza de sechestrare splenica
Splina este frecvent afectată în boala celulelor secera, deoarece celulele roșii în formă de seceră provoacă îngustarea vaselor de sânge și funcția redusă în curățarea celulelor defecte . Este de obicei infarctată înainte de sfârșitul copilăriei la persoanele care suferă de anemie falciformă. Această afectare a splinei crește riscul de infecție de la organismele încapsulate ; antibioticele preventive și vaccinurile sunt recomandate celor care nu au o funcție adecvată a splinei .
Crizele de sechestrare splenica sunt mariri acute, dureroase ale splinei, cauzate de captarea intrasplenica a globulelor rosii si care are ca rezultat o scadere abrupta a nivelului de hemoglobina cu potential de soc hipovolemic . Crizele de sechestrare sunt considerate o urgență. Dacă nu sunt tratați, pacienții pot muri în 1-2 ore din cauza insuficienței circulatorii. Managementul este de susținere, uneori cu transfuzie de sânge. Aceste crize sunt trecatoare; acestea continuă timp de 3-4 ore și pot dura o zi.
Sindromul toracic acut
Sindromul toracic acut este definit de cel puțin două dintre aceste semne sau simptome: durere toracică, febră, infiltrat pulmonar sau anomalie focală, simptome respiratorii sau hipoxemie. Este a doua cea mai frecventă complicație și reprezintă aproximativ 25% din decesele la pacienții cu MSC. Majoritatea cazurilor prezintă crize vaso-ocluzive, iar apoi dezvoltă sindrom toracic acut. Cu toate acestea, aproximativ 80% dintre oameni au crize vaso-ocluzive în timpul sindromului toracic acut.
Criza aplastică
Crizele aplastice sunt cazuri de agravare acută a anemiei inițiale a pacientului, producând aspect palid , ritm cardiac rapid și oboseală. Această criză este declanșată în mod normal de parvovirusul B19 , care afectează direct producția de globule roșii prin invadarea precursorilor celulelor roșii și înmulțirea și distrugerea acestora. Infecția cu parvovirus previne aproape complet producția de globule roșii timp de două până la trei zile. La indivizii normali, acest lucru este de mică importanță, dar durata de viață scurtă a celulelor roșii a pacienților cu SCD duce la o situație bruscă, care pune viața în pericol. Numărul de reticulocite scade dramatic în timpul bolii (determinând reticulocitopenie ), iar schimbarea rapidă a celulelor roșii duce la scăderea hemoglobinei. Această criză durează între 4 și 7 zile să dispară. Majoritatea pacienților pot fi gestionați de susținere; unii au nevoie de o transfuzie de sânge.
Criza hemolitică
Crizele hemolitice sunt scăderi acute accelerate ale nivelului hemoglobinei. Celulele roșii din sânge se descompun într-un ritm mai rapid. Acest lucru este deosebit de comun la persoanele cu deficit coexistent de G6PD . Managementul este de susținere, uneori cu transfuzii de sânge.
Alte
Una dintre cele mai timpurii manifestări clinice este dactilita , care se prezintă încă de la vârsta de șase luni și poate apărea la copiii cu trăsătură de celule falciforme. Criza poate dura până la o lună. Având în vedere că pneumonia și secerizarea în plămâni pot produce ambele simptome ale sindromului toracic acut, pacientul este tratat pentru ambele afecțiuni. Poate fi declanșată de crize dureroase, infecție respiratorie, embolizare a măduvei osoase sau, eventual, de atelectazie, administrare de opiacee sau intervenție chirurgicală. Pot apărea și ulcere hematopoietice .
Complicații
Anemia falciforme poate duce la diferite complicații, inclusiv:
- Riscul crescut de infecții bacteriene severe se datorează pierderii țesutului splinei funcțional (și comparabil cu riscul de infecții după îndepărtarea chirurgicală a splinei ). Aceste infecții sunt de obicei cauzate de organisme încapsulate, cum ar fi Streptococcus pneumoniae și Haemophilus influenzae . Profilaxia zilnică cu penicilină este cel mai frecvent utilizat tratament în timpul copilăriei, unii hematologi continuând tratamentul pe termen nelimitat. Pacienții beneficiază astăzi de vaccinarea de rutină pentru S. pneumoniae .
- Accidentul vascular cerebral , care poate rezulta dintr-o îngustare progresivă a vaselor de sânge, împiedică oxigenul să ajungă în creier . Infarctul cerebral apare la copii si hemoragia cerebrala la adulti.
- AVC silențios nu provoacă simptome imediate, dar este asociat cu leziuni ale creierului. AVC silențios este probabil de cinci ori mai frecvent decât accidentul vascular cerebral simptomatic. Aproximativ 10-15% dintre copiii cu MSC suferă accidente vasculare cerebrale, cu accidente vasculare cerebrale silentioase predominând la pacienții mai tineri.
- Colelitiaza (litiază biliară) și colecistita pot rezulta din producția excesivă de bilirubină și precipitarea din cauza hemolizei prelungite .
- Ca urmare a ischemiei, poate apărea necroza avasculară (necroză osoasă aseptică ) a șoldului și a altor articulații majore.
- Scăderea reacțiilor imune din cauza hiposplenismului (funcționarea defectuoasă a splinei)
- Priapism și infarct al penisului
- Osteomielita (infecția bacteriană a oaselor), cea mai frecventă cauză a osteomielitei în SCD este Salmonella (în special serotipurile atipice Salmonella typhimurium, Salmonella enteritidis, Salmonella choleraesuis și Salmonella paratyphi B), urmată de Staphylococcus aureus și Gram-negativ intravascular intravascular. secerizarea intestinului duce la infarct ischemic negru.
- Necroza papilară acută în rinichi
- Ulcere ale picioarelor
- La ochi, retinopatia de fond, retinopatia proliferativă, hemoragiile vitroase și dezlipurile de retină pot duce la orbire. Sunt recomandate controale anuale regulate ale ochilor.
- În timpul sarcinii, restricție de creștere intrauterină , avort spontan și preeclampsie
- Durere cronică: Chiar și în absența durerii vaso-ocluzive acute, mulți pacienți au dureri cronice neraportate.
- Hipertensiunea pulmonară (creșterea presiunii asupra arterei pulmonare ) poate duce la încordarea ventriculului drept și la un risc de insuficiență cardiacă ; simptomele tipice sunt dificultăți de respirație, scăderea toleranței la efort și episoadele de sincopă . 21% dintre copii și 30% dintre adulți au dovezi de hipertensiune pulmonară atunci când sunt testați; aceasta este asociată cu distanța redusă de mers pe jos și cu o mortalitate crescută.
- Cardiomiopatie și disfuncție diastolică a ventriculului stâng cauzate de fibroză sau cicatrizarea țesuturilor cardiace. Acest lucru contribuie, de asemenea, la hipertensiunea pulmonară, scăderea capacității de efort și aritmii .
- Insuficiența renală cronică din cauza nefropatiei falciforme se manifestă prin hipertensiune arterială , pierderea proteinelor în urină , pierderea globulelor roșii în urină și agravarea anemiei. Dacă evoluează spre insuficiență renală în stadiu terminal , are un prognostic prost.
Genetica

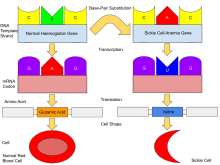
În mod normal, oamenii au hemoglobină A , care constă din două lanțuri alfa și două beta, hemoglobina A2 , care constă din două lanțuri alfa și două delta, și hemoglobină F (HbF), constând din două lanțuri alfa și două gama în corpul lor. Dintre aceste trei tipuri, hemoglobina F domină până la vârsta de aproximativ 6 săptămâni. Ulterior, hemoglobina A domină de-a lungul vieții. La persoanele diagnosticate cu drepanitate, cel puțin una dintre subunitățile β-globinei din hemoglobina A este înlocuită cu ceea ce este cunoscut sub denumirea de hemoglobină S. În anemia cu celule falciforme, o formă comună de boală secerată, hemoglobina S înlocuiește atât β-globina. subunități din hemoglobină.
Boala secerică are un model autosomal recesiv de moștenire de la părinți. Tipurile de hemoglobină pe care o persoană le produce în celulele roșii din sânge depind de ce gene ale hemoglobinei sunt moștenite de la părinții săi. Dacă un părinte are anemia cu celule secera, iar celălalt are trăsătura celulelor falciforme, atunci copilul are o șansă de 50% de a avea drepano și o șansă de 50% de a avea trăsătură de celule secera. Atunci când ambii părinți au trăsătura celulelor secera, un copil are o șansă de 25% de apariție a celulelor falciforme; 25% nu poartă nicio alele de celule falciforme, iar 50% au starea heterozigotă.
Mutația genei celulelor falciforme a apărut probabil spontan în diferite zone geografice, așa cum sugerează analiza endonucleazei de restricție. Aceste variante sunt cunoscute ca Camerun, Senegal, Benin, Bantu și Arabia Saudită. Importanța lor clinică se datorează faptului că unele sunt asociate cu niveluri mai ridicate de HbF, de exemplu, variantele din Senegal și din Arabia Saudită și tind să aibă o boală mai ușoară.
Defectul genei este o mutație dintr-o singură nucleotidă (vezi polimorfismul cu o singură nucleotidă – SNP) ( codonul GAG care se schimbă în GTG) a genei β-globinei, care are ca rezultat substituirea glutamatului (E/Glu) cu valină (V/Val) la poziţia 6 (înlocuire E6V). Hemoglobina S cu această mutație este denumită HbS, spre deosebire de HbA adultă normală. Aceasta este în mod normal o mutație benignă, care nu provoacă efecte evidente asupra structurilor secundare , terțiare sau cuaternare ale hemoglobinei în condiții de concentrație normală de oxigen . Cu toate acestea, la o concentrație scăzută de oxigen , HbS polimerizează și formează precipitate fibroase deoarece forma deoxi a hemoglobinei expune un plasture hidrofob pe proteina dintre elicele E și F (Phe 85, Leu 88).
La persoanele heterozigote pentru HbS ( purtători ai hemoglobinei falciforme), problemele de polimerizare sunt minore deoarece alela normală poate produce jumătate din hemoglobină. La persoanele homozigote pentru HbS, prezența polimerilor cu lanț lung ai HbS distorsionează forma globulelor roșii de la o formă netedă, asemănătoare unei gogoși , la zdrențuită și plină de vârfuri, făcându-l fragil și susceptibil la rupere în capilare . Purtătorii au simptome numai dacă sunt lipsiți de oxigen (de exemplu, în timp ce urcă un munte) sau când sunt sever deshidratați .

Alela responsabilă pentru anemia falciformă poate fi găsită pe brațul scurt al cromozomului 11 , mai precis 11p15.5 . O persoană care primește gena defectuoasă atât de la tată, cât și de la mamă dezvoltă boala; o persoană care primește o alelă defecte și una sănătoasă rămâne sănătoasă, dar poate transmite boala și este cunoscută ca purtător sau heterozigot. Heterozigoții sunt încă capabili să contracteze malarie, dar simptomele lor sunt în general mai puțin severe.
Datorită avantajului adaptativ al heterozigotului, boala este încă răspândită, în special în rândul persoanelor cu ascendență recentă din zonele afectate de malarie, cum ar fi Africa , Mediterana , India și Orientul Mijlociu . Malaria a fost istoric endemică în sudul Europei, dar a fost declarată eradicată la mijlocul secolului al XX-lea, cu excepția cazurilor rare sporadice.
Parazitul malariei are un ciclu de viață complex și petrece o parte din acesta în celulele roșii din sânge. Într-un purtător, prezența parazitului malariei determină ruperea prematură a globulelor roșii cu hemoglobină defectă, făcând parazitul Plasmodium incapabil să se reproducă. Mai mult, polimerizarea Hb afectează în primul rând capacitatea parazitului de a digera Hb. Prin urmare, în zonele în care malaria este o problemă, șansele de supraviețuire ale oamenilor cresc de fapt dacă poartă trăsături de celule falciforme (selecție pentru heterozigot).
În Statele Unite, fără malarie endemică, prevalența anemiei falciforme în rândul persoanelor de origine africană este mai mică (aproximativ 0,25%) decât în rândul oamenilor din Africa de Vest (aproximativ 4,0%) și este în scădere. Fără malarie endemică, mutația celulelor falciforme este pur dezavantajoasă și tinde să scadă în populația afectată prin selecție naturală , iar acum artificial prin screening genetic prenatal . Cu toate acestea, comunitatea afro-americană descinde dintr-un amestec semnificativ de mai multe grupuri etnice africane și non-africane și reprezintă, de asemenea, descendenții supraviețuitorilor sclaviei și comerțului cu sclavi. Astfel, un grad de diluare genetică prin încrucișarea cu oameni non-africani și presiunea ridicată a sănătății selective prin sclavie (în special comerțul cu sclavi și pasajul de mijloc , adesea mortal ) pot fi explicațiile cele mai plauzibile pentru prevalența mai scăzută a anemiei falciforme (și , eventual, alte boli genetice) printre afro-americani în comparație cu africanii de vest. Un alt factor care limitează răspândirea genelor celulelor falciforme în America de Nord este absența relativă a poligamiei . În societățile poligame, bărbații afectați pot avea mulți copii cu mai mulți parteneri.
Fiziopatologia

Pierderea elasticității globulelor roșii este esențială pentru patofiziologia siclemiei. Globulele roșii normale sunt destul de elastice și au o formă de disc biconcavă, ceea ce permite celulelor să se deformeze pentru a trece prin capilare. În boala celulelor falciforme, tensiunea scăzută a oxigenului favorizează formarea celulelor roșii din sânge și episoadele repetate de falciformitate afectează membrana celulară și scad elasticitatea celulei. Aceste celule nu reușesc să revină la forma normală atunci când tensiunea normală a oxigenului este restabilită. În consecință, aceste celule sanguine rigide nu se pot deforma pe măsură ce trec prin capilare înguste, ducând la ocluzia vaselor și ischemie .
Anemia propriu-zisă a bolii este cauzată de hemoliză , distrugerea globulelor roșii, din cauza formei lor. Deși măduva osoasă încearcă să compenseze prin crearea de noi celule roșii, nu se potrivește cu rata de distrugere. Celulele roșii sănătoase funcționează de obicei timp de 90-120 de zile, dar celulele falciforme durează doar 10-20 de zile.
Diagnostic
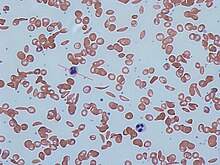
În HbS, hemoleucograma completă dezvăluie niveluri de hemoglobină în intervalul de 6-8 g/dl cu un număr mare de reticulocite (deoarece măduva osoasă compensează distrugerea celulelor secera prin producerea mai multor globule roșii). În alte forme de boală secerată, nivelurile de Hb tind să fie mai ridicate. Un film de sânge poate prezenta caracteristici ale hiposplenismului ( celule țintă și corpi Howell-Jolly ).
Secerizarea globulelor roșii, pe o peliculă de sânge, poate fi indusă prin adăugarea de metabisulfit de sodiu . Prezența hemoglobinei falciforme poate fi demonstrată și cu „testul de solubilitate seceră” (numit și „sickledex”). Un amestec de hemoglobină S (HbS) într-o soluție reducătoare (cum ar fi ditionitul de sodiu ) dă un aspect tulbure, în timp ce Hb normal dă o soluție limpede.
Formele anormale de hemoglobină pot fi detectate prin electroforeza hemoglobinei , o formă de electroforeză pe gel pe care diferitele tipuri de hemoglobină se mișcă cu viteze diferite. Hemoglobina cu celule falciforme (HgbS) și hemoglobina C cu falciformă (HgbSC) — cele mai frecvente două forme — pot fi identificate de acolo. Diagnosticul poate fi confirmat prin cromatografie lichidă de înaltă performanță . Testele genetice sunt rareori efectuate, deoarece alte investigații sunt foarte specifice pentru HbS și HbC.
O criză acută a celulelor falciforme este adesea precipitată de infecție. Prin urmare, ar trebui efectuate în mod obișnuit o analiză de urină pentru a detecta o infecție oculta a tractului urinar și o radiografie toracică pentru a căuta pneumonie oculta.
Persoanele care sunt purtători cunoscuți ai bolii sau care riscă să aibă un copil cu anemie falciformă pot fi supuse consilierii genetice . Consilierii genetici lucrează cu familiile pentru a discuta despre beneficiile, limitările și logistica opțiunilor de testare genetică, precum și impactul potențial al testării și al rezultatelor testelor asupra individului. În timpul sarcinii, testarea genetică poate fi efectuată fie pe o probă de sânge de la făt , fie pe o probă de lichid amniotic . Deoarece prelevarea unei probe de sânge de la un făt are riscuri mai mari, cel din urmă test este de obicei utilizat. Screeningul neonatal, denumit uneori screening pentru nou-născuți , oferă nu numai o metodă de depistare precoce a persoanelor cu drepanocidă, dar permite, de asemenea, identificarea grupurilor de persoane care poartă trăsătura celulelor falciforme. Consilierii genetici pot ajuta persoanele de culoare și familiile lor să abordeze disparitățile rasiale și etnice care există în asistența medicală.
În 2010, a existat o considerație și o dezbatere semnificativă în SUA în jurul screening-ului cuprinzător al sportivilor pentru SCD. Societatea Americană de Hematologie a concluzionat într-o declarație din 2012 că nu susțin testarea sau dezvăluirea stării de trăsătură a celulelor falciforme ca o condiție prealabilă pentru participarea la activități atletice din cauza lipsei de dovezi științifice, a inconsecvenței cu bunele practici medicale și a inconsecvenței cu sănătatea publică. etică. Ei au recomandat intervenții universale pentru a reduce leziunile legate de efort și decesele eficiente pentru toți sportivii, indiferent de statutul lor de celule falciforme.
management
Tratamentul presupune o serie de măsuri. Deși s-a recomandat din punct de vedere istoric ca persoanele cu boală secerată să evite exercițiile fizice, exercițiile fizice regulate le pot aduce beneficii oamenilor. Deshidratarea trebuie evitată. Se recomandă o dietă bogată în calciu, dar eficacitatea suplimentelor cu vitamina D rămâne incertă. Utilizarea L-glutaminei a fost susținută de FDA începând cu vârsta de cinci ani, deoarece scade complicațiile.
Acid folic și penicilină
De la nastere si pana la varsta de cinci ani, se recomanda penicilina zilnic, datorita sistemului imunitar imatur care ii face mai predispusi la bolile din prima copilarie. Suplimentarea alimentară cu acid folic fusese recomandată anterior de OMS. O analiză Cochrane din 2016 a utilizării sale a constatat că „efectul suplimentelor asupra anemiei și a oricăror simptome de anemie rămâne neclar” din cauza lipsei de dovezi medicale.
Prevenirea malariei
Efectul protector al trăsăturii celulelor falciforme nu se aplică persoanelor cu boală de celule falciforme; de fapt, sunt mai vulnerabili la malarie, deoarece cea mai frecventă cauză a crizelor dureroase în țările cu malarie este infecția cu malarie. Persoanele cu siclemie care trăiesc în țările cu malarie ar trebui să primească medicamente pe tot parcursul vieții pentru prevenire .
Criza vaso-ocluzivă
Majoritatea persoanelor cu siclemie au episoade intens dureroase numite crize vaso-ocluzive. Cu toate acestea, frecvența, severitatea și durata acestor crize variază enorm. Crizele dureroase sunt tratate simptomatic cu medicamente pentru durere ; gestionarea durerii necesită administrarea de medicamente opioide la intervale regulate până la aplanarea crizei. Pentru crizele mai ușoare, un subgrup de pacienți se descurcă cu AINS (cum ar fi diclofenac sau naproxen ). Pentru crizele mai severe, majoritatea pacienților necesită tratament în spital pentru opioidele intravenoase.
Lichidele suplimentare, administrate fie oral, fie intravenos, sunt o parte de rutină a tratamentului crizelor vaso-ocluzive, dar dovezile despre calea, cantitatea și tipul cel mai eficient de înlocuire a lichidelor rămân incerte.
Crizanlizumab , un anticorp monoclonal țintă față de p-selectină, a fost aprobat în 2019 în Statele Unite pentru a reduce frecvența crizelor vaso-ocluzive la cei de 16 ani și peste.
Prevenirea accidentului vascular cerebral
Ecografia Doppler transcranian (TCD) poate detecta copiii cu drepanoci care au un risc mare de accident vascular cerebral. Testul cu ultrasunete detectează vasele de sânge parțial obstrucționate de celulele falciforme prin măsurarea ratei de sânge în creier, deoarece viteza fluxului sanguin este invers legată de diametrul arterial și, în consecință, viteza mare a fluxului sanguin este corelată cu îngustarea arterelor. În 2002, Institutul Național de Sănătate (NIH) a emis o declarație prin care recomandă ca copiii cu drepanoți să primească anual ecranul cu ultrasunete Doppler transcranian, iar în 2014 un grup de experți convocat de NIH a emis linii directoare reiterând aceeași recomandare. O analiză a dosarelor medicale, efectuată de doctorul hematolog Julie Kanter de la Universitatea din Alabama din Birmingham, a arătat că, în medie, doar 48,4% dintre copiii cu drepană primesc testul cu ultrasunete recomandat.
Un studiu NIH din 1994 a arătat că copiii cu risc de accident vascular cerebral care au primit transfuzii de sânge au avut o rată anuală de accident vascular cerebral de mai puțin de 1%, în timp ce acei copii care nu au primit transfuzii de sânge au avut o rată de accident vascular cerebral de 10% pe an. (Vezi și studiul din 1998 în New England Journal of Medicine .) Pe lângă ultrasunete și transfuzii de sânge, medicamentul generic ieftin hidroxiuree poate reduce riscul de leziuni ireversibile ale organelor și creierului. Ghidurile NIH publicate în 2014 afirmă că toți copiii și adolescenții ar trebui să ia hidroxiuree, la fel ca și adulții cu complicații grave sau trei sau mai multe crize de durere într-un an.
Sindromul toracic acut
Managementul este similar cu criza vaso-ocluzivă, cu adăugarea de antibiotice (de obicei o chinolonă sau macrolidă, deoarece se crede că bacteriile cu deficit de perete celular [„atipice”] contribuie la sindrom), suplimentarea cu oxigen pentru hipoxie și observarea atentă. În absența dovezilor de înaltă calitate cu privire la eficacitatea antibioticelor pentru sindromul toracic acut la persoanele cu drepanitate, nu există un tratament standard cu antibiotice din 2019. Se recomandă ca persoanele cu suspiciune de sindrom toracic acut să fie internate în spital cu înrăutățirea gradientului Aa o indicație pentru internarea la UTI.
În cazul în care infiltratul pulmonar se înrăutățește sau crește necesarul de oxigen, este indicată o simplă transfuzie de sânge sau un schimb de transfuzie . Acesta din urmă implică schimbul unei părți semnificative din masa eritrocitară a persoanei cu celule roșii normale, ceea ce scade nivelul hemoglobinei S din sângele pacientului. Cu toate acestea, există în prezent dovezi incerte cu privire la posibilele beneficii sau daune ale transfuziei de sânge pentru sindromul toracic acut la persoanele cu siclemie.
Hidroxiuree
Hidroxiureea , cunoscută și sub denumirea de hidroxicarbamidă , reduce probabil frecvența episoadelor dureroase și riscul de îmbolnăvire care amenință viața sau deces, dar în prezent nu există suficiente dovezi cu privire la riscul de efecte adverse. Hidroxiureea și flebotomia combinate pot fi mai eficiente decât transfuzia și chelarea combinate în ceea ce privește durerea, boala care pune viața în pericol și riscul de deces.
A fost primul medicament aprobat pentru tratamentul anemiei falciforme și s-a dovedit că scade numărul și severitatea atacurilor în 1995 și s-a dovedit că poate crește timpul de supraviețuire într-un studiu din 2003. Acest lucru se realizează, parțial, prin reactivarea fetală . producerea de hemoglobină în locul hemoglobinei S care provoacă anemia falciformă. Hidroxiureea a fost utilizată anterior ca agent de chimioterapie și există o anumită îngrijorare că utilizarea pe termen lung poate fi dăunătoare, dar acest risc este fie absent, fie foarte mic și beneficiile sunt probabil mai mari decât riscurile.
Voxelotor a fost aprobat în Statele Unite în 2019 pentru a crește hemoglobina la persoanele cu boala SS.
Transfuzie de sange
Transfuziile de sânge sunt adesea folosite în gestionarea bolii de celule secera în cazuri acute și pentru a preveni complicațiile prin scăderea numărului de globule roșii (RBC) care se pot forma prin adăugarea de globule roșii normale. La copii, s-a demonstrat că terapia preventivă cu transfuzie cu eritrocite reduce riscul primului accident vascular cerebral sau al accidentului vascular cerebral silențios atunci când ultrasonografia Doppler transcraniană arată un flux sanguin cerebral anormal. La cei care au suferit un accident vascular cerebral anterior, reduce, de asemenea, riscul de accident vascular cerebral recurent și accidente vasculare cerebrale suplimentare silențioase.
Transplant de măduvă osoasă
Transplantul de măduvă osoasă s-a dovedit eficient la copii; sunt singurul remediu cunoscut pentru MSC. Cu toate acestea, transplanturile de măduvă osoasă sunt dificil de obținut din cauza tipării specifice HLA necesare. În mod ideal, o rudă apropiată (alogenă) ar dona măduva osoasă necesară transplantului. Sunt în curs de dezvoltare unele terapii genetice care ar modifica ex vivo celulele stem ale măduvei osoase ale pacientului , care pot fi apoi transplantate înapoi în pacient după ce chimioterapia elimină celulele originale nemodificate.
Necroza avasculară
Atunci când se tratează necroza avasculară a osului la persoanele cu siclemie, scopul tratamentului este reducerea sau oprirea durerii și menținerea mobilității articulațiilor . Opțiunile de tratament actuale includ odihna articulației, kinetoterapie , medicamente pentru ameliorarea durerii , intervenții chirurgicale de înlocuire a articulațiilor sau grefa osoasă . Sunt necesare studii de înaltă calitate, randomizate, controlate pentru a evalua cea mai eficientă opțiune de tratament și pentru a determina dacă o combinație de kinetoterapie și chirurgie este mai eficientă decât kinetoterapie singură.
Terapii psihologice
Terapiile psihologice, cum ar fi educația pacientului , terapia cognitivă , terapia comportamentală și psihoterapia psihodinamică , care au scopul de a completa tratamentele medicale actuale, necesită cercetări suplimentare pentru a determina eficacitatea acestora.
Prognoză
Aproximativ 90% dintre oameni supraviețuiesc până la vârsta de 20 de ani și aproape 50% supraviețuiesc după vârsta de 50 de ani. În 2001, conform unui studiu efectuat în Jamaica, supraviețuirea medie estimată pentru oameni a fost de 53 de ani pentru bărbați și 58 de ani pentru femeile cu SCD homozigot. . Speranța de viață specifică în mare parte din lumea în curs de dezvoltare este necunoscută. În 1975, aproximativ 7,3% dintre persoanele cu SCD au murit înainte de a împlini 23 de ani; în timp ce în 1989 2,6% dintre persoanele cu MSC au murit până la vârsta de 20 de ani.
Epidemiologie
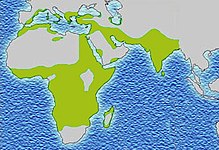
Cea mai mare frecvență a bolii cu celule falciforme se găsește în regiunile tropicale, în special în Africa sub-sahariană, regiunile tribale din India și Orientul Mijlociu. Migrația populațiilor substanțiale din aceste zone cu prevalență ridicată către țări cu prevalență scăzută din Europa a crescut dramatic în ultimele decenii, iar în unele țări europene, drepanarea a depășit acum condiții genetice mai familiare, cum ar fi hemofilia și fibroza chistică . În 2015, s-a soldat cu aproximativ 114.800 de decese.
Drepanocitoarea apare mai frecvent în rândul persoanelor ai căror strămoși au trăit în regiunile sub-sahariane tropicale și subtropicale , unde malaria este sau a fost comună. Acolo unde malaria este obișnuită, purtarea unei singure alele (trăsătură) de celule falciforme conferă un avantaj heterozigot ; oamenii cu una dintre cele două alele ale siclemiei prezintă simptome mai puțin severe atunci când sunt infectați cu malarie.
Această afecțiune este moștenită într-un model autozomal recesiv, ceea ce înseamnă că ambele copii ale genei din fiecare celulă au mutații. Părinții poartă fiecare câte o copie a genei mutante, dar de obicei nu prezintă semne și simptome ale afecțiunii.
Africa
Trei sferturi din cazurile de celule falciforme apar în Africa. Un raport recent al OMS a estimat că aproximativ 2% dintre nou-născuții din Nigeria au fost afectați de anemie falciforme, dând un total de 150.000 de copii afectați născuți în fiecare an numai în Nigeria. Frecvența purtătorului variază între 10 și 40% în Africa ecuatorială, scăzând la 1-2% pe coasta Africii de Nord și <1% în Africa de Sud. Studiile din Africa arată o scădere semnificativă a ratei mortalității infantile, cu vârsta cuprinsă între 2 și 16 luni, din cauza trăsăturii celulelor falciforme. Acest lucru s-a întâmplat în zonele cu cazuri predominante de malarie.
Uganda are a cincea cea mai mare sarcină de boală secerată din Africa. Un studiu indică faptul că 20 000 de bebeluși pe an se nasc cu drepanocită, cu trăsătura celulelor falciforme la 13,3% și cu boala 0,7%.
| Țară | Populație (2020) | Subregiune | % din prevalență | Prevalența | Incidenţă |
| Angola | 32.866.272 | Africa de mijloc | 0,09375 | 3.081.213 | 14.869 |
| Camerun | 26.545.863 | Africa de mijloc | 0,117 | 3.105.866 | 11.826 |
| RD Congo | 89.561.403 | Africa de mijloc | 0,1163333333 | 10.418.977 | 65.536 |
| Ghana | 31.072.940 | Africa de Vest | 0,09375 | 2.913.088 | 9.588 |
| Guineea | 13.132.795 | Africa de Vest | 0,139375 | 1.830.383 | 8.907 |
| Niger | 24.206.644 | Africa de Vest | 0,07025 | 1.700.517 | 8.756 |
| Nigeria | 206.139.589 | Africa de Vest | 0,1286666667 | 26.523.294 | 150.000 |
| Tanzania | 59.734.218 | Africa de Est | 0,0545 | 3.255.515 | 19.585 |
| Uganda | 45.741.007 | Africa de Est | 0,07025 | 3.213.306 | 17.936 |
| Zambia | 18.383.955 | Africa de Est | 0,082 | 1.507.484 | 9.958 |
| Algeria | 43.851.044 | Africa de Nord | 0,029 | 1.271.680 | 6.624 |
| Benin | 12.123.200 | Africa de Vest | 0,1286666667 | 1.559.852 | 8.125 |
| Botswana | 2.351.627 | Africa de Sud | 0,029 | 68.197 | 355 |
| Burkina Faso | 20.903.273 | Africa de Vest | 0,07025 | 1.468.455 | 7.649 |
| Burundi | 11.890.784 | Africa de Est | 0,023 | 273.488 | 1.425 |
| Cabo Verde | 555.987 | Africa de Vest | 0,023 | 12.788 | 67 |
| Republica Centrafricană | 4.829.767 | Africa de mijloc | 0,082 | 396.041 | 2.063 |
| Ciad | 16.425.864 | Africa de mijloc | 0,0585 | 960.913 | 5.005 |
| Comore | 869.601 | Africa de Est | 0,023 | 20.001 | 104 |
| Congo | 5.518.087 | Africa de mijloc | 0,1615 | 891.171 | 4.642 |
| Côte d'Ivoire | 26.378.274 | Africa de Vest | 0,07025 | 1.853.074 | 9.652 |
| Djibouti | 988.000 | Africa de Est | 0,023 | 22.724 | 118 |
| Egipt | 102.334.404 | Africa de Nord | 0,029 | 2.967.698 | 15.458 |
| Guineea Ecuatorială | 1.402.985 | Africa de mijloc | 0,181 | 253.940 | 1.323 |
| Eritreea | 3.546.421 | Africa de Est | 0,023 | 81.568 | 425 |
| Eswatini | 1.160.164 | Africa de Sud | 0,023 | 26.684 | 139 |
| Etiopia | 114.963.588 | Africa de Est | 0,029 | 3.333.944 | 17.366 |
| Gabon | 2.225.734 | Africa de mijloc | 0,181 | 402.858 | 2.098 |
| Gambia | 2.416.668 | Africa de Vest | 0,082 | 198.167 | 1.032 |
| Guineea-Bissau | 1.968.001 | Africa de Vest | 0,035 | 68.880 | 359 |
| Kenya | 53.771.296 | Africa de Est | 0,04675 | 2.513.808 | 13.094 |
| Lesotho | 2.142.249 | Africa de Sud | 0,023 | 49.272 | 257 |
| Liberia | 5.057.681 | Africa de Vest | 0,07025 | 355.302 | 1.851 |
| Libia | 6.871.292 | Africa de Nord | 0,029 | 199.267 | 1.038 |
| Madagascar | 27.691.018 | Africa de Est | 0,04675 | 1.294.555 | 6.743 |
| Malawi | 19.129.952 | Africa de Est | 0,035 | 669.548 | 3.488 |
| Mali | 20.250.833 | Africa de Vest | 0,082 | 1.660.568 | 8.650 |
| Mauritania | 4.649.658 | Africa de Vest | 0,04675 | 217.372 | 1.132 |
| Mauritius | 1.271.768 | Africa de Est | 0,023 | 29.251 | 152 |
| Maroc | 36.910.560 | Africa de Nord | 0,029 | 1.070.406 | 5.576 |
| Mozambic | 31.255.435 | Africa de Est | 0,035 | 1.093.940 | 5.698 |
| Namibia | 2.540.905 | Africa de Sud | 0,03883333333 | 98.672 | 514 |
| Rwanda | 12.952.218 | Africa de Est | 0,035 | 453.328 | 2.361 |
| Sao Tome & Principe | 219.159 | Africa de mijloc | 0,181 | 39.668 | 207 |
| Senegal | 16.743.927 | Africa de Vest | 0,07025 | 1.176.261 | 6.127 |
| Seychelles | 98.347 | Africa de Est | 0,023 | 2.262 | 12 |
| Sierra Leone | 7.976.983 | Africa de Vest | 0,1615 | 1.288.283 | 6.711 |
| Somalia | 15.893.222 | Africa de Est | 0,029 | 460.903 | 2.401 |
| Africa de Sud | 59.308.690 | Africa de Sud | 0,029 | 1.719.952 | 8.959 |
| Sudul Sudanului | 11.193.725 | Africa de Est | 0,04675 | 523.307 | 2.726 |
| Sudan | 43.849.260 | Africa de Nord | 0,03883333333 | 1.702.813 | 8.870 |
| A merge | 8.278.724 | Africa de Vest | 0,09375 | 776.130 | 4.043 |
| Tunisia | 11.818.619 | Africa de Nord | 0,023 | 271.828 | 1.416 |
| Zimbabwe | 14.862.924 | Africa de Est | 0,035 | 520.202 | 2.710 |
| Total | 1.338.826.604 | Africa | 91.868.664 | 495.726 |
Statele Unite
Numărul persoanelor care suferă de această boală în Statele Unite este de aproximativ 100.000 (unul din 3.300), afectând în mare parte americanii de origine africană sub-sahariană. În Statele Unite, aproximativ unul din 365 de copii afro-americani și unul din 16.300 de copii hispano-americani suferă de anemie falciformă. Speranța de viață pentru bărbații cu MSC este de aproximativ 42 de ani, în timp ce femeile trăiesc cu aproximativ șase ani mai mult. Alte 2 milioane sunt purtători ai trăsăturii celulelor falciforme. Majoritatea copiilor cu MSC născuți în Statele Unite sunt identificați prin screening-ul neonatal de rutină. Începând cu 2016, toate cele 50 de state includ screening-ul pentru boala celulelor secera ca parte a screening-ului nou-născutului. Sângele nou-născutului este prelevat printr-o înțepătură de călcâi și este trimis la un laborator pentru testare. Bebelușul trebuie să fi mâncat de cel puțin 24 de ore înainte de a putea fi efectuat testul de înțepare la călcâi. Unele state necesită, de asemenea, un al doilea test de sânge să fie făcut atunci când copilul are două săptămâni pentru a asigura rezultatele. Anemia falciforme este cea mai frecventă tulburare genetică în rândul afro-americanilor. Aproximativ 8% sunt purtători și 1 din 375 se naște cu această boală. Susținătorii pacienților pentru boala secerantă s-au plâns că primește mai puține finanțări guvernamentale și private pentru cercetare decât boli rare similare, cum ar fi fibroza chistică , cercetătorul Elliott Vichinsky afirmând că acest lucru arată discriminarea rasială sau rolul bogăției în susținerea sănătății.
Franţa
Ca urmare a creșterii populației în regiunile afro-caraibiene din Franța de peste mări și a imigrației din Africa de Nord și sub-sahariană în Franța continentală, boala celulelor falciforme a devenit o problemă majoră de sănătate în Franța. SCD a devenit cea mai frecventă boală genetică din țară, cu o prevalență generală la naștere de una din 2.415 în Franța metropolitană , înaintea fenilcetonuriei (una din 10.862), hipotiroidismului congenital (una din 3.132), hiperplaziei suprarenale congenitale (una din 19.008) și fibroza chistică (una din 5.014) pentru aceeași perioadă de referință.
Din anul 2000, screening-ul neonatal al MSC a fost efectuat la nivel național pentru toți nou-născuții definiți ca fiind „la risc” pentru MSC pe baza originii etnice (definiți ca cei născuți din părinți originari din Africa subsahariană, Africa de Nord, Marea Mediterană). zonă (Italia de Sud, Grecia și Turcia ), peninsula arabă, insulele franceze de peste mări și subcontinentul indian).
Regatul Unit
În Regatul Unit, se crede că între 12.000 și 15.000 de persoane suferă de drepanitate, cu aproximativ 250.000 de purtători ai afecțiunii numai în Anglia. Întrucât numărul purtătorilor este doar estimat, toți nou-născuții din Marea Britanie primesc un test de sânge de rutină pentru a depista boala. Datorită faptului că mulți adulți din grupurile cu risc ridicat nu știu dacă sunt purtători, femeilor însărcinate și ambilor parteneri dintr-un cuplu li se oferă screening, astfel încât să poată primi consiliere dacă au trăsătura celulelor falciforme. În plus, donatorii de sânge din grupurile cu risc ridicat sunt, de asemenea, verificați pentru a confirma dacă sunt purtători și dacă sângele lor filtrează corect. Donatorii care se dovedesc a fi purtători sunt apoi informați și sângele lor, deși este adesea folosit pentru cei din același grup etnic, nu este folosit pentru cei cu drepanocită care necesită o transfuzie de sânge.
Orientul Mijlociu
În Arabia Saudită , aproximativ 4,2% din populație poartă trăsătura celulelor falciforme și 0,26% au boala celulelor falciforme. Cea mai mare prevalență este în provincia de Est, unde aproximativ 17% din populație poartă gena și 1,2% suferă de drepanție. În 2005, Arabia Saudită a introdus un test premarital obligatoriu, inclusiv electroforeza HB, care urmărea scăderea incidenței SCD și talasemiei .
În Bahrain , un studiu publicat în 1998, care a acoperit aproximativ 56.000 de persoane din spitalele din Bahrain, a constatat că 2% dintre nou-născuți suferă de siclemie, 18% dintre persoanele chestionate au trăsătura celulelor falciforme și 24% erau purtători ai mutației genetice care provoacă boala. Țara a început screening-ul tuturor femeilor însărcinate în 1992, iar nou-născuții au început să fie testați dacă mama era purtătoare. În 2004, a fost adoptată o lege prin care cuplurile care intenționează să se căsătorească să beneficieze de consiliere premaritală gratuită . Aceste programe au fost însoțite de campanii de educație publică.
India și Nepal
Drepanocitoarea este comună în unele grupuri etnice din centrul Indiei, unde prevalența a variat de la 9,4 la 22,2% în zonele endemice din Madhya Pradesh , Rajasthan și Chhattisgarh . Este, de asemenea, endemic printre oamenii Tharu din Nepal și India; cu toate acestea, ei au o rată de malarie de șapte ori mai mică, în ciuda faptului că trăiesc într-o zonă infestată cu malarie.
Insulele Caraibe
În Jamaica , 10% din populație poartă gena celulelor falciforme, ceea ce o face cea mai răspândită tulburare genetică din țară.
Istorie
Primul raport modern al bolii cu celule falciforme ar fi putut fi în 1846, unde s-a discutat despre autopsia unui sclav fugit executat; constatarea cheie a fost absența splinei. Se pare că sclavii africani din Statele Unite au manifestat rezistență la malarie, dar erau predispuși la ulcere la picioare. Caracteristicile anormale ale globulelor roșii, care mai târziu și-au dat numele bolii, au fost descrise pentru prima dată de Ernest E. Irons (1877–1959), stagiar la cardiologul din Chicago și profesor de medicină James B. Herrick (1861–1954), în 1910. Irons a văzut în sângele unui bărbat pe nume Walter Clement Noel, un student de 20 de ani, în primul an, din Grenada, celule „alungite și în formă de seceră”. Noel fusese internat la Spitalul presbiterian din Chicago în decembrie 1904, suferind de anemie. Noel a fost readmis de mai multe ori în următorii trei ani pentru „reumatism muscular” și „atacuri bilioase”, dar și-a încheiat studiile și s-a întors în capitala Grenadei (St. George) pentru a practica stomatologia . A murit de pneumonie în 1916 și este înmormântat în cimitirul catolic din Sauteurs , în nordul Grenadei. La scurt timp după raportul lui Herrick, un alt caz a apărut în Virginia Medical Semi-Monthly cu același titlu, „Corpuscule roșii de sânge alungite și în formă de seceră deosebite într-un caz de anemie severă”. Acest articol se bazează pe un pacient internat la Spitalul Universității din Virginia la 15 noiembrie 1910. În descrierea ulterioară făcută de Verne Mason în 1922, este folosit pentru prima dată denumirea de „anemia secerată”. Problemele copilăriei legate de drepanarea nu au fost raportate până în anii 1930, în ciuda faptului că acest lucru nu poate fi neobișnuit în populațiile afro-americane.
Medicul din Memphis Lemuel Diggs , un cercetător prolific în drepanocitoarea, a introdus pentru prima dată distincția dintre drepanocitoarea și trăsătură în 1933, deși până în 1949, caracteristicile genetice nu fuseseră elucidate de James V. Neel și EA Beet. 1949 a fost anul în care Linus Pauling a descris comportamentul chimic neobișnuit al hemoglobinei S și a atribuit acest lucru unei anomalii a moleculei în sine. Modificarea moleculară a HbS a fost descrisă în 1956 de Vernon Ingram . Sfârșitul anilor 1940 și începutul anilor 1950 au văzut o înțelegere suplimentară a legăturii dintre malarie și drepanocitoarea. În 1954, introducerea electroforezei hemoglobinei a permis descoperirea unor subtipuri particulare, cum ar fi boala HbSC.
Studii de istorie naturală la scară largă și studii de intervenție ulterioare au fost introduse în anii 1970 și 1980, ceea ce a condus la utilizarea pe scară largă a profilaxiei împotriva infecțiilor pneumococice, printre alte intervenții. Filmul TV al lui Bill Cosby , câștigător al Emmy, în 1972, To All My Friends on Shore , a descris povestea părinților unui copil care suferă de drepanocită. Anii 1990 au avut dezvoltarea hidroxicarbamidei, iar rapoartele de vindecare prin transplant de măduvă osoasă au apărut în 2007.
Unele texte vechi se referă la aceasta ca drepanocitoză.
Societate și cultură
Securitatea Socială din SUA
Începând cu 15 septembrie 2017, Administrația de Securitate Socială din SUA a emis o hotărâre de interpretare a politicii care oferă informații de bază despre drepanocitoarea și o descriere a modului în care Securitatea Socială evaluează boala în timpul procesului său de adjudecare pentru cererile de invaliditate.
Stigmatul în SUA
În SUA, există stigmate în jurul SCD care descurajează persoanele cu SCD să primească îngrijirea necesară. Aceste stigmate afectează în principal persoanele de ascendență afro-americană și latină, potrivit Institutului Național de Inimă, Plămân și Sânge. Persoanele cu SCD experimentează impactul stigmatelor bolii asupra multiplelor aspecte ale vieții, inclusiv bunăstarea socială și psihologică. Studiile au arătat că cei cu MSC simt adesea că trebuie să-și păstreze diagnosticul secret pentru a evita discriminarea la locul de muncă și, de asemenea, între semeni în relații. În anii 1960, guvernul SUA a sprijinit inițiativele de screening la locul de muncă pentru boli genetice, în încercarea de a fi protector față de persoanele cu SCD. Prin efectuarea acestei verificări, s-a intenționat ca angajații să nu fie plasați în medii care ar putea fi dăunătoare și declanșa SCD.
Stigmatul în Uganda
Uganda are a cincea cea mai mare sarcină a bolii cu celule falciforme (SCD) din lume. În Uganda , stigmatizarea socială există pentru cei cu boală secerată din cauza lipsei de cunoștințe generale despre această boală. Decalajul general în cunoștințele despre boala secerată este observat în rândul adolescenților și adulților tineri din cauza secretului sancționat cultural despre boală. În timp ce majoritatea oamenilor au auzit în general despre boală, o mare parte a populației este relativ dezinformată despre modul în care este diagnosticată sau moștenită MSC. Cei care sunt informați despre boală au aflat despre ea de la familie sau prieteni și nu de la profesioniștii din domeniul sănătății . Eșecul de a furniza publicului informații despre boala secerată are ca rezultat o populație cu o înțelegere slabă a cauzelor bolii, a simptomelor și a tehnicilor de prevenire. Diferențele, din punct de vedere fizic și social, care apar la cei cu boală secerantă, cum ar fi icterul, încetinirea creșterii fizice și maturitatea sexuală întârziată, îi pot determina, de asemenea, să devină ținte ale hărțuirii, respingerii și stigmatizării.
Rata bolii cu celule falciforme în Uganda
Datele compilate despre boala cu celule falciforme în Uganda nu au fost actualizate de la începutul anilor 1970. Deficiența datelor se datorează lipsei fondurilor guvernamentale de cercetare, chiar dacă ugandezii mor zilnic din cauza SCD. Datele arată că frecvența de trăsătură a siclemiei este de 20% din populația din Uganda. Aceasta înseamnă că 66 de milioane de oameni sunt expuși riscului de a avea un copil care suferă de drepanție. De asemenea, se estimează că aproximativ 25.000 de ugandezi se nasc în fiecare an cu SCD și 80% dintre acești oameni nu trăiesc peste cinci ani. SCD contribuie, de asemenea, cu 25% la rata mortalității infantile în Uganda. Poporul Bamba din Uganda, situat în sud-vestul țării, poartă 45% din genă, care este cea mai mare frecvență de trăsătură înregistrată în lume. Clinica de celule falciforme din Mulago este o singură clinică de drepanocită din țară și, în medie, vede 200 de pacienți pe zi.
Concepții greșite despre boala cu celule falciforme
Stigmatul din jurul bolii este deosebit de rău în regiunile țării care nu sunt la fel de afectate. De exemplu, ugandezii din est tind să cunoască mai bine această boală decât ugandezii din vest, care sunt mai predispuși să creadă că boala celulelor falciforme a rezultat ca o pedeapsă a lui Dumnezeu sau a vrăjitoriei . Alte concepții greșite despre SCD includ credința că este cauzată de factori de mediu, dar, în realitate, SCD este o boală genetică. Au existat eforturi în întreaga Uganda pentru a aborda concepțiile sociale greșite despre boală. În 2013, a fost înființată Fundația pentru salvarea celulelor falciforme din Uganda pentru a răspândi conștientizarea bolii cu celule falciforme și pentru a combate stigmatul social legat de această boală. În plus față de eforturile acestei organizații, este nevoie de includerea educației asupra drepaniei în programele comunitare preexistente de educație pentru sănătate , în scopul de a reduce stigmatizarea bolii cu celule falciforme în Uganda.
Izolarea socială a persoanelor cu siclemie
Stigmatul adânc înrădăcinat al SCD din societate determină familiile să ascundă adesea starea de boală a membrilor familiei de teamă să nu fie etichetate, blestemate sau lăsate în afara evenimentelor sociale. Uneori, în Uganda, când se confirmă că un membru al familiei are siclemie, se evită relațiile intime cu toți membrii familiei. Stigmatizarea și izolarea socială pe care oamenii cu drepano tind să le experimenteze este adesea consecința concepțiilor greșite populare conform cărora persoanele cu SCD nu ar trebui să socializeze cu cei care nu suferă de boală. Această mentalitate le fură persoanelor cu MSC dreptul de a participa liber la activități comunitare, ca toți ceilalți. Stigmatul legat de MSC și izolarea socială în școli, în special, pot face viața tinerilor care trăiesc cu drepanomie extrem de dificilă. Pentru copiii de vârstă școlară care trăiesc cu MSC, stigmatizarea cu care se confruntă poate duce la respingerea colegilor. Respingerea de la egal la egal implică excluderea din grupuri sau adunări sociale. Adesea îl conduce pe persoana exclusă să experimenteze suferință emoțională și poate duce la performanța lor academică slabă, evitarea școlii și eșecul ocupațional mai târziu în viață. Această izolare socială este, de asemenea, probabil să aibă un impact negativ asupra persoanelor cu stima de sine a SCD și calitatea generală a vieții.
Femeile din Uganda și stigmatizarea SCD
Mame de copii cu siclemie
Mamele copiilor cu drepano tind să primească cantități disproporționate de stigmatizare de la semenii lor și de la membrii familiei. Aceste femei vor fi adesea învinuite pentru diagnosticul copilului lor de MSC, mai ales dacă MSC nu este prezentă în generațiile anterioare, din cauza suspiciunii că sănătatea precară a copilului ar fi putut fi cauzată de eșecul mamei de a implementa măsuri preventive de sănătate sau de a promova un mediu sănătos. pentru ca copilul ei să prospere. Încrederea pe teoriile legate de factorii de mediu pentru a da vina pe mamă reflectă cunoștințele slabe ale multor Uganda asupra modului în care este dobândită boala, deoarece este determinată de genetică, nu de mediu. De asemenea, mamele copiilor cu drepanitate au deseori resurse foarte limitate pentru a-și proteja viitorul împotriva stigmatului de a avea MSC. Această lipsă de acces la resurse rezultă din rolurile lor subordonate în cadrul structurilor familiale, precum și din disparitățile de clasă care împiedică capacitatea multor mame de a-și satisface costurile și responsabilitățile suplimentare de îngrijire a copilului.
Femeile însărcinate cu siclemie
Femeile care trăiesc cu MSC care rămân însărcinate se confruntă adesea cu discriminare extremă și descurajare în Uganda. Aceste femei sunt adesea marcate de colegii lor ca fiind iresponsabile pentru faptul că au un copil în timp ce trăiesc cu drepano sau chiar fac sex în timp ce trăiesc cu SCD. Criticile și judecata pe care aceste femei le primesc, nu numai de la profesioniștii din domeniul sănătății, ci și de la familiile lor, le lasă adesea să se simtă singure, deprimate, anxioase, rușinate și cu foarte puțin sprijin social . Majoritatea femeilor însărcinate cu MSC continuă să fie, de asemenea, mame singure, deoarece este obișnuit ca ele să fie părăsite de partenerii lor de sex masculin care susțin că nu cunoșteau statutul SCD al partenerului lor. Nu numai că abandonul experimentat de aceste femei le provoacă suferință emoțională, dar acest nivel scăzut de sprijin parental poate fi legat de simptome depresive și de o calitate generală mai scăzută a vieții copilului odată ce se naște.
Cercetare
Transplant de sânge din cordonul ombilical
În timp ce transplantul de sânge din cordonul ombilical poate vindeca afecțiunea, un donator adecvat este disponibil doar la 10% dintre oameni. Aproximativ 7% dintre oameni mor și ca urmare a procedurii și poate apărea boala grefă versus gazdă .
Terapia genică
Boli, cum ar fi siclemia, pentru care fenotipul sau funcția celulară normală a unei persoane pot fi restabilite în celulele care au boala printr-o copie normală a genei care este mutată, pot fi un bun candidat pentru tratamentul de terapie genică. Riscurile și beneficiile legate de terapia genică pentru drepanocitul nu sunt cunoscute.
În 2001, se pare că boala cu celule secera a fost tratată cu succes la șoareci folosind terapia genică . Cercetătorii au folosit un vector viral pentru a-i face pe șoareci, care au, în esență, același defect care provoacă boala cu celule falciforme umane, să exprime producția de hemoglobină fetală (HbF), pe care o persoană nu o produce în mod normal la scurt timp după naștere. La oameni, se știe că utilizarea hidroxiureei pentru a stimula producția de HbF ameliorează temporar simptomele drepaniei. Cercetătorii au demonstrat că această metodă de terapie genică este o modalitate mai permanentă de a crește producția terapeutică de HbF.
Studiile clinice de fază 1 de terapie genetică pentru boala cu celule secerate la oameni au fost începute în 2014. Studiile clinice vor evalua siguranța măduvei osoase modificate cu vector lentiviral pentru adulții cu boală severă a celulelor severă. Începând cu 2020, totuși, nu au fost raportate studii controlate randomizate. Un raport de caz pentru prima persoană tratată a fost publicat în martie 2017, încă câteva persoane fiind tratate de atunci.
Platforme de editare genetică precum CRISPR/Cas9 au fost folosite pentru a corecta mutația care provoacă boala în celulele stem hematopoietice prelevate de la o persoană cu această afecțiune. În iulie 2019, instrumentul de editare a genelor CRISPR a fost folosit pentru a edita celulele măduvei osoase de la o persoană cu SCD pentru a „activa” gena pentru hemoglobina fetală . O serie de cercetători au considerat că implicațiile etice ale SCD sunt una dintre primele aplicații potențiale ale tehnologiei CRISPR, având în vedere abuzurile istorice și neglijarea comunității afro-americane din partea domeniului medical.
În 2017, douăsprezece studii clinice s-au concentrat pe terapia genică pentru tratarea anemiei falciforme. Dintre aceste 12 studii, patru dintre ele au înlocuit gena HBB mutantă cu una sănătoasă. Trei studii au folosit Mozobil, un medicament folosit pentru a trata tipurile de cancer, pentru a determina dacă creșterea celulelor stem poate fi utilizată pentru terapia genică. Un studiu s-a concentrat pe analiza probelor de măduvă osoasă de la pacienți cu anemie falciforme. Un alt studiu a experimentat utilizarea sângelui din cordonul ombilical de la bebeluși atât cu și fără anemie falciforme pentru a dezvolta terapia genică.
Transplant de celule stem hematopoietice
Nu există dovezi medicale solide care să determine riscurile și beneficiile potențiale legate de tratarea persoanelor cu boală secerată cu transplant de celule stem hematopoietice.
Note
Referințe
Lectură în continuare
|
Resurse bibliotecii despre siclemie |
- Brown RT, ed. (2006). Manual cuprinzător al cancerului infantil și al siclemiei: o abordare biopsihosocială . Presa Universitatii Oxford. ISBN 978-0-19-516985-0.
- Hill SA (2003). Gestionarea bolii falciforme în familiile cu venituri mici . Temple University Press. ISBN 978-1-59213-195-2.
- Serjeant GR, Serjeant BE (2001). Siclemie . Presa Universitatii Oxford. ISBN 978-0-19-263036-0.
- Tapper M (1999). În sânge: anemia cu celule falciforme și politica rasei . University of Pennsylvania Press. ISBN 978-0-8122-3471-8.